2. 浙江大学环境与资源学院,浙江杭州 310058
2. College of Environmental and Resource Sciences, Zhejiang University, Hangzhou 310058, China
氮素是植物体内叶绿素、蛋白质、核酸和激素的重要组分,是作物生长发育与产量形成中最重要的必需元素[1],它对促进植物体内源激素及抗逆性的产生起积极作用[2]。铵态氮 (NH4+-N) 和硝态氮 (NO3–-N) 是作物吸收利用的主要氮源形态,但吸收 NH4+-N 时比吸收 NO3–-N 消耗的能量要少。因此,理论上供 NH4+ 的植株要比供 NO3– 的植株早发稳长[3],并能获得更高的生物量[4]、提高作物的抗性[5]。何会流[6]研究表明,凤仙花生物量随铵硝比降低呈下降趋势,但铵硝比为 50/50 时出现最大值,可溶性蛋白、可溶性糖含量在铵硝比 50/50 时最高,MDA 含量在全铵态氮处理下显著增高;胡琳莉等[7]发现铵硝比为 10∶90 处理较纯硝处理显著提高大白菜可溶性蛋白和可溶性糖含量及 SOD、POD、CAT 活性,降低 MDA 含量,有效地抑制膜脂过氧化。
低温是影响植物生长和分布的全球性自然灾害[8]。低温导致细胞膜透性增大、选择性丧失,是植物低温伤害的最重要原因之一。低温胁迫还会导致植物体内活性氧平衡遭到破坏,光合作用受到抑制、渗透调节物质迅速积累及抗氧化酶活性下降等[9–13],引起代谢紊乱,严重时甚至使植物死亡。刘慧英等[9]研究表明,降低温度使嫁接苗和实生苗均表现为抗氧化酶活性下降,说明低温胁迫降低了植物体活性氧防御系统的能力,提高了体内自由基浓度,加剧了膜脂过氧化作用。然而,关于低温胁迫下不同氮素形态对棉花幼苗的抗氧化作用的影响及其与棉花抗冷性的关系尚未见报道。
棉花属于锦葵科棉属植物,原产于亚热带,喜温好光,生育期最适宜温度为 20~30℃,当日平均温度低于 18℃ 时就会对棉花生长发育造成严重危害。新疆作为我国最大棉区,在早春经常遭遇寒潮、倒春寒等低温气象灾害,严重影响植株生长发育及产量形成[14],给农业生产带来巨大经济损失。因此,我们假设在低温条件下通过增铵营养可改善棉花植株的氮素营养和调控棉花生育前期的生长发育,将极大促进棉花的生长,提高棉苗的抗逆能力。为此,本文进行了不同铵硝配比对低温胁迫棉花幼苗抗氧化酶活性及脂质过氧化伤害的研究,探讨不同氮素形态与抗寒性的关系,为通过调节氮素形态提高棉花抗冷性提供理论依据。
1 材料与方法 1.1 试验设计供试棉花 (Gossypium hirsutum L.) 品种为‘新陆早 13 号’。水培试验采用蛭石为介质,在 12 cm × 12 cm 的培养钵内育苗,把培养钵置于 45 cm × 33 cm × 20 cm 的保险盒中,每个保险盒中放置 12 个培养钵,保险盒内注入营养液,模拟研究在低温胁迫下不同铵/硝配比对苗期 (60 d 左右) 棉花叶片过氧化伤害及其抗氧化酶活性的影响。采用两因素随机试验设计,即 2 个温度处理 [15℃ 和 25℃,分别设置在两个其它条件相同的人工气候室内:黑夜/白天为 10 h/14 h,光照强度 280 μmol/(m 2·s),相对湿度为 65% ± 2%],和 5 个铵硝配比处理 (0/100、25/75、50/50、75/25 和 100/0)。总氮水平为 5 mmol/L。在营养液中加入占总氮量 3% 的硝化抑制剂 (DCD),每个处理均设 3 次重复。营养液中大量元素配方遵循 Hoagland 营养液,微量元素参照 Hammer 等[15]的方法配制,营养液每 3 d 更换一次。在生长 60 d 后采样分析棉花幼苗生长及抗氧化参数。试验重复了 2 次,第一次用于干物质含量测定,第二次的鲜样用于电解质渗出率、丙二醛 (MDA)、游离脯氨酸 (Pro) 和可溶性蛋白质 (SP) 含量、超氧化物歧化酶 (SOD)、过氧化物酶 (POD) 和过氧化氢酶 (CAT) 活性的测定。
1.2 测定项目与方法出苗 60 d 后,选取各处理长势均匀的棉株 6 株,将茎秆、叶片等器官分开,洗净,在 105℃ 烘箱中杀青 30 min,然后在 80℃ 条件下烘干至恒重后称重,即为各器官干物质量。电解质渗出率用 DDS-307 型电导率仪测定;丙二醛 (MDA) 含量采用硫代巴比妥酸 (TBA) 法[6]测定;游离脯氨酸 (Pro) 含量采用茚三酮比色法[6]测定;可溶性蛋白质 (SP) 含量采用考马斯亮蓝 G-250 法测定[7];超氧化物歧化酶 (SOD) 活性测定用氮蓝四唑 (NBT) 光化学还原法[10];过氧化物酶 (POD) 活性测定用愈创木酚法[10];过氧化氢酶 (CAT) 活性采用过氧化氢紫外线法测定[10],每次测定均重复 4 次。所有酶活性以单位粗蛋白为基准表示。
1.3 数据统计与分析数据分析用 Microsoft Excel 2010 软件,采用 SPSS 19.0 软件进行双因素方差分析和差异显著性检验 (Duncan 法),使用 Sigmaplot 12.5 软件绘图。
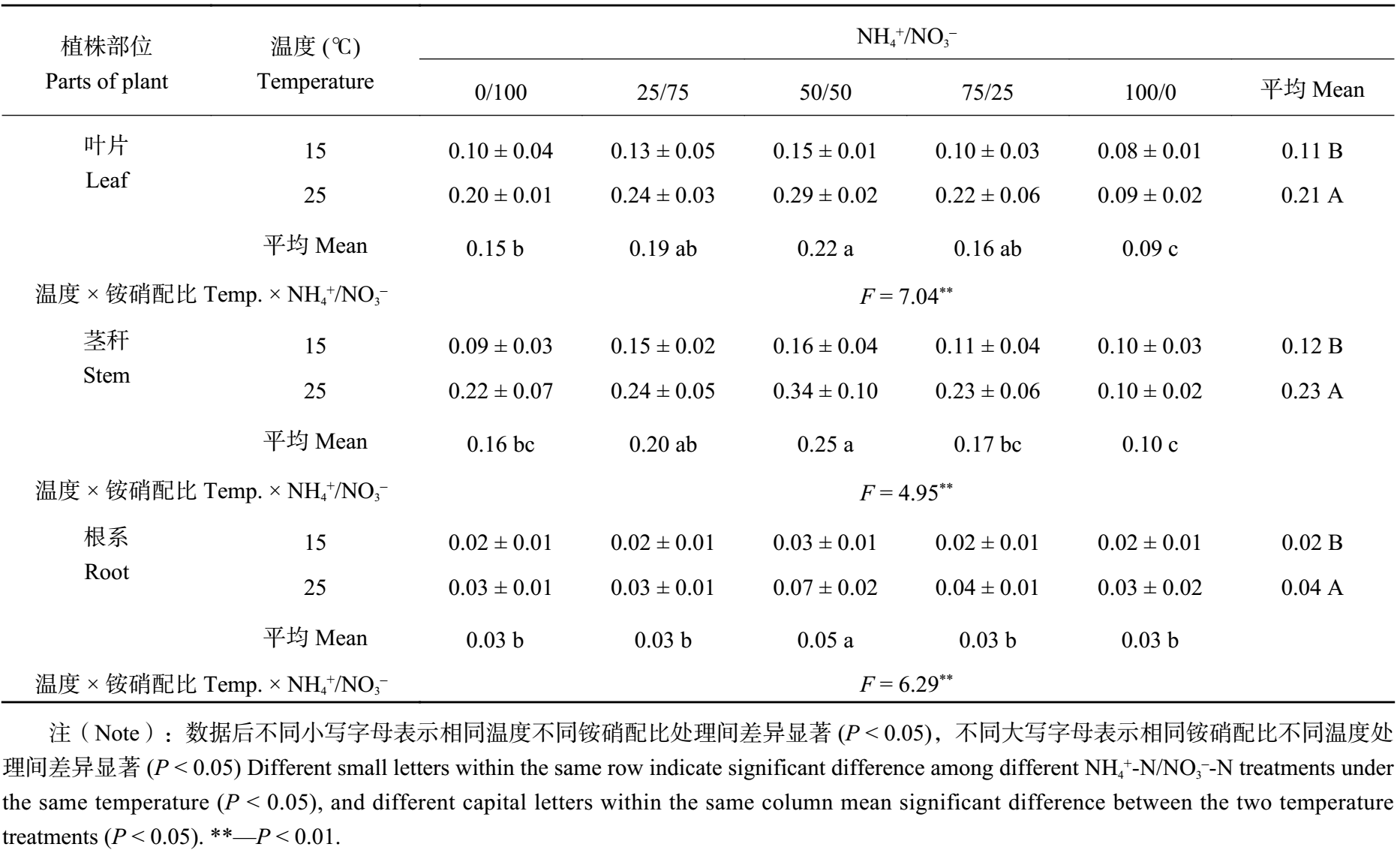
2 结果与分析 2.1 不同铵硝配比对低温胁迫下棉花幼苗生长的影响由表 1 可以看出,25℃ 条件下,铵硝混合营养对棉苗各器官生物量积累均有显著的影响 (P < 0.05)。相同温度条件下,均表现为叶片、茎秆及根系干重在 NH 4+/NO3– 为 50/50 处理时最大,纯铵营养处理最小。对棉苗生物量的影响效果均表现出铵硝混合营养优于纯铵或纯硝营养处理。低温 (15℃) 胁迫下,NH4+/NO3– 为 50/50 处理时棉苗各器官生物量最大,显著高于其他处理,纯硝处理最小。NH4+/NO3– 为 50/50 处理的茎秆、叶片、根系比纯硝处理分别增加了 42.4%、30.6% 和 45.9%。茎秆生物量表现出显著性差异 (P < 0.05)。在棉花生长过程中,低温胁迫抑制了棉花地上部和地下部各营养器官的生长,而铵硝混合营养有利于棉苗干物质的积累及后期的生长发育。这说明铵硝混合营养在逆境条件下表现出更显著促进植物生长发育的效果。
| 表1 低温胁迫下供应不同 NH4+/NO3– 比的棉花幼苗生物量 (g/plant, DW) Table 1 Biomass of cotton seedlings under low temperature stress and supplied with different ratio of NH4+/NO3– |
 |
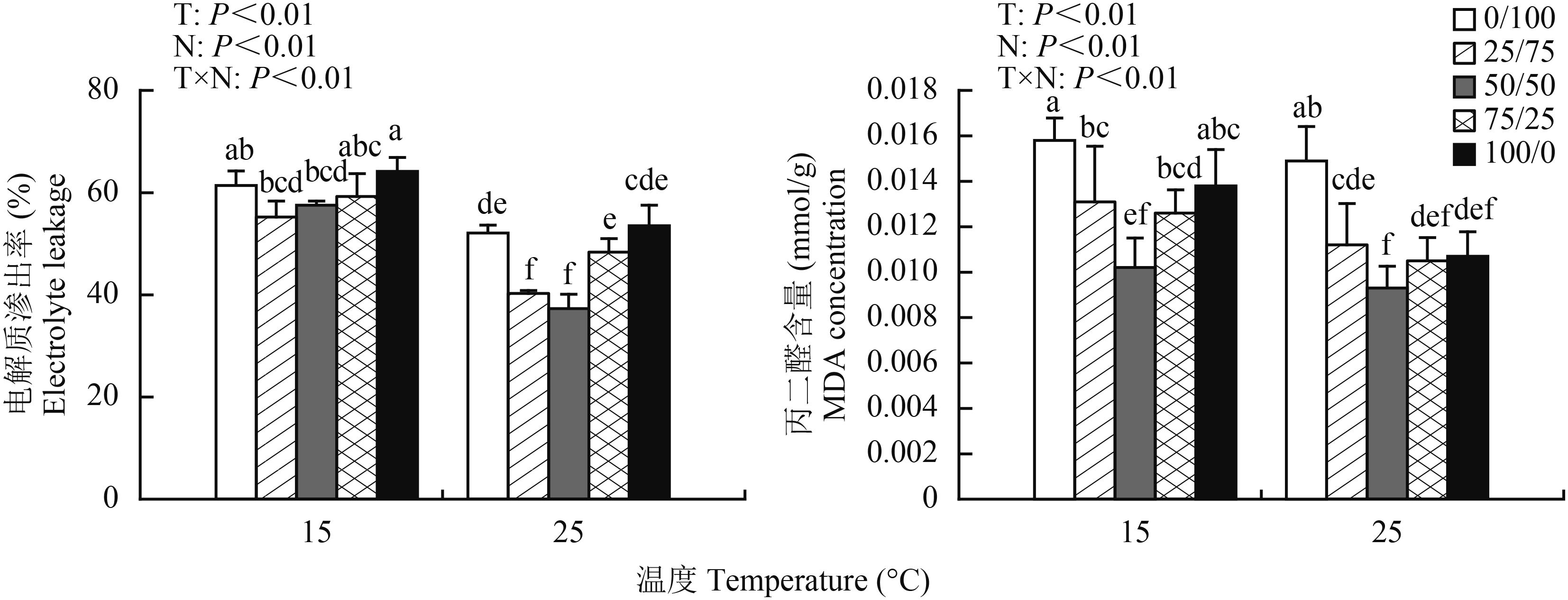
从图 1 可知,相同温度时随着营养液中 NH4+-N/NO3–-N 比值的增加,棉花幼苗电解质渗出率呈先降低后升高的趋势,铵硝混合营养处理棉苗电解质渗出率显著低于纯铵 (NH4+-N/NO3–-N 比为 100/0) 或纯硝 (NH4+-N/NO3–-N 比为 0/100) 营养处理 (P < 0.05)。25℃ 常温条件下,营养液中 NH 4+-N/NO3–-N 比为 50/50 处理电解质渗出率最小,分别比同温度纯铵和纯硝营养处理减小了 43.5% 和 39.7%,处理间差异显著 (P < 0.05)。与常温相比,低温胁迫促使棉花幼苗电解质渗出率显著升高。
由图 1 可以看出,相同温度条件下,棉花幼苗 MDA 含量随营养液中 NH4+-N 比例的增加呈现先下降后上升的趋势,铵硝混合 (NH4+-N/NO3–-N 比为 50/50) 营养处理显著低于纯铵或纯硝营养处理 (P < 0.05)。常温 (25℃) 下,营养液中 NH 4+-N/NO3–-N 比 50/50 处理棉花幼苗 MDA 含量为 9.3 μmol/g,纯铵和纯硝营养处理 MDA 含量为 10.7 μmol/g 和 14.9 μmol/g,增加幅度分别达到 15.1% 和 60.2%;低温胁迫 (15℃) 下,营养液中 NH4+-N/NO3–-N 比为 50/50 处理棉花幼苗 MDA 含量与纯铵、纯硝营养处理相比增幅达 35.3%、54.9%。同一铵硝配比条件下,低温胁迫使棉花幼苗 MDA 含量显著增高 (P < 0.05)。
从图 1 还可以看出,温度与铵硝配比存在明显交互作用,棉苗电解质渗出率和 MDA 含量均表现为随营养液中 NH4+-N/NO3–-N 比例增加先降低后升高的变化趋势,铵硝比为 50/50 处理显著低于其他处理 (P < 0.01)。
由此说明,低温胁迫使棉花幼苗叶片细胞膜受到伤害,膜透性增大,电解质大量外渗,MDA 含量增加,产生了渗透胁迫,而铵硝混合营养能够显著降低棉株 MDA 含量,并明显降低了低温胁迫条件下 MDA 含量的增加幅度,保护细胞膜的完整性,降低质膜透性,降低膜脂过氧化程度,从而提高棉花幼苗对低温胁迫的抗性,减轻低温对棉花植株的伤害程度,维持正常生长发育。
 |
|
图1
不同 NH4+/NO3– 配比对低温胁迫下棉花幼苗电解质渗出率和丙二醛含量的影响
Fig. 1
Effects of different NH4+/NO3– ratios on the electrolyte leakage and MDA concentration of cotton seedlings under low-temperature stress
|
由图 2 可以看出,棉花幼苗 SP、Pro 含量随着营养液中 NH4+ 浓度增大先增加后减少,铵硝混合营养处理 SP、Pro 含量明显高于纯铵或纯硝营养处理,营养液中 NH4+-N/NO3–-N 比为 25/75 处理达最大值,纯铵营养处理最小。相同铵硝营养配比条件下,低温使棉花幼苗 SP、Pro 含量明显增大,15℃ 营养液 NH4+-N/NO3–-N 为 25/75 处理的棉花幼苗 Pro 含量比 25℃ 时升高 46.2%。说明在低温胁迫下铵硝混合营养有利于维持细胞渗透调节能力,减少水分散失,有效减轻低温胁迫对棉花苗期的危害。温度与铵硝配比交互作用方差分析表明,铵硝混合营养处理 SP、Pro 含量明显高于纯铵或纯硝营养处理 (p < 0.01)。
 |
|
图2
不同 NH4+/NO3– 配比对低温胁迫下棉花幼苗可溶性蛋白质和游离脯氨酸含量的影响
Fig. 2
Effects of different NH4+/NO3– ratios on the concentration of soluble protein (SP) and proline (Pro) in cotton seedlings under low-temperature stress
|
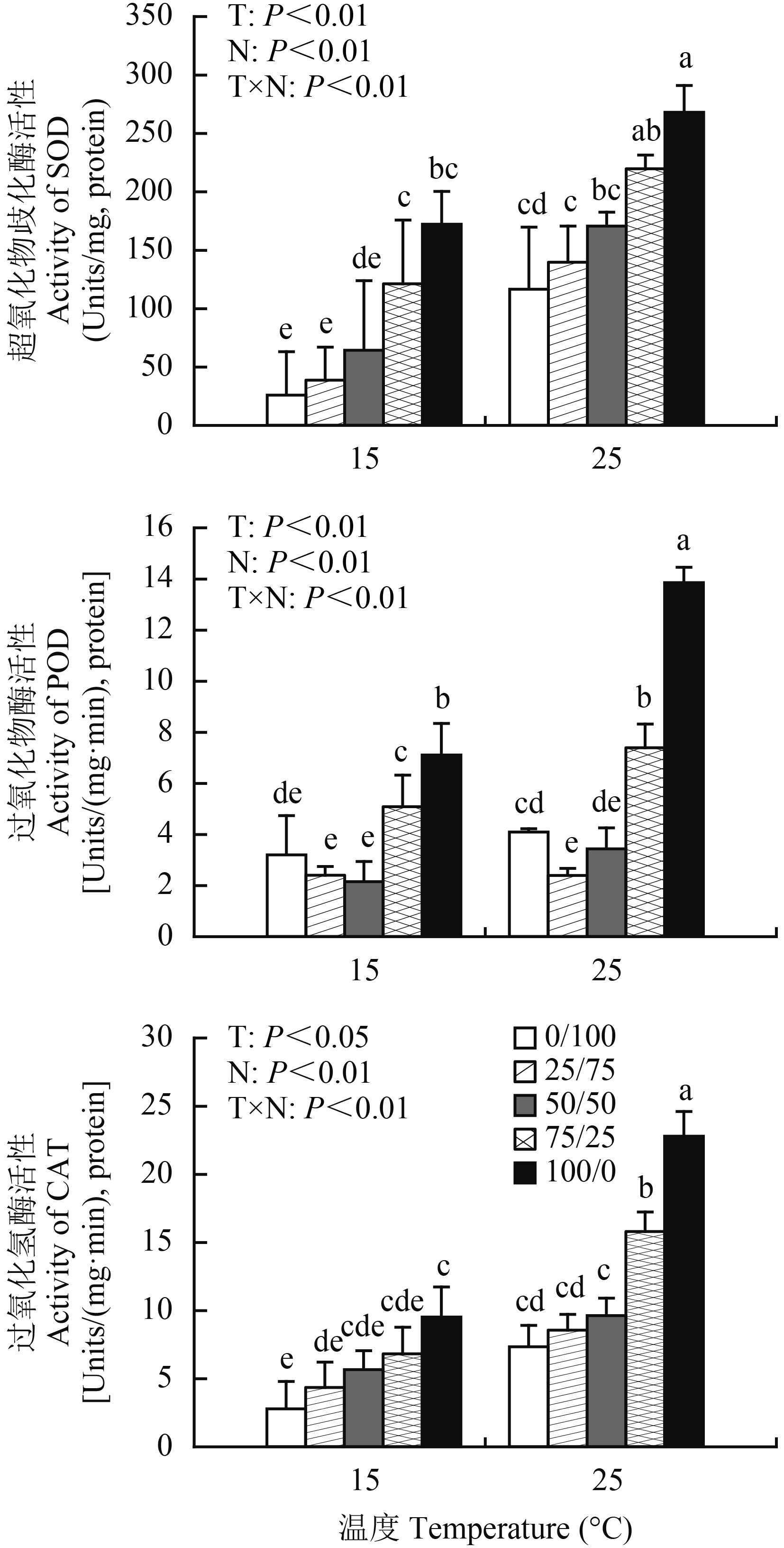
图 3 表明,无论是常温还是低温胁迫下,棉花幼苗 SOD 活性随着铵比例的增加显著增大 (P < 0.01),在纯铵营养处理时达到最大值 (25℃ 时为 268.1 Unit/mg, protein,15℃ 为 172.3 Units/mg, protein),且在低温胁迫下下降幅度较大。例如,在常温条件下,纯铵营养处理棉花 SOD 活性较纯硝营养处理增大了 129.7%,在低温胁迫下,纯铵营养处理较纯硝营养处理增大 563.7%。与常温相比,低温使棉花幼苗 SOD 活性显著降低。说明低温逆境下增铵营养使棉花幼苗具有更灵敏的 SOD 活性调节能力,促使棉苗启动 SOD 活性响应机制,通过提高其活性,快速清除细胞内产生的 ROS,降低 ROS 伤害。
POD 也是植物体内重要的清除逆境下细胞内活性氧自由基的防御酶之一,低温胁迫和不同铵硝营养配比对棉花幼苗 POD 活性影响显著 (图 3)。相同温度条件下,棉花幼苗 POD 活性随着营养液中 NH4+-N/NO3–-N 比例升高而呈现出先降低,NH4+-N/NO3–-N 比为 50/50 营养处理达最低,此后再升高,纯铵营养处理达最大值,铵硝混合营养显著低于纯铵或纯硝营养。15℃ 时,棉苗 POD 活性纯铵处理比 NH4+-N/NO3–-N 比为 50/50 处理增大了 229.7%,25℃ 时增大 302.9%。低温胁迫条件下,棉花幼苗 POD 活性显著降低,NH4+/NO3– 为 0/100,50/50,100/0 时,15℃ 处理比 25℃ 处理分别降低了 27.9%、59.4%、94.8%。
 |
|
图3
不同 NH4+/NO3– 配比对低温胁迫下棉花幼苗抗氧化物酶活性的影响
Fig. 3
Effects of different NH4+/NO3– ratios on the antioxidant defense anzyme activities in cotton seedlings under low-temperature stress
|
从棉花幼苗叶片内 CAT 活性测定结果 (图 3) 可知,铵硝配比相同处理,低温 (15℃) 胁迫显著降低了棉苗 CAT 活性。相同温度条件下,棉花幼苗 CAT 活性随营养液中铵比例增加逐渐递增,纯铵营养处理最大,纯硝营养处理最小,不同处理间差异显著 (P < 0.01)。例如,15℃ 处理时,纯铵营养棉苗 CAT 活性为纯硝营养时的 4.33 倍;25℃ 时为 4.27 倍。纯铵与纯硝营养处理 CAT 活性差异显著 ( P < 0.05)。SOD、POD、CAT 活性在各处理温度与氮素形态不同配比的交互作用差异显著 ( P < 0.01)。
3 讨论 3.1 低温胁迫下铵硝配比对棉花幼苗生物量的影响不同铵硝配比的氮素营养对于作物氮素吸收和累积有重要影响。曹翠玲等[4]的研究表明,单纯供应硝态氮时,作物幼苗体内氮素转化快,植株氮素累积量最大。章笑赟等[16]发现,营养液增铵处理芥蓝全氮含量显著高于纯硝处理,但不同增铵处理间无显著差异,不同器官含氮量表现为叶 > 根 > 茎;不同器官氮吸收累积量大小为叶 > 茎 > 根。本研究结果表明,常温和低温胁迫条件下,棉花地上部、根系中含氮量随着营养液中 NH 4+-N 比例增加而逐渐递增,且低温处理极显著高于常温处理 (P < 0.01);氮素吸收量先增加后减少,常温处理极显著高于低温胁迫处理 ( P < 0.01),低温胁迫抑制了棉株对氮素的吸收,铵硝混合营养可明显减轻低温胁迫对棉苗氮素吸收的抑制作用。相同温度条件下,不同器官中全氮含量为叶 > 根 > 茎,氮素吸收量为叶片 > 茎秆 > 根系,这与前人的研究结果一致。而雷玉玲等 [17]在莴苣上的试验结果表明,营养液 NH4+-N/NO3–-N 比为 10/90 的处理可明显促进莴苣植株的生长,提高其地上部和根系的全氮含量和氮素积累量,增铵至 25% 和 50% 则以上指标显著降低。其可能原因是不同种类植物对增铵营养的敏感程度不同导致的差异。
3.2 低温胁迫下铵硝配比对棉花幼苗电解质渗出率和 MDA 含量的影响同时供应铵、硝态氮营养条件下,多种植物均表现为混合营养优于纯铵或纯硝营养[4–7]。低温胁迫是影响植物生长发育的重要环境限制因子之一。低温胁迫的影响主要体现在降低光合[18]、酶钝化失活、膜系统受损[19]、细胞失水,进而导致代谢紊乱,甚至植物死亡。植物体内存在一系列抗氧化保护酶和非酶物质,在正常条件下可清除活性氧自由基,使其产生和清除处于一种动态平衡状态下,保护植物细胞免受活性氧的危害,维持细胞膜系统的稳定性,有效增强植物的抗逆性[20–22]。低温胁迫下植物体内产生大量活性氧自由基,促使 MDA 积累,质膜透性增大,发生膜脂过氧化作用,致使膜损伤;还会使植物体内渗透调节物质积累[23]。
细胞电解质的大量渗漏常作为膜伤害或变性的重要标志[24]。电解质渗出率和 MDA 含量的大小能够直接反映膜受损伤程度的大小[25–26]。通过测定电解质渗出率的变化情况可以反映出质膜受损伤的严重程度,进而判断植物抵抗低温胁迫能力的强弱。Dong 等[27]报道黄瓜幼苗在低温胁迫下,细胞膜透性增加,电解质渗漏。膜脂过氧化的最终产物 MDA 会导致细胞膜严重损伤,其含量也可以直接反映膜损伤程度的大小[28–29],其含量越高,表明细胞组织的保护能力越差。王萍等[30]的研究结果证实,水稻在低温胁迫下幼苗 MDA 含量随着温度的降低、胁迫时间延长而明显增加。本试验结果表明,低温胁迫促使棉花幼苗电解质渗出率显著升高,棉花幼苗电解质渗出率纯铵营养处理 15℃ 时是 25℃ 时的 1.20 倍,纯硝营养为 1.18 倍,这与 Dong 等[27]、罗宁等[31]、辛慧慧等[32]在黄瓜、玉米、棉花上研究结果一致。低温胁迫使棉花幼苗脂质过氧化产物 MDA 含量也明显升高,表明低温胁迫使棉株体内活性氧自由基的产生和消除平衡系统遭到破坏,活性氧自由基的产生速率明显高于清除速率,体内超常积累活性氧自由基,自由基启动膜脂过氧化作用,使过氧化产物 MDA 积累,从而危害棉株的正常生长发育。不同氮素形态对植物细胞膜系统也有影响。郭莹等[33]研究发现,水培条件下随着铵态氮比例的增大,大白菜中 MDA 含量、电导率升高。本试验中,棉花幼苗电解质渗出率和 MDA 含量均随营养液中铵比例增加先减小后增大,在营养液中 NH4+-N/NO3–-N 比例为 50/50 时达最小,纯硝营养处理次之,纯铵营养处理最大。铵态氮比例较高时 MDA 含量增加,推测可能是由于纯铵营养条件影响氮代谢中有关酶类的活性,使棉株体内铵态氮过量积累,产生高铵毒害,导致细胞膜系统受到伤害,铵硝混合营养可以有效减轻铵浓度过大引起的细胞膜损伤,从而减小膜脂过氧化作用,促进作物生长,提高作物的抗逆境胁迫能力。
3.3 低温胁迫下铵硝配比对棉花幼苗渗透调节物质的影响Pro 和 SP 是逆境胁迫下植物体内最有效和最重要的有机渗透调节物质。SP 和 Pro 含量与植物的抗冷性呈正相关,有报道指出,低温胁迫提高小麦[34]、棉花[35]、耧斗菜[36]等植物体内 Pro 和 SP 含量。本试验结果表明,低温处理使棉花幼苗 SP、Pro 含量明显升高。SP 含量的增加可能有两种来源:一部分是由于低温诱导了一些新蛋白质的合成,一部分是从膜或其它结合形式释放。SP 和 Pro 均是植物体内重要的含氮有机化合物,氮素形态对其影响显著。何会流等[6]研究表明,凤仙花 SP、SS 含量在 NH4+-N/NO3–-N 50/50 处理时最高;刘国英等[26]研究指出,番茄幼苗 Pro 含量随营养液中铵态氮比例的增加而增大。本试验结论与前人研究结果基本一致,棉花幼苗 SP 和 Pro 含量均随营养液中 NH4+-N/NO3–-N 比值的增大先增加后减少,NH4+-N/NO3–-N 比为 25/75 时最大。说明低温胁迫下铵硝混合营养处理能够稳定和增加棉苗体内 SP 和 Pro 含量,增强植物细胞亲水性,增加植物持水力,束缚更多的水分,以适应不良环境条件,减少逆境对植物的伤害。
3.4 低温胁迫下铵硝配比对棉花幼苗抗氧化酶活性的影响研究表明,在保护植物对低温引发的活性氧伤害时,抗氧化酶系统扮演着一个重要的角色[37–38]。SOD 是抗氧化系统中极为重要和在植物体内普遍存在的金属酶,在酶保护系统中处于核心地位[39–40]。茄子在低温胁迫下,细胞膜透性增大,SOD 和 POD 活性上升,CAT 活性下降,且低温下耐寒性强的品种能保持更高的保护酶活性、细胞膜完整性,具有较好的抗逆能力[41]。刘慧英等[9]研究表明,降低温度,嫁接苗和实生苗均表现为抗氧化酶活性下降,表明低温胁迫降低了植物活性氧防御系统能力,提高了自由基浓度,加剧了膜脂过氧化作用。本研究结果显示,棉花幼苗 SOD、CAT 活性在 15℃ 低温处理后呈下降趋势,说明低温胁迫使棉花幼苗细胞结构遭受严重伤害,导致抗氧化酶活性降低,加速活性氧积累,其产生速率远大于清除速率,从而加剧了细胞膜的过氧化作用,结合 MDA (图 1) 研究结果可知,低温对棉花幼苗产生了活性氧伤害。这与前人[9, 32, 35, 41]的研究结果一致。王利超等[42]研究发现,铵硝混合营养增强了 SOD、POD 活性。马晓霞等[43]研究表明,随着 NH4+-N 浓度的增加,浮萍体内 POD 活性呈现先增大后减小的趋势,SOD 和 MDA 含量则表现出先降低再升高的变化特征。由此看出,不同铵硝营养对植物抗氧化酶活性影响因植物种类不同而异。本试验结果表明,棉花幼苗 SOD、CAT 活性随营养液中 NH4+-N/NO3–-N 比增大逐渐递增,而 POD 活性则表现为先降低后升高的变化,说明铵硝混合营养有效提高了棉株抵抗活性氧伤害的能力,有利于提高棉花抗寒性。可能原因是低温胁迫条件下,棉花幼苗对铵态氮营养的选择性吸收增强,而植物以 NH4+-N 为主要氮源时,积累在植物体内高浓度的 NH4+ 会引起铵毒害,NH4+ 容易穿过生物膜,阻碍质子驱动势的形成,破坏膜结构[40],通过铵硝混合营养的调节,有效降低了高铵引起的铵毒,使棉株体内与作物抗寒性有关的 Pro 含量增加,有利于增强植株抗寒性蛋白的合成,同时促进一些保护酶合成或其活性增强,抗氧化酶保护体系协同清除活性氧能力增强[26, 35],从而减轻低温胁迫对棉花造成的逆境伤害。
4 结论1) 低温胁迫抑制了棉苗生长,铵硝混合营养可降低低温胁迫对棉苗生长的抑制,表现出显著促进生长发育的效应。
2) 低温胁迫条件下,铵硝混合营养有效减轻铵毒,减小膜脂过氧化作用,降低了棉苗电解质渗出率和 MDA 含量。
3) 铵硝混合营养增加了低温胁迫下棉苗体内渗透调节物质的积累,有效避免低温脱水伤害。
4) 增铵营养显著提高低温下抗氧化保护酶活性,能够更有效清除自由基。
综上所述,纯铵营养条件下棉苗产生高铵毒害现象,电解质渗出率、MDA 含量高,SP、Pro 含量低,生物量较少;纯硝营养下虽然电解质渗出率低,SP、Pro 含量高,但由于硝酸盐同化前需消耗大量能量,致使生物量并不高。铵硝比为 50/50 的混合处理有效减轻了铵毒,减轻了低温胁迫对棉苗的损伤程度,促进生长发育,提高棉花苗期抗逆性。
| [1] | Burke I C, Lauenroth W K, Partow J. Regional and temporal variation in net primary production and nitrogen mineralization in grasslands[J]. Ecology, 1997, 78(5): 1331–1340. |
| [2] |
汪耀富, 张瑞霞, 胡筱岚, 等. 渗透胁迫下氮肥形态对烟叶脯氨酸和内源激素含量的影响[J].
安徽农业科学, 2004, 32(4): 738–741.
Wang Y F, Zhang R X, Hu X L, et al. Effect of osmotic stress on proline and endogenous hormone content in flue-cured tobacco leaves under different nitrogen forms[J]. Journal of Anhui Agricultural Sciences, 2004, 32(4): 738–741. |
| [3] |
王岚, 黄承和, 陈玉子, 等. 铵硝配比对巴西香蕉生长和氮素营养的影响[J].
热带作物学报, 2016, 37(1): 26–29.
Wang L, Huang C H, Chen Y Z, et al. Effects of NH4+/NO3– ratios on growth and nitrogen nutrition in Brazil banana [J]. Chinese Journal of Tropical Crops, 2016, 37(1): 26–29. |
| [4] |
曹翠玲, 李生秀. 氮素形态对作物生理特性及生长的影响[J].
华中农业大学学报, 2004, 23(5): 581–586.
Cao C L, Li S X. Effects of N form on crop physiological characteristics and growth[J]. Journal of Huazhong Agricultural University, 2004, 23(5): 581–586. |
| [5] |
文俊, 陈建军, 林锐锋, 等. 渍水胁迫对不同氮源供应下烤烟生长的影响[J].
中国农学通报, 2013, 29(7): 133–137.
Wen J, Chen J J, Lin R F, et al. Effects of different nitrogen source on growth of flue-cured tobacco under soil waterlogging stress[J]. Chinese Agricultural Science Bulletin, 2013, 29(7): 133–137. DOI:10.11924/j.issn.1000-6850.2012-3045 |
| [6] |
何会流. 不同氮素形态对凤仙花生长及某些生理指标的影响[J].
江苏农业科学, 2013, 41(7): 163–165.
He H L. Effect of different form nitrogen on growth and physiological indexes of garden balsam[J]. Jiangsu Agricultural Science, 2013, 41(7): 163–165. |
| [7] |
胡琳莉, 廖伟彪, 马彦霞, 等. 弱光下不同铵硝配比氮素对大白菜幼苗生长和抗氧化的影响[J].
园艺学报, 2016, 43(5): 897–906.
Hu L L, Liao W B, Ma Y X, et al. Effects of ammonium: nitrate ratios on growth and antioxidant enzyme activities of Chinese cabbage seedling under low light intensity[J]. Acta Horticulturae Sinica, 2016, 43(5): 897–906. |
| [8] | Guilbault K R, Brown C S, Friedman J M, et al. The influence of chilling requirement on the southern distribution limit of exotic Russian olive in western North America[J]. Biological Invasions, 2012, 14(8): 1711–1724. DOI:10.1007/s10530-012-0182-4 |
| [9] |
刘慧英, 朱祝军, 吕国华. 低温胁迫对嫁接西瓜耐冷性和活性氧清除系统的影响[J].
应用生态学报, 2004, 15(4): 659–663.
Liu H Y, Zhu Z J, Lü G H. Effect of low temperature stress on chilling tolerance and protective system against active oxygen of grafted watermelon[J]. Chinese Journal of Applied Ecology, 2004, 15(4): 659–663. |
| [10] |
武辉, 张巨松, 石俊毅, 等. 棉花幼苗对不同程度低温逆境的生理响应[J].
西北植物学报, 2013, 33(1): 74–82.
Wu H, Zhang J S, Shi J Y, et al. Physiological responses of cotton seedlings under low temperature stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(1): 74–82. |
| [11] | Bilska A, Pawel S. Closure of plasmodesmata in maize (Zea mays) at low temperature: a new mechanism for inhibition of photosynthesis [J]. Annals of Botany, 2010, 106: 675–686. DOI:10.1093/aob/mcq169 |
| [12] | Liang L H, Mei X, Lin F, et al. Effect of low temperature stress on tissue structure and physiological index of cashew young leaves[J]. Ecology and Environmental Sciences, 2009, 18(1): 317–320. |
| [13] | Huang W, Zhang S B, Cao K F. The different effects of chilling stress under moderate light intensity on photosystem Ⅱ compared with photosystem Ⅰ and subsequent recovery in tropical tree species[J]. Photosynthesis Research, 2010, 103(3): 175–182. DOI:10.1007/s11120-010-9539-7 |
| [14] |
赖先齐, 刘月兰, 徐腊梅, 等. 北疆棉区棉花低温冷害的初步分析及对策探讨[J].
新疆农业科学, 2008, 45(5): 782–786.
Lai X Q, Liu Y L, Xu L M, et al. Preliminary analysis and countermeasures of chilling damage to cotton in the north of Xinjiang[J]. Xinjiang Agricultural Sciences, 2008, 45(5): 782–786. |
| [15] | Hammer P A, Tibbitts T W, Langhans R W. Baseline growth studies of ‘Grand Rapids’ lettuce in controlled environments[J]. Annual Botany, 1989, 63: 643–649. DOI:10.1093/oxfordjournals.aob.a087793 |
| [16] |
章笑赟, 祁百福, 宋世威, 等. 不同铵硝配比对芥蓝伤流液组分及植株氮磷钾积累的影响[J].
中国蔬菜, 2014,, (1): 31–36.
Zhang X Y, Qi B F, Song S W, et al. Effects of different ammonium and nitrate ratios on Chinese Kale bleeding sap component and its plant nitrogen, phosphorus and potassium accumulation[J]. China Vegetables, 2014,, (1): 31–36. |
| [17] |
雷玉玲, 陈紫妍, 宋世威, 等. 不同铵硝配比对叶用莴苣生长及氮磷钾养分积累的影响[J].
中国蔬菜, 2015,, (9): 48–52.
Lei Y L, Chen Z Y, Song S W, et al. Effects of different ammonium and nitrate ratios on lettuce growth and accumulation of plant nitrogen, phosphorus and potassium[J]. China Vegetables, 2015,, (9): 48–52. |
| [18] | Yamor W, Noguchi K, Terashima I. Temperature acclimation of photosynthesis in spinach leaves: analyses of photosynthetic components and temperature dependencies of photosynthetic partial reactions[J]. Plant Cell and Environment, 2005, 28(4): 536–547. DOI:10.1111/pce.2005.28.issue-4 |
| [19] | De S B, Clavel T, Clerté C, et al. Influence of anaerobiosisi and low temperature on bacillus cereus growth, metabolism, and membrane properties[J]. Applied and Environmental Microbiology, 2012, 78(6): 1715–1723. DOI:10.1128/AEM.06410-11 |
| [20] | Tripathy B C, Oelmüller R. Reactive oxygen species generation and signaling in plants[J]. Plant Signaling & Behavior, 2012, 7(12): 1621–1633. |
| [21] | Karuppanapandian T, Juncheol M, Changsoo K, et al. Reactive oxygen species in plants: their generation, signal transduction, and scavenging mechanisms[J]. Australian Journal of Crop Science, 2011, 5(6): 709–725. |
| [22] | O'Brien J A, Daudi A, Butt V S, Bolwell G P. Reactive oxygen species and their role in plant defence and cell wall metabolism[J]. Planta, 2012, 236(3): 765–779. DOI:10.1007/s00425-012-1696-9 |
| [23] |
陈磊, 朱月林, 杨立飞, 王聪. 氮素不同形态配比对菜用大豆生长、种子抗氧化酶活性及活性氧代谢的影响[J].
植物营养与肥料学报, 2010, 16(3): 768–772.
Chen L, Zhu Y L, Yang L F, Wang C. Effects of nitrogen forms and ratios on plant growth, seed antioxidant enzyme activities and reactive oxygen metabolism of vegetable soybean[J]. Plant Nutrition and Fertilizer Science, 2010, 16(3): 768–772. DOI:10.11674/zwyf.2010.0337 |
| [24] | Claussen W, Lenz F. Effect of ammonium and nitrate on net photosynthesis, flower formation, growth and yield of eggplants (Solanum melongena L.) [J]. Plant and Soil, 1995, 171: 267–274. DOI:10.1007/BF00010281 |
| [25] |
王英, 吕德国, 秦嗣军, 等. 低温对山定子和平邑甜茶幼苗根系氮代谢酶及游离氨基酸的影响[J].
园艺学报, 2010, 37(2): 179–184.
Wang Y, Lv D G, Qin S J, et al. Effects of low-temperature on enzymes activities of nitrogen metabolism and free amino acids contents in root of Malus baccata Borkh. and Malus hupehensis Rehd. seedling [J]. Acta Horticultruae Sinica, 2010, 37(2): 179–184. |
| [26] |
刘国英. 亚低温胁迫下氮素形态对番茄幼苗生理特性和根系形态的影响[D]. 杨凌: 西北农林科技大学硕士学位论文, 2014.
Liu G Y. Effects of nitrogen forms on physiological and root morphology of tomato seedlings under sub-low temperature [D]. Yanglin: MS Thesis of Northwest Agricultural and Forestry University, 2014. |
| [27] | Dong X, Bi H, Wu G, et al. Drought-induced chilling tolerance in cucumber involves membrane stabilization improved by antioxidant system[J]. International Journal of Plant Production, 2013, 7(1): 67–80. |
| [28] | Jane L, Marc R K, Protection against heat stress-induced oxidative damage in Arabidopsis involves calcium, abscisic acid, ethylene acid[J]. Protection against heat stress-induced oxidative damage in Arabidopsis involves calcium, abscisic acid, ethylene, and salicylic acid[J]. Plant Physiology, 2002, 128: 682–695. DOI:10.1104/pp.010320 |
| [29] | Sofo A, Dichio B, Xiloyannis C, et al. Lipoxygenase activity and proline accumulation in leaves and roots of olive trees in response to drought stress[J]. Plant Physiology, 2004, 121: 58–65. DOI:10.1111/ppl.2004.121.issue-1 |
| [30] |
王萍, 张成军, 陈国祥. 低温对水稻剑叶膜脂过氧化和脂肪酸组分的影响[J].
作物学报, 2006, 32(4): 568–572.
Wang P, Zhang C J, Chen G X. Effects of low temperature on lipid peroxidation and fatty acid composition of flag leaf in rice[J]. Acta Aronomica Sinica, 2006, 32(4): 568–572. |
| [31] |
罗宁, 魏湜, 李晶, 等. 低温胁迫对玉米苗期根系特征及电导率的影响[J].
生态学杂志, 2014, 33(10): 2694–2699.
Luo N, Wei T, Li J, et al. Effects of low-temperature stress on root system characteristics and electric conductivity of maize seedlings[J]. Chinese Journal of Ecology, 2014, 33(10): 2694–2699. |
| [32] |
辛慧慧, 李防洲, 侯振安, 等. 低温胁迫下棉花幼苗对外源水杨酸的生理响应[J].
植物生理学报, 2014, 50(5): 660–664.
Xin H H, Li F Z, Hou Z A, et al. Physiological response of cotton seedlings to exogenous salicylic acid under low temperature stress[J]. Plant Physiology Journal, 2014, 50(5): 660–664. |
| [33] |
郭莹, 杨晓云, 司朝光, 等. 不同形态氮素营养对大白菜芝麻状斑点病发生的影响[J].
园艺学报, 2011, 38(8): 1489–1497.
Guo Y, Yang X Y, Si C G, et al. Effects of different ratios of NO3–-N: NH4+-N on black sesame spot in Chinese cabbage [J]. Acta Horticulturae Sinica, 2011, 38(8): 1489–1497. |
| [34] |
李春燕, 陈思思, 徐雯, 等. 苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响[J].
作物学报, 2011, 37(12): 2293–2298.
Li C Y, Chen S S, Xu W, et al. Effects of low temperature at seedling stage on antioxidation enzymes and cytoplasmic osmoticum of leaves in wheat cultivar Yangmai 16[J]. Acta Agronomica Sinica, 2011, 37(12): 2293–2298. DOI:10.3969/j.issn.1000-2561.2011.12.019 |
| [35] |
武辉. 低温胁迫下棉花幼苗生理生化响应机制的研究[D]. 乌鲁木齐: 新疆农业大学硕士学位论文, 2012.
Wu H. Study of physiological and biochemical response mechanism of cotton seedlings under low temperature stress [D]. Urumqi: MS Thesis of Xinjiang Agricultural University, 2012. |
| [36] |
陈菲. 低温胁迫对耧斗菜脯氨酸和可溶性蛋白质含量的影响[J].
北方园艺, 2011,, (5): 29–31.
Chen F. Influence of cold resistance on the contents of the dissociative proline and the dissoluble albumen of Aquilegia vulgaris [J]. Northern Horticulture, 2011,, (5): 29–31. |
| [37] | Imahori Y, Takemura M, Bai J. Chilling-induced oxidative stress and antioxidant responses in mume (Prumus mume) fruit during low temperature storage [J]. Postharvest Biology and Technology, 2008, 49: 54–60. DOI:10.1016/j.postharvbio.2007.10.017 |
| [38] | Ashraf M. Biotechnological approach of improving plant salt tolerance using antioxidants as markers[J]. Biotechnology Advances, 2009, 27: 84–93. DOI:10.1016/j.biotechadv.2008.09.003 |
| [39] | Bowler C, Montagu M V, Inze D. Superoxide dismutase and stress tolerance[J]. Annual review of plant physiology and plant molecular biology, 1992, 43: 83–116. DOI:10.1146/annurev.pp.43.060192.000503 |
| [40] |
张福锁, 樊小林, 李晓林. 土壤与植物营养研究新动态(第二卷)[M]. 北京: 中国农业出版社, 1995.
Zhang F S, Fan X L, Li X L. The new dynamics of soil and plant nutrition (2nd volume)[M]. Beijing: China Agriculture Press, 1995. |
| [41] |
李建设, 耿广东, 程智慧. 低温胁迫对茄子幼苗抗寒性生理生化指标的影响[J].
西北农林科技大学学报, 2003, 31(2): 90–96.
Li J S, Gen G D, Cheng Z H. Effects of chilling stress on chill-resistance physiological and biochemical indexes of eggplant seedlings[J]. Journal of Norhtwest University of Agriculture and Forestry, 2003, 31(2): 90–96. |
| [42] |
王利超, 王涵, 朴世领, 等. 铵硝氮配比对烤烟生长生理及产量和品质的影响[J].
西北农林科技大学学报(自然科学版), 2012, 40(12): 136–144.
Wang L C, Wang H, Piao S L, et al. Effects of different nitrogen forms on the growth, photosynthesis, yield and quality of tobacco[J]. Journal of Northwest University of Agriculture and Forestry (Natural Science Edition), 2012, 40(12): 136–144. |
| [43] |
马晓霞. 浮萍对不同氮素形态和水平的代谢响应[D]. 重庆: 重庆大学硕士学位论文, 2012.
Ma X X. The metabolic response of duckweed to different nitrogen species and concentrations [D]. Chongqing: MS Thesis of Chongqing University, 2012. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 
