磷是植物生长发育的必需大量营养元素。由于土壤矿物对磷具有强烈的吸附固定作用,造成土壤磷移动性差,从而导致其作物有效性低,成为限制植物生长及产量提高的因素。因此,提高土壤磷高效吸收利用的根际过程一直是植物营养学研究热点之一。土壤中微生物的活动对土壤磷素的活化和利用影响很大,其中丛枝菌根 (abuscular mycorrhizal,AM) 真菌对植物根系的侵染可以促进宿主植物对水分和养分的吸收,改善植物营养状况[1],尤其是在低磷条件下可提高植物对磷素的吸收[2–3],促进植物的生长发育,这也是植物在长期进化过程中形成的协助植物从土壤中摄取磷的特定适应机制[4]。AM 真菌根外菌丝与根系相比较,菌丝可延伸到更加广泛的区域获取磷素[1]。现已研究发现大约 80% 的植物磷素是通过 AM 真菌吸收的。
AM 真菌在自然界中分布广泛,能与绝大多数陆地植物形成共生体即丛枝菌根。AM 真菌具有生态专性共生特性,不同 AM 真菌在与植物建立共生关系时具有一定的选择性[5]。研究发现不同种类真菌以及相同物种不同基因型的真菌,因生境条件的差异,接种同一植物后其侵染发育状况及菌根功能效应存在差异[6–7]。本研究采用温室盆栽试验的方法,以玉米为宿主植物,测定了 4 种磷水平土壤中,AM 真菌的菌根侵染状况、孢子数、菌丝量等,从氮、磷平衡角度研究了土壤磷对不同丛枝菌根真菌发育及其对宿主植物生长和养分吸收的影响,为有效应用菌根技术,提高土壤养分利用率提供依据。
1 材料与方法 1.1 试验材料供试植物玉米品种为‘京科糯 2000’,由京研种业提供。供试土壤采自北京市大兴区长子营镇沙壤土,土壤有机质 2.27 g/kg、全磷 0.49 g/kg、全钾 27.4 g/kg、全氮 1.2 g/kg、速效磷 1.4 mg/kg、碱解氮 15.4 mg/kg、速效钾 42.0 mg/kg、pH 为 7.9、电导率 16.2 μS/cm。供试土壤经风干,过 2 mm 网筛后,在 105℃ 下湿热间歇灭菌 2 次后备用。试验采用白色塑料花盆 (210 mm × 170 mm),每盆装土 2 kg。
供试 AM 真菌菌种取自本单位丛枝菌根真菌种质资源库收藏的Funneliformis mosseae (BGC XJ06A)、Claroideoglomus claroideum (BGC XJ06F)、Rhizophagus aggregatus (BGC XJ06D)、Claroideoglomus etunicatum (BGC XJ06C)、Diversispora eburnea (BGC XJ06B)、Diversispora spurca (BGC XJ06E) 6 个菌种,依次标记为 F.m、C.c、R.a、C.et、D.eb、D.s。试验所用接种剂均用高粱扩繁,接种物含有真菌孢子、菌丝、侵染根段等繁殖体及混合基质。接种方法是在播种玉米前时按 30 g/pot 接种量将菌剂平铺于种子下方 2 cm 深的土层中,不接种处理加入等量的灭菌菌剂。
1.2 试验设计试验设 4 个施磷水平,依次为 0、50、200、500 mg/kg,标记为 P0、P50、P200、P500;同一施磷水平设接种 F.m、C.c、R.a、C.et、D.eb、D.s 和不接种菌剂 (以下简称 CK) 7 个处理;试验共 28 个处理,每个处理 4 次重复。为保证玉米正常生长,以营养液的形式一次施入底肥 N 200 mg/kg、K 150 mg/kg、Mg 100 mg/kg、Zn 5 mg/kg、Mn 5 mg/kg、Cu 5 mg/kg。
玉米种子经 1% 的甲醛消毒和清水冲洗并浸种后,于 28℃ 恒温催芽,出芽后选取生长一致的种子播种。每盆播 3 颗种子,出苗后间留一株长势一致的苗。试验于 2014 年 4 月 2 日至 6 月 6 日在北京市农林科学院植物营养与资源研究所温室进行。塑料盆随机摆放,期间每天浇水一次。
1.3 收获与分析测定玉米生长 2 个月后,将植株地上部、地下部分别收获。将根系用自来水和去离子水冲洗干净,取 0.5 g 根样剪成 1 cm 根段,用于菌根侵染率测定,剩余的根系和地上部样品放入信封纸袋,105℃ 杀青 30 min 后于 70℃ 烘 48 h,称取干重并粉碎用于测定植株养分含量。取部分混合均匀土壤样品测定菌丝密度和孢子密度。
1.3.1 植株氮、磷含量测定 植株样品经 H2SO4-H2O2 消煮后,用电感耦合等离子发射光谱仪 (ICP) 测定磷浓度,用凯氏定氮仪测定氮,同时加入国家标准局提供的标准物质以保证样品测定过程中的准确性。
1.3.2 菌根侵染率、菌丝密度、孢子数测定 取鲜根系,切成 1 cm 左右的根段,将根段用墨水醋染色方法[8]染色,选取 30 条根段制片,镜检。根据根段中菌根侵染强度分级标准 0、< 10%、< 50%、> 50% 和 > 90%,丛枝丰度分级标准 0、< 50%、> 50%,定义每条根段,把每条根的分级定义输入“MYCOCALC”软件,计算出 F%、M%、A% 等参数。F% 代表整个根系中 AM 真菌侵染率,M% 代表整个根系中 AM 真菌结构形成的强度,A% 代表整个根系中丛枝结构形成的丰度。土壤样品中菌丝密度采用真空泵微孔滤膜抽滤方法[9]测定,在体视显微镜下计数湿筛分离法获得的孢子测定土壤样品中的孢子数。
1.4 数据分析试验数据用 Microsoft Excel 进行整理并作图,用 SAS 统计分析软件 (Version 6.12) 对数据进行方差分析,LSD 法多重比较平均数间的差异显著程度 (P < 0.05)。
2 结果与分析 2.1 玉米菌根侵染状况表 1 显示,不接种处理的玉米根系均没有被 AM 真菌侵染。在 P50 条件下,玉米根系中 AM 真菌侵染率 (F%),AM 真菌结构形成的强度 (M%) 和丛枝结构形成的丰度 (A%) 相对于不加磷 (P0) 处理都有明显的增加,当磷处理增加到 P200 和 P500 时,菌根的 F%、M%、A% 都在持续的降低,可见玉米菌根侵染状况随土壤磷含量增加呈促进作用,但当磷含量达到高磷水平时,会抑制 AM 真菌的侵染。在 P0 和 P50 条件下,接种 F.m 处理 F% 均大于 75%,表明 75% 以上的根系有菌根侵染点存在,且该菌的丛枝结构在根系中的比例也均大于 50% (M%、A%),是侵染的四级水平,显著高于其他五个 AM 真菌接种处理,接种 C.c、R.a、C.et 的菌根侵染状况均好于接种 D.s、D.eb 处理。在高磷 P200 和 P500 条件下,仅有 F.m 真菌处理的侵染状况良好,其他菌种侵染状况较差,甚至没有侵染。表明不同磷处理下,不同 AM 真菌对玉米的侵染能力存在明显差异。
| 表1 不同磷水平下玉米菌根侵染状况 Table 1 Colonization of maize plants inoculated with AM fungi at different P levels |
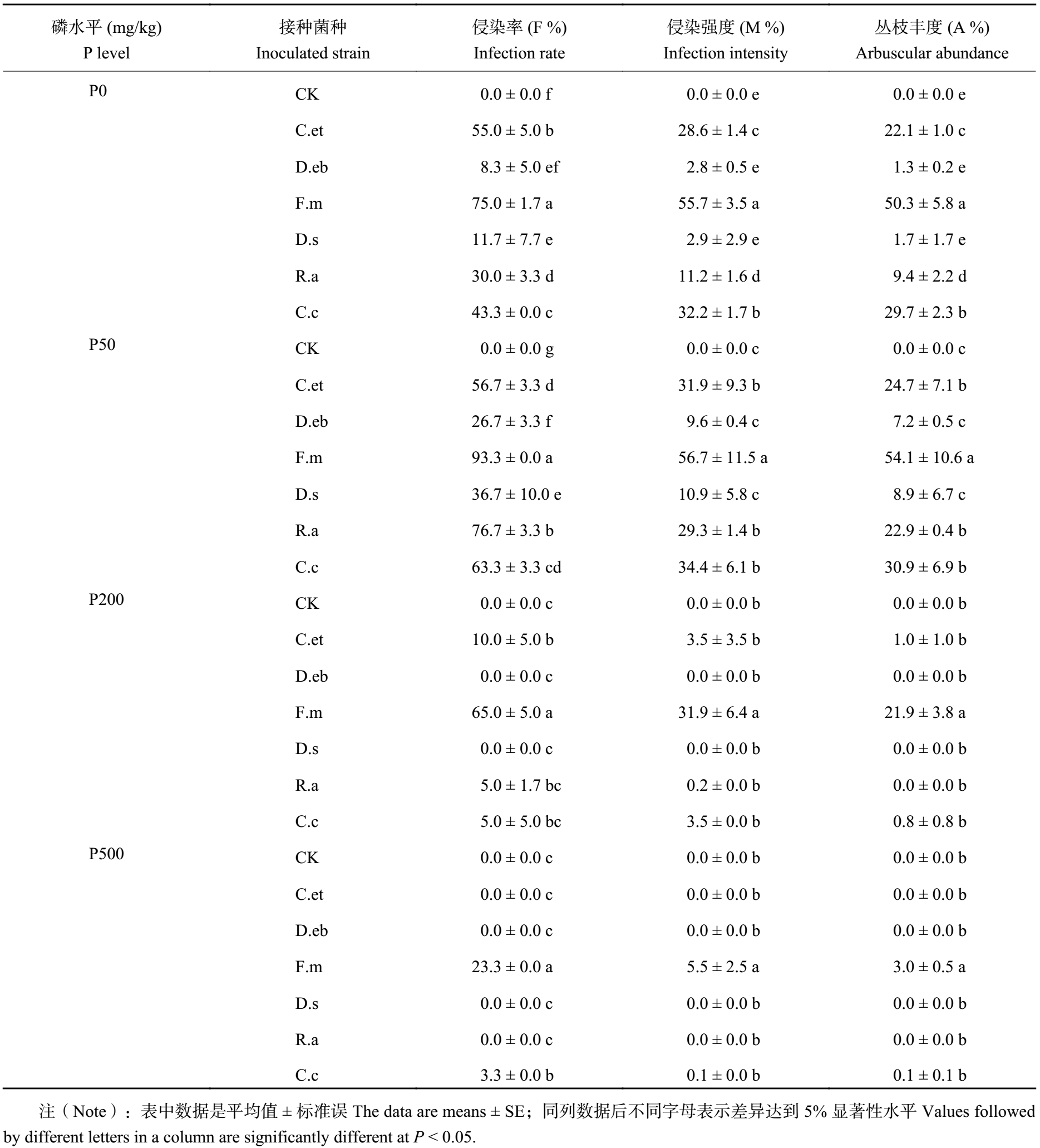 |
不同 AM 真菌产孢和菌丝生长能力差异明显,且不同磷水平土壤对 AM 真菌生物量的影响也不同 (表 2)。在 P50 条件下,AM 真菌的孢子数、菌丝密度明显高于不加磷 P0 处理,且当磷水平增加到 P200 和 P500 时,孢子数、菌丝密度随土壤磷含量增加而降低。在 P0 和 P50 条件下,C.c、R.a、C.et、F.m 处理真菌的孢子数、菌丝密度均显著高于 D.s、D.eb 处理,孢子数 C.c > R.a > C.et > F.m,菌丝密度 F.m > C.c > R.a 和 C.et。在高磷 P200 和 P500 处理下,接种 F.m 真菌孢子数、菌丝密度最高,其他菌种因侵染状况较差其生物量也很少。可见不同磷水平对不同 AM 真菌生物量的影响规律与侵染能力的影响一致。
| 表2 不同磷水平下 AM 真菌生物量 Table 2 Biomass of AM fungi at different P levels |
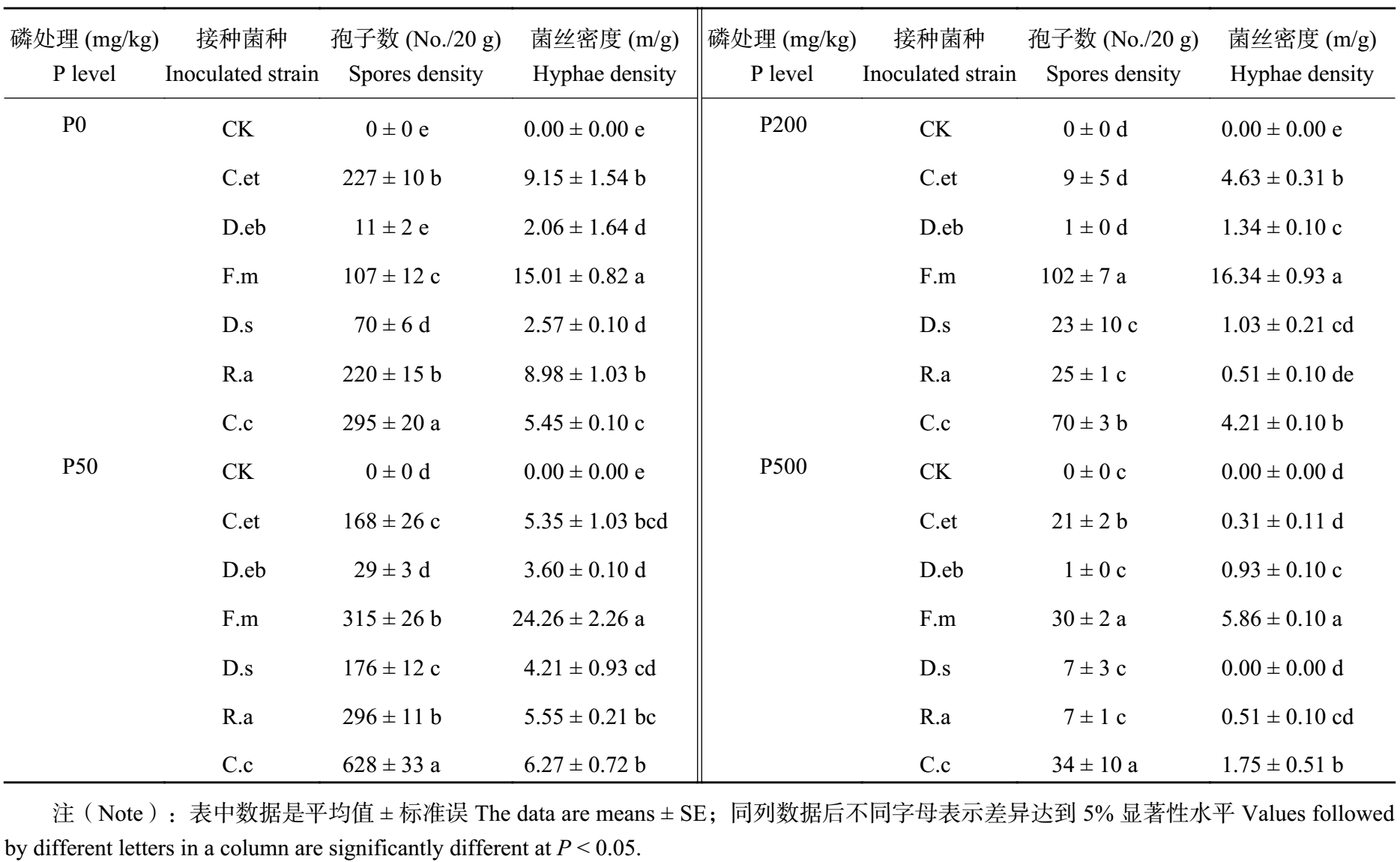 |
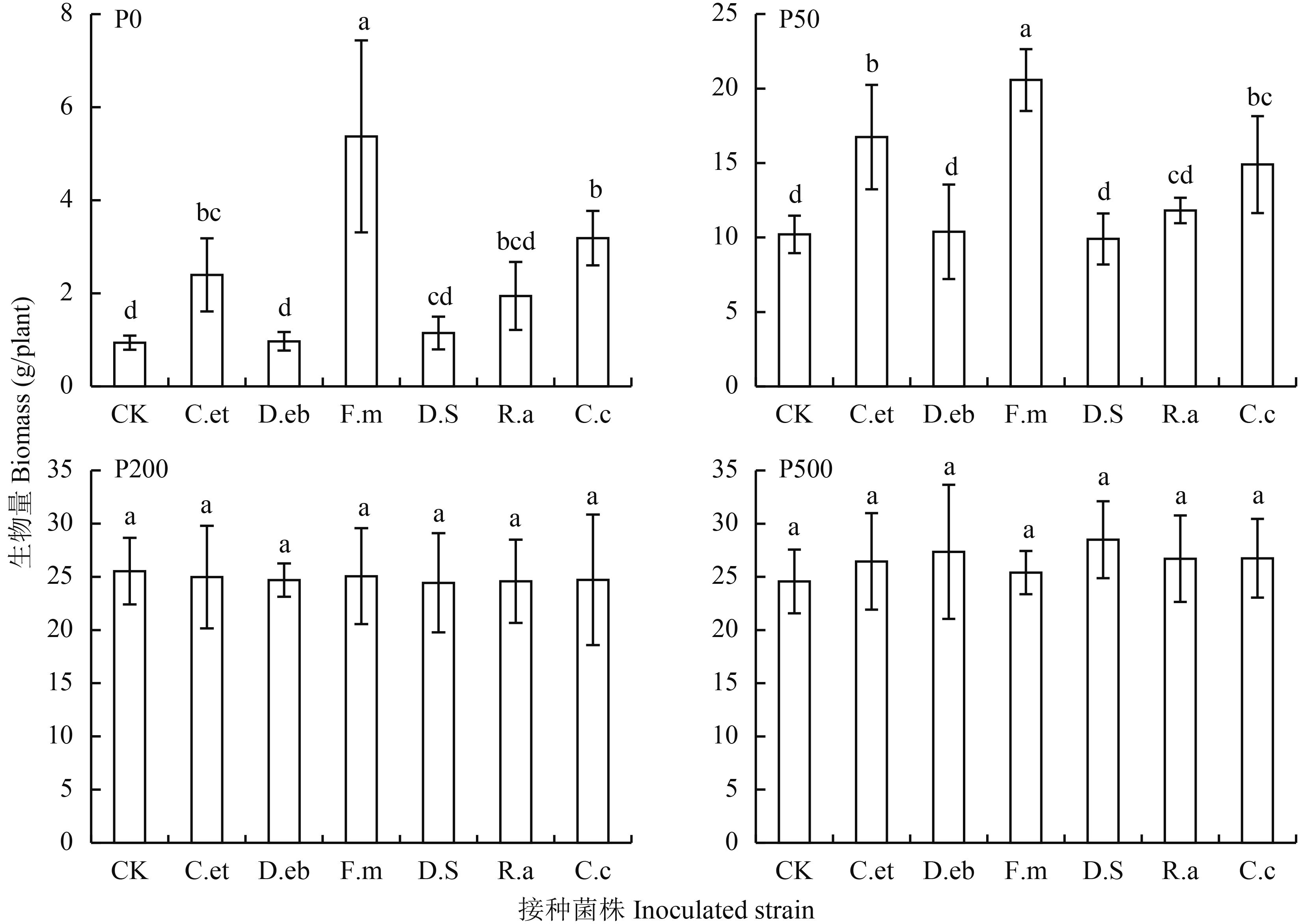
图 1 结果可以看出,在 P0 和 P50 处理下,接种不同 AM 真菌对玉米生物量有不同影响,接种 F.m、C.c、C.et 处理显著高于不接种对照处理,表明 AM 真菌对玉米植株的生长有一定的促进作用。在高磷 P200 和 P500 处理下,不接种对照与接种不同 AM 真菌对玉米生物量没有影响,且高磷处理的玉米生物量明显高于低磷处理。
 |
|
图1
不同磷水平下接种 AM 真菌对玉米生物量的影响
Fig. 1
Effects of inoculation with AM fungi on biomass of maize at different P levels
|
不同磷水平土壤对玉米植株 N 含量的影响不同,其氮的含量表现为 P0 > P50 > P200 > P500 ( 图 2)。在不加磷 P0 水平下,接种处理均显著降低了玉米植株中氮含量,在 P50 水平下,接种处理 F.m、R.a、D.eb 植株 N 含量显著低于不接种对照。在高磷 P200 和 P500 两个水平下接种处理间无显著差异。
 |
|
图2
不同磷水平下接种 AM 真菌对玉米植株氮含量的影响
Fig. 2
Effects of inoculation with AM fungi on shoot N concentrations of maize at different P levels
|
在不加磷 (P0) 水平下,接种处理均显著促进了玉米植株中磷含量的提高。在 P50 水平下,仅有接种处理 F.m 植株磷含量显著高于不接种对照。在 P200 和 P500 两个水平下接种处理间无显著差异 (图 3)。
 |
|
图3
不同磷水平下接种 AM 真菌对玉米植株磷含量的影响
Fig. 3
Effects of inoculation with AM fungi on shoot P concentrations of maize at different P levels
|
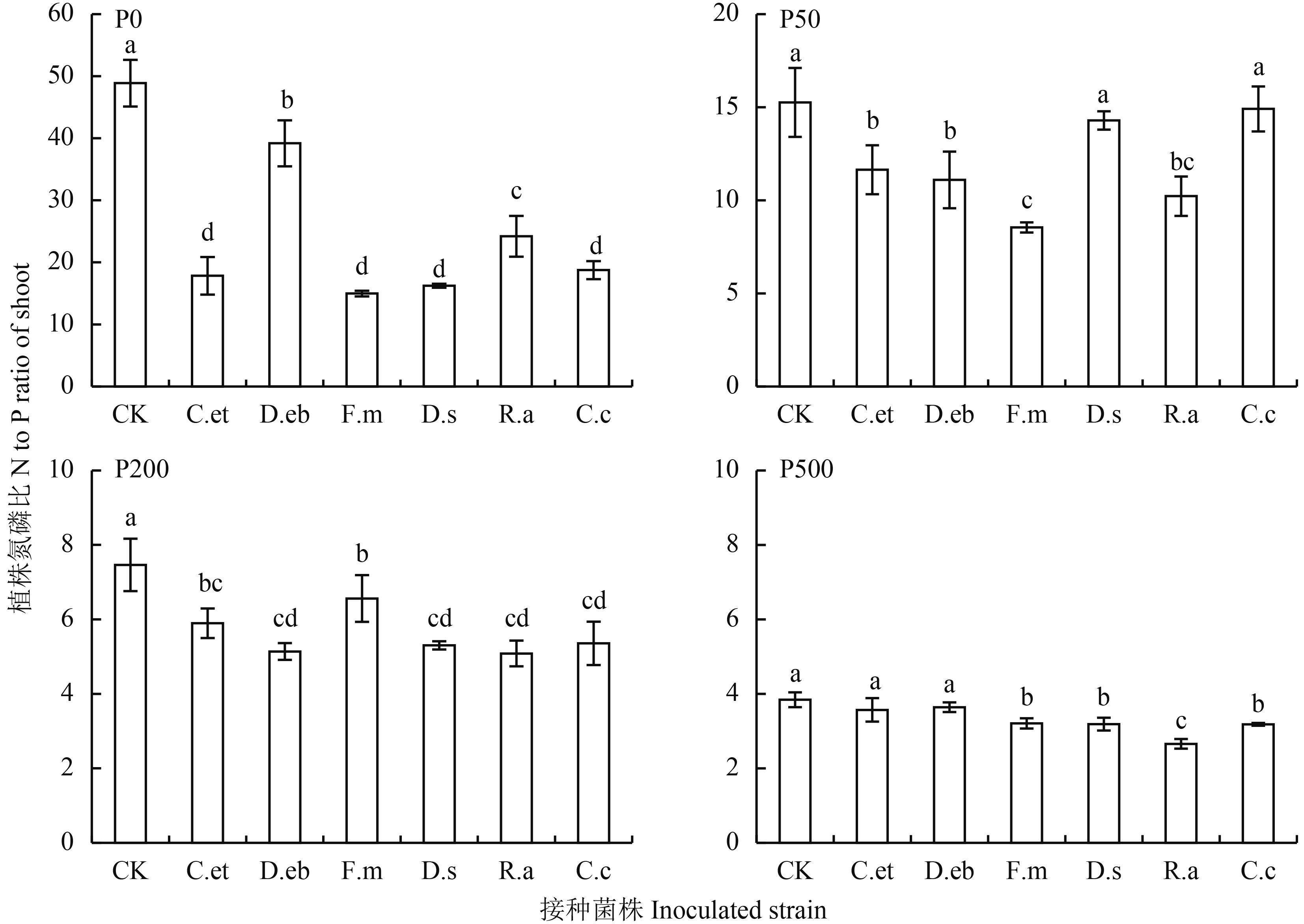
在 P0、P50、P200 水平下,接种 AM 真菌处理降低了玉米植株中 N/P 比 (图 4),且不同菌种间存在差异,接种真菌 F.m 处理的 N/P 比最小。从图 5 可看出,在 P0、P50 处理,AM 真菌侵染率与植株 N/P 比值成负相关关系,P0 处理 r 值为 0.716,P50 处理的 r 值为 0.573。在高磷 P500 水平下,各处理玉米植株 N/P 比无显著差异。
 |
|
图4
不同磷水平下接种 AM 真菌对玉米植株氮磷比的影响
Fig. 4
Effects of inoculation with AM fungi on N/P ratios of maize at different P levels
|
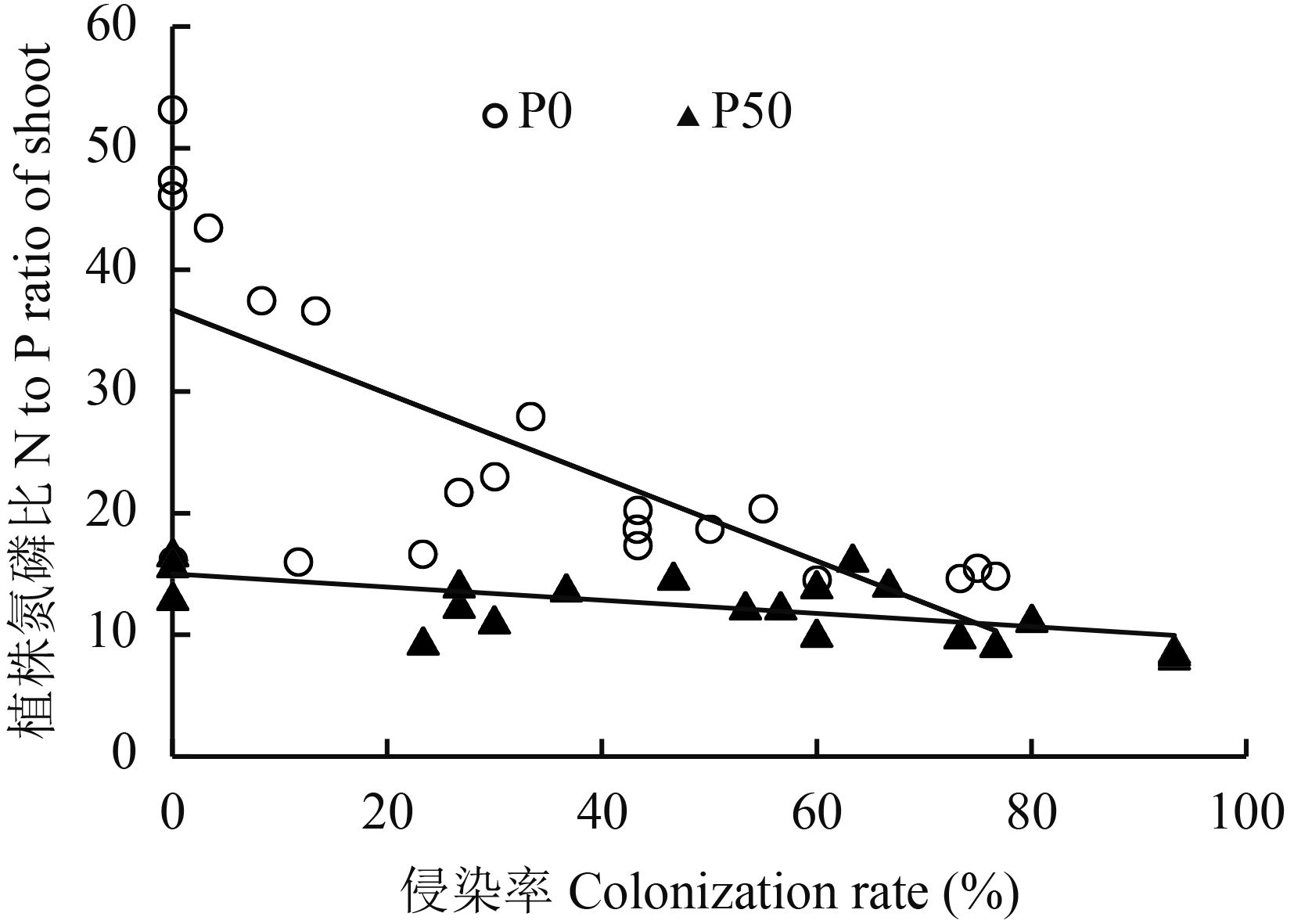 |
| 图5 玉米植株氮磷比与 AM 真菌侵染率相关性 Fig. 5 The correlation between N/P ratios of maize and colonization rate of AM fungi at different P levels |
菌根侵染率是表示 AM 真菌是否与宿主植物建立共生关系的重要指标,能衡量其生态适应性,在一定程度上决定植物的生长与抗逆性能力[10]。本研究表明在土壤磷含量 50 mg/kg 水平下,玉米菌根的侵染、菌根结构、菌丝密度及孢子数比不施磷水平显著增加,当磷处理增加到 200 mg/kg 和 500 mg/kg 时,菌根侵染状况及生物量持续降低,可见土壤低磷含量对 AM 真菌侵染宿主植物根系有促进作用,但会随着磷含量的升高,促进效果逐渐降低,直至最后呈抑制侵染作用。大量研究也证实,磷素营养与菌根形成关系最为密切,即土壤磷水平显著影响菌根侵染率,从而影响菌丝和孢子的繁殖[11]。极端缺磷时,提高磷的供应会促进菌根真菌的生长发育,但超过了一定磷水平,则开始抑制其侵染和繁殖[2, 12]。这可能是因为当土壤中的 P 浓度大于 200 mg/kg 时,可以满足玉米体内磷的需求,使得玉米不再需要依赖 AM 真菌的作用,这时 AM 真菌的存在会和玉米竞争养分,从而抑制 AM 真菌对玉米根系的侵染。而且不同磷水平对不同 AM 真菌生物量的影响规律与侵染能力的影响一致。
本研究结果显示,不同磷水平及同一磷水平下,不同 AM 真菌对玉米的侵染、产孢和菌丝生长能力存在明显差异,主要由于 AM 真菌具有生态专性特点,所以不同 AM 真菌侵染同一宿主植物的能力也会不同。在 P0 和 P50 条件下接种 F.m、C.c、R.a、C.et 的菌根侵染状况均好于接种 D.s、D.eb 处理。在 P0 和 P50 条件下,C.c、R.a、C.et、F.m 处理真菌的孢子数、菌丝密度均显著高于 D.s、D.eb 处理。其中 F.m 侵染状况及菌丝密度最佳,但其孢子数次之;C.c、R.a 菌种侵染不佳但其孢子数最多,菌丝密度次之。这可能与不同菌种的侵染率、孢子数、菌丝密度等生物学指标存在差异有关,这与前期研究结果一致,即分离自宿主植物和来源地等生态条件不同的 AM 真菌,对土壤的生态适应能力及菌根结构繁殖能力表现不同[13–15]。在高磷水平 (P 200 和 500 mg/kg) 下,仅有 F.m 真菌不仅侵染状况良好,其生物量也最高,可见 F.m 对高磷土壤有很强的适应能力。
3.2 不同磷水平土壤接种 AM 真菌对玉米生物量,植株氮、磷含量及 N/P 比的影响AM 真菌与植物根系建立互惠共生体后,通过 AM 真菌根外菌丝来吸收土壤中的磷元素及其它营养元素并转运到宿主植物体内,改善植物营养状况,促进植物生长并提高产量,但 AM 真菌效应的发挥与土壤养分密切相关[16–17]。有研究表明,低磷更有利于菌根效应的发挥,过高磷条件 (大于 250 mg/kg 土) 时,靠植物根系直接吸收磷营养就能完全满足其正常生长需要,无需菌根真菌改善其磷营养状况[2]。同时,过量施用磷肥还能降低植物根系光合产物分配量,使菌丝完全成为消耗光合产物的消费者[18]。这正说明了低磷土壤中植物更需要 AM 真菌帮助其吸收转化磷养分,也就更利于 AM 真菌的侵染,使其更好的发挥菌根功能,同时高磷土壤中,植物不需要 AM 真菌,更不需要光合产物的竞争者,所以在高磷土壤中植物根系可能会分泌某种物质抑制 AM 真菌侵染。可见,只有土壤磷水平适宜时真菌才能表现出良好促生效应,本研究中玉米生物量的变化也证实这一点,且不同 AM 真菌对玉米生物量有不同影响,菌种 F.m、C.c、C.et 的促生效应显著高于其他菌种。
在 P0、P50 水平下,接种处理均显著提高了玉米植株中磷含量,而降低了玉米植株中氮含量,这可能是由于接种真菌后改善了植株磷营养状况,并促进了玉米生长,生物量增加的稀释效应导致氮含量的降低。
土壤养分条件会直接影响植物对养分的吸收与利用、植物 N/P 比化学计量特征以及生物量分配[19–20]。植物 N/P 比化学计量特征在一定程度能反映土壤中氮和磷的相对有效性,对于合理施肥管理有一定的指导作用[21]。因此 N/P 比的变化可以用来判断植物是受氮限制还是受磷限制[19, 22]。Gusewell[19]认为陆地植物 N/P 比 < 10 时表示植物受到氮限制,N/P 比 > 20 表示植物受到磷限制。本研究中在不同磷水平土壤接种 AM 真菌对玉米植株中 N/P 比变化的影响不同,在 P0、P50、水平下,接种 AM 真菌降低玉米植株 N/P 比到 10~24.2 之间,且不同菌种间存在差异,真菌 F.m 对玉米植物 N/P 比调节能力最强。表明在适量磷条件下,接种 AM 真菌通过根外菌丝扩大植物根系的吸收面积,从而增强对养分竞争能力,调节植株体 N/P 比达到平衡,从而能够促进玉米生长。
4 结论本文中土壤添加低量磷 (50 mg/kg) 更适合 AM 真菌的侵染及生长发育,也利于菌根效应的发挥,侵染能力及效应表现为菌种 F.m > C.c > R.a > C.et,且 F.m 为耐高磷菌种;本研究从植物 N/P 比生态化学计量特征角度探讨了接种不同菌根真菌对玉米生长和氮、磷养分吸收的影响,结果表明真菌 F.m 对玉米植物 N/P 比调节能力最强。可见,AM 真菌的存在会通过降低植物体内 N/P 比变化范围,以调节植物体中 N/P 比对环境养分供给的适用,从而使玉米生理代谢及对养分的需求达到最佳状态,这对于提高土壤养分利用有重要意义。
| [1] | Smith S E, Read D J. Mycorrhizal symbiosis (3rd edition)[M]. New York, USA: Academic Press, 2008. |
| [2] |
贺超, 贺学礼, 马丽, 陈伟燕. AM真菌和施磷量对黄芩光合特性和根系生长的影响[J].
西北农业学报, 2014, 23(11): 180–184.
He C, He X L, Ma L, Chen W Y. Effects of oculation AM Fungi and phosphote application on growth and photosynthetic characteristics of Scuteliaria baiealensis [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2014, 23(11): 180–184. DOI:10.7606/j.issn.1004-1389.2014.11.030 |
| [3] |
毕银丽, 孙江涛, Ypyszhan Zhakypbek, 等. 不同施磷水平下接种菌根玉米营养状况及光谱特征分析[J].
煤炭学报, 2016, 41(5): 1227–1235.
Bi Y L, Sun J T, Zhakypbek Y, et al. Hyperspectral characterization and nutrition condition of maize inoculated with arbuscularmycorrhiza in different phosphorus levels[J]. Journal of China Coal Society, 2016, 41(5): 1227–1235. |
| [4] |
韦莉莉, 卢昌熠, 丁晶, 俞慎. 丛枝菌根真菌参与下植物-土壤系统的养分交流及调控[J].
生态学报, 2016, 36(14): 4233–4243.
Wei L L, Lu C Y, Ding J, Yu S. Functional relationships between arbuscular mycorrhizal symbionts and nutrient dynamics in plant-soil-microbe system[J]. Acta Ecologica Sinica, 2016, 36(14): 4233–4243. |
| [5] | Van der Heijden M G. Different arbuscular Mycorrhizal fungal species are potential determinants of plant community structure[J]. Ecology, 1998, 79: 2082–2091. DOI:10.1890/0012-9658(1998)079[2082:DAMFSA]2.0.CO;2 |
| [6] | Van der Heijden E W, Kuyper T W. Does origin of mycorrhizal fungus or mycorrhizal plant influence effectiveness of the mycorrhizal symbiosis[J]. Plant and Soil, 2001, 230: 161–174. DOI:10.1023/A:1010377320729 |
| [7] | Liu H L, Tan Y, Nell M, et al. Arbuscular mycorrhizal fungal colonization of Glycyrrhizaglabra roots enhances plant biomass, phosphorus uptake and concentration of root secondary metabolites [J]. Journal of Arid Land, 2014, 6(2): 186–194. DOI:10.1007/s40333-013-0208-5 |
| [8] | Vierheilig H, Coughlan A P, Wyss U, Piche Y. Ink and vinegar, a simple staining technique for arbuscular-mycorrhizal fungi[J]. Applied and Environmental Microbiology, 1998, 64(12): 5004–5007. |
| [9] | Jakobsen I, Abbott L K, Robson A D. External hyphae of vesicular-arbuscular mycorrhizal fungi associated withTrifolium subterraneum L. 1. spread of hyphae and phosphorus in flow into roots [J]. New Phytologist, 2006, 120: 371–380. |
| [10] |
王晓英, 王冬梅, 陈保冬, 等. 丛枝菌根真菌群落对白三叶草生长的影响[J].
生态学报, 2010, 30(6): 1456–1462.
Wang X Y, Wang D M, Chen B D, et al. Growth response of white clover to inoculation with different arbuscular mycorrhizal fungi communities[J]. Acta Ecologica Sinica, 2010, 30(6): 1456–1462. |
| [11] | Mcarthur D A J, Knowles N R. Influence of vesicular-arbuscular mycorrhizal fungi on the response of potato to phosphorus deficiency[J]. Plant Physiology, 1993, 101: 147–160. DOI:10.1104/pp.101.1.147 |
| [12] | Chen B D, Roos P, Borggaard O K, et al. Mycorrhiza and root hairs in barley enhance acquisition of phosphorus and uranium from phosphate rock but mycorrhiza decreases root to shoot uranium transfer[J]. New Phytologist, 2005, 165: 591–598. |
| [13] |
张淑彬, 纪晶晶, 王幼珊, 等. 内蒙古露天煤矿区回填土壤具生态适应能力丛枝菌根真菌的筛选[J].
生态学报, 2009, 29(7): 3730–3738.
Zhang S B, Ji J J, Wang Y S, et al. The screening of arbuscular mycorrhizal fungi with high ecological adaptations in back fill soil of open pitmining area in Inner Mongolia[J]. Acta Ecologica Sinica, 2009, 29(7): 3730–3738. |
| [14] |
刘邦芳, 赵淇, 朱均, 等. 灰棕紫泥土中具生态适应能力丛枝菌根真菌的筛选[J].
西南农业大学学报(自然科学版), 2006, 28(4): 577–609.
Liu B F, Zhao Q, Zhu J, et al. Screening of arbuscular mycorrhizal fungi with high ecological adaptations in purple soil[J]. Journal of Southwest Agricultural University (Natural Science), 2006, 28(4): 577–609. |
| [15] |
王幼珊, 张美庆, 张弛, 等. VA菌根真菌抗盐碱菌株的筛选[J].
土壤学报, 1994, 31(增刊2): 79–83.
Wang Y S, Zhang M Q, Zhang C, et al. Selection of salt tolerant isolate of VA mycorrhizal fungi[J]. Acta Pedologica Sinica, 1994, 31(Suppl.): 79–83. |
| [16] |
王平, 贺学礼, 赵丽莉, 等. 真菌和施氮量对黄芩幼苗生长和微量元素的影响[J].
华北农学报, 2012, 27(增刊2): 259–263.
Wang P, He X L, Zhao L L, et al. Effects of inoculation AM fungi and phosphote application on growth and photosynthetic characteristics of Scuteliaria baiealensis [J]. Acta Agriculturae Boreali-Sinica, 2012, 27(Suppl.): 259–263. |
| [17] | Hart M M, Forsythe J A. Using arbuscularmycorrhizal fungi to improve the nutrient quality of crops; nutritional benefits in addition to phosphorus[J]. ScientiaHorticulturae, 2012, 148: 206–214. |
| [18] | He X L, Li Y P, Zhao L L. Dynamics of arbuscular mycorrhizal fungi and glomalin in the rhizosphere of Artemisia ordosica Krasch. in Mu Us sandland, China [J]. Soil Biology & Biochemistry, 2010, 42(8): 1313–1319. |
| [19] | Güsewell S. N: P ratios in terrestrial plants: variation and functional significance[J]. New Phytologist, 2004, 164(2): 243–266. DOI:10.1111/j.1469-8137.2004.01192.x |
| [20] | Tessier J T, Raynal D J. Use of nitrogen to phosphorus ratios in plant tissue as an indicator of nutrient limitation and nitrogen saturation[J]. Journal of Applied Ecology, 2003, 40(3): 523–534. DOI:10.1046/j.1365-2664.2003.00820.x |
| [21] |
陈梅梅. 丛枝菌根真菌对植物生态化学计量比的影响及其效应研究[D]. 北京: 中国科学院博士学位论文, 2008.
Chen M M. The response of CNP stoichiometry of plant to AMF colonization and its effects on ecosystems [D]. Beijing: PhD Dissertation, Chinese Academy of Sciences, 2008. |
| [22] | Wright I J, Reich P B, Comelissen J H C, et al. Assessing the generality of global leaf trait relationships[J]. New Phytologist, 2005, 166(2): 485–496. DOI:10.1111/j.1469-8137.2005.01349.x |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 
