2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
氮是植物生长必需的大量元素[1],土壤中供给植物生长的氮素形态主要是无机态的 NH4+-N 和 NO3–-N[2–3]。玉米作为世界重要的粮食及能源作物,生长在通气良好的旱地土壤中,因而硝酸盐是其主要的氮素来源。一般认为玉米因其所处的环境,该作物可能具有高效的硝态氮吸收利用特征。
近年来人们也发现,虽然在土壤溶液中硝态氮浓度远高于铵态氮[4],但铵态氮的存在对玉米的生长具有促进作用。与硝酸根相比,根系吸收和同化铵所消耗的能量较少;甚至在其浓度较低的情况下,铵仍是植物优先吸收的氮源。土壤中少量铵的存在可促进根系生长和后期的籽粒灌浆。此外,根系吸收铵的过程中产生的 H+ 可使根际土壤酸化,从而提高磷、铁等微溶营养元素的利用效率[5–8]。玉米在喇叭口期通常需要追施氮肥,促进植株迅速生长,从一个侧面反映了玉米根系对铵态氮肥的有效吸收和利用。
在玉米生长环境中,由于土壤的通气状况良好使硝化作用增强。土壤中施入铵态氮肥后,因集中施用 (穴施或沟施) 使铵态氮在根系周围存留较长的时间,因此,玉米根系对铵态氮的吸收利用是其氮素营养的重要组成部分。植物对铵的吸收主要是由根系中的一系列铵转运体 (ammonium transporter,AMT) 介导的[9–11]。研究这些基因及其编码蛋白对铵的响应规律,有助于进一步理解玉米的氮素营养及响应机制。
玉米对氮素营养特征应包括其对 NH4+-N 和 NO3–-N 的综合吸收利用能力。以往的认识主要集中在玉米植株对硝态氮的利用方面,而对其利用铵态氮的能力和特征还未引起足够重视。很多报道表明,与单一的 NH4+-N 或 NO3–-N 营养相比,铵硝混合更有利于植物生长,可提高氮素吸收、干物质积累和经济产量[12–14]。但是铵硝混合条件下,不同形态氮素相互影响的作用机理目前尚不清楚。所以通过研究玉米的铵硝营养特征,揭示玉米利用铵态氮的能力和特征,对今后玉米施肥具有一定指导意义。
前人有关玉米铵硝营养特征的研究,主要集中在生物学表现 (生物量和产量)、离子吸收特性、含氮量及相关基因的表达方面。本文采用水培试验模拟田间的铵硝状况,研究了玉米苗期对氮素及氮素形态的生长响应;采用实时的非损伤微测技术,研究不同供氮形态和供氮水平条件下玉米根系对 NH4+ 和 NO3– 的吸收动力学特征;利用实时定量 PCR 技术,研究了玉米根系中 AMT 基因对铵的响应特征。
1 材料与方法 1.1 供试材料供试玉米品种为我国北方种植面积最大的高产品种郑单 958,从南京市玄武区蔬菜种子公司购得。
1.2 植株培养试验试验于 2015 年 5 月至 7 月在中国科学院南京土壤研究所温室中进行。挑选饱满、大小一致的玉米种子,用 2.5% 次氯酸钠对种子进行表面消毒 15 min,蒸馏水浸没下表面 24 h 后,放置于尼龙网上,暗处发芽。待其长出真叶后,选择长势一致的幼苗,移至容积为 1.2 L 的 PVC 培养桶 (9.5 cm × 9 cm × 12.5 cm) 中培养,上覆遮光 4 孔塑料盖,每桶 4 穴,每穴留苗 2 颗。一周后,用改良后不加氮的 Hoagland 全营养液培养,温室培养条件为 27℃/25℃ (昼/夜),16 h 光照/8 h 黑暗周期 [相对湿度为 70%,光强为 400 μmol/(m 2·s)]。两周后分别进行缺氮、单一供应铵态氮、单一供应硝态氮处理。缺氮为不加氮 (其余营养元素同完全 Hoagland 营养液),单一供应铵态氮为 0.5 mmol/L 硫酸铵,单一供应纯硝态氮为 1 mmol/L 硝酸钠 [为确保营养液中没有发生硝化过程,加入硝化抑制剂:0.7 μmol/L 二氰二氨 (C2H4N4)]。共 3 个处理,每处理设 3 个重复。营养液用 NaOH 和 HCl 溶液调节 pH 至 6.5 左右,每 3 天更换一次营养液。处理 7 天后,收获植株并测定相关指标。
1.3 植物生长指标的测定供试玉米水培处理 7 天后收获。植株分为地上部和根系,分别测量鲜重、干重。地上部分取样时,直接剪取后用双蒸水冲洗,擦干;地下部分取整株根系于 0.1 mmol/L CaSO4 溶液中浸泡 5 分钟,并用双蒸水冲洗以除去附属于根系表面的离子。干样经粉碎、消煮 (H2SO4–H2O2 消煮法) 后用化学分析仪测定全氮含量[15]。
1.4 玉米根系对 NH4+ 和 NO3– 的吸收动力学特征的研究玉米根系 NH4+ 吸收动力学实验采用非损伤微测技术 (Non-invasive Micro-Test,NMT,北京旭月科技有限公司)。选择清水中发芽一周的幼苗,于含有 0.25 mmol/L NH4NO3 的营养液中培养两周。测定前分别进行氮饥饿处理 (3 d) 或维持正常培养。根据根的位置和形态,分别选取健康、一致的不定根用于非损伤测定。首先从根尖开始对根系不同根段进行扫描,找到铵的最大吸收位点。平衡溶液采用无 N 基本溶液 (pH 5.5),平衡 10 min,扫描时测试溶液分别用 100 μmol/L NH4Cl 和 100 μmol/L NaNO3 进行 NH4+ 和 NO3– 流速的检测。
在最大吸收点处附近,分别灌流不同浓度的铵溶液:20、30、50、75、100、125 μmol/L NH4Cl,从低到高每个浓度下记录五分钟流速;然后分别记录 5 min 在灌流 100 μmol/L NH4NO3 时的 NH4+ 和 NO3– 的流速,以观察铵根对硝酸根以及硝酸根对铵根吸收的影响。
通常采用 Michaelis-Menten 动力学方程[16]表示植物对离子等的吸收状况,在离子吸收过程中,动力学参数 Vmax 值和 Km 值是反映植物吸收该离子的重要特征[17]。本研究参照前人方法[17]计算不同处理植株铵离子吸收的 Vmax 值和 Km 值。
1.5 根系 AMT 基因表达丰度的测定对缺氮、纯铵、纯硝处理 24 h 的玉米根系,取样后迅速置于液氮中 –80℃ 冻存,每个处理 3 次重复。根系总 RNA 的提取利用 TaKaRa 公司的 RNA 提取 TRizol 试剂盒进行;定量 PCR 的 cDNA 模板制备用 TaKaRa 公司的反转录试剂盒进行。以玉米的看家基因ZmActin (AJ420856.1) 作为内标。定量 PCR 引物参考 Gu 等的方法[18]。
1.6 数据处理与分析数据统计分析使用 SPSS (16.0),用 T-test 进行显著性分析。采用 SigmaPlot 13.0 绘图工具作图。
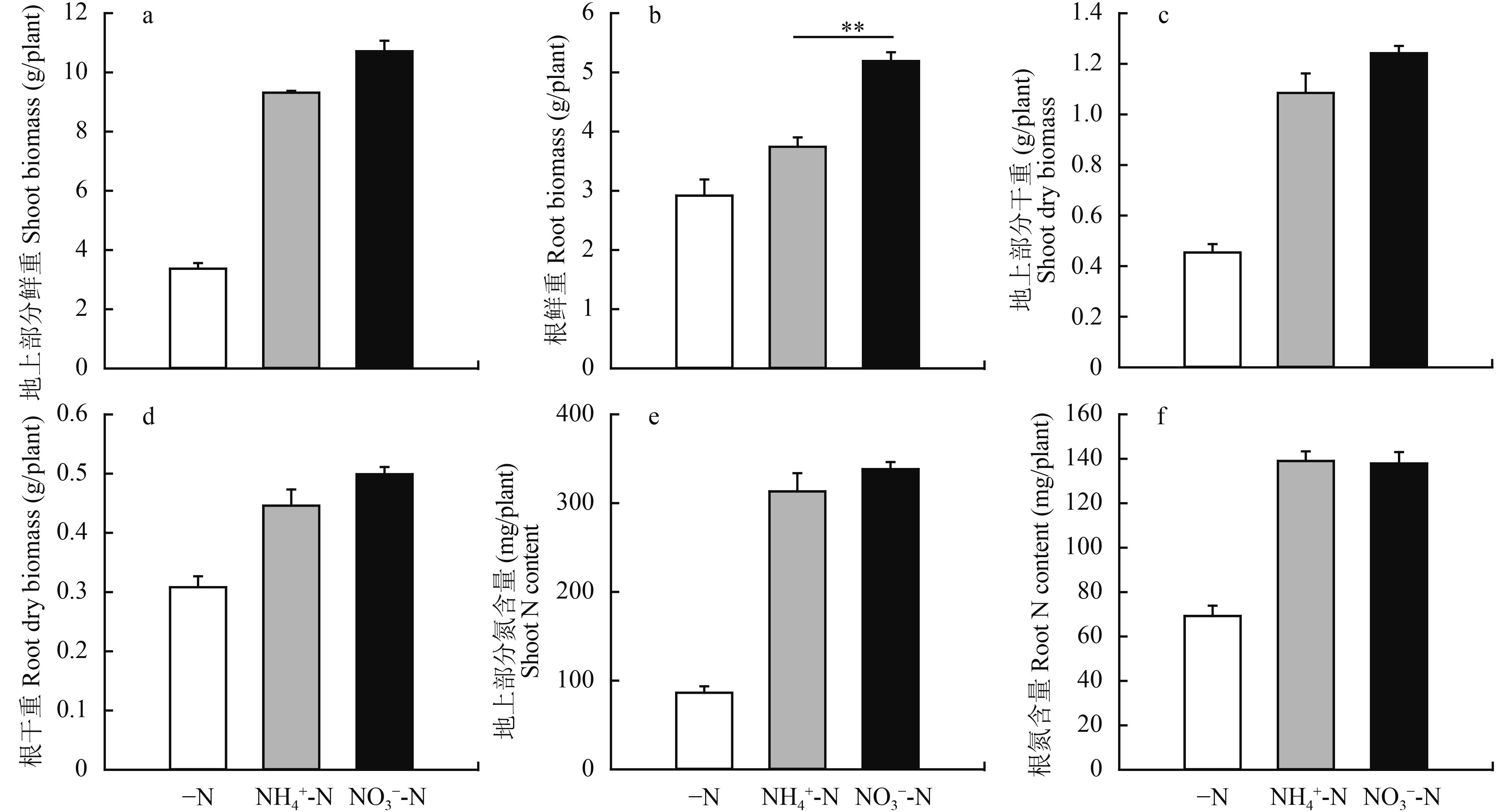
2 结果与分析 2.1 铵态氮与硝态氮对玉米幼苗生长的作用在单一供应铵态氮或者硝态氮 (浓度均为 1 mmol/L) 条件下,两种氮源均可对玉米幼苗的生长具有极显著的促进作用 (图 1);与缺氮对照相比,供铵和供硝幼苗地上部生物量分别提高了 1.8 和 2.2 倍 (图 1a 和 c),根系生物量分别增加了 22% 和 44% (图 1b 和 d)。在此浓度下 (1 mmol/L),硝态氮对玉米幼苗茎、叶生长的促进作用比铵态氮高 15%(图 1a 和 c),供硝比供铵也更有利于根系的生长 (图 2b 和 d)。
对处理 7 天的玉米地上部和根系含氮量测定结果显示 (图 1e 和 f),与缺氮对照相比,供氮处理植株的含氮量大幅度提高了 1.5~2 倍。纯硝处理植株含氮量较纯铵处理略有升高,但二者差异不显著,表明在供试条件下,玉米幼苗也可通过对铵态氮的吸收和利用形成与硝态氮相近的生长支撑效果。
 |
|
图1
不同形态氮素处理 7 天玉米幼苗生长量及含氮量
Fig. 1
Biomass and nitrogen content of maize seedlings treated 7 days with pure ammonium or nitrate supplement
|
为了进一步对图 1 中的现象提供解释,我们用同批玉米幼苗的根系进行了非损伤微测 (NMT) 研究,着重明确其铵态氮吸收特征。
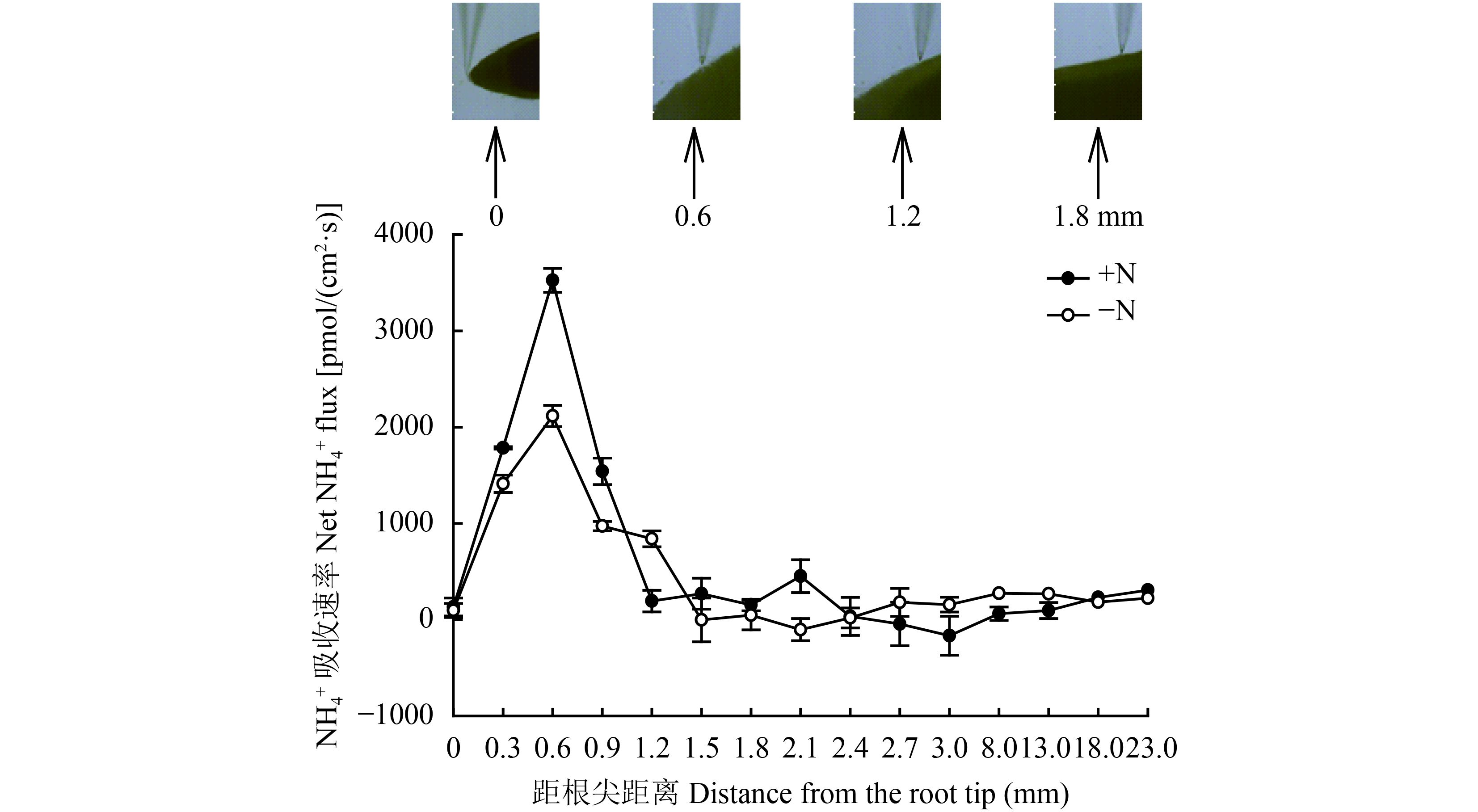
考虑到不同区段的根系可能对养分离子的吸收能力有所不同,在进行非损伤测定时,首先以 0.3 mm 长度为间隔从根尖顶端开始扫描了根系不同区域 (图 2) 吸收铵离子的速率。NMT 扫描及统计结果显示,在缺氮或正常供氮预处理情况下,铵吸收最强 (以吸收速率作为指标) 的区域都发生在距离根尖 0.6 mm 处 (图 2),该区域相当于根的分生区;因此后续的实验均在该区域进行。图 2 的初步结果还显示,持续保持供氮状态的根系比缺氮 (氮饥饿) 预处理的吸铵速率在分生区要高出 80% 左右。
为了进一步研究不同状况下玉米根系的 NH4+ 吸收速率,分别设置了纯铵 (100 μmol/L NH4Cl)、铵硝混合 (100 μmol/L NH4NO3) 条件,以模拟田间可能出现的铵主导 (如施肥后的短时间内) 或者铵硝混合的氮营养状况。
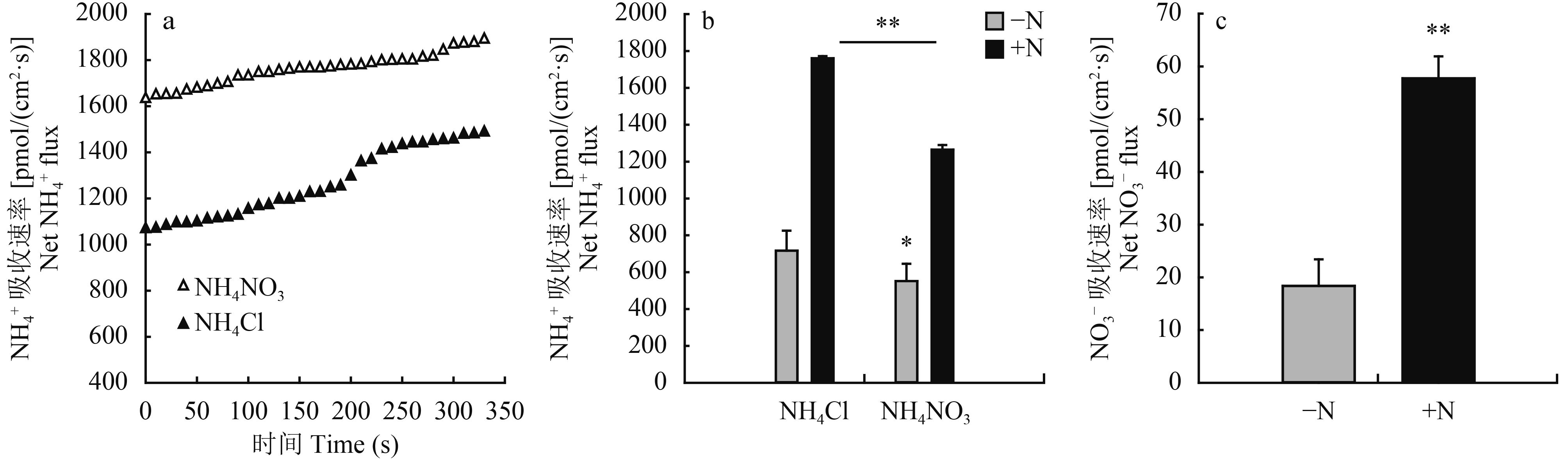
由图 3a 的 NMT 扫描数据可见,在纯铵溶液中玉米根的铵吸收速率可达 1760.2 pmol/(cm2·s);而当同时有等量硝共存的情况下,铵的吸收速率则显著降低。用 5 分钟内记录的数据平均,统计结果显示,纯铵条件下比铵硝混合时的铵的吸收速率高 39.2% (图 3b),表明硝的存在可能对玉米根系吸铵有较强的抑制作用。另一方面,氮饥饿预处理 (3 天) 则使得根系的铵吸收速率降低一倍以上 (图 3b)。
由于上述结果暗示了玉米根系中的铵、硝吸收之间可能存在某种互补关系 (图 3a 和 b),我们用类似的 NMT 实验体系测定了玉米根系对硝的吸收特征。测定结果表明,在低浓度范围内,根系对 NO3– (100 μmol/L) 的平均吸收速率 (5 分钟) 仅为相同浓度 NH4+ 吸收速率的 1/20~1/30 (图 3c)。考虑到即使 NMT 测定系统中因为铵、硝所用的离子选择电极的不同而可能使二者的测定结果不具有直接的可比性,我们的测定结果也可能从一个侧面反映了在典型高亲和浓度范围内,玉米对铵的吸收效率是很高的;也有可能的是,玉米对硝态氮的吸收在较高浓度 (低亲和) 范围内更有优势。在本文研究条件下,通过 NMT 系统所测得的玉米根系吸收 NO3– 的 Km 值为 759 μmol/L,则可为上述推测提供部分支撑。
 |
|
图2
玉米幼苗根系不同区段的 NH4+ 吸收速率
Fig. 2
Determination of NH4+ uptake rates along the distal segments of maize roots
|
 |
|
图3
不同状态下玉米根系的 NH4+ 吸收速率
Fig. 3
NH4+ uptake of maize roots under different conditions
|
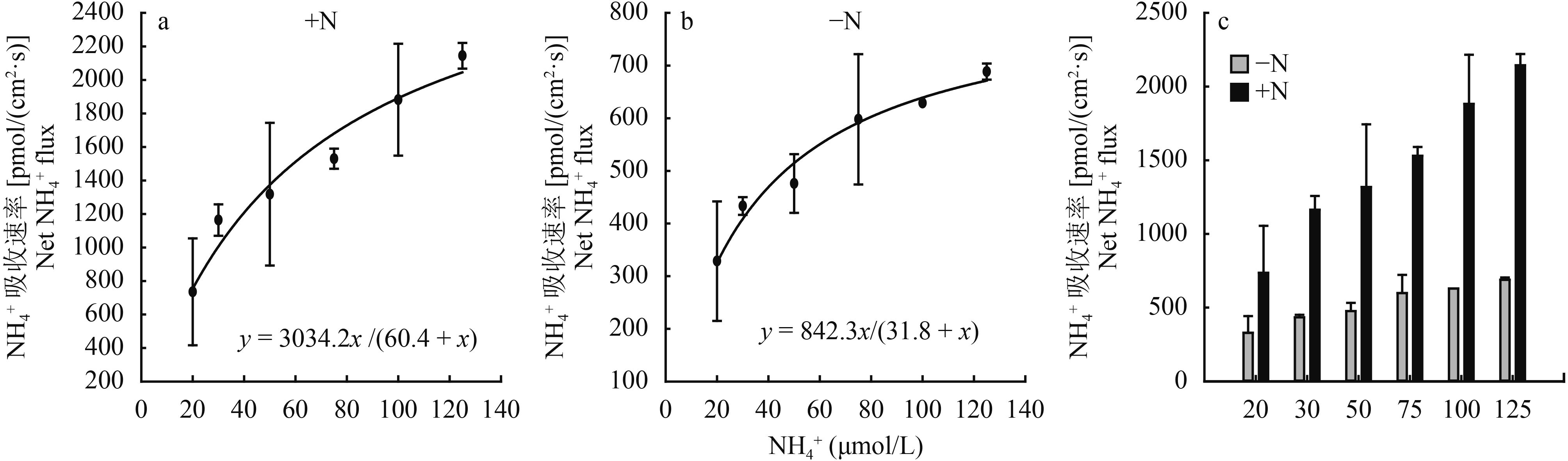
在不同浓度下 (20~125 μmol/L) 玉米根系对 NH 4+ 的吸收速率随 NH4+ 供应浓度的增加而增加,且在较高浓度下呈现饱和的吸收状态 (图 4)。通过米氏方程 (Michalies-Menten) 拟合 (图 4a),得到其 Km 值为 60.4 μmol/L,Vmax 值为 3034.2 pmol/(cm2·s)。而在氮饥饿预处理的根中,Km 和 Vmax 值则分别为 31.8 μmol/L 和 842.3 pmol/(cm2·s)(图 4b);分别比正常情况下降低了约 1 倍和 3 倍。图 4c 为不同状况下根系铵吸收速率的统计结果 (n = 6)。亲和力 (Km 值) 和吸收速率的改变反映了体内铵离子的基础水平,有可能会调控根系对该离子的吸收特征。
 |
|
图4
根系吸铵的动力学特征分析
Fig. 4
Kinetic evaluation of NH4+ uptake in maize roots
|
上述结果表明,玉米根系中存在高效的 NH4+ 吸收系统,且其吸铵功能与根系所处的氮营养环境密切相关。而 NH4+ 的吸收由根系中专一性的转运蛋白 AMT 介导,为了进一步揭示玉米根系高效吸铵的分子机制,测定了不同供氮处理下根系中相关 AMT 基因 ZmAMT1;1a 和 ZmAMT1;3 的表达特征。这两个基因主要负责玉米根系的高亲和铵吸收过程[18]。由图 5 可见,ZmAMT1;1a 和 ZmAMT1;3 的表达丰度仅在供应铵态氮条件下才维持较高的水平。而当根系处于缺铵 (–N 或者供 NO3–) 状态时,两基因的表达丰度均显著处于较低水平。这说明玉米根中的 AMT 基因在供铵状态下受到促进和激发,这与前文所述持续供铵条件下根系的高效 NH4+ 吸收能力相吻合。
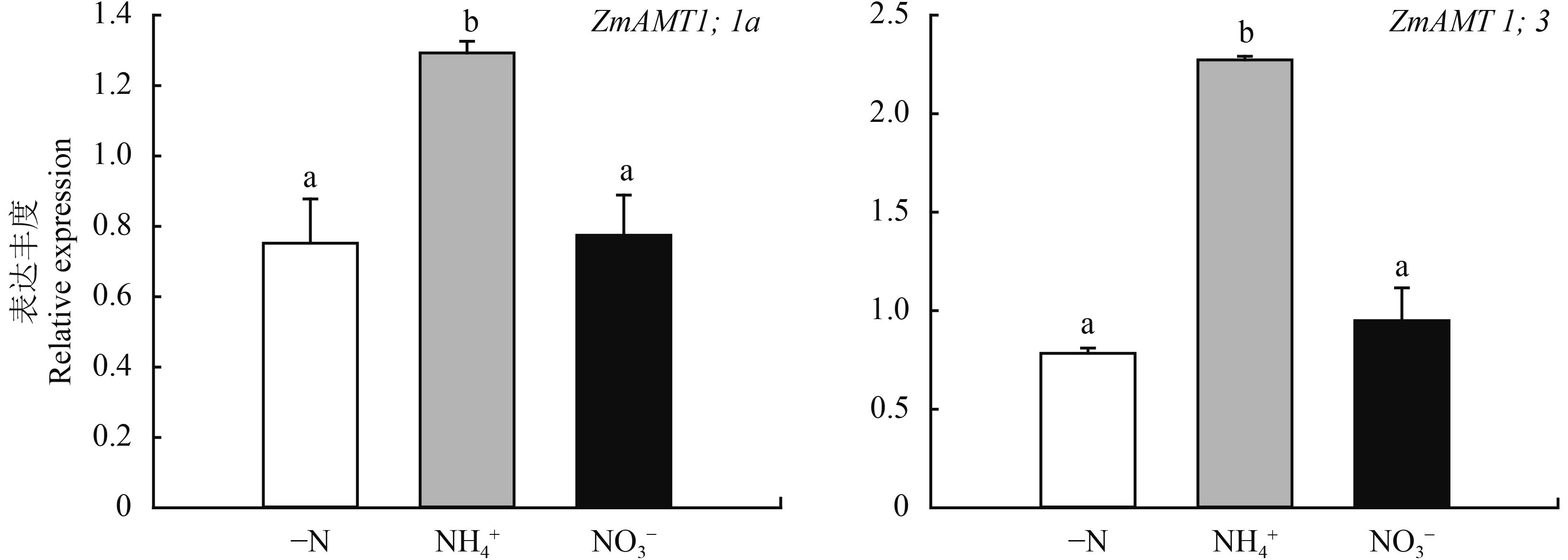 |
|
图5
不同供氮状态下玉米根系中 AMT 基因的表达丰度
Fig. 5
Expression of root-specific AMT genes in response to different N sources
|
由于玉米生长在旱地环境,土壤中的氮以硝态氮为主,故通常认为玉米具备高效的硝态氮吸收机制而忽略了其对铵态氮的吸收和利用。有研究结果表明,增施铵态氮肥,可显著增加玉米的产量[19]。本研究通过水培试验模拟了土壤中可能出现的 NH4+-N (追施氮肥后) 或 NO3–-N 为主导的氮素营养环境,发现铵态氮本身也可被玉米根系高效吸收而且对其生长的支撑作用与硝态氮相近。
本研究运用的非损伤微测技术是目前最为灵敏和精密的实时测定技术,可通过逐段扫描的方式获悉活体根系吸收养分离子的实况。本研究发现玉米根系对微摩尔浓度范围的 NH4+ 具有很高的吸收速率,在此典型的高亲和浓度范围内,NH4+ 的吸收速率远高于 NO3–。这一结果与 Gu 等[18]的玉米 15N 标记研究、Zhang 等[20],Zhong 等[21]用非损伤微测系统对杨树及小麦的研究结果一致。我们发现,玉米对铵的吸收速率与根系所处的氮营养环境有关。根系保持在 NH4+ 营养的环境中可使其具有较高的 NH4+ 吸收速率和较低的 Km 值 (吸收通量较高)。这与前人对水稻的研究报道有所不同。Wang 等[22]、Sonoda 等[23]发现,氮饥饿预处理的水稻根系具有较高的铵吸收能力,且水稻根系中的 OsAMT1;1、OsAMT1;2 和 OsAMT1;3 等基因的表达受缺氮诱导。早期的研究表明,水稻对的 NH4+ 吸收受其体内氮素或谷氨酰胺的水平的反馈抑制[22–23]。Yang 等[24]进一步通过电生理实验发现了水稻 OsAMT1;1 所介导的铵吸收受其底物 NH4+ 的反馈抑制调节。由此可见,生长于铵态氮主导环境中的水稻很可能利用这一反馈调节机制防止体内过量 NH4+ 的积累和毒害作用。而在玉米中观测到的结果与水稻正好相反,其吸铵速率及相关 AMT 基因表达则在铵营养环境中得到显著促进。考虑到玉米所生长的旱地环境,在大部分生长周期内,其根系周围占主导地位的氮源是硝态氮,而铵态氮仅在追施氮肥后的较短时段内才会维持较高的水平。因此玉米根系的吸铵能力受铵态氮环境促进的现象可能反映了这一植物适时利用有限 (时间尺度上) 的铵态氮资源以快速补充其氮素营养的一种高效策略。我们在田间常见的玉米喇叭口期追施氮肥后植株迅速生长的现象,即可见一斑。
另一方面,本文所述的环境中缺铵或 NO3– 的存在降低根中 AMT 基因的表达,并显著抑制 NH4+ 的吸收效率的现象,则反映了玉米根中的铵、硝吸收系统之间可能存在一定的协调性:铵硝共存或者以硝为主的情况下,铵的吸收受到抑制,进而避免氮素吸收利用系统在功能上的冗余。由此推测,不同植物对铵、硝氮源的吸收利用和响应特征可能是其长期适应生长环境而进化出的对其生长有利和有效的一种适应机制。玉米根系中保留的高效铵吸收系统可作为其获取足够氮源的一个重要的机制性补充,以满足植株快速生长的需求。将来比较有意义的研究可着眼于玉米的铵、硝吸收系统之间是如何进行高效协同的。
| [1] | Raven J A, Handley L L, et al. Global aspects of C/N interactions determining plant-environment interactions[J]. Journal of Experimental Botany, 2004, 55: 11–25. |
| [2] | Von Wirén N, Gazzarrini S, Gojon A, et al. The molecular physiology of ammonium uptake and retrieval[J]. Plant Biology, 2000, 3: 254–261. |
| [3] |
何念祖, 孟赐福. 植物营养原理[M]. 上海: 上海科学技术出版社, 1987: 59–124.
He N Z, Meng C F. Principle of plant nutrition [M]. Shanghai: Shanghai Science and Technology Press, 1987: 59–124. |
| [4] | Miller A J, Cramer M D. Root nitrogen acquisition and assimilation[J]. Plant and Soil, 2004, 274: 1–36. |
| [5] | Hoffmann C, Ladewig E, Claassen N, et al. Phosphorus uptake of maize as affected by ammonium and nitrate-nitrogen measurements and model-calculations[J]. Journal of Plant Nutrition and Soil Science, 1994, 157: 225–232. |
| [6] | Bloom A J, Meyerhoff P A, Taylor A R, et al. Root development and absorption of ammonium and nitrate from the rhizosphere[J]. Journal of Plant Growth Regulation, 2003, 21: 416–431. |
| [7] | Taylor A R, Bloom A J. Ammonium, nitrate, and proton fluxes along the maize root[J]. Plant, Cell and Environment, 1998, 21: 1255–1263. DOI:10.1046/j.1365-3040.1998.00357.x |
| [8] | Shen Z C, Zhang J F, Guo S, et al. Impact of nitrogen form on iron uptake and distribution in maize seedlings in solution culture[J]. Plant and Soil, 2001, 235: 143–149. DOI:10.1023/A:1011902320662 |
| [9] | Javelle A, Lupo D, Ripoche P, et al. Substrate binding, deprotonation, and selectivity at the periplasmic entrance of the Escherichia coli ammonia channel AmtB [J]. Proceedings of the Nationnal Academy of Sciences of the United States of America, 2008, 105(13): 5040–5045. DOI:10.1073/pnas.0711742105 |
| [10] | Loqué D, Mora S I, Andrade S L, et al. Pore mutations in ammonium transporter AMT1 with increased electrogenic ammonium transport activity[J]. The Journal of Biological Chemistry, 2009, 284: 24988–24995. DOI:10.1074/jbc.M109.020842 |
| [11] | Ludewig U, von Wirén N, Frommer W B. Uniport of NH4+ by the root hair plasma membrane ammonium transporter LeAMT1;1 [J]. The Journal of Biological Chemistry, 2002, 277(16): 13548–13555. DOI:10.1074/jbc.M200739200 |
| [12] |
汪建飞, 董彩霞, 沈其荣. 不同铵硝比对菠菜生长、安全和营养品质的影响[J].
土壤学报, 2007, 44(4): 683–688.
Wang J F, Dong C X, Shen Q R. Effects of NH4+-N/NO3–-N ratio on growth, food safety and nutritional quality of spinach(Spinacia Oleracea L.) [J]. Acta Pedologica Sinica, 2007, 44(4): 683–688. DOI:10.11766/trxb200604240415 |
| [13] |
李生秀, 王和平. 旱地土壤的合理施肥Ⅸ.不同用量的铵、硝态氮对玉米产量的影响[J].
干旱地区农业研究, 1993, 11(增刊2): 45–49.
Li S X, Wang H P. Rational application of fertilizers on dry lands[J]. Agricultural Research in the Arid Areas, 1993, 11(Suppl.): 45–49. |
| [14] |
曹翠玲, 李生秀. 氮素形态对作物生理特性及生长的影响[J].
华中农业大学学报, 2004, 23(5): 581–586.
Cao C L, Li S X. Effect of N form on crop physiological characteristics and growth[J]. Journal of Huazhong Agricultural University, 2004, 23(5): 581–586. |
| [15] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
Lu R K. Analytical methods for soil and agro-chemistry [M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [16] |
田霄鸿, 李生秀, 王清君. 几种作物NO3– 吸收动力学参数测定方法初探
[J].
土壤通报, 2001, 32(1): 16–18.
Tian X H, Li S X, Wang Q J. Preliminary study on the methods for determining absorption kinetic parameters of NO3– by using some crops [J]. Chinese Journal of Soil Science, 2001, 32(1): 16–18. |
| [17] | Cacco G, Ferrari G, Saccomani M. Variability and inheritance of sulfate uptake efficiency and ATP-sulfurylase in maize[J]. Crop Science, 1978, 18(3): 503–505. DOI:10.2135/cropsci1978.0011183X001800030038x |
| [18] | Gu R, Duan F, An X, et al. Characterization of AMT-mediated high-affinity ammonium uptake in roots of maize ( Zea mays L.) [J]. Plant Cell Physiology, 2013, 54(9): 1515–1524. DOI:10.1093/pcp/pct099 |
| [19] |
臧贺藏, 王景言, 张杰, 等. 不同氮肥模式下2个高产玉米品种物质积累与产量效益特性研究[J].
核农学报, 2015, 29(12): 2402–2409.
Zang H Z, Wang J Y, Zhang J, et al. Study on dry matter accumulation and yield benefit characteristics of two high-yield maize cultivars under different nitrogen regimes[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(12): 2402–2409. DOI:10.11869/j.issn.100-8551.2015.12.2402 |
| [20] | Zhang C X, Meng S, Li Y M, et al. Net NH4+ and NO3– fluxes, and expression of NH4+ and NO3– transporter genes in roots of Populussimonii after acclimation to moderate salinity [J]. Trees, 2014, 28(6): 1813–1821. DOI:10.1007/s00468-014-1088-9 |
| [21] | Zhong Y, Yan W, Chen J, et al. Net ammonium and nitrate fluxes in wheat roots under different environmental conditions as assessed by scanning ion-selective electrode technique[J]. Scientific Reports, 2014, 27(4): 72–79. |
| [22] | Wang M Y, Siddiqi M Y, Ruth T J, Glass A D M. Ammonium uptake by rice roots. ii. Kinetics of 13NH4+ influx across the plasma lemma [J]. Plant Physiology, 1993, 103: 1259–1267. DOI:10.1104/pp.103.4.1259 |
| [23] | Sonoda Y, Ikeda A, Saiki S, et al. Feedback regulation of the ammonium transporter gene family AMT1 by glutamine in rice [J]. Plant Cell Physiology, 2003, 44: 1396–1402. DOI:10.1093/pcp/pcg169 |
| [24] | Yang S Y, Hao D L, Cong Y, et al. The rice OsAMT1;1 is a proton-independent feedback regulated ammonium transporter [J]. Plant Cell Report, 2015, 34: 321–330. DOI:10.1007/s00299-014-1709-1 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

