硼是高等植物生长发育所必需的微量元素,不同作物或同一作物的不同品种对硼的敏感性及需求量不尽相同。我国第二次土壤普查显示,中国耕种土壤的缺硼面积达 3300 万公顷,大部分位于我国长江以南柑橘种植的主产区,其中作为中国柑橘优势产区之一的赣南产区属于其典型的缺硼区域[1]。传统解决缺硼的方法是进行土壤改良,提高硼的有效性或施加硼肥,但其成本高,且易造成植株硼毒害[2]。因此,筛选和培育硼效率高的作物品种以适应广泛缺硼的土壤是一项经济有效的增产途径[3]。柑橘一般采用嫁接的方式进行繁殖,其中砧木是果树的基础,对接穗的生长、果实大小、产量、品质及抗性都有很大的影响并直接决定果园的经济效益[4],因此选择优势砧木对果树的生长显得尤为重要。
有关不同砧木接穗组合的硼反应差异已做了一些探索,盛鸥等[5]研究了不同硼浓度下同为枳壳砧木的纽荷尔脐橙与朋娜脐橙硼吸收的差异,结果表明纽荷尔的硼效率系数显著低于朋娜,对缺硼更加敏感;Liu 等[6]更进一步研究了嫁接到不同砧木的纽荷尔脐橙缺硼胁迫下硼的吸收转运差异,结果显示嫁接于枳橙砧木的纽荷尔脐橙硼利用效率高于枳壳砧木纽荷尔脐橙。关于硼在光合作用中的作用也有所报道,Dell 等[7]发现缺硼会导致叶片光合面积下降;Han 等[8]研究发现缺硼会显著降低柑橘叶片光合色素及净光合速率,并显著影响柑橘体内糖类的代谢。一些研究表明,不同砧木的脐橙对缺硼的反应存在明显差异[4–6],其中赣南脐橙主栽的枳壳砧木对缺硼敏感,而拟推广的枳橙砧木在缺硼条件下则表现较好[6],但是关于不同砧木幼苗硼吸收利用差异以及与光合作用的关系研究涉及较少。本研究选用赣南拟推广的枳橙砧木 (硼不敏感型) 和主栽的枳壳砧木 (硼敏感型),研究两种砧木对不同硼水平下生长状况、硼利用效率、光合特性和产物的影响,以期进一步揭示不同砧木在不同硼水平下的生理反应机制及差异,为柑橘优势砧木的选择提供理论依据。
1 材料和方法 1.1 试验材料和设计试验材料为长势相对一致且生长状况良好的枳橙 (硼不敏感型) 和枳壳 (硼敏感型) 两种砧木实生苗。
试验于 2015 年 3 月 24 日在华中农业大学盆栽场温室内进行。首先用自来水把幼苗的根系冲洗干净,将全部幼苗浸泡在蒸馏水中饥饿处理 2 d,然后移栽时用二次蒸馏水冲洗干净,移入装有 3.5 L 营养液的塑料桶中。塑料桶使用前先用稀盐酸浸泡,然后用蒸馏水冲洗干净,塑料桶的外周涂上黑色油漆。营养液配方参考 Hoagland 和 Arnon的配方[9],略有调整,大量元素组成 (mmol/L): KNO32.00、Ca(NO3)2 1.23、MgSO4 0.50、Na2HPO4 0.14、NaH2PO4 0.32。微量元素组成 (μmol/L): MnCl2 4.45、ZnSO4 0.80、CuSO4 0.16、Na2MoO4 0.18、EDTA-Fe 37.30。试剂全部使用分析纯,各处理均采用一级水培养。营养液每 7 天更换 1 次,第 1 周采用全营养液的 1/4 浓度培养,接下来 4 周采用全营养液的 1/2 浓度培养,之后使用全量营养液,设 5 个硼水平为0、2、5、10、50 μmol/L,依次标记为 B0、B2、B5、B10 和 B50,每个处理 3 次重复。营养液每 4 h 通气 20 min,pH 每天用 HCl 或 NaOH 调节维持在 6.0 左右。
1.2 取样与测定两种不同的砧木实生苗培养 114 d 后,将每株分根、茎、叶 3 个部分取样,先用自来水冲洗干净,再用一级水冲洗,最后将样品在 105℃ 的烘箱中杀青 30 min 后于 75℃ 下烘干至恒重,称取干重后磨碎储存。磨碎的样品用 0.1 mol/L 的 HCl 浸提,姜黄素比色法测定硼含量。
取样时,选取主枝上健康成熟的第 3~4 功能叶用 Li-6400P 便携式光合测定仪测净光合速率;用酒精比色法[10]测定叶片光合色素含量;根据 García-Luis[11]的方法进行可溶性糖、蔗糖、果糖和淀粉含量的测定。
不同形态硼的提取及硼含量测定:参照 Du[12]等方法,略有改动。每株幼苗选取主枝上相同部位完全展开的新叶约 0.50 g 左右,取样后将其分别剪成 1 mm2 左右的碎片置于干燥的塑料瓶中,加入 10 mL —级水,25℃ 100 r/min 水浴震荡 24 h,用 0.15 mm 细纱网过滤,再用定量滤纸过滤,所得滤液即为自由态硼;残渣用 10 mL 1 mol/L NaCl 洗入塑料瓶,25℃ 100 r/min 水浴震荡 24 h,细纱网过滤后用定量滤纸过滤,所得滤液即为半束缚态硼;剩余残渣用 10 mL 1 mol/L HCl 洗入塑料瓶中,25℃ 100 r/min 水浴震荡 24 h,用定量滤纸过滤,所得滤液即为束缚态硼;提取出来的待测液分别用姜黄素比色法测定硼含量。
1.3 数据分析硼积累量 (μg/plant) = 硼含量 (mg/kg) × 相应部位干物重 (g/plant)[15]
硼利用效率 (g/μg) = 全株干重 (g)/全株硼积累量 (μg)[15]
数据使用 SAS 9.1.3 对各处理及不同砧木进行差异显著性分析,使用 Microsoft Excel 制表,Origin 8.6 (U.S.A, Origin Lab Corp.) 作图。
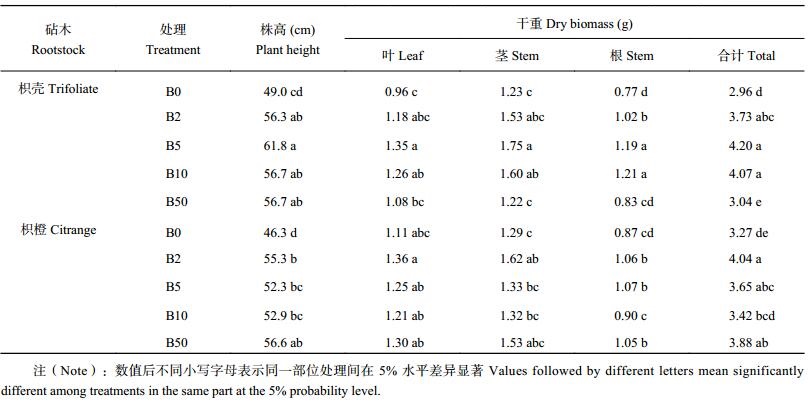
2 结果与分析 2.1 不同硼水平对两种砧木各部位干物质积累量的影响由表 1可知,与各水平施硼处理相比,B0 处理两种砧木幼苗的叶片、茎、根及整株干物重均受到了不同程度的影响,其中枳壳砧木 B0 较 B10 分别降低了 23.8%,23.1%,36.4%,27.3%,而株高也较 B10 下降 13.6%,枳橙砧木分别降低了 8.3%,2.3%,3.3%,4.4%,表明枳橙砧木干物质受缺硼影响较枳壳砧木轻。其中 B0 和 B2 处理条件下,枳橙砧木较枳壳砧木能积累更多的干物质,随着外界硼浓度的增加,枳壳砧木积累了更多的干物质。当外界硼浓度的增加到 50 μmol/L,枳壳砧木各部位干物重都显著低于其他不同施硼处理,与 B5 处理相比,枳壳幼苗叶、茎、根及总干重,显著降低了 20.0%、30.3%、30.3%、27.6%;而枳橙幼苗在较高硼浓度的环境中,各部位干重较 B2 处理的减少都在 6% 以内。由此可知枳橙砧木较枳壳砧木受缺硼影响较轻,仅需要较低浓度的硼维持正常生长,并且在较高硼浓度下枳橙砧木同样能较好的调节保持其生长。
| 表1 不同硼处理对枳壳与枳橙砧木株高及干物质积累量的影响 Table 1 Effects of B level on the seedling height and dry weight of trifoliate and citrange orange |
 |
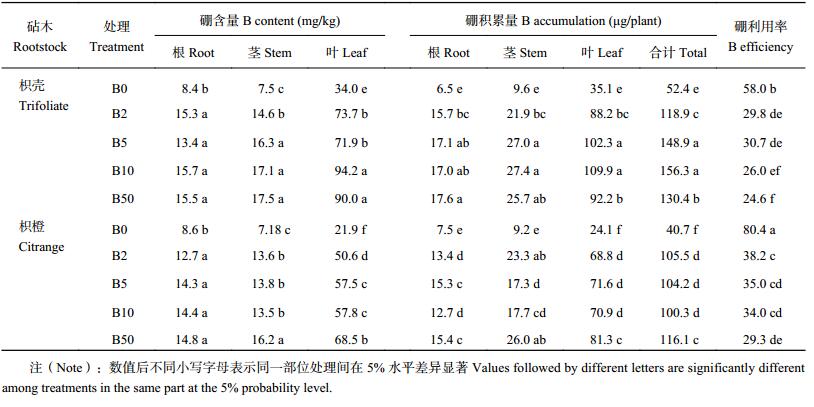
从表 2可知,不同硼水平条件下,两种砧木叶片中的硼含量及硼积累量均显著高于茎和根,两种砧木幼苗各处理不同部位硼积累量表现出叶片 > 茎 > 根的趋势,且两种砧木幼苗的叶片在各硼水平之间的差异较根和茎显著。B0 处理显著降低了两种砧木各部位硼含量及硼积累量,其中叶片硼含量及积累量的降低在植株各部位中是最大的;不同施硼处理,枳橙砧木各部位硼含量均低于枳壳砧木的相应部位,硼的积累量也呈相似趋势,即枳橙砧木比枳壳砧木具有更低的需硼量;结合表 1中两种砧木在不同硼水平条件下干物质的积累量,可知枳橙砧木能以较低的需硼量积累相对较多的干物质,即枳橙砧木具有较高的硼利用效率。由表 2同样得知,相同硼浓度下枳橙砧木的硼利用率均高于或显著高于枳壳砧木,进一步表明枳橙砧木植株水平硼的利用能力更强。
| 表2 不同硼处理对枳壳与枳橙砧木各部位硼含量及硼积累量的影响 Table 2 Effects of B level on B concentration and B accumulation of different parts of trifoliate and citrange orange |
 |
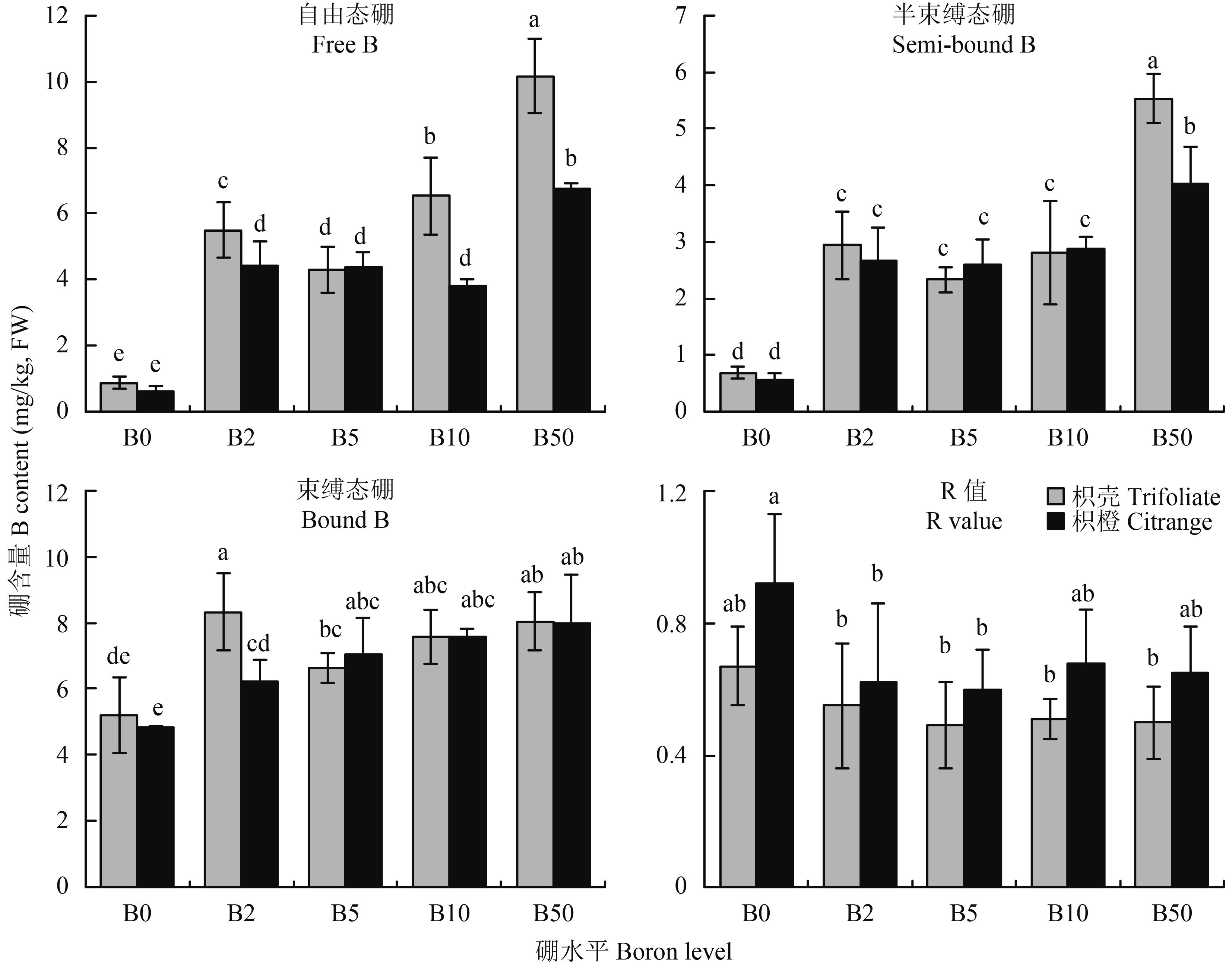
由图 1看出,除枳壳砧木在 B50 处理时自由态硼高于束缚态硼,其他处理两种砧木 3 种形态硼含量的大小均表现为束缚态硼 > 自由态硼 > 半束缚态硼。与 B0 处理相比,不同施硼条件下两种砧木叶片不同形态的硼均显著增加。不同硼处理下,枳壳砧木自由态硼的相对含量均高于枳橙砧木,束缚态硼的相对硼含量则低于枳橙砧木,说明枳橙砧木叶片细胞壁在各个硼处理条件下已经结合了相对较多的硼而枳壳砧木的自由态硼仍然占较大比例,表明枳壳砧木硼的利用能力弱。B0 和 B2 处理枳壳叶片束缚态硼含量均高于枳橙砧木,而在 B5、B10 和 B50 硼水平下低于枳橙砧木,说明枳橙砧木在较低的硼浓度下就满足了细胞壁对硼的需求,表明枳壳砧木细胞壁对硼的需求量较枳橙砧木高。
 |
|
图1
不同硼处理对枳壳和枳橙砧木叶片不同形态硼的影响
Fig. 1
Effect of B level on boron forms of trifoliate and citrange orange leaves
[注(Note):柱上不同小写字母表示同一部位处理间在 5% 水平差异显著 Different letters above the bars mean significantly different among treatments in the same part at the 5% probability level.] |
R 值为半束缚态硼/自由态硼,比值大小代表了硼跨膜能力的高低,即细胞水平上硼利用能力的大小[13]。图 1表明,与其他不同施硼处理相比,缺硼均增加了两种砧木的 R 值,且相同硼浓度枳壳砧木 R 值均低于枳橙砧木,说明缺硼使柑橘砧木自身产生某些适应机制以促进对硼的利用,且相同硼处理,枳橙砧木在细胞水平上的硼利用能力高于枳壳砧木,该结果与植株水平的硼利用率一致。
2.4 不同硼水平对两种砧木净光合速率的影响图 2表明, B0 处理,枳橙和枳壳砧木的净光合速率均显著低于其他供硼处理,枳橙砧木和枳壳砧木最高降幅分别为 41.6% 和 59.1%,且相同硼浓度下,枳壳砧木的净光合速率都显著低于枳橙砧木 (B10 处理除外) 。供硼条件下,枳橙砧木的净光合速率在不同处理间未达到显著差异,而枳壳砧木随着外界硼浓度的增加,其净光合速率显著增加,但当硼达到 50 μmol/L 时,其净光合速率较 B10 处理显著降低了 26.7%,说明相同硼浓度下,枳橙砧木光合性能均高于枳壳砧木,且枳壳砧木光合作用更易受硼浓度的影响。
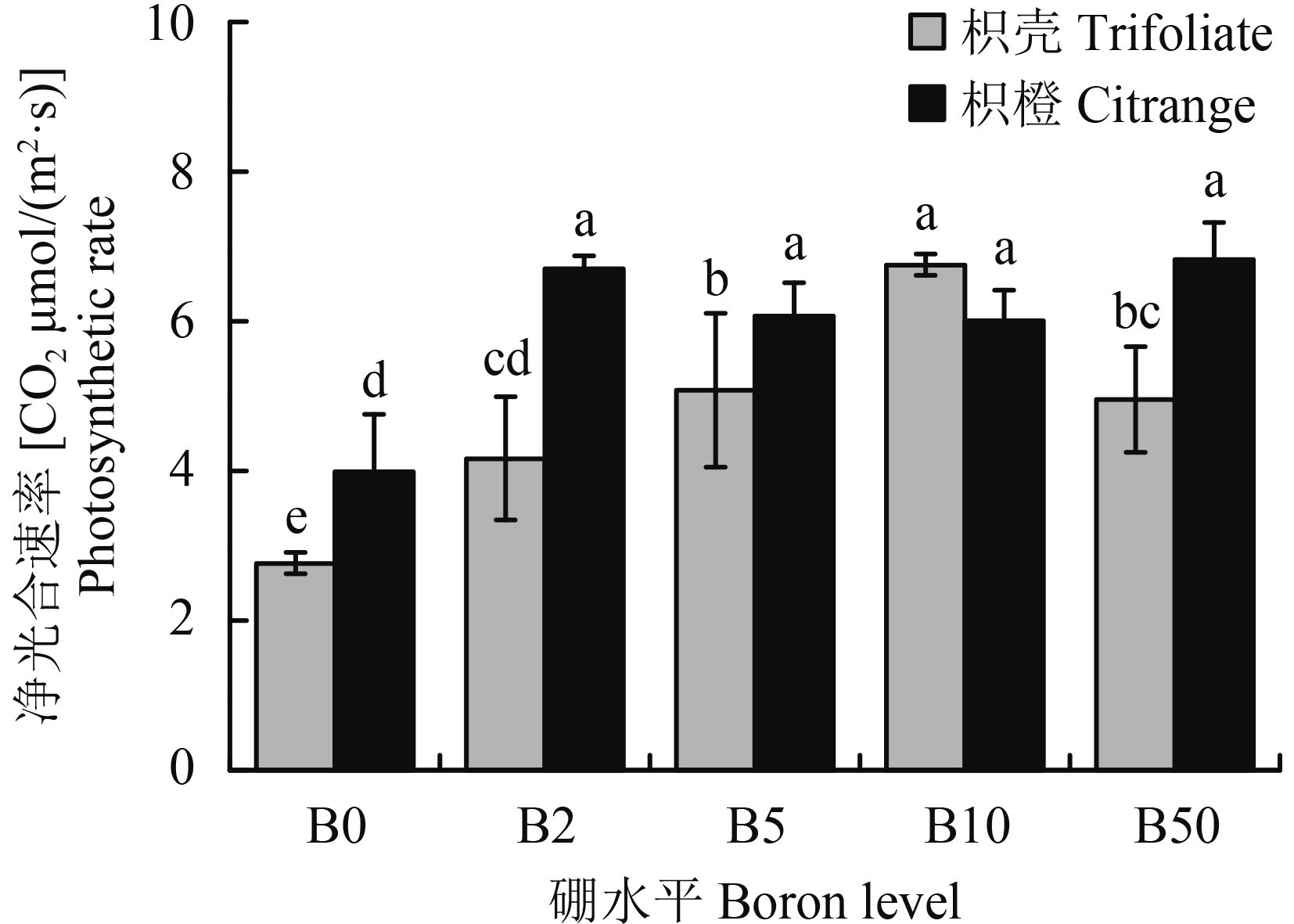 |
| 图2 不同硼处理对枳壳和枳橙砧木叶片净光合速率的影响 Fig. 2 Effect of B level on photosynthetic rate of trifoliate and citrange orange leaves [注(Note):柱上不同小写字母表示同一部位处理间在 5% 水平差异显著 Different letters above the bars mean significantly different among treatments in the same part at the 5% probability level.] |
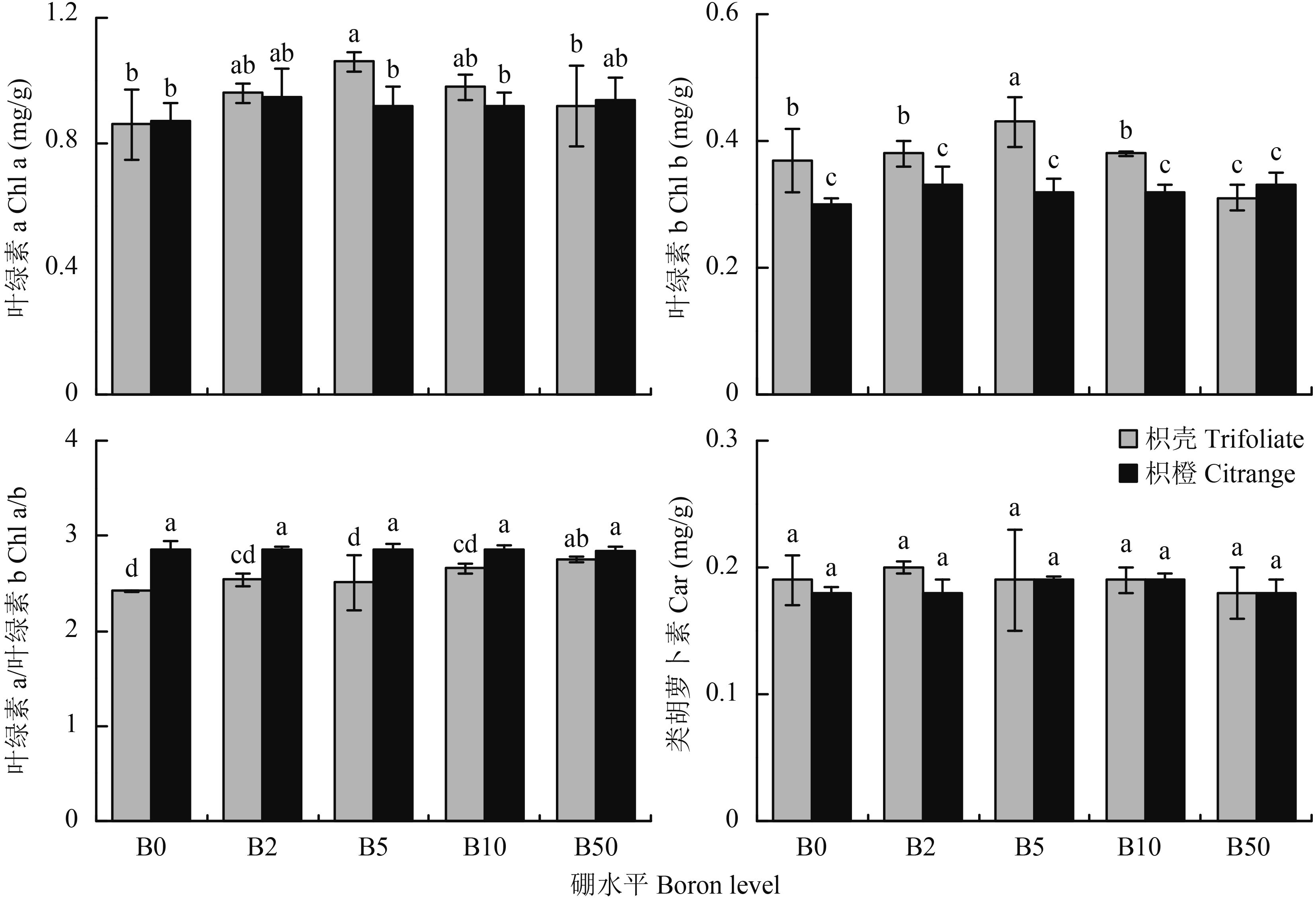
由图 3可知,缺硼处理枳橙砧木叶片光合色素含量较其他供硼处理无显著差异,枳壳砧木 Chl a、Chl b 含量有所减少,其中 B50 处理时,Chl b 含量显著低于其他硼水平。相同硼水平时,两种砧木之间 Chl a 和 Car 含量相差不大,而 Chl b 含量在各个供硼处理 (除 B50) 下,枳壳砧木 Chl b 含量均显著高于枳橙砧木。 Chl a 的含量随着外界硼浓度的增加呈现先升高后降低的趋势,其中 B5 处理均高于其他各处理, Chl b 呈现出相同的趋势,并由 Chl a/b 的值可以看出,枳橙砧木各个硼处理间相差不大;而枳壳缺硼处理 Chl a/b 有所下降,其中 B0 处理,其比值均低于其他各处理,说明缺硼对枳壳砧木光合色素的影响较枳橙砧木大。
 |
|
图3
不同硼处理对枳壳和枳橙砧木叶片光合色素含量的影响
Fig. 3
Effect of B on photosynthetic pigment of trifoliate and citrange orange leaves
[注(Note):柱上不同小写字母表示同一部位处理间在 5% 水平差异显著 Different letters above the bars mean significantly different among treatments in the same part at the 5% probability level.] |
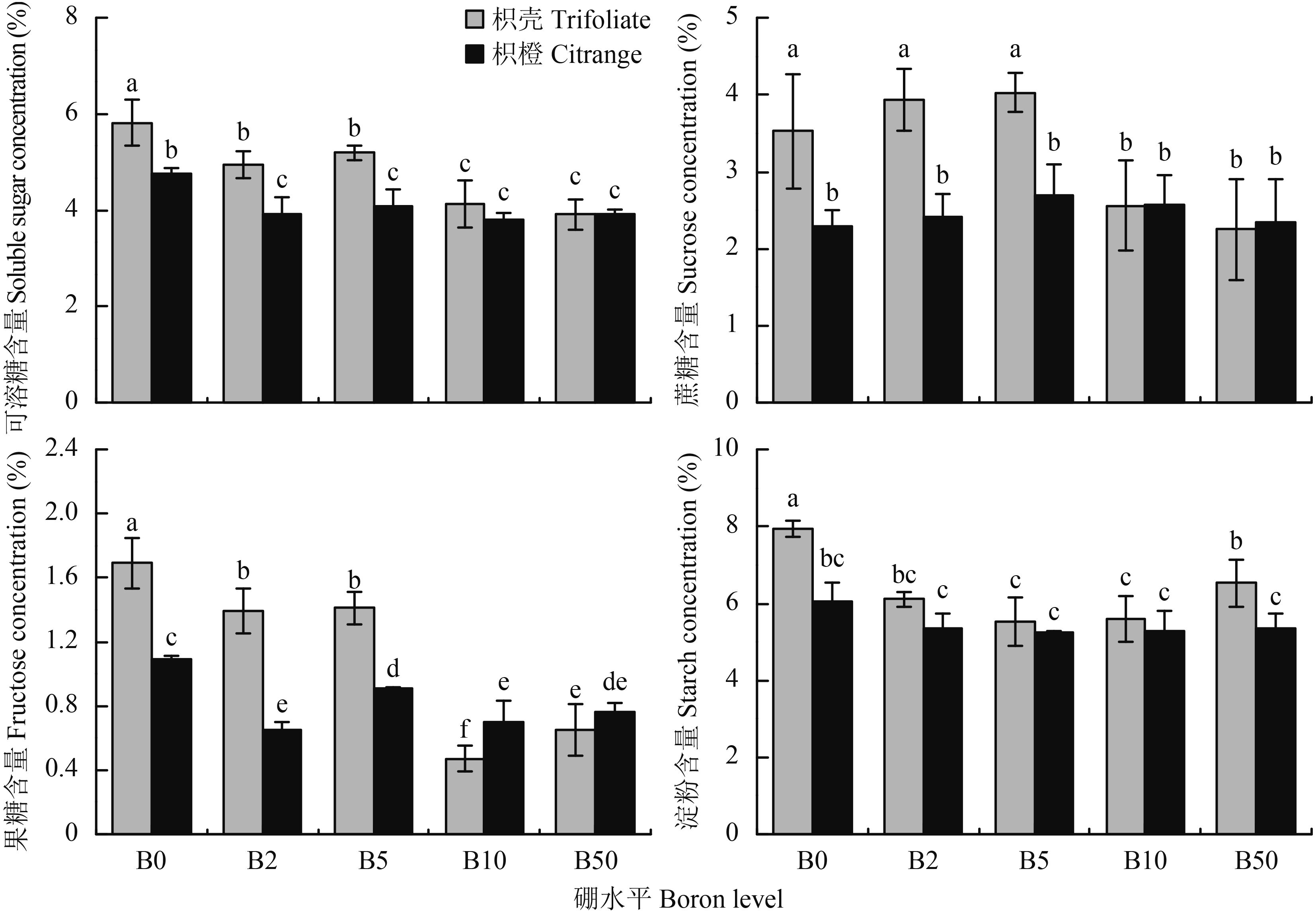
由图 4看出,B0 条件下,两种砧木叶片中可溶性糖、果糖和淀粉的含量均高于其他处理。另外,B0、B2、B5 处理时,枳壳砧木叶片可溶性糖、蔗糖、果糖均显著高于枳橙砧木;B10 和 B50 水平时,枳橙砧木的果糖含量高于枳壳砧木。此外,枳壳砧木叶片的淀粉含量在各硼水平下均高于枳橙砧木,其中 B0 处理,枳壳砧木叶片的淀粉含量高于其他供硼处理。总体上,枳橙砧木的可溶性糖、蔗糖和果糖含量在各硼水平间的差异较枳壳砧木要小,而淀粉含量比较稳定。
 |
|
图4
不同处理枳壳和枳橙砧木叶片可溶性糖、蔗糖、果糖和淀粉含量
Fig. 4
Concentration of soluble sugar, sucrose, fructose and starch of trifoliate and citrange orange leaves
[注(Note):柱上不同小写字母表示同一部位处理间在 5% 水平差异显著 Different letters above the bars mean significantly different among treatments in the same part at the 5% probability level.] |
植株水平上硼的利用能力大小通常以消耗单位硼所产生的干物质量来表示[14],即硼的生理利用效率。本实验室 Liu 等[15]研究表明,相同接穗嫁接到不同砧木上其耐缺硼的能力有显著的差异,其主要的因素是砧木的不同引起的;Mei等[16]研究也表明,不同砧木在缺硼条件下对硼的吸收和利用有所不同。本试验进一步证明两种不同类型的砧木幼苗对缺硼的反应存在显著差异,且枳橙砧木能在低硼条件下积累相对较多的干物质,受低硼影响小,说明枳橙砧木耐低硼胁迫能力强,在植株水平上比枳壳砧木具有更高的硼生理利用效率。
硼是细胞壁合成所必需的原料,其中束缚态硼主要是在细胞内与果胶组分尤其是 RG-II 紧密结合参与细胞壁合成的那部分硼[17],代表植株对硼需求的多少。本试验结果表明,随着外界硼浓度的增加,枳橙和枳壳砧木束缚态硼均出现一定程度的增加,随后变化不明显,Dannel 等[18]研究认为植物细胞壁拥有有限的硼结合位点,当硼的结合位点完全被占用后细胞壁中硼不会继续增加。半束缚态硼主要是参与细胞壁在细胞质中合成的那部分硼,可以反映细胞对硼的需求[18],杜昌文等[3]研究表明,硼要被细胞壁利用,首先得跨膜进入细胞质,即自由态硼转化为半束缚态硼。本试验中半束缚态硼在不同施硼处理中随外界硼水平变化表现稳定,硼含量变化相对较小,与 Wang等[19]在枳壳砧木和刘桂东等[20]在嫁接到这两种砧木上的纽荷尔脐橙研究结果一致。自由态硼主要是存在于自由空间内的硼,其含量的高低直接反映了植物对硼的利用能力,植物组织中自由态的硼可能存在一个临界浓度,这个临界值在不同的生育期和不同的组织中有些变化,如果低于相对应的临界值,植物的生长就会受阻。据此, 硼低效表现为较高的游离态硼的临界浓度, 而硼高效则表现为较低游离态硼的临界浓度[14]。进而引入一个相对营养指标 R = 半束缚态硼/自由态硼,R 值愈大表示硼效率愈高,本试验中,各个硼水平下,枳壳砧木 R 值均低于枳橙砧木,从细胞水平上进一步解释了枳橙砧木硼的利用效率高于枳壳砧木,与植株水平上硼利用效率结果一致。
3.2 不同砧木光合性能的差异缺硼直接或间接的影响植物光合作用[21]。许多的试验表明,缺硼以及硼毒害都会降低柑橘叶片中叶绿素 a、叶绿素 b 和类胡萝卜素的含量和叶绿素 a 和 b 的比值,以及显著影响叶片净光合速率[8,22–24]。本试验 B0 处理枳橙砧木叶片光合色素含量较其他硼水平无显著差异,枳壳砧木叶绿素 a、叶绿素 b 的值有所减少,而两种砧木净光合速率都显著低于其他供硼的处理,与上述结果不尽一致,这可能与砧木种类和缺硼培养时间长短有关,硼对叶片中的叶绿素含量影响不大,但缺硼明显降低了植株的光合效率,与焦晓燕等[25]在绿豆上研究的结果相一致,Zhao等[26]和 Bottrill等[27]的试验同样出现缺硼叶片有较高叶绿素和较低的光合速率的现象,结合本试验结果,表明叶片光合速率的下降可能不是叶绿素含量下降所致。
研究表明缺硼影响了光合作用相关酶的活性,从而间接影响了净光合速率等参数[7,21],通过对雪柑幼苗的研究发现,缺硼显著增加了叶片中淀粉和己糖的含量,而蔗糖含量显著降低,认为缺硼下柑橘叶片大量积累己糖和淀粉引发反馈调节从而抑制光合作用,且调节作用可能是通过直接干扰叶绿体功能和间接抑制光合酶活性实现[8]。本研究发现,B0 处理两种砧木叶片中可溶性糖、果糖和淀粉的含量均高于其他处理,而蔗糖在 B2、B5 处理条件下与 B0 处理相比并无差异,但随外界硼浓度增加其含量显著降低,可能由于低硼浓度阻碍蔗糖向外运输,导致蔗糖在叶片中积累,而外界硼浓度对枳橙砧木叶片中蔗糖含量无明显影响。因此,硼可能通过多种途径调节光合作用,焦晓燕等[25]研究显示,缺硼引起绿豆叶片中碳水化合物的积累,本研究也表明,缺硼引起枳橙和枳壳砧木叶片生成的碳水化合物转运受阻造成积累,故缺硼时植株生长受到抑制并非是碳水化合物缺乏造成的。对两种砧木而言,枳壳砧木缺硼时叶片积累了比枳橙砧木更多的碳水化合物。也有研究显示缺硼对植株碳水化合物的糖代谢基本没有影响[28]。所以,硼对光合色素及碳水化合物的影响在不同的物种间差异较大,可能与植物种类或硼浓度有关。
4 结论枳橙砧木的需硼量低于枳壳砧木,且当外界硼浓度较低时,枳橙砧木能以较低的需硼量积累较多的干物质;相同供硼处理,枳橙砧木无论在植株水平还是细胞水平的硼利用率均高于枳壳砧木,并且枳橙砧木较枳壳砧木更能耐高硼环境,即枳橙砧木硼阈值较宽。另外,缺硼会降低枳橙和枳壳砧木 Chl a、Chl b 和 Car 等光合色素的含量,其中枳壳砧木受缺硼影响较为显著,且缺硼对枳壳砧木光合速率的影响大,并积累了较多的碳水化合物,说明其反馈抑制光合作用较枳橙砧木严重,这在一定程度上解释了种植在相同环境下,枳橙砧木长势良好而枳壳砧木缺硼较为严重的原因。
| [1] |
王瑞东, 姜存仓, 刘桂东. 赣南脐橙产区果园土壤有效硼含量的现状与分析[J].
中国南方果树, 2011, 40(4): 1–3,7.
Wang R D, Jiang C C, Liu G D, et al. Status and Analysis on Available Boron Content in Soil of Gannan Navel Orange Orchards[J]. South China Fruits, 2011, 40(4): 1–3,7. |
| [2] |
黄玫, 潘学军, 张文娥, 周金忠. 缺硼胁迫对不同基因型葡萄硼效率及硼积累、分配的影响[J].
果树学报, 2015, 32(1): 79–86.
Huang M, Pan X J, Zhang W E, Zhou J Z. Effect of boron deficiency stress on boron efficiency, accumulation and distribution in different Vitis genotypes[J]. Journal of Fruit Science, 2015, 32(1): 79–86. |
| [3] |
杜昌文, 王运华, 徐芳森, 王火焰.不同硼效率甘蓝型油菜品种中硼的形态及其相互关系[J]. 植物营养与肥料学报, 2002, 8(1): 105—109.
Du C W, Wang Y H, Xu F S, Wang H Y. Study on boron forms and their relationship in rape cultivars with different boron efficiency[J]. Plant Nutrition and Fertilizer Science, 2002, 8(1): 105—109. |
| [4] | Castle W, Tucker D, Krezdorn A, Youtsey C. Rootstocks for Florida citrus[M]. Gainesville: University of Florida, 1993. 1—22. |
| [5] |
盛鸥, 宋尚伟, 彭抒昂, 等. 不同硼浓度对脐橙生长和硼吸收、分布的影响[J].
湖南农业大学学报(自然科学版), 2007, 33(6): 76–84.
Sheng O, Song S W, Peng S A, et al. Differential response in plant growth, boron absorption and distribution of two navel orange cultivars in relation to boron supply[J]. Journal of Hunan Agricultural University (Natural Sciences), 2007, 33(6): 76–84. |
| [6] | Liu G D, Wang R D, Wu L S, et al. Boron distribution and mobility in navel orange grafted on citrange and trifoliate orange[J]. Plant and Soil, 2012, 360(1-2): 123–133. DOI:10.1007/s11104-012-1225-4 |
| [7] | Dell B, Huang L B. Physiological response of plants to low boron[J]. Plant and Soil, 1997, 193(1): 103–120. |
| [8] | Han S, Chen L S, Jiang H X, et al. Boron deficiency decreases growth and photosynthesis, and increases starch and hexoses in leaves of citrus seedlings[J]. Journal of Plant Physiology, 2008, 165(13): 1331–1341. DOI:10.1016/j.jplph.2007.11.002 |
| [9] | Hoagland D R, Arnon D I. The water culture method for growing plants without soil[J]. California Agriculture Experimental Station, 1950, 347: 1–32. |
| [10] |
王学奎.植物生理生化实验原理和技术(第2版)[M]. 北京: 高等教育出版社, 2006. 134—136.
Wang X K. Principles and techniques of plant physiological biochemical experiment (2nd edition)[M]. Beijing: Higher Education Press, 2006: 134—136. |
| [11] | García-Luis A, Oliveira M E M, Bordón Y, et al. Dry matter accumulation in citrus fruit is not limited by transport capacity of the pedicel[J]. Annals of Botany, 2002, 90(6): 755–764. DOI:10.1093/aob/mcf257 |
| [12] | Du C W, Wang Y H, Xu F S, et al. Study on the physiological mechanism of boron utilization efficiency in rape cultivars[J]. Journal of Plant Nutrition, 2002, 25(2): 231–244. DOI:10.1081/PLN-100108832 |
| [13] |
杜昌文, 王运华, 徐芳森, 王火焰. 一个甘蓝型油菜硼素营养遗传指标的建立及其应用初探[J].
植物营养与肥料学报, 2000, 6(3): 349–352.
Du C W, Wang Y H, Xu F S, Wang H Y. Preliminary study on establishment of one boron nutrition genetic index and its application in rape[J]. Plant Nutrition and Fertilizer Science, 2000, 6(3): 349–352. |
| [14] | Siddiqi M Y, Glass A. Utilization index: A modified approach to the estimation and comparison of nutrient utilization efficiency in plants[J]. Journal of Plant Nutrition, 1981, 4(3): 289–302. DOI:10.1080/01904168109362919 |
| [15] | Liu G D, Jiang C C, Wang Y H. Distribution of boron and its forms in young Newhall navel orange (Citrus sinensis Osb.) plants grafted on two rootstocks in response to deficient and excessive boron[J]. Soil Science and Plant Nutrition, 2011, 57(1): 93–104. DOI:10.1080/00380768.2010.551299 |
| [16] | Mei L, Sheng O, Peng S A, et al. Growth, root morphology and boron uptake by citrus rootstock seedlings differing in boron-deficiency responses[J]. Scientia Horticulturae, 2011, 129(3): 426–432. DOI:10.1016/j.scienta.2011.04.012 |
| [17] | Hu H, Brown P H. Localization of boron in cell walls of squash and tobacco and its association with pectin (evidence for a structural role of boron in the cell wall)[J]. Plant Physiology, 1994, 105(2): 681–689. DOI:10.1104/pp.105.2.681 |
| [18] | Dannel F, Pfeffer H, Römheld V. Distribution within the plant or compartmentation does not contribute substantially to the detoxification of excess boron in sunflower (Helianthus annuus)[J]. Australia Journal of Plant Physiology, 1999, 26(2): 95–99. DOI:10.1071/PP98110 |
| [19] | Wang R D, Liu G D, Liu L C, Jiang C C. Relationship between leaf chlorosis and different boron forms in Trifoliate orange seedlings under excessive boron supply[J]. Soil Science and Plant Nutrition, 2014, 60(3): 325–332. DOI:10.1080/00380768.2014.893536 |
| [20] |
刘桂东, 姜存仓, 王运华, 等. 硼对两种不同砧木" 纽荷尔”脐橙叶片硼形态影响的差异[J].
中国农业科学, 2011, 44(5): 982–989.
Liu G D, Jiang C C, Wang Y H, et al. Effect of boron on leaf boron forms of Newhall Navel orange grafted on two rootstocks[J]. Scientia Agricultura Sinica, 2011, 44(5): 982–989. |
| [21] | El-Shintinawy F. Structural and functional damage caused by boron deficiency in sunflower leaves[J]. Photosynthetica, 1999, 36(4): 565–573. DOI:10.1023/A:1007096105491 |
| [22] | Han S, Tang N, Jiang H X, et al. CO2 assimilation, photosystem II photochemistry, carbohydrate metabolism and antioxidant system of citrus leaves in response to boron stress[J]. Plant Science, 2009, 176: 143–153. DOI:10.1016/j.plantsci.2008.10.004 |
| [23] | PapadakisI E, Dimassi K N, Bosabalidis A M, et al. Boron toxicity in ‘Clementine’ mandarin plants grafted on two rootstocks[J]. Plant Science, 2004, 166(2): 539–547. DOI:10.1016/j.plantsci.2003.10.027 |
| [24] | PapadakisI E, Dimassi K N, Bosabalidis A M, et al. Effects of B excess on some physiological and anatomical parameters of ‘Navelina’ orange plants grafted on two rootstocks[J]. Environmental and Experimental Botany, 2004, 51(3): 247–257. DOI:10.1016/j.envexpbot.2003.11.004 |
| [25] |
焦晓燕, 王劲松, 武爱莲, 等. 缺硼对绿豆叶片光合特性和碳水化合物含量的影响[J].
植物营养与肥料学报, 2013, 19(3): 615–622.
Jiao H Y, Wang J S, Wu A L, et al. Effects of boron deficiency on photosynthesis and carbohydrate contents in leaves of mung bean (Phaseolus aureus Roxb)[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(3): 615–622. |
| [26] | Zhao D L, Oosterhuis D M. Cotton growth and Physiological responses to boron deficiency[J]. Journal of Plant Nutrition, 2003, 26(4): 855–867. DOI:10.1081/PLN-120018570 |
| [27] | Bottrill D E, Possingham J V, Kriedemann P E. The effect of nutrient deficiencies on photosynthesis and respiration in spinach[J]. Plant and Soil, 1970, 32(1): 424–438. |
| [28] | Alves M, Chicau P, Matias H, et al. Metabolic analysis revealed altered amino acid profiles in Lupinus albus organs as a result of boron deficiency[J]. Physiologia Plantarum, 2011, 142(3): 224–232. DOI:10.1111/ppl.2011.142.issue-3 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

