2. 中国农业大学农学与生物技术学院,北京 100193;
3. 河南省烟草公司烟草研究所,河南郑州 472000
2. Agronomy and Biotechnology College, China Agricultural University, Beijing 100193, China;
3. Tobacco Research Institute of Henan Provincial Tobacco Company, Zhengzhou 472000, China
烟草是一种对氯吸收具有“奢侈”特性的植物[1],叶片氯含量与土壤供氯量直接相关[2–4];同时,烟草也是一种“忌氯植物”,过量的氯不仅会影响烤烟的生理作用[5–6],还会导致烤后的烟叶杂气重,香吃味差,燃烧性下降甚至熄火,焦油含量高,安全性低,烟叶的品质急剧下降[7–8]。黄淮海烟区和西北烟区是我国土壤氯含量较高的两大烟区,烟叶氯含量高的问题一直没有得到很好解决。目前,降低烤烟氯含量的措施主要有两个方面:一是选择合理的耕作制度,选择对氯敏感的作物,如马铃薯、甜菜、小麦等作为烟草的前作;选择喜氯作物,如甘蓝、碱蓬、莴苣等与烤烟间作、套作。二是优化大田管理措施,选择合适作物进行秸秆覆盖;减少使用含氯的灌溉水,适时浇水,杜绝大水漫灌;施用不含氯的化肥和农药[9]。由于耕地面积有限,实际生产中操作不到位,土壤中氯离子来源广等原因,土壤中氯含量未能得到有效降低,再加上烟株对氯的奢侈吸收,烟叶降氯效果一直不理想。
氯离子通道家族,是定位于生物膜上的一大类跨膜蛋白家族,主要参与植物体内 Cl– 离子的跨膜转运、细胞渗透调节、细胞信号传导以及膜电势等生理功能[10]。有研究表明,盐害下,选择合适的 Cl– 通道抑制剂,可在一定程度上降低植物对氯素的吸收,缓解过量氯害对植物的伤害作用[11]。常用的 Cl– 通道抑制剂有 Zn2+、NFA (尼氟灭酸)、9-AC (蒽-9-羧酸)、DIDS (4, 4′-二异硫氰基-2, 2′-二磺酸盐)、CCCP (间-氯苯腙羰基氰化物)等[12–13]。目前,关于施用不同种类抑制剂对烟株生理指标的影响研究尚未见报道。为此本试验以烤烟为试材,研究施用抑制剂 NFA、9-AC 和 Zn2+ 对烤烟氯离子通道蛋白基因、光合色素含量、叶绿素荧光、相关元素含量以及生物量的影响,为降低土壤中过量的氯素对烟草生长发育的不良影响提供参考。
1 材料与方法 1.1 试验材料试验于 2015 年在河南科技大学农学院农场进行,供试烟草 (Nicotiana tabacum L.) 品种为‘豫烟 10 号’。供试土壤类型为褐土,质地为砂壤土,土壤 pH 值为 7.5,有机质为 20.3 g/kg,碱解氮为 68.3 mg/kg,速效磷为 15.7 mg/kg,速效钾为 119.5 mg/kg,水溶性 Cl– 为 20.8 mg/kg。盆栽采用内径 40 cm、高 35 cm 的塑料盆,每盆装土 20.0 kg。移栽前保持每盆 Cl– 含量为 50 mg/kg (一般植烟最适宜区域土壤 Cl– 含量不超过 30 mg/kg[14]),土壤氯含量不足时以分析纯 KCl 补充。每盆施纯 N 5.0 g,各处理 N∶P2O5∶K2O 配比均为 1∶1.5∶3。
1.2 试验方法试验共设 4 个处理,NFA 200 μmol/L、9-AC 200 μmol/L、Zn2+ 200 μmol/L,以蒸馏水处理作为对照 (CK)。每个处理总计种植 25 盆,分别于移栽后 30、45、60、75 d 进行抑制剂灌根处理 (各个时期每天 1 L 一次性灌完,连灌 3 天,灌根时间为 16∶00~17∶00 pm)。移栽后 80 d,随机采集不同处理烤烟植株中部功能叶片,并迅速置于液氮中,–80℃ 保存备用,取样时每个处理重复 3 次。
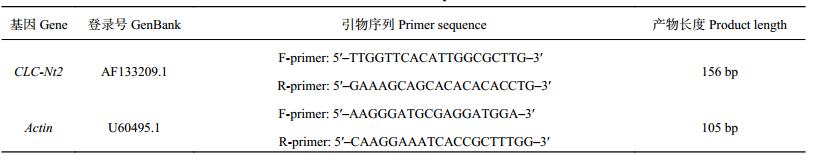
1.3 测定项目和方法1.3.1 PCR 和荧光定量 PCR 按照 Trizol 试剂 (Invitrogen) 使用说明书提取鲜烟叶样品的总 RNA,利用 1.0% 琼脂糖凝胶电泳检测完整度。参考 Fermentas First Strand cDNA Synthesis Kit 逆转录试剂盒说明书进行 cDNA 的合成。运用 Primer Premier 5.0 软件设计引物序列,并由生工生物工程 (上海) 股份有限公司合成。引物序列见表 1。其中选择烟草 beta-Actin 作为内参基因。利用 SYBR Premix Ex TaqTM II (Tli RNaseH Plus) TAKARA:RR820A 试剂盒 (宝生物工程·大连有限公司) 在 Step One PlusTM 型实时荧光定量 PCR 仪 (Applied Biosystems,USA) 上进行反应。PCR 反应体系为 20 μL,包括 2 × SYBR Premix Ex TaqTMⅡ10.0 μL,10 μmol/LForward primer 0.8 mL,10 μmol/LReverse primer 0.8 μL,50 × ROX Reference Dye 0.4 μL,cDNA template 2.0 μL,dH2O 6.0 μL。PCR 反应程序:95℃ 1 min,95℃ 30 s,57℃ 30 s;72℃ 1 min,40 个循环。扩增结束后利用熔解曲线检测产物特异性:95℃ 15 s,60℃ 1 min,从 60℃ 缓慢升温至 95℃,每次上升 0.3℃。
| 表1 引物序列 Table 1 Primer sequences |
 |
1.3.2 光合色素的测定 叶绿素及类胡萝卜素采用 95% 乙醇提取法[15]测定。
1.3.3 叶绿素荧光参数的测定 移栽后 80 d,于晴天上午 9∶00~11∶00,采用 FMS2 脉冲调制式荧光仪 (英国 Hansatech),测定暗适应下最大荧光 (Fm)、初始荧光 (Fo) 以及光适应下稳态荧光 (Fs)、初始荧光 (Fo')、最大荧光 (Fm') 等荧光参数,参照 Genty 等[16]的方法及 FMS2 型叶绿素荧光仪使用手册,计算:PSⅡ潜在活性 (Fv/Fo) = (Fm–Fo)/Fo,PSⅡ最大光化学效率 (Fv/Fm) = (Fm–Fo)/Fm,PSⅡ量子效率 (ФPSⅡ) = (Fm'–Fs)/Fm',光化学淬灭系数 (qP) = (Fm'–Fs)/(Fm'–Fo'),非光化学淬灭系数 (NPQ) = (Fm–Fm')/Fm' 等。以上指标的测定选取受光方向一致的中部功能叶片,每处理重复测定 5 片叶。
1.3.4 植物干重的测定 在烟株移栽 80 d 时,每处理随机选取 3 株,用去离子水反复冲洗干净烤烟植株。将根、茎、叶分开,于 105℃ 杀青 15 min,70℃ 烘干至恒重后称重,计算总干重、根冠比。
1.3.5 K+、Cl–、NO3– 的测定 将烘干的烟样磨碎,过 60 目筛。K+ 含量采用 YC/T217-2007 法测定[17];Cl– 含量采用 YC/T162-2002 测定[18];NO3–-N 采用 Cataldo 的水杨酸法测定[19]。
1.4 试验数据处理试验数据选择 Ct 值比较法 (2–ΔΔCt 法) 进行计算,假设对照的目的基因表达量为 1,在不同抑制剂处理下目的基因的表达量是对照的 F 倍,则 F = 2–ΔΔCt,其中 ΔΔCt = 处理 (CtCLC-Nt2 – CtActin) – 对照 (CtCLC-Nt2 – CtActin)。
运用 SPSS20.0 和 Microsoft Excel 2013 进行数据处理和统计分析。采用 Duncan 新复极差测验法 (P < 0.05) 进行显著性分析。
2 结果与分析 2.1 不同 Cl– 通道抑制剂对烤烟氯离子通道蛋白CLC-Nt2 基因表达的影响2.1.1 总 RNA 质量检测 提取的总 RNA 经 1.0% 琼脂糖凝胶电泳检测鉴定,28S rRNA 和 18S rRNA 条带清晰可见,无明显降解 (图 1),说明提取的总 RNA 完整性良好,满足实验需求。
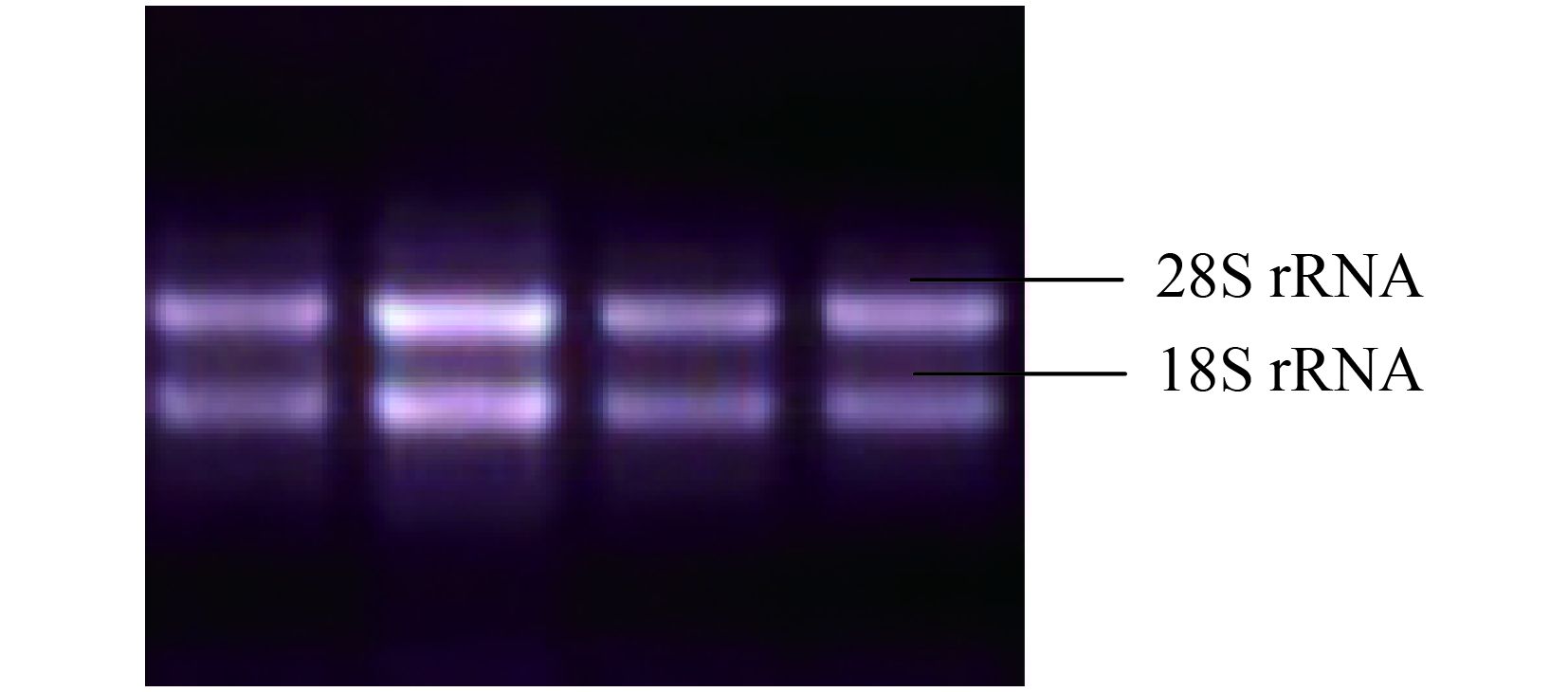 |
| 图1 烤烟叶片总 RNA 1.0% 琼脂糖凝胶电泳图 Fig. 1 Total RNA of flue-cured tobacco leaves in 1.0% agarose gel electrophoresis |
2.1.2 不同处理烤烟叶片CLC-Nt2 基因表达差异CLC-Nt2 基因是一种重要的阴离子通道蛋白,通过电势梯度和信号传递等方式参与 Cl–、NO3– 和 HCO3– 等阴离子的运输[20]。由图 2可知,与对照相比,施用抑制剂的烟叶CLC-Nt2 基因的表达量均显著降低 (P < 0.05),但 3 组抑制剂处理之间差异不显著。
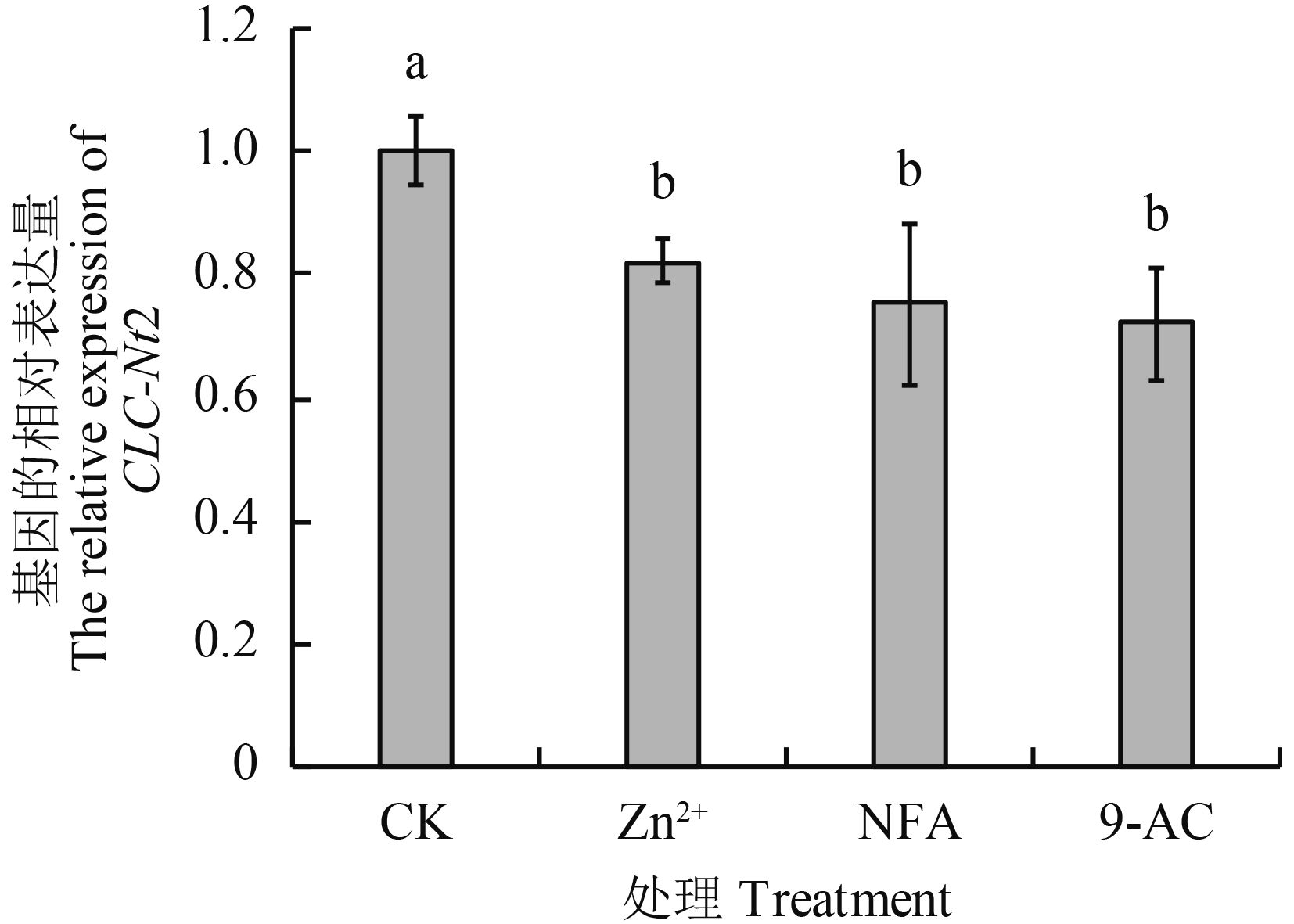 |
| 图2 不同 Cl– 通道抑制剂处理烤烟叶片CLC-Nt2 基因表达 Fig. 2 Expression ofCLC-Nt2 gene under different chloride channel inhibitors in flue-cured tobacco leaves [注(Note):方柱上不同字母表示不同处理间差异显著 (P < 0.05) Different letters above the bars indicate significant difference among treatments at the 0.05 level.] |
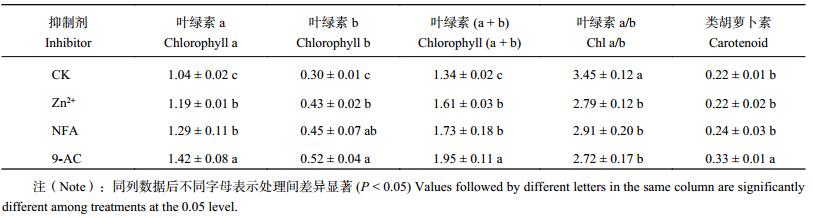
如表 2所示,所有抑制剂处理的叶绿素 a、叶绿素 b、总叶绿素含量均显著高于对照 (P < 0.05),在 200 μmol/L Zn2+、200 μmol/LNFA、200 μmol/L 9-AC 抑制剂处理下的植株与对照相比,叶绿素 a 的含量分别增加了 14.42%、24.04%、36.54%,叶绿素 b 的含量分别增加了 43.33%、50.0%、73.33%,叶绿素 (a + b) 的含量分别增加了 20.15%、29.10%、45.52%。而叶绿素 a/b 值则显著低于对照组 (P < 0.05),这可能是因为抑制剂对叶绿素 a 和叶绿素 b 含量提高的程度不同引起的。类胡萝卜素含量除了施用 9-AC 的处理显著提高外,其他处理虽有所上升,但与对照相比差异不明显。
| 表2 不同抑制剂处理烤烟叶片光合色素含量 (mg/g) Table 2 Effects of different inhibitors on photosynthetic pigment contents in flue-cured tobacco leaves |
 |
2.3.1 对烤烟叶片 Fv/Fo 和 Fv/Fm 的影响 Fv/Fo、Fv/Fm 是表征光化学反应状况的两个重要参数。Fv/Fo 一般用于度量 PSⅡ的潜在活性;Fv/Fm 则代表 PSⅡ的最大光化学效率,一定程度上反映了光抑制程度[21]。Fv/Fo 和 Fv/Fm 在四个处理间表现出相同的变化趋势,即 9-AC > NFA > Zn2+ > CK。其中 9-AC 处理和 NFA 处理的叶片 Fv/Fo、Fv/Fm 值均与对照差异显著 (P < 0.05),施 Zn2+ 的处理 Fv/Fm 显著高于对照,而 Fv/Fo 与对照相比则差异不明显。但 Fv/Fo、Fv/Fm 在 3 种抑制剂处理间差异不显著。
| 表3 不同抑制剂处理烤烟叶片叶绿素荧光参数 Table 3 Parameters of chlorophyll fluorescence of flue-cured tobacco leaves under different inhibitors |
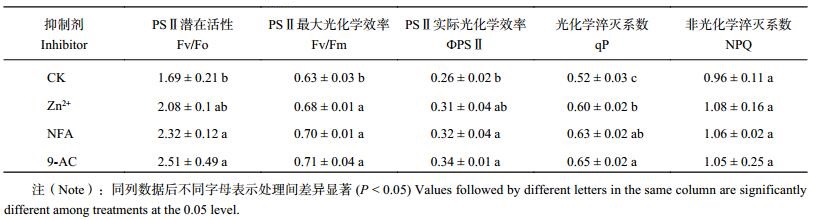 |
2.3.2 对烤烟叶片 ФPSII、qP 和 NPQ 的影响 PSⅡ实际光化学效率 (ФPSⅡ),反映了在 PSⅡ反应中心部分关闭的情况下,实际 PSⅡ光能捕获的效率[21],是衡量植物光合能力的一个重要指标。光化学淬灭系数 (qP) 反映了 PSⅡ天线色素吸收的光能用于光合电子传递的份额,代表了 PSⅡ反应中心开放的程度;非光化学淬灭系数 (NPQ) 反映了不能用于光合电子传递而以热的形式耗散掉的光能,它是一种自我保护机制,及时地将过量的光能耗散,起到保护光合机构的作用[22–24]。由表 3可知,抑制剂处理烤烟叶片的 ФPSⅡ分别比对照提高 23.16%、26.28%、32.97%,其中 NFA 和 9-AC 处理均与对照达到显著差异 (P < 0.05),但 3 种抑制剂处理间差异不显著。抑制剂处理的 qP 分别比对照提高 16.27%、20.60%、26.17%,且都达到显著水平 (P < 0.05),其中 9-AC 与 Zn2+ 处理之间差异显著 (P < 0.05),而 NFA 处理的 qP 与两处理差异均不显著。抑制剂处理的 NPQ 分别比对照提高 13.11%、10.52%、9.42%,但均未达到显著水平。
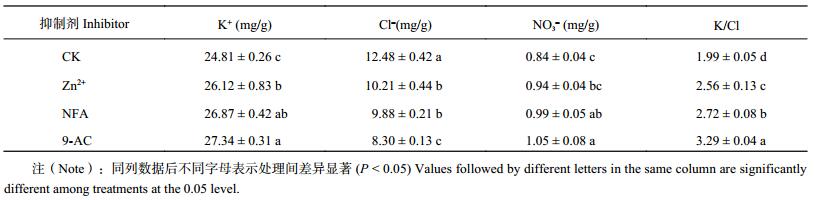
2.4 不同 Cl– 通道抑制剂对烤烟 K+、Cl–、NO3– 以及 K/Cl 的影响由表 4可以看出,与对照相比,外施 200 μmol/L 抑制剂的 3 个处理 Zn2+、NFA、9-AC,Cl– 含量显著下降,K+ 含量以及 K/Cl 显著上升,NO3– 含量不同程度的增加。其中,Cl– 含量分别降低了 18.17%、20.76%、33.48%,K+ 含量分别提高 5.28%、8.28%、10.20%,K/Cl 分别提高 8.72%、36.62%、65.59%,且均与对照达到显著差异 (P < 0.05);NO3– 含量分别提高 12.19%、19.09%、25.24%,其中 NFA 和 9-AC 处理与对照差异显著 (P < 0.05)。整体上四个处理的作用效果表现为 9-AC > NFA > Zn2+ > CK。
| 表4 不同抑制剂处理烤烟叶片 K+、Cl–、NO3– 含量以及 K/Cl 比 Table 4 Contents of K+, Cl–, NO3– and K/Cl ratio in flue-cured tobacco leaves affected by different inhibitors |
 |
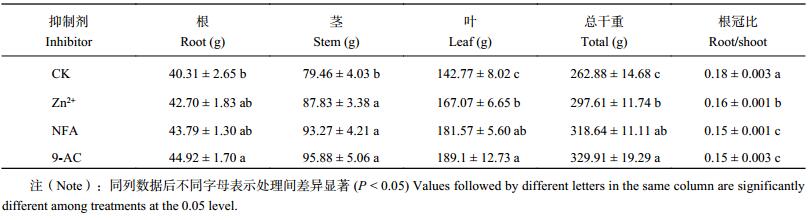
由表 5可知,与对照相比,3 种抑制剂处理的烟株茎、叶、总干重显著提高 (P < 0.05),根冠比显著降低 (P < 0.05),根干重均增加,但仅施用 9-AC 的根干重达到显著差异水平 (P < 0.05)。不同抑制剂处理之间,9-AC 处理的根、茎、叶各部分物质积累量以及总干重最多,NFA 次之。其中,在根和茎干物质积累中,3 种抑制剂处理间差异不显著,在叶干物质和总干重上却表现出一致的规律性,即 9-AC 处理明显高于施 Zn2+ 处理,且达到显著水平 (P < 0.05),NFA 处理与两处理差异均不显著,在根冠比上 NFA 和 9-AC 间差异不明显,但均比施用 Zn2+ 的根冠比低,且都达到显著水平 (P < 0.05)。
| 表5 不同抑制剂处理烤烟干物质积累量及根冠比 Table 5 Dry matter accumulation in flue-cured tobacco affected by different inhibitors |
 |
越来越多的研究发现,植物 CLC 家族能够参与盐胁迫下 Cl– 平衡,这表明该蛋白家族在植物的耐氯生理中有潜在的功能[25–26]。本试验采用实时荧光 (SYBR Green I 染料) 定量检测的方法检测CLC-Nt2 基因在烤烟叶片中的表达,发现施用 200 μmol/L 的 Cl– 离子通道抑制剂能抑制 Cl– 离子通道蛋白CLC-Nt2 基因在 mRNA 转录水平上的表达,说明该基因在 Cl– 离子运输过程中具有重要的作用。
叶绿素包括叶绿素 a 和叶绿素 b,其中叶绿素 a 有利于吸收长波光,叶绿素 b 有利于吸收短波光,它们是光合作用中最重要、最有效的色素,其含量的高低直接影响着植物光合作用的强弱及有机物质的合成[27–28]。类胡萝卜素是光合作用的辅助色素,帮助叶绿素接收光能,同时还可在强光下逸散能量,保护叶绿素分子在强光下不致被光氧化而破坏[29]。盐胁迫能引起植物体内叶绿素的降解[30–32],杨颖丽等[33]也指出,盐胁迫不仅能引起小麦叶片叶绿素 a、叶绿素 b 和叶绿素总量的减少,而且对叶绿素 b 的破坏程度明显强于对叶绿素 a。从试验结果可以看出,在植烟土壤含 Cl– 较高的条件下,施用抑制剂的处理叶绿素 a、叶绿素 b、叶绿素总量都增加,且与对照相比均达到显著水平。造成叶绿素含量上升的原因可能与抑制剂有效阻止大量的 Cl– 离子进入细胞质,降低细胞膜脂过氧化程度,缓解了叶绿素的分解有关[34]。其中叶绿素 b 作为一种天线色素,它含量的升高,更有利于增强叶绿体的捕光能力,相对提高烟株的光能利用率[21]。高氯条件下,施用抑制剂更有利于烟株对短波光的吸收,即对叶绿素 b 的促进作用更明显,因此,叶绿素 a/b 值显著低于对照。类胡萝卜素含量在整个试验中保持了稳定,说明相比叶绿素,抑制剂对类胡萝卜素的促进作用不明显。抑制剂在整体上提高了光合色素含量,有利于高氯条件下烤烟叶片对光合电子的捕获和传递。
叶绿素荧光是光合作用的探针,通过分析叶绿素荧光参数的变化,可以探明光合机构受影响的部位[23,35]。Belkhodja 等[36]研究发现,盐胁迫下大麦 Fv/Fm 和 qP 降低;吴雪霞等[37]以番茄幼苗为研究对象,结果表明,NaCl 处理使 Fo 显著上升,Fm、Fv/Fo 和 Fv/Fm、ETR 和 ΦPSⅡ均降低;李青云等[38]指出,盐胁迫下草莓叶片的 Fv/Fo 值、Fv/Fm 值均呈下降趋势。本试验结果表明,在较高氯条件下,外施 200 μmol/LCl– 离子通道抑制剂可引起 Fv/Fo、Fv/Fm、ФPSII、qP、NPQ 等荧光参数不同程度的增加。其中 Fv/Fo、Fv/Fm 的增加,说明抑制剂减缓了高氯对烤烟 PSⅡ原初光化学活性的抑制,提高了 PSⅡ潜在活性;ФPSII 和 qP 的增加,则提高了叶片 ФPSⅡ反应中心开放部分的比例,将更多的光能用于光化学传递,从而提高光合电子传递效率;NPQ 值增大,则说明抑制剂增强了烟株的热能耗散能力,在一定程度上起到保护光合机构的作用。
在植烟土壤含 Cl– 较高的条件下,外施 Cl– 通道抑制剂 200 μmol/L,能够显著影响烤烟叶片中 K+、Cl–、NO3– 以及 K/Cl 的值。本研究结果表明,外施抑制剂,能够显著降低 Cl– 含量,与烤烟叶片中CLC-Nt2 基因表达强度的结果一致,说明叶片中 Cl– 含量的降低,可能是由于CLC-Nt2 基因表达减弱引起的。外施抑制剂的处理,烤烟叶片中 NO3– 的含量明显增加,这可能是因为 Cl– 与 NO3– 离子之间有拮抗作用[11],抑制剂在降低 Cl– 吸收的同时促进其对 NO3– 吸收和积累。同时,与对照相比,K+ 含量上升,但 K+ 增加的幅度远小于 Cl– 降低的幅度。抑制剂显著降低了 Cl– 含量,促进了植株对 K+ 的吸收,进而引起 K/Cl 值的显著增加。高氯条件下,施用抑制剂 Zn2+,引起烤烟叶片 Cl– 含量降低,K+ 和 NO3– 含量上升的结果与屈娅娜等[11]以大豆为材料,得到的盐胁迫下施用 Zn2+ 后,大豆幼苗体内 Cl– 含量降低,K+ 和 NO3– 含量上升的结果一致,但是 NFA 的结果正好相反。可能是因为抑制剂作用效果因研究物种不同、浓度效应不同而有所差异。
根冠比反映了植物在一定环境条件下的生物量分配策略[39]。高氯条件下,由于烤烟各部位对抑制剂的敏感性不同,导致了生物量分配的变化。施用抑制剂处理的烤烟根冠比显著低于对照,而地上部生物量以及总干重则显著高于对照,3 种抑制剂处理之间叶片中干物质积累量更是达到显著水平。这可能是因为外源抑制剂对地上部的影响大于根部,施用抑制剂后烤烟叶片光合色素含量增加,光化学活性增强,叶片合成和积累有机物的能力提高,但是向根系输入的同化物量则较为稳定。
4 结论当植烟土壤中 Cl– 浓度较高时,外施氯离子通道抑制剂能够对烤烟植株生长以及体内一系列生理活动产生积极影响。施用抑制剂能有效降低烤烟叶片CLC-Nt2 基因的表达强度,提高叶片光合色素含量,维持较高的 PSⅡ稳定性,为光合作用提供充足光能,增强植株干物质积累能力,还能在降低 Cl– 含量的同时提高 K+ 和 NO3– 的积累。其中,9-AC 处理的烟株整体表现最优,而施用 Zn2+ 的处理在基本满足降低叶片氯离子含量的同时降低了生产成本,为生产过程中合理降氯提供参考。氯离子通道抑制剂对植物的作用效果比较复杂,在作用的过程中可能不仅受到来自土壤养分、气候因子等自然因素的影响,还可能因施用浓度、植物种类的不同而异,因此,作用效果还需经过实际生产加以验证。有关氯离子通道抑制剂的作用机制及其对植物品质的影响有待进一步的探讨。
| [1] |
秦松. 贵州植烟土壤氯素特征与含氯钾肥施用探讨[J].
西南农业大学学报(自然科学版), 2001, 23(5): 471–473.
Qing S. Chloride content in tobacco planting soils in Guizhou and the possibility of chlorine-containing potash[J]. Journal of Southwest Agricultural University, 2001, 23(5): 471–473. |
| [2] |
成延鏊, 伍任军, 吴纯奎, 等. 四川烤烟区土壤氯的动态与施氯量确定[J].
中国烟草学报, 1995, (2): 21–28.
Cheng Y A, Wu R J, Wu C K, et al. The study on soil Cl movement and Cl application of flue-cured tobacco in Sichuan Province[J]. Acta Tabacaria Sinica, 1995, (2): 21–28. |
| [3] |
邹焱, 袁家富, 章新军, 等. 鄂西南烤烟叶片含氯状况及施氯效果[J].
湖北农业科学, 2000, (6): 40–42.
Zou Y, Yuan J F, Zhang X J, et al. Preliminary study on leaf Cl content and Cl application on flue-cured tobacco in southwest Hubei Province[J]. Hubei Agricultural Sciences, 2000, (6): 40–42. |
| [4] |
李姗姗, 刘国顺, 张玉丰. 施氯量对凉山烤烟产量和品质的影响[J].
河南农业大学学报, 2008, 42(1): 14–17.
Li S S, Liu G S, Zhang Y F. Effects of chloride application rate on yield and quality of flue-cured tobacco of liangshan[J]. Journal of Henan Agricultural University, 2008, 42(1): 14–17. |
| [5] | Karaivazoglou N A, Papakosta D K, Divanidis S. Effect of Chloride in irrigation water and form of nitrogen fertilizer on Virginia (flue-cured) tobacco[J]. Field Crops Research, 2005, 92: 61–74. DOI:10.1016/j.fcr.2004.09.006 |
| [6] |
李明德, 肖汉乾, 汤海涛, 等. 湖南烟区土壤含氯状况及烤烟施氯效应[J].
植物营养与肥料学报, 2007, 13(1): 44–50.
Li M D, Xiao H Q, Tang H T, et al. Status of chlorine content in tobacco-planting soils in Hunan province and tobacco responses on chlorine application[J]. Plant Nutrition and Fertilizer Science, 2007, 13(1): 44–50. |
| [7] |
吕春伟. 云南烤烟40级钾氯元素含量及规律[J].
安徽烟草科技, 1994, (4): 12–18.
Lü C W. Contents and trends of potassium and chlorine of 40 grades flue-cured tobacco leaf in Yunnan province[J]. Anhui Tobacco Science Technology, 1994, (4): 12–18. |
| [8] |
李永忠, 罗鹏涛. 氯在烟草体内的生理代谢功能及其应用[J].
云南农业大学学报, 1995, (10): 57–61.
Li Y Z, Luo P T. The physiology function and application of chlorine ion in tobacco[J]. Journal of Yunnan Agricultural University, 1995, (10): 57–61. |
| [9] |
刘鹏, 朱金峰, 郭利, 等. 烤烟氯离子来源及控制措施研究进展[J].
江西农业学报, 2013, 25(3): 74–77.
Liu P, Zhu J F, Guo L, et al. Research Progress in Source and Control Measures of Chlorine Ion in Flue-cured Tobacco[J]. Acta Agriculturae Jiangxi, 2013, 25(3): 74–77. |
| [10] |
於丙军, 刘友良. 植物中的氯、氯通道和耐氯性[J].
植物学通报, 2004, 21(4): 402–410.
Yu B J, Liu Y. Chloride Channel and Chlorine Tolerance in Plants[J]. Chinese Bulletin of Botany, 2004, 21(4): 402–410. |
| [11] |
屈娅娜, 於丙军. 氯离子通道抑制剂对盐胁迫下野生和栽培大豆幼苗离子含量等生理指标的影响[J].
南京农业大学学报, 2008, 31(2): 17–21.
Qu Y N, Yu B J. Effects of chloride channel blockers on ion contents and other physiological indexes ofGlycine soja andGlycine max seedlings under NaCl stress[J]. Journal of Nanjing Agricultural University, 2008, 31(2): 17–21. |
| [12] | Barbier-Brygoo H, Vinauger M, Colcombet J, et al. Anion channels in higher plants: functional characterization, molecular structure and physiological role[J]. Biochimica et Biophysica Acta, 2000, 1465(1-2): 199–218. DOI:10.1016/S0005-2736(00)00139-5 |
| [13] | Suzuki M, Morita T, Iwamoto T. Diversity of Cl– channels[J]. Cellular & Molecular Life Sciences, 2006, 63(1): 12–24. |
| [14] |
陈江华, 刘建利, 李志宏. 中国植烟土壤及烟草养分综合管理[M]. 北京: 科学出版社, 2008. 34—79.
Chen J H, Liu J L, Li Z H. The integrated management of tobacco fields soil and tobacco nutrients [M]. Beijing: Sciences Press, 2008. 34—79. |
| [15] |
张志良. 植物生理学实验指导[M]. 北京: 高等教育出版社, 1990. 154—156.
Zhang Z L. Instruction of plant physiological experiment [M]. Beijing: Higher Education Press, 1990. 154—156. |
| [16] | Genty B, Briantais J M, Baker N R. The relationship between the quantum yields of photosynthetic electron transport and photochemical quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta, 1989, 990: 87–92. DOI:10.1016/S0304-4165(89)80016-9 |
| [17] |
YC/T217-2007烟草及烟草制品钾的测定连续流动法[S]. 北京: 中国标准出版社, 2007.
YC/T217-2007. The determination of potassium in tobacco and tobacco products by continuous Flow Analytical Method (CFA)[S]. Beijing: Standards Press of China, 2007. |
| [18] |
YC/T162-2011烟草及烟草制品氯的测定连续流动法[S]. 北京:中国标准出版社, 2011.
YC/T162-2011. The determination of chlorine in tobacco and tobacco products by continuous Flow Analytical Method (CFA) [S]. Beijing: Standards Press of China, 2011. |
| [19] |
周阮宝, 谷雨萍, 茆敦俊, 周嘉槐. 介绍两种简易测定硝态氮的比色方法[J].
植物生理学通讯, 1991, 27(4): 299–301.
Zhou R B, Gu Y P, Mao D J, Zhou J H. Two simple colorimetric methods for NO3–-N[J]. Plant Physiology Communications, 1991, 27(4): 299–301. |
| [20] | Stauber T, Weinert S, Jentsch T J. Cell biology and physiology of CLC chloride channels and transporters[J]. Comprehensive Physiology, 2012, 2: 1701–1744. |
| [21] |
张守仁. 叶绿素荧光动力学参数的意义及讨论[J].
植物学通报, 1999, 16(4): 444–448.
Zhang S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J]. Chinese Bulletin of Botany, 1999, 16(4): 444–448. |
| [22] | Havaux M, Strasser R J, Greppin H. A theoretical and experimental analysis of the qP and qN coefficients of chlorophyll fluorescence quenching and their relation to photochemical and nonphotochemical events[J]. Photosynthesis Research, 1991, 27(1): 41–55. DOI:10.1007/BF00029975 |
| [23] |
赵会杰, 邹琦, 于振文. 叶绿素荧光分析技术及其在植物光合机理研究中的应用[J].
河南农业大学学报, 2000, 34(3): 248–251.
Zhao H J, Zou Q, Yu Z W. Chlorophyll fluorescence analysis technique and its application to photosynthesis of plant[J]. Journal of Henan Agricultural University, 2000, 34(3): 248–251. |
| [24] |
赵丽英, 邓西平, 山仑. 不同水分处理下冬小麦旗叶叶绿素荧光参数的变化研究[J].
中国生态农业学报, 2007, 15(1): 63–66.
Zhao L Y, Deng X P, Shan L. Effects of altered water condition on some chlorophyll fluorescence parameters of f lag leaves of winter wheat[J]. Chinese Journal of Eco-Agriculture, 2007, 15(1): 63–66. |
| [25] | Angeli A D, Thomine S, Frachisse J M, et al. Anion channels and transporters in plant cell membranes[J]. Febs Letters, 2007, 581: 2367–2374. DOI:10.1016/j.febslet.2007.04.003 |
| [26] | Zifarelli G, Pusch M. CLC transport proteins in plants[J]. Febs Letters, 2010, 584: 2122–2127. DOI:10.1016/j.febslet.2009.12.042 |
| [27] |
项锡娜, 陈泰豪, 吴月燕, 等. 盐胁迫对红叶石楠‘鲁班’生理生化特性及叶片显微结构的影响[J].
植物生理学报, 2014, 50(7): 917–924.
Xiang X N, Chen T H, Wu Y Y, et al. Effects of Salt Stress on Physio-Biochemical Characteristics and Leaf Microstructurein Photinia glabra ‘Rubens’ Seedlings[J]. Plant Physiology Journal, 2014, 50(7): 917–924. |
| [28] |
姜卫兵, 高光林, 俞开锦, 等. 水分胁迫对果树光合作用及同化代谢的影响研究进展[J].
果树学报, 2002, 19(6): 416–420.
Jiang W B, Gao G L, Yu K J, et al. A Review of Studies on Effect of Water Stress on Photosynthesis and Assimilation Metabolism in Fruit Crops[J]. Journal of Fruit Science, 2002, 19(6): 416–420. |
| [29] |
向彬方, 向利红, 丁晓波, 等. 青稞幼苗对盐胁迫生理生化的响应[J].
内江师范学院学报, 2008, 23(增刊2): 257–259.
Xiang B F, Xiang L H, Ding X B, et al. Physiological and biochemical responses of barley seedling to salt stress[J]. Journal of Neijiang Normal University, 2008, 23(z1): 257–259. |
| [30] |
夏阳, 孙明高, 李国雷, 等. 盐胁迫对四园林绿化树种叶片叶绿素含量动态变化的影响[J].
山东农业大学学报(自然科学版), 2005, 36(1): 30–34.
Xia Y, Sun M G, Li G L, et al. The effects of salt stress on the contents of chlorophyll in seedling leaves of four garden tree species[J]. Journal of Shandong Agricultural University (Natural Sciences), 2005, 36(1): 30–34. |
| [31] |
吴月燕, 李波, 张燕忠, 崔鹏. 盐胁迫对杜鹃生理生化与叶绿体亚显微结构的影响[J].
浙江大学学报(农业与生命科学版), 2011, 37(6): 642–648.
Wu Y Y, Li B, Zhang Y Z, Cui P. Effects of salt stress on physiological-biochemical characteristics and chloroplast submicroscopic structure of rhododendron indicum[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2011, 37(6): 642–648. |
| [32] |
史冬平, 杨笑, 张永清. 镧浸种对盐胁迫下小麦幼苗生长及其生理特征的影响[J].
西北植物学报, 2013, 33(6): 1159–1164.
Shi D P, Yang X, Zhang Y Q. Effects of Lanthanum on the Growth and Physiological Characteristics of Wheat Seedling under Salt Stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(6): 1159–1164. |
| [33] |
杨颖丽, 杨宁, 王莱, 等. 盐胁迫对小麦幼苗生理指标的影响[J].
兰州大学学报?自然科学版, 2007, 43(2): 29–34.
Yang Y L, Yang N, Wang L, et al. Effect of salinity on the physiological characteristics in two wheat cultivars[J]. Journal of Lanzhou University (Natural Sciences), 2007, 43(2): 29–34. |
| [34] | Prakash M, Ramachandran K. Effects of moisture stress and anti-transpirants on leaf chlorophyll, soluble protein and photosynthetic rate in brinjal plants[J]. Journal of Agronomy & Crop Science, 2000, 184(3): 153–156. |
| [35] |
冯建灿, 胡秀丽, 毛训甲. 叶绿素荧光动力学在研究植物逆境生理中的应用[J].
经济林研究, 2002, 20(4): 14–18.
Feng J C, Hu X L, Mao X J. Application of chlorophyll fluorescence dynamics to plant physiology in adverse circumstance[J]. Economic Forest Researches, 2002, 20(4): 14–18. |
| [36] | Belkhodja R, Morales F, Abadia A, et al. Chlorophyll fluorescence as a possible tool for salinity tolerance screening in barley (Hordeum vulgare L.)[J]. Plant Physiology, 1994, 104(2): 667–673. DOI:10.1104/pp.104.2.667 |
| [37] |
吴雪霞, 于力, 朱为民. 外源一氧化氮对NaCl胁迫下番茄幼苗叶绿素荧光特性的影响[J].
中国生态农业学报, 2009, 17(4): 746–751.
Wu X X, Yu L, Zhu W M. Effect of exogenous nitric oxide on chlorophyll fluorescence characteristics in tomato seedlings under NaCl stress[J]. Chinese Journal of Eco-Agriculture, 2009, 17(4): 746–751. |
| [38] |
李青云, 葛会波, 胡淑明, 等. 外源钙对盐胁迫下草莓叶绿素荧光参数的影响[J].
沈阳农业大学学报, 2006, 37(3): 482–484.
Li Q Y, Ge H B, Hu S M, et al. Effects of exogenous calcium on chlorophyll fluorescence parameter of strawberry under salt stress[J]. Journal of Shenyang Agricultural University, 2006, 37(3): 482–484. |
| [39] |
王树凤, 胡韵雪, 孙海菁, 等. 盐胁迫对2种栎树苗期生长和根系生长发育的影响[J].
生态学报, 2014, 34(4): 1021–1029.
Wang S F, Hu Y X, Sun H J, et al. Effects of salt stress on growth and root development of two oak seedlings[J]. Acta Ecologica Sinica, 2014, 34(4): 1021–1029. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

