光合作用是植物和光合细菌将光能转化为化学能的过程。天然色素分子吸收的光能主要用于反应中心的光化学反应,而过量的激发能则以热耗散等方式耗散掉。光合速率是光合作用的重要体现,叶片的气孔导度和叶绿素含量在叶片光合性能的维系中起着重要作用[1]。花生是我国重要的经济作物之一,是重要的食用油和蛋白质来源,在保证国家油料安全方面有举足轻重的作用[2]。花生叶片的光合作用是作物产量形成的直接动力,产量高低取决于光合产物的积累与分配[3]。而光合产物的多少取决于光合面积、光合速率和光合时间[4]。花生要获得高产必须使花生植株在生育期内保持旺盛的光合作用,促进光合产物的积累,并使光合产物尽可能多的分配到荚果中去[5]。
将暗适应的绿色植物或含有叶绿素的部分组织突然暴露在可见光下之后就会观察到,植物绿色组织发出一种强度不断变化的暗红色荧光,荧光随时间变化的曲线称为叶绿素荧光诱导动力学曲线[6]。在室温条件下,绿色植物发出的这种荧光信号,绝大部分来自叶绿体光系统 II(PS II) 的天线色素蛋白复合体中的叶绿素 a 分子[7]。叶绿素荧光动力学技术是研究植物光合功能的快速的无损伤的探针。近年来,快速叶绿素荧光诱导动力学曲线已成为研究光合作用,特别是原初光化学反应的有力工具之一[8–9]。自然条件下的叶绿素荧光和光合作用有着十分密切的关系。一方面,当植物被暴露在过强的光照条件下,荧光起着十分重要的保护作用,避免叶绿体吸收光能超过光合作用的消化能力,将强光灼伤的损失降低到最小;另一方面,一般来说,自然条件下叶绿素荧光和光合速率是相互负关联的,光合速率高,荧光弱;反之,当光合强度下降时,则荧光的发射就增强[10]。快速叶绿素荧光诱导动力学曲线所包含的丰富和复杂的信息可以反映 PSII 的原初光化学反应和光合机构状态的变化。Strasser 等[11]建立的快速叶绿素荧光诱导动力学曲线的数据分析方法 (JIP 测定技术),为研究 PSII 反应中心的原初光化学反应建立了有效的方法。此外,应用 PSI 对 820 nm 光吸收曲线可以深入了解两个光系统的协调关系[12]。
生物炭是生物体高温热解得到的产物,木屑、农作物秸秆、动物粪便和城市一些生活垃圾都可以作为生产生物炭的原料[13]。生物炭和其他有机质相比是一种含碳量高且更为稳定的有机碳,不仅可以增加土壤中碳储量,有效减少二氧化碳的释放,还可以作为土壤改良剂,提高土壤肥力和生产力[14]。炭基肥是利用生物炭与其他化肥混合制成的长效肥料,炭基肥利用自身超强的吸附性把土壤中作物生长所需要的营养元素吸附在自己周围,可以防止肥料的流失而达到缓释的效果[15]。关于炭基肥料的研究及应用在我国刚刚起步,相关的研究结果还较少[16]。马欢欢等[17]将通过挤压工艺制作的炭基肥施入土壤后,发现适量炭基肥可以缓释肥效,减少肥料流失,同时有将土壤 pH 值由偏酸性向中性调节的趋势,改善了土壤的 pH 值状况。且使用添加生物质炭的肥料起到了一定的增温作用,土温提高后有利于花生的出苗,提高出苗率[18]。炭基缓释肥是以作物秸秆、玉米芯、花生壳及农林生产废弃物等通过嫌氧不完全燃烧制取的生物质炭 (炭黑) 为材料,配合不同比例的氮、磷、钾等养分生产的一种具有缓释功能的专用肥料。本研究利用炭基缓释肥,通过大田定位试验,进行不同处理花生叶片的快速叶绿素荧光诱导动力学曲线测定,分析了施用炭基缓释肥及不同用量生物炭条件下花生开花下针期叶片光合性能指标的差异,PSⅡ与PSⅠ性能,以期探明花生叶片光合性能对新型肥料及生物炭的生理反应,为研究炭基缓释肥及生物炭提高花生产量的机理提供理论依据。
1 材料与方法 1.1 试验地概况试验地位于沈阳市沈阳农业大学花生定位科研基地 (123°33' E,40°48'N),地处松辽平原南部的中心地带,属于温带湿润–半湿润季风气候。年均气温 7.0~8.1℃,10℃以上积温 3300~3400℃,无霜期为 148~180 d,2013 年降雨量为 661 mm。试验地为旱地棕壤,成土母质为第四纪黄土性母质上的简育湿润淋溶土。炭基肥定位试验始于 2011 年,试验前耕层土壤的基本理化性质:有机质 13.1 g/kg、全氮 0.53 g/kg、全磷 0.67 g/kg、全钾 18.8 g/kg、碱解氮含量 56.2 mg/kg、速效磷含量 12.5 mg/kg、速效钾含量 89.6 mg/kg、pH 值为 6.81。
1.2 试验设计试验地种植制度为一年一熟花生连作,品种为花育 33,种植密度为 15 万穴/hm2,每穴种植 2 株。试验设 5 个处理:1) CK (不施肥);2) C15 (生物炭 225 kg/hm2);3) C50 (生物炭 750 kg/hm2);4) NPK (N 82.5、P2O5 82.5、K2O 97.5 kg/hm2);5) TJHS (炭基缓释肥 750 kg/hm2)。每个处理重复 3 次,每个小区面积 27 m2 (4.5 m × 6 m)。采用 90 cm 大垄双行种植方式,小行距 30 cm,株距 15 cm,采用随机排列。供试的肥料包括生物炭 (C 22%、N 0.3%、P2O5 0.2%、K2O 2.4%),炭基缓释肥 (含 C 6.6%、N 11%、P2O5 11%、K2O 13%),尿素,磷酸二铵和硫酸钾。所有肥料混匀后采用条施做基肥一次施入,施入深度 15—20 cm,覆土。其中 C15 处理与 TJHS 处理碳素投入量相同,NPK 处理与 TJHS 处理养分投入量相同。
1.3 样本采集与分析2013 年 5 月 15 日进行播种,10 月 9 日收获。植物样本于花生生长关键生育时期—开花下针期 (7 月 21 日) 采集,每个小区采集 3 片花生功能叶 (最新完全展开叶片),放入自封袋,保存于 0℃ 冰盒中。所有叶片依次采用叶片夹夹住叶片中部,进行 30 min 暗适应,然后采用 M-PEA-2 型植物效率仪进行各项指标测定。
1.4 测定项目与方法1.4.1 快速叶绿素荧光诱导动力学曲线的测定 以 Schansker 等[19]方法为参考,应用连续激发式荧光仪 M-PEA-2 (Hansatech,英国),先将采集样本叶片先暗适应 30 min,然后测定快速叶绿素荧光诱导动力学曲线 (OJIP 曲线) 和对 820 nm (远红光测量光为峰值 820 ± 20 nm) 的光吸收曲线。OJIP 曲线由 3000 μmol/(m2·s) 的脉冲光诱导,荧光信号记录是从 10 μs 开始,至 1 s 结束,记录的初始速率为每秒 118 个数据。
1.4.2 JIP-test 分析 根据 Strasser 等[20–21]的方法,对获得的 OJIP 荧光诱导曲线进行分析。分析时需知 Fo (20 μs 时荧光,O 相)、Fk (300 μs 时荧光,K 相)、Fj (2 ms 时荧光,J 相)、Fi (30 ms 时荧光,I 相)、Fm (最大荧光,P 相);Vk、Vj 和 Vi (K、J 和 I 点的相对可变荧光);可变荧光 Fk 占 Fj-Fo 振幅的比例 Wk;捕获的激子将电子传递到电子传递链中 QA 下游的其他电子受体的概率 Ψo;以吸收光能为基础的光化学性能指数 PIABS;PSⅠ的最大氧化还原活性 ΔI/Io = (I0.4 – I40)/I0.4。
1.5 统计分析方法试验数据采用 Microsoft Excel 2013 和 SPSS19.0 软件进行统计分析。
2 结果与分析 2.1 不同处理对光系统Ⅱ(PSⅡ)性能的影响2.1.1 快速叶绿素荧光诱导动力学曲线 由图 1a和图 1b可以看出,与不施肥 (CK) 相比,C15、C50、NPK 和炭基肥处理花生功能叶快速叶绿素荧光诱导动力学曲线 (即 OJIP 曲线) 变化显著,以不施肥 CK 处理的 OJIP 曲线作为参照,将各处理 OJIP 曲线标准化。典型的快速荧光诱导动力学曲线有 O、J、I、P 等相,如果在极短的时间内 (即 J 点之前),叶绿素荧光上升出现 K 点,则表明放氧复合体系统 (OEC) 的活性被抑制[22]。降低 K 和 J 荧光强度值,可以降低放氧复合体系统的损伤程度。比较 K、J 两点相对荧光强度大小的变化,可以算出 OEC 受损程度。由图 1c可以看出,C15 和 C50 处理 K、J 和 I 三点的荧光强度明显低于不施肥处理,其中 J 点降低幅度最大,且 J 点处 C15 降低幅度小于 C50。可见在一定用量范围内,增加生物炭投入量可以降低花生叶片放氧复合体系统损伤程度。由图 1d可以看出,NPK、TJHS 两处理 K、J 和 I 三点的荧光强度明显低于不施肥处理,其中 J 点降低幅度最大,且 NPK 处理的 J 点降低幅度特别明显,幅度最大。可以得出,采用氮磷钾配施用和炭基肥均可以有效降低花生功能叶放氧复合体系统损伤,但炭基肥效果不如氮磷钾配施明显。
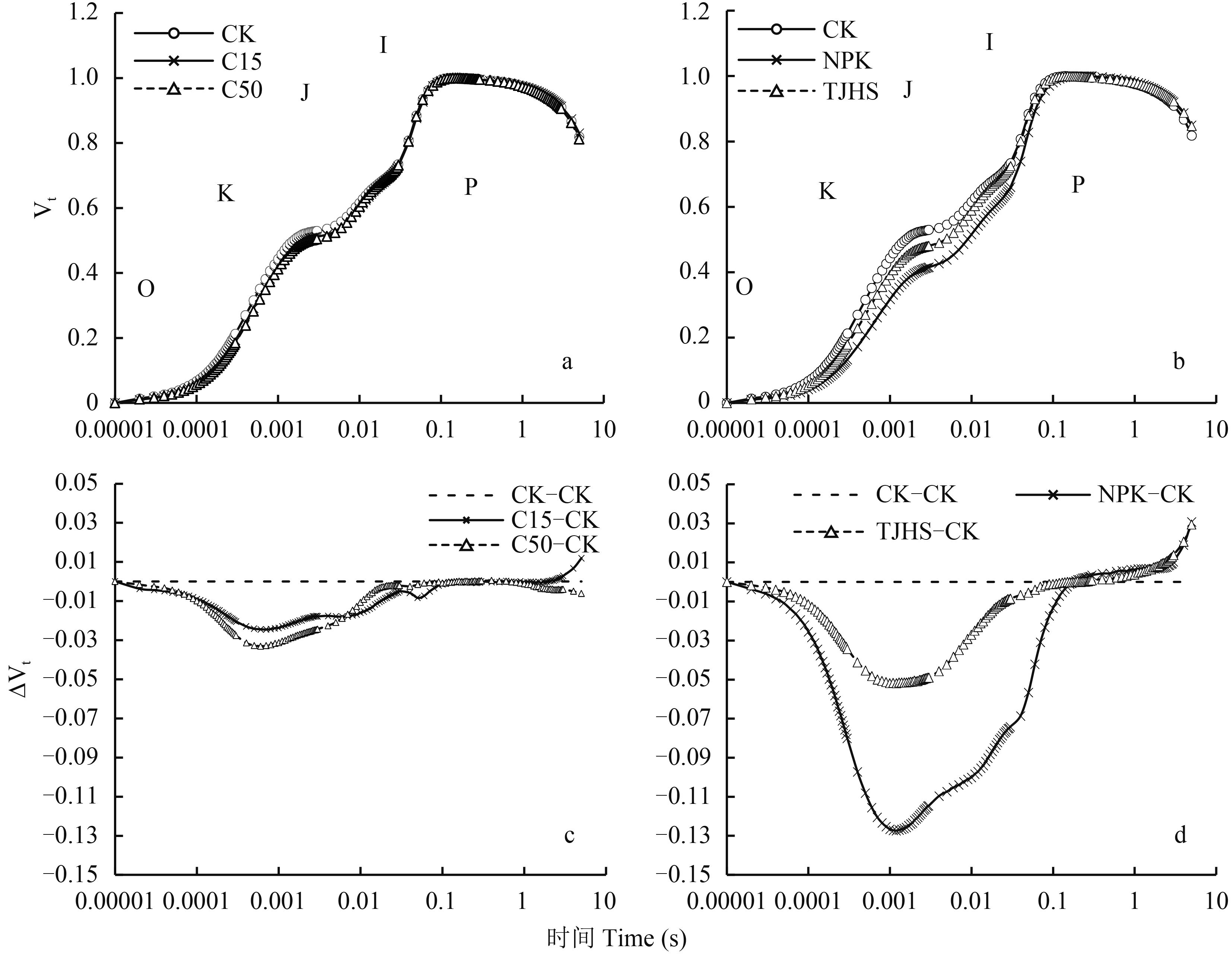 |
| 图1 不同施肥处理对花生功能叶 PSⅡ相对可变荧光强度 (Vt) 及其差值 (ΔVt) 的影响 Fig. 1 Effects of different treatments on the relative variable fluorescence intensity (Vt) and the difference of relative variable fluorescence intensity (ΔVt) of peanut functional leaves |
2.1.2 不同处理对花生功能叶电子由 QA 传递到 QB 的概率 (ψo) 的影响 激子将电子传递到电子传递链中 QA 下游的其他电子受体 (QB) 的概率 ψo 是综合评价 PSⅡ电子传递链性能的主要指标[23]。其受 PSⅡ供体侧的电子供应能力和受体侧 (包括 PSI) 接受电子的能力制约。由图 2可以看出,随着生物炭施入量的增加,可以有效地提高花生功能叶的 ψo 值,C15 处理的 ψo 值与 CK 相比提高了 13.71%。对比炭基肥处理与 C15 处理,炭基肥处理 ψo 值比 C15 处理高 6.56%,达到了显著水平。由此可以看出,等量生物炭素投入量的情况下,施用炭基肥更有利于提高花生功能叶电子由 QA 传递到 QB 的概率。对比炭基肥处理与 NPK 处理,ψo 值差异不显著。由此可见,施用 NPK 与施用炭基肥对于花生功能叶 ψo 值提升效果相差不大。
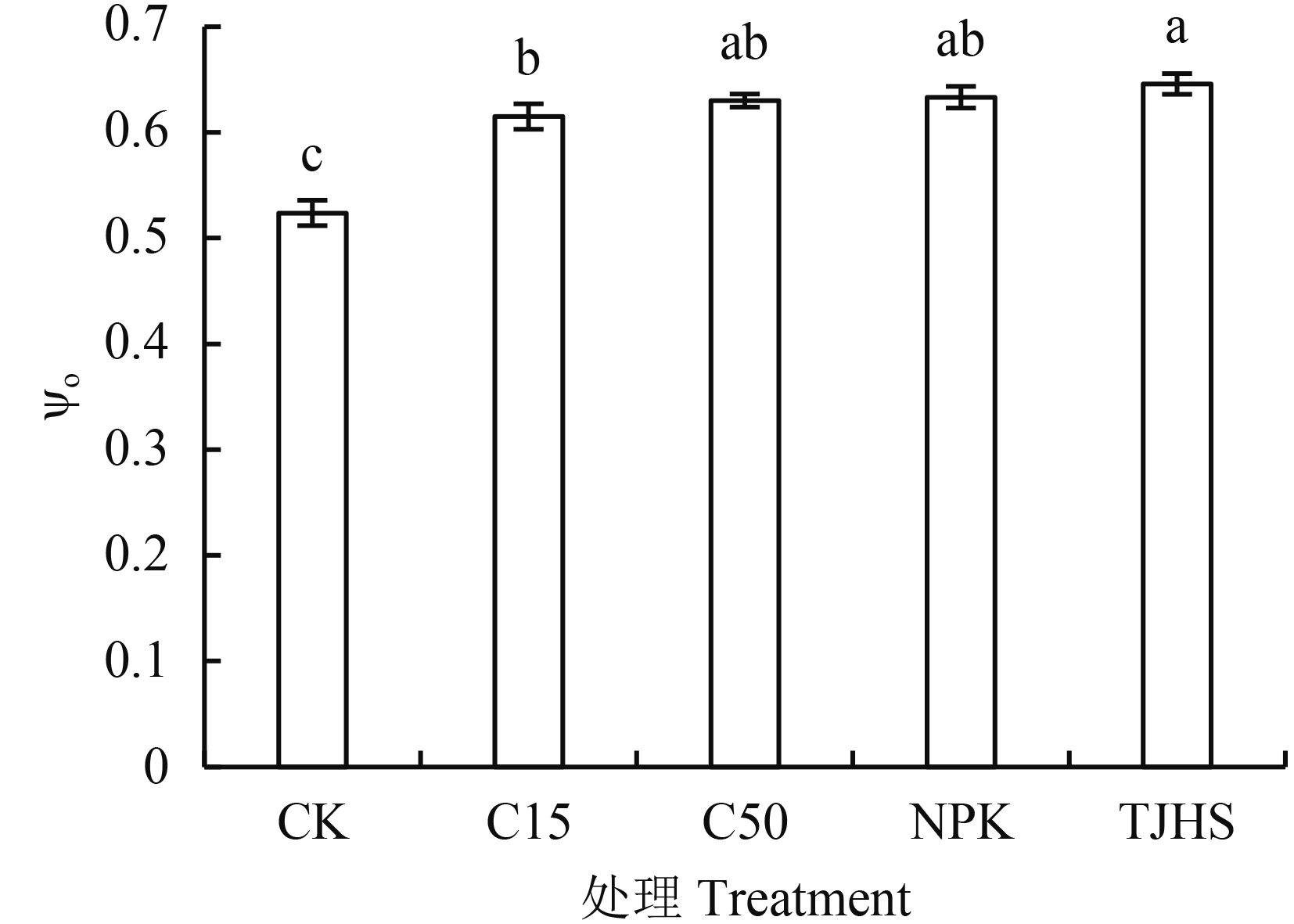 |
| 图2 不同处理对花生功能叶电子由 QA 传递到 QB 的概率 (Ψo) 的影响 Fig. 2 Effects of different treatments on probability of the electron moves from QA to QB (Ψo) [注(Note):柱上不同字母表示不同处理间差异达 5% 显著水平 Different letters above the bars mean significant difference among the treatments at the 5% level.] |
2.1.3 不同处理对花生功能叶以吸收光能为基础的光化学性能指数 (PIABS) 的影响 以吸收光能为基础的性能指数 PIABS 主要用于衡量 PSⅡ整体性能。由图 3可以看出,CK 处理最低,仅为 4.79,炭基肥处理最高,为 8.41。C15 处理和 C50 处理 PIABS 值比CK处理分别提高了 58.25%、49.27%,表明施入一定数量生物炭可有效提高花生功能叶的 PIABS 值;但随着生物炭用量的增高,PIABS 值并未表现出正相关关系。对比炭基肥处理与 C15 处理,炭基肥处理的 PIABS 值提高了 12.27%,差异显著。表明等量生物炭素投入量的情况下,施用炭基肥更有利于提高花生功能叶 PIABS 值。对比炭基肥处理和 NPK 处理,炭基肥处理的 PIABS 值提高了 17.62%。表明等养分投入情况下,施用炭基肥对于提高花生叶片 PIABS 值效果好于氮磷钾配施。
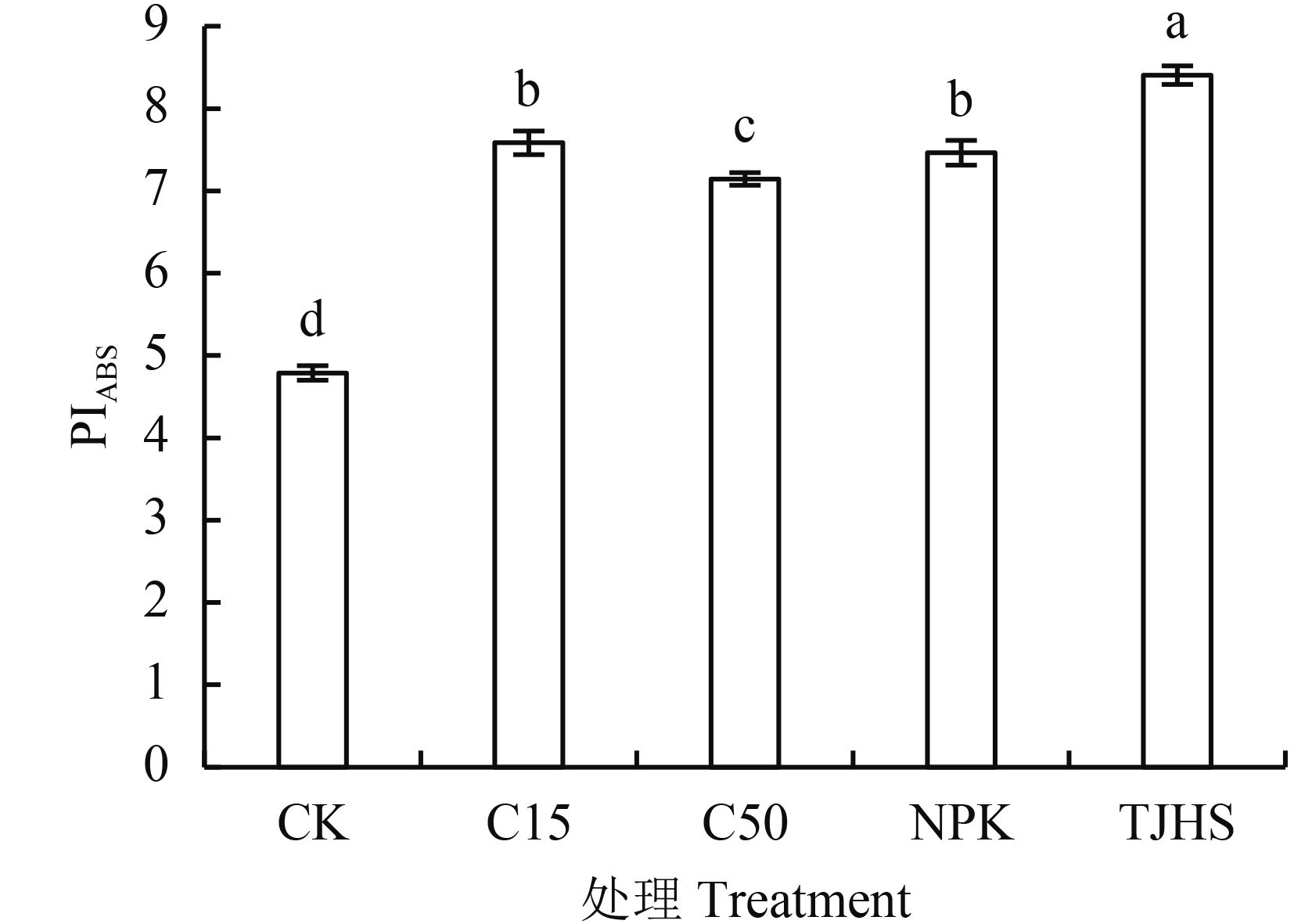 |
| 图3 不同处理对花生功能叶吸收光能为基础的光化学性能指数 (PIABS) 的影响 Fig. 3 Effects of different treatments on performance index on the absorption basis (PIABS) of peanut functional leaves [注(Note):柱上不同字母表示不同处理间差异达 5% 显著水平 Different letters above the bars mean significant difference among the treatments at the 5% level.] |
2.1.4 不同处理对花生功能叶叶绿素可变荧光 Fk 占 Fo-Fj 振幅比例 (Wk) 的影响 通过 JIP-text 数据处理方法,比较 K 点和 J 点的相对荧光强度的大小变化 (Wk),可以计算出 OEC 受损程度与 QA 的积累程度。由图 4可以看出,各处理间无明显差异,可见等碳量投入或等养分投入条件下,不同施肥对花生功能叶片 Wk 值无明显影响。
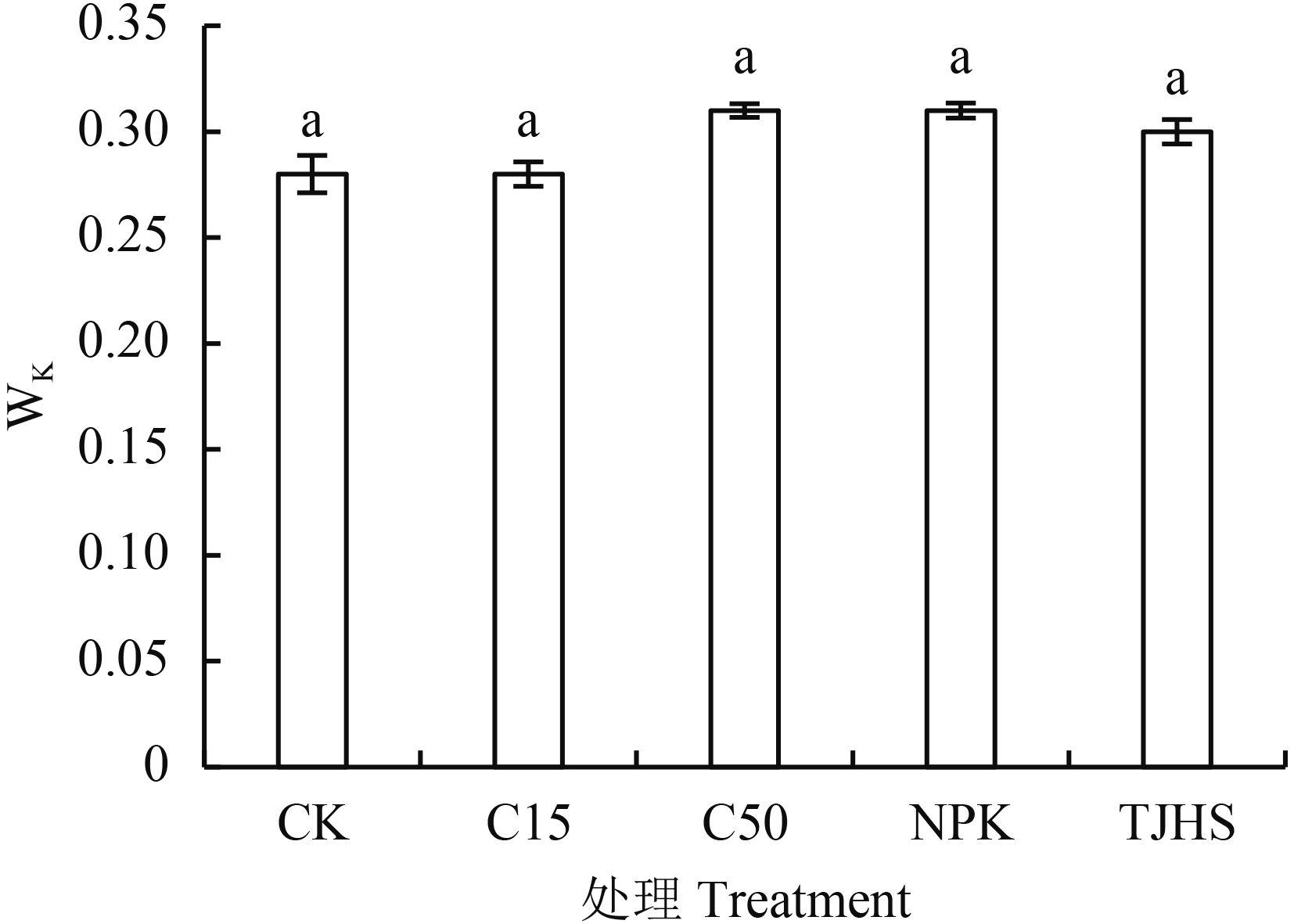 |
| 图4 不同处理对花生功能叶叶绿素可变荧光 Fk 占 Fo-Fj振幅的比例 (Wk) 的影响 Fig. 4 Effects of different treatments on the ratio of the variable fluorescence (Wk) at Fk to the amplitude Fo-Fj [注(Note):柱上相同字母表示不同处理间在 5% 水平差异不显著 Same letters above the bars indicate no significant difference among the treatments at the 5% level.] |
2.1.5 不同施肥处理对花生功能叶叶绿素可变荧光 Fj 占 Fo-Fp 振幅比例 (Vj) 的影响 K 点和 J 点的相对荧光强度的大小变化 (Vj) 也是衡量 OEC 受损程度与 QA 的积累程度的有效指标之一。Vj 值越高表示花生叶片 OEC 受损程度越大,PSⅡ反应中心电子传递链供体侧和受体侧的电子传递能力增强。由图 5可以看出,CK 处理 Vj 值最高为 0.48,与其他四个处理差异显著;而 C15、C50、NPK 和炭基肥处理的 Vj 值均低于 CK 处理。可见无论施入低量生物炭、高量生物炭、氮磷钾肥料或炭基肥均可以显著减低花生功能叶 Vj 值,炭基肥与等碳量或等氮磷钾养分处理间未表现出明显差异。
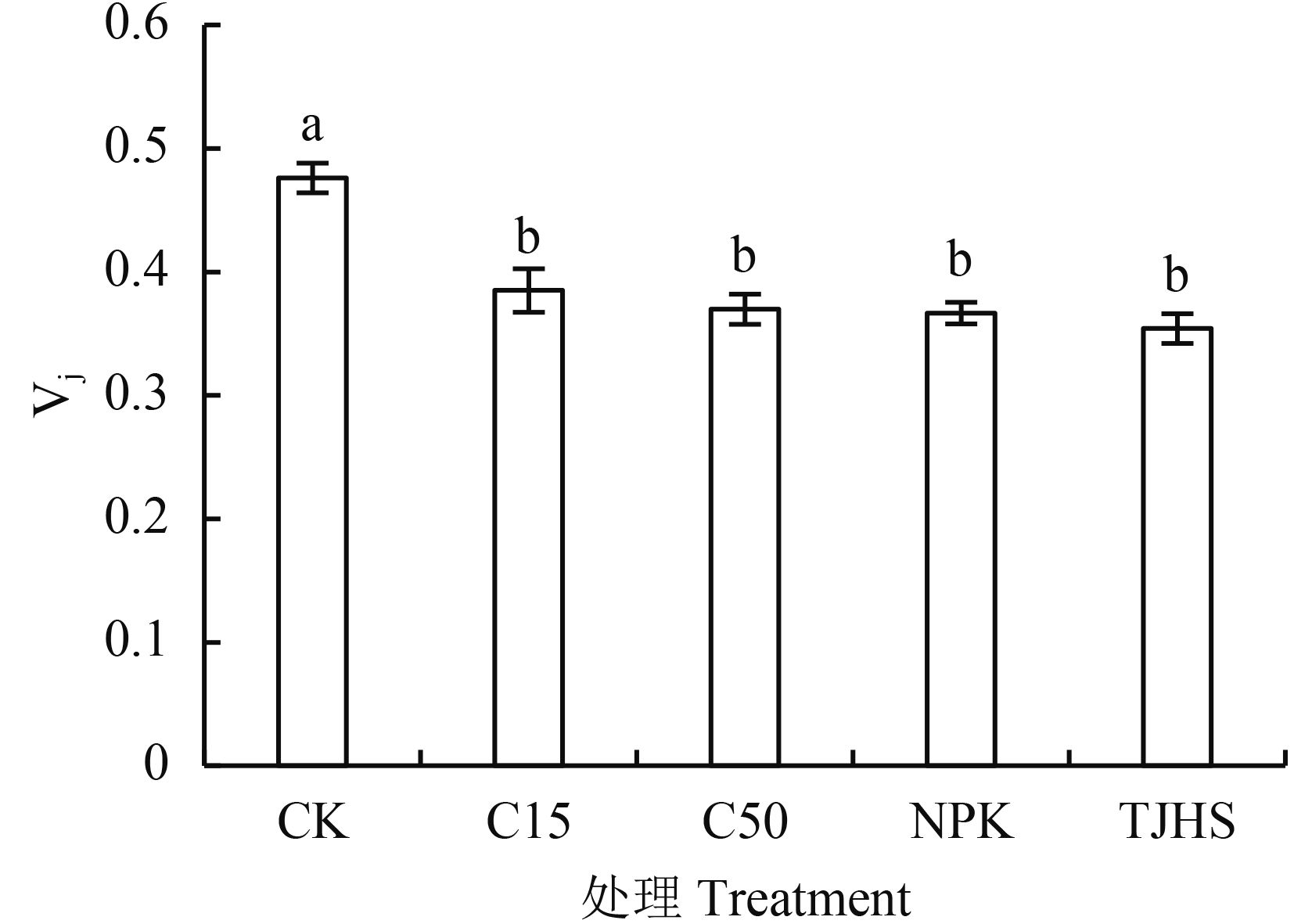 |
| 图5 可变荧光 Fj 占 Fo-Fp 振幅比例 (Vj) 的影响 Fig. 5 Effects of different treatments on ratio of variable fluorescence (Vj) at Fj to the amplitude Fo-Fp of peanut functional leaves [注(Note):柱上不同字母表示不同处理间差异达 5% 显著水平 Different letters above the bars mean significant difference among the treatments at the 5% level.] |
2.2.1 不同处理对花生功能叶 820 nm 相对光吸收值 (It) 及其差值 (ΔIt) 的影响 由图 6a、b可以看出,不同时间内不同处理 It 值呈“V”型变化。将各处理标准化后可以看出,ΔIt 值随着时间增长,C15 处理 > CK 处理 > C50 处理 (图 6c)。表明低量生物炭投入有利于 ΔIt 升高,但生物炭量达到一定程度时,ΔIt 值反而处于下降趋势。NPK 处理的 ΔIt 值随着时间变化波动较大,有时高于 CK 处理,有时低于 CK 处理。而炭基肥处理的 ΔIt 值变化较为平稳,逐步处于上升趋势。表明等养分投入情况下,炭基肥处理对于 820 nm 光的吸收稳定,更有利于花生功能叶片对于 820 nm 光的吸收 (图 6d)。
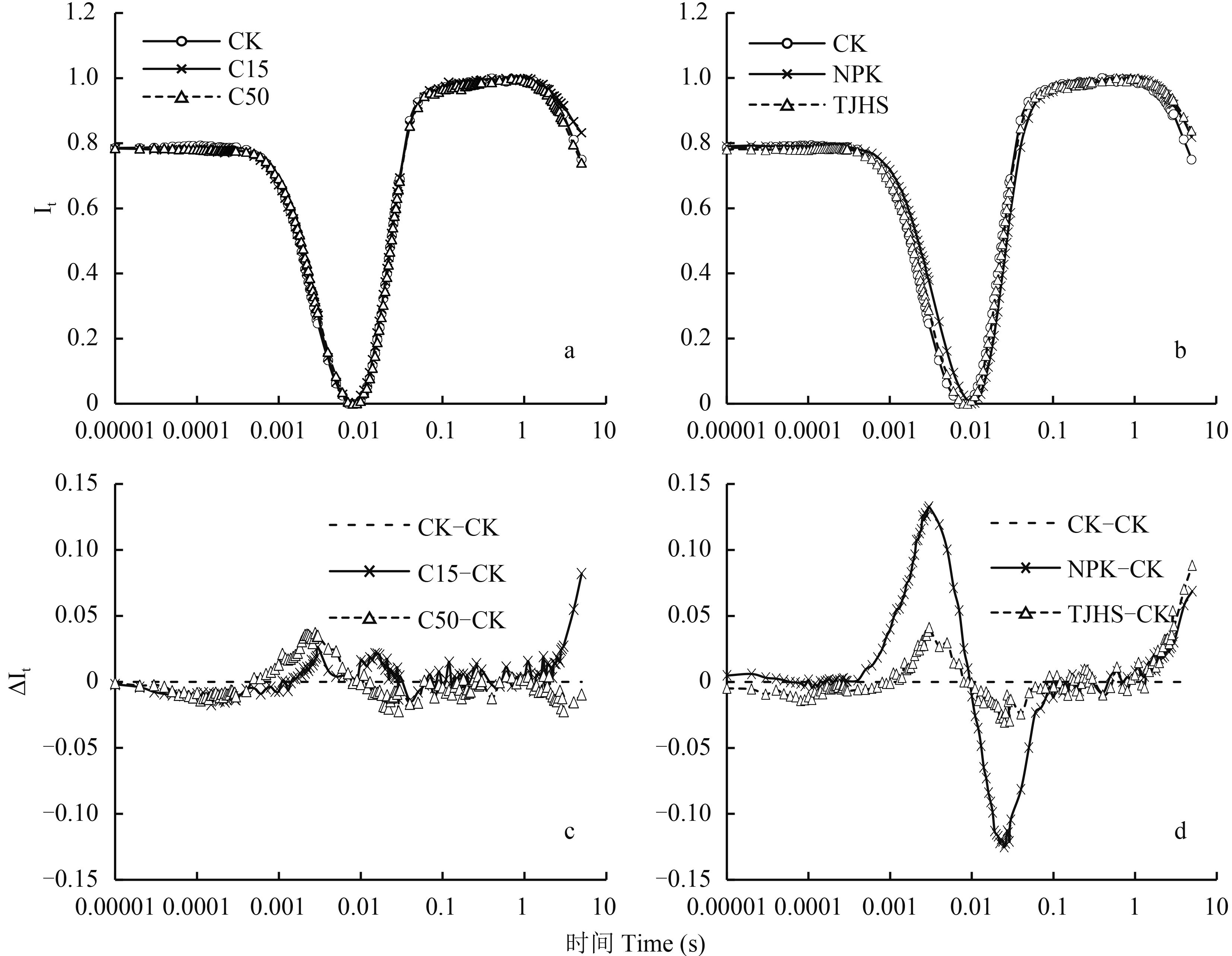 |
| 图6 不同处理对花生功能叶 820 nm 相对光吸收值 (It) 及其差值 (ΔIt) 的影响 Fig. 6 Effects of different treatments on 820 nm relative light absorbance (It) and the difference of relative light absorbance (ΔIt) of peanut functional leaves |
2.2.2 不同处理对花生功能叶 PSⅠ的最大氧化还原活性 (ΔI/Io) 的影响 PSⅠ的最大氧化还原活性 (ΔI/Io) 反映 PSⅠ反应中心 P700 的最大氧化还原能力,是对 PSⅠ性能综合评价的重要指标[19]。由图 7可以看出,NPK 处理的 ΔI/Io 值最低,仅为 0.279;最高的为 C50 处理 (0.292),其余依次为炭基肥处理 (0.291)、C15 处理 (0.290) 和 CK 处理 (0.281)。对比 CK、C15 和 C50 三个处理,可以看出,增施生物炭用量提高了花生功能叶 ΔI/ Io 值。其中,C15 处理 ΔI/Io 值与 CK 相比提高了 3.20%,C50 处理提高了 3.91%。C15、C50 两处理差异不显著,表明此条件下,生物炭投入量达到一定数量后,再增加其投入量对于花生功能叶 ΔI/Io 值的提升作用不大。对比炭基肥处理与 C15 处理,ΔI/Io 值差异不显著,可见等碳素投入情况下,炭基肥对提高花生功能叶 PSⅠ的最大氧化还原活性作用与生物炭相当。炭基肥处理 ΔI/Io 值比氮磷钾处理高 4.3%,差异显著。表明炭基肥在提升花生功能叶 PSⅠ的最大氧化还原活性作用方面比等养分氮磷钾配施更好。
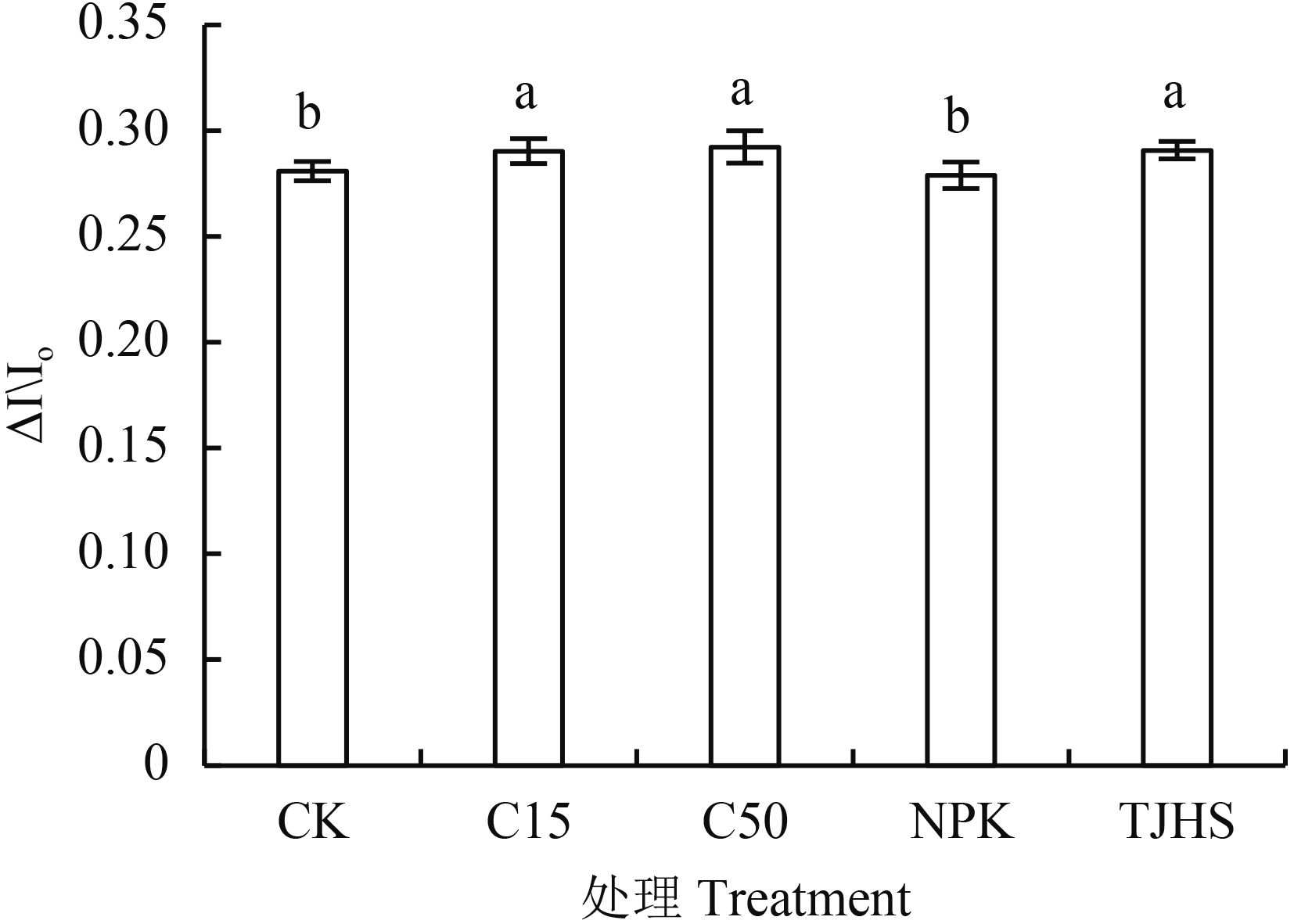 |
| 图7 各处理对花生功能叶 PS Ⅰ的最大氧化还原活性 (ΔI/Io) 的影响 Fig. 7 Effects of different treatments on maximal oxidation-reduction activity of PSⅠ (ΔI/Io) of peanut functional leaves [注(Note):柱上不同字母表示不同处理间差异达 5% 显著水平 Different letters above the bars mean significant difference among the treatments at the 5% level.] |
有研究认为,光合活性的降低是叶片衰老的最主要特征,也可能是诱发叶片衰老的信号,植物的衰老或非生物胁迫等都直接或间接地影响植物 PSⅡ的功能[24]。因为叶绿素荧光和光合原初反应存在着密切关系,它可以显示反应中心及供体侧和受体侧的氧化还原状态[25],所以当环境条件变化时,叶绿素荧光的变化可以在一定程度上反映环境因子对植物的影响[7]。植物快速叶绿素荧光诱导曲线可获得大量 PSⅡ反应中心的数据,继而可深入分析环境条件变化对植物光合机构的影响。
Ψo 是对 PSⅡ反应中心电子传递链性能的综合评价之一,受 PSⅡ供体侧的电子供应能力和受体侧 (包括 PSⅠ)接收电子的能力制约,PIABS 可以衡量 PSⅡ整体性能[22]。Ψo 和 PIABS 在施用炭基缓释花生专用肥 (TJHS) 后显著提高,说明 PSⅡ反应中心电子传递链性能和 PSⅡ整体性能得到了显著增强,其反应中心电子传递性能提高。快速叶绿素荧光诱导动力学曲线有 O、J、I 和 P 等相,如果在极短的时间内 (即 J 点之前),叶绿素荧光上升出现 K 点,则表明放氧复合体系统 (OEC) 的活性被抑制[22],J 点荧光的上升表明 QA 的大量积累。本试验表明施用炭基肥可以引起 OJIP 曲线显著变化,降低 K 点以及 J 点荧光强度值,通过 JIP-test 数据处理方法,比较 K 和 J 点相对荧光强度的大小变化 (Wk 和 Vj),可以计算出 OEC 受损程度与 QA 积累程度[26]。本研究表明,与其余几个处理相比 (CK、C15、C50、NPK), 施炭基缓释花生专用肥 (TJHS) 处理 J 点相对荧光强度 Vj 有所降低,K 点相对荧光强度 Wk 各处理之间差异不显著,Vj 降低幅度大于 Wk 升高幅度,说明施炭基缓释花生专用肥可以增强叶片 PSⅡ反应中心电子传递链供体侧和受体侧的电子传递能力,增强放氧复合体和 QA 之后电子传递链的活性;其中对 PSⅡ反应中心电子受体侧性能的改善大于供体侧。
PSⅠ性能的强弱不仅受自身性能的影响,同时还受到 PSⅡ性能的影响[15]。PSⅠ的最大氧化还原活性 (ΔI/Io) 反映了 PSⅠ反应中心 P700 的最大氧化还原能力,是对 PSⅠ性能的综合评价,本研究表明,施用炭基缓释花生专用肥 (TJHS) 处理增加功能叶对 820 nm 光吸收量,对 PSⅠ的最大氧化还原活性 ΔI/Io 有提高趋势,说明适量施用一定程度上提高 PSⅠ反应中心色素因子即 P700 的最大氧化还原能力,有利于花生光合功能。
4 结论1) 与不施肥处理相比,不同施肥处理均能显著影响花生功能叶快速叶绿素荧光诱导动力学曲线变化,K、J、I 点的荧光强度值明显降低。在一定用量范围内,增加生物炭投入量可以降低花生营养生长时期叶片放氧复合体系统损伤程度;氮磷钾配合施用和炭基肥均可以有效降低花生营养生长时期功能叶放氧复合体系统损伤,但炭基肥效果不如氮磷钾配施明显。
2) 施入一定量的生物炭可以提高花生营养生长时期叶片光系统中电子传递、光能吸收、氧化还原性能,同时降低叶片 OEC 受损程度;但随着生物炭用量逐渐增大,效果减弱。施用炭基缓释肥在提高叶片光系统性能方面要优于生物炭和氮磷钾配施。
| [1] |
王群瑛, 胡昌浩. 玉米不同叶位叶片的初步研究[J].
作物学报, 1986, 12(4): 273–278.
Wang Q Y, Hu C H. Study on the structure and photosynthetic properties of leaf blades on different levels in maize[J]. Acta Agronomica Sinica, 1986, 12(4): 273–278. |
| [2] |
周录英, 李向东, 汤笑, 等. 氮、磷、钾肥配施对花生生理特性及产量品质的影响[J].
生态学报, 2008, 28(6): 2708–2714.
Zhou L Y, Li X D, Tang X, et al. Effects of N, P, K fertilizer combined application on physiological characteristics, yield and kernel quality of peanut[J]. Acta Ecologica Sinica, 2008, 28(6): 2708–2714. |
| [3] |
黄玉茜, 韩立思, 韩晓日, 等. 辽宁风沙土区连作年限对花生光合特性和产量的影响[J].
沈阳农业大学学报, 2011, 42(4): 438–442.
Huang Y Q, Han L S, Han X R, et al. Effects of continuous cropping on yields and photosynthetic characteristics of peanuts in sandy soil region of Liaoning[J]. Journal of Shenyang Agricultural University, 2011, 42(4): 438–442. |
| [4] | Ma B L, Dwyer L M. Nitrogen uptake and use of two contrasting maize hybrids differing in leaf senescence[J]. Plant and Soil, 1998, 199: 283–291. DOI:10.1023/A:1004397219723 |
| [5] |
张春芳, 杨劲峰, 韩晓日, 等. 不同品种花生叶片光合特性及产量比较研究[J].
沈阳农业大学学报, 2014, 45(2): 152–157.
Zhang C F, Yang J F, Han X R, et al. Difference of photosynthetic characteristics and pod yield of two peanut varieties[J]. Journal of Shenyang Agricultural University, 2014, 45(2): 152–157. |
| [6] |
李鹏民, 高辉远. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].
植物生理与分子生物学学, 2005, 31(6): 559–566.
Li P M, Gao H Y. Application of the fast chlorophyⅡ fluorescence induction dynamics analysis in photosynthesis study[J]. Journal of Plant Physiology and Molecular Biology, 2005, 31(6): 559–566. |
| [7] | Krause G H, Wei E. Chlorophyll fluorescence and photosysthesis: The basis[J]. Annual Review of Plant Physiology, 1991, 42(4): 313–349. |
| [8] | Schansker G, Toth S Z, Strasser R J. Methylviologen and dibromothymoquinone treatments of pea leaves reveal the role of photosystemⅠin the Chl a fluorescence rise OJIP[J]. Biochimica et biophysica acta, 2005, 1706: 250–261. DOI:10.1016/j.bbabio.2004.11.006 |
| [9] | Ilík P, Schansker G, Kotabová E, et al. A dip in the chlorophyll fluorescence induction at 0. 2-2s in trebouxia-possessing lichens reflects a fast reoxidation of photosystemⅠ. A comparison with higher plants[J]. Biochimica et Biophysica Acta, 2006, 1757: 12–20. DOI:10.1016/j.bbabio.2005.11.008 |
| [10] |
李晓, 冯伟, 曾晓春. 叶绿素荧光分析技术及应用进展[J].
西北植物学报, 2006, 26(10): 2186–2196.
Li X, Feng W, Zeng X C. Advances in chlorophyll fluorescence analysis and its uses[J]. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(10): 2186–2196. |
| [11] | Strasser B J, Strasser R J. Measuring fast fluorescence transients to address environmental questions: The JIP test [A]. Mathis P. Photosynthesis: from light to biosphere [M]. Dordrecht: KAP Press, 1995. 977—980. |
| [12] | Dai J, Gao H, Dai Y, et al. Changes in activity of energy dissipating mechanisms in wheat flag leaves during senescence[J]. Plant Biology, 2004, 6(2): 171–177. DOI:10.1055/s-2004-817845 |
| [13] | Lehmann J, Gaunt J, Rondon M. Bio-char sequestration in terrestrial ecosystems-a review[J]. Mitigation and Adaptation Strategies for Global Change, 2006, 11: 403–427. |
| [14] | Lehmann J, Da Silva J P Jr, Steiner C, et al. Nutrient availability and leaching in an archaeological Anthrosol and a Ferralsol of the Central Amazon basin: Fertilizer, manure and charcoal amendments[J]. Plant and Soil, 2002, 249: 343–357. |
| [15] | Rondon M A, Lehmann J, Ramírez J, Hurtado M. Biological nitrogen fixation by common beans (Phaseolus vulgaris L.) increases with bio-char additions[J]. Biology and Fertility of Soils, 2007, 43: 699–708. DOI:10.1007/s00374-006-0152-z |
| [16] |
刘玉学, 王耀锋, 吕豪豪, 等. 不同稻秆炭和竹炭施用水平对小青菜产量, 品质以及土壤理化性质的影响[J].
植物营养与肥料学报, 2013, 19(6): 1438–1444.
Liu Y X, Wang Yao F, Lv H H, et al. Effects of different application rates of rice straw biochar and bamboo biochar on yield and quality of greengrocery (Brassica chinensis) and soil properties[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(6): 1438–1444. |
| [17] |
马欢欢, 周建斌, 王刘江, 等. 秸秆炭基肥料挤压造粒成型优化及主要性能[J].
农业工程学报, 2014, 30(5): 270–276.
Ma H H, Zhou J B, Wang L J, et al. Straw carbon based fertilizer granulation molding optimization and its main properties[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(5): 270–276. |
| [18] |
刘小虎, 赖鸿雁, 韩晓日, 等. 炭基缓释花生专用肥对花生产量和土壤养分的影响[J].
土壤通报, 2013, 44(3): 698–701.
Liu X H, Lai H Y, Han X R, et al. Effects of charcoal-based solow release peanut specific fertilizer application on peanut yield and soil nutrients[J]. Chinese Journal of Soil Science, 2013, 44(3): 698–701. |
| [19] | Schansker G, Srivastava A G, Strasser R J. Characterization of the 820nm transmission signal paralleling the chlorophyll a fluorescence rise (OJIP) in pea leaves[J]. Functional Plant Biology, 2003, 30: 785–796. DOI:10.1071/FP03032 |
| [20] | Strasser R J, Srivastava A, Tsimilli-Michael M. The fluorescence transient as a tool to characterize and screen photosynthetic samples [A]. Yunus M, Pathre U, Mohanty P. Probing photosynthesis: mechanism, regulation and adaptation [M]. London: Taylor and Francis Press, 2000, 25: 445—483. |
| [21] | Strasser R J, Tsimill-Michael M, Srivastava A. Analysis of the chlorophyll a fluorescence transient[A]. Govindjee P G. Advances in photosynthesis and respiration [M]. Netherlands: KAP Press, 2004. 1—47. |
| [22] | Strasser R J, Gocindjee S A. Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J]. Photochemistry and Photobiology, 1995, 61: 32–42. DOI:10.1111/php.1995.61.issue-1 |
| [23] |
李耕, 高辉远, 刘鹏, 等. 氮素对玉米灌浆期叶片光合性能的影响[J].
植物营养与肥料学报, 2010, 16(3): 536–542.
Li G, Gao H Y, Liu P, et al. Effects of nitrogen fertilization on photosynthetic performance in maize leaf at grain filling stage[J]. Plant Nutrition and Fertilizer Science, 2010, 16(3): 536–542. |
| [24] | Chen S G, Dai X B, Qiang S, et al. Effect of a nonhost-selective toxin fromAlternaria alternata on chloroplast-electron transfer activity inEupatorium adenophorum[J]. Plant Pathology, 2005, 54: 671–677. DOI:10.1111/ppa.2005.54.issue-5 |
| [25] | Maxwell K, Johnson G N. Chlorophyll fluorescence a practical guide[J]. Journal of Experimental Botany, 2000, 51: 659–668. |
| [26] | Chen H X, Li W J, An S Z, et al. Characterization of PSⅡ photochemistry and thermo stability in salt-treated rumex leaves[J]. Journal of Plant Physiology, 2004, 161: 257–264. DOI:10.1078/0176-1617-01231 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

