2. 西北农林科技大学水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨凌,712100;
3. 中国科学院水利部水土保持研究所,陕西杨凌,712100
2. State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau, Institute of Soil and Water Conservation, Northwest A&F University, Yangling, Shaanxi 712100, China;
3. Institute of Soil and Water Conservation, Chinese Academy of Science and Ministry of Water Resource, Yangling, Shaanxi 712100, China
随着全世界人口的持续增长和经济快速发展,大量消耗化石燃料排放 CO2,大气 CO2 浓度以前所未有的速度增加[1]。已有研究表明,CO2 浓度已经由工业革命时期的 280 μmol/mol 增加到现在的 400 μmol/mol,预计到 21 世纪末会增加到 730~1020 μmol/mol[2–3]。此外,由于 CO2 浓度增加所产生的温室效应导致全球变暖,对全球的生态环境和气候变化产生了深远影响[4]。温度的升高和降雨类型的改变,导致干旱成为世界范围内普遍存在的问题[5]。在全球气候变化的背景下,大气 CO2 浓度升高和干旱胁迫相互伴生、相互耦合,对陆地生态系统产生巨大的影响[6]。CO2 浓度升高及其干旱胁迫协同作用对植物生理生态过程以及生态系统的影响已引起各国政府和科学家的关注。
CO2 是植物光合作用的底物,其浓度的升高通常会显著提高植物的净光合速率,促进光合作用和植物的生长[7–8];而干旱胁迫引起的植物水分亏缺,降低了叶绿体光化学及生物化学活性,使光合作用受到抑制,从而影响植物的生长发育[9]。碳水化合物是植物光合作用的主要产物,按其存在形式可分为结构性碳水化合物 (structural carbohydrates, SC) 和非结构性碳水化合物 (non-structural carbohydrates, NSC)。NSC 主要包括淀粉、可溶性糖等水溶性糖类,是植物生长代谢过程中重要的能量供应物质[10–12]。植物组织中 NSC 的变化在很大程度上决定着植株的代谢过程和生长状况[13]。分析植物体内 NSC 的变化,可以在一定程度上为揭示植物对某一特定生境的适应机理提供重要线索。近年来众多学者对 CO2 浓度升高和干旱胁迫协同作用下植物体光合特性和 NSC 含量变化进行了研究,如董彦红等[3]研究发现 CO2 浓度倍增能够促进黄瓜叶片中 NSC 含量的积累,降低渗透势,缓解干旱胁迫造成的不利影响;刘娟娟等[14]研究表明 CO2 浓度增加与干旱胁迫的交互作用减弱了木本幼苗气孔变化的敏感性,使得气孔变化缓慢,延迟了水分胁迫的发生。然而,这些研究主要集中于农作物[3,15–17]、树木[14,18]方面,而对于牧草的研究报道较少[19–20],尤其是对牧草 NSC 含量变化及其分配特征的研究。
黄土丘陵区由于其特殊的黄土母质、气候和地形特征,加上长期以来不合理的土地利用,水土流失严重,生态环境十分脆弱,对全球气候变化响应剧烈。白羊草 [Bothriochloa ischaemum (L.) Keng.] 是多年生禾本科孔颖草属 C4 植物,是该区自然植被恢复后期草本植被群落的优势物种,具有繁殖能力快、再生能力强和耐践踏等优点,在区域水土保持和生态恢复方面发挥着重要作用。然而,在全球大气 CO2 浓度升高和区域干旱胁迫的共同作用下,白羊草的光合特性和 NSC 含量会发生怎样的变化?CO2 浓度升高能否缓解干旱胁迫造成的负面效应?本研究通过室内模拟试验,对白羊草在 CO2 浓度倍增和干旱胁迫条件下的光合特性及非结构性碳水化合物含量及其分配特征进行了研究,旨在为研究未来大气 CO2 浓度升高以及干旱半干旱地区水分亏缺等逆境胁迫下植物的适应机制提供科学依据。
1 材料与方法 1.1 试验材料与设计本研究采用盆栽控制试验,于 2014 年 6 月在中国科学院水土保持研究所干旱大厅进行。以黄土丘陵区典型草本植物白羊草 [Bothriochloa ischaemum (L.) Keng.] 为试验材料,盆栽器皿为自制的 PVC 圆筒 (内径 × 长为 15 cm × 20 cm),圆筒中央放置 0.025 mm 的尼龙网袋作为根际袋 (直径 × 长为 9 cm × 18 cm),盆栽土壤为陕北安塞县的黄绵土。首先在根际袋内装入风干的黄绵土,然后在根袋外围圆筒底部铺碎石,在碎石上放置一根高出桶面 2 cm,内径为 2 cm 的 PVC 管作为灌水通道,之后在根袋四周加入黄绵土。充分供水使盆中的土壤完全湿润,2014 年 6 月 9 日在根际袋内采用穴播的方法播种白羊草种子。每盆点取 3 个穴,每穴播 3 粒种子,充分供水。
2014 年 8 月 1 日,每盆每穴保留 1 株长势相近的幼苗 (每盆保留 3 株幼苗),然后将盆移入人工气候室 (AGC-D003N 逆境型,浙江求是人工环境有限公司) 中进行 CO2 浓度倍增和干旱胁迫处理。试验采用裂区设计,主因子为 CO2 浓度处理,设 2 个 CO2 水平:正常 CO2 浓度 (400 μmol/mol,A) 和倍增 CO2 浓度 (800 μmol/mol,E),用钢瓶装 CO2 作为外部 CO2 供应源,每天 24 h 不间断供应。裂区因子为水分处理,设对照 (75%~80% 的田间持水量,C)、轻度干旱胁迫 (55%~60% 的田间持水量,M) 和重度干旱胁迫 (35%~40% 的田间持水量,S) 3 个水平。每种处理 5 个重复。CO2 浓度由 2 个人工气候室控制,分别设定为 400 μmol/mol 和 800 μmol/mol,其他条件相同 [湿度 55%,光照 500 μmol/(m2·s),温度 28℃/22℃ (昼/夜)]。于 2014 年 9 月 17 日开始进行盆栽控水处理,盆栽土壤含水量采用称重法进行测定与控制,即每天下午进行称重,补充消耗的水分,使其维持在设定的水平。
1.2 光合–光响应曲线测定及模型选择于 2014 年 10 月 11 日和 10 月 12 日 (白羊草开花前期) 对两个人工气候室中的白羊草叶片光合–光响应曲线进行测定。用 Li-6400 自带红蓝光源 (Li-6400-02B-LED) 模拟光强梯度 2000、1600、1200、1000、800、600、400、300、200、160、120、80、40 和 0 μmol/(m2·s) 共 14 个,设定改变光照强度后,最小稳定时间 60 s,重复 3 次。
研究表明白羊草光合–光响应曲线的最佳模型为非直角双曲线模型[21],其表达式为:
| $\begin{aligned}\!{P_n}\! =\! & \frac{{aPAR \!\!+\!\! {P_{\max }} - \sqrt {{{(aPAR\!\! +\!\! {P_{\max }})}^2} \!\!-\!\! 4\theta aPAR{P_{\max }}} }}{{2\theta }}\\ & - {R_d}\end{aligned}$ |
式中,Pn 为净光合速率 [μmol/(m2·s)];θ 为光合曲线弯曲程度的凸度;a (AQY) 为表观量子效率 (mol/mol);Pmax 为最大光合速率 [μmol/(m2·s)];PAR 为光合有效辐射 [μmol/(m2·s)];Rd 为暗呼吸速率 [μmol/(m2·s)]。
1.3 植物样品的采集2014 年 11 月 15 日 (干旱胁迫处理第 58 d) 盆栽试验结束后,将每盆中的 3 株白羊草齐地剪去作为植株的地上部分。然后将根际袋从 PVC 管中取出,将根际袋中的土壤倒出,取出地下根系部分,用自来水冲洗干净。将每盆植株的地上部分和根系分别装入牛皮纸袋中,于鼓风干燥箱中 105℃ 杀青 5 min,然后 80℃ 烘干至恒重,分别称取地上和地下部分的干重后,粉碎,过 0.38 mm 筛,装袋用于非结构性碳水化合物 (NSC) 含量的测定。
1.4 NSC 含量的测定NSC 含量为可溶性糖和淀粉含量之和。可溶性糖和淀粉含量的测定采用蒽酮比色法[22],具体操作方法参照高俊凤[23]。
1.5 数据处理采用 Photosynthesis Work Bench 软件对光合–光响应曲线的参数进行计算。采用 SPSS16.0 单因素方差分析 (ANOVA) 对不同处理间光合–光响应曲线参数、可溶性糖、淀粉和非结构性碳水化合物的含量进行差异显著性水平的检验 (P = 0.05),双因素方差分析 (two-way ANOVA) 用于检验 CO2 浓度和水分条件以及它们之间可能存在的交互作用。采用 Origin 9.0 软件绘图。
2 结果与分析 2.1 CO2 浓度升高和干旱胁迫对白羊草叶片光合–光响应曲线的影响从图 1可看出,在光照强度为 0~400 μmol/(m2·s) 时,叶片的净光合速率迅速上升,当光强达到 400 μmol/(m2·s) 后,净光合速率上升幅度减弱,之后逐渐稳定。CO2 浓度倍增显著提高了白羊草叶片最大净光合速率 (Pmax )、表观量子效率 (AQY)、光饱和点 (LSP) 和光补偿点 (LCP)(P < 0.01),而干旱胁迫则显著降低了Pmax 、AQY 和LSP (P < 0.01)(表 1)。CO2 浓度和土壤水分对白羊草叶片光合–光响应曲线参数无显著的交互作用。
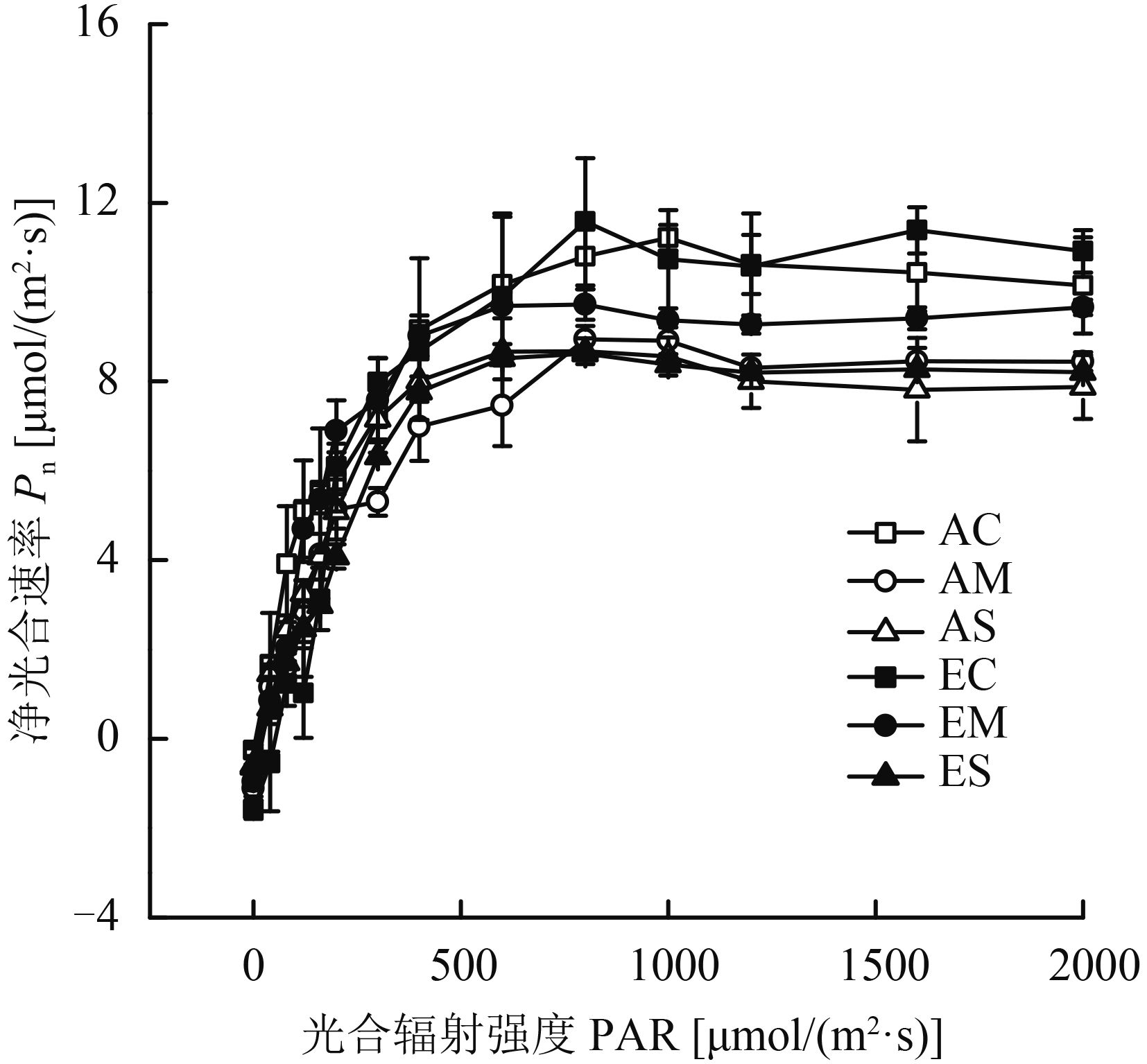 |
| 图1 不同 CO2 浓度和水分条件下白羊草叶片光合–光响应曲线 Fig. 1 Photosynthesis-light response curves ofBothriochloa ischaemum under different CO2 concentrations and water regimes [注(Note):AC—CO2 400 μmol/mol + 75%~80% FC; AM—CO2 400 μmol/mol + 55%~60% FC; AS—CO2 400 μmol/mol + 35%~40% FC; EC—CO2 800 μmol/mol + 75%~80% FC; EM—CO2 800 μmol/mol + 55%~60% FC; ES—CO2 800 μmol/mol + 35%~40% FC.] |
| 表1 不同 CO2 浓度和水分条件下白羊草叶片光合–光响应曲线参数及其方差分析 Table 1 Variance analysis of parameters of photosynthesis-light response curves inBothriochloa ischaemum under different CO2 concentrations and water regimes |
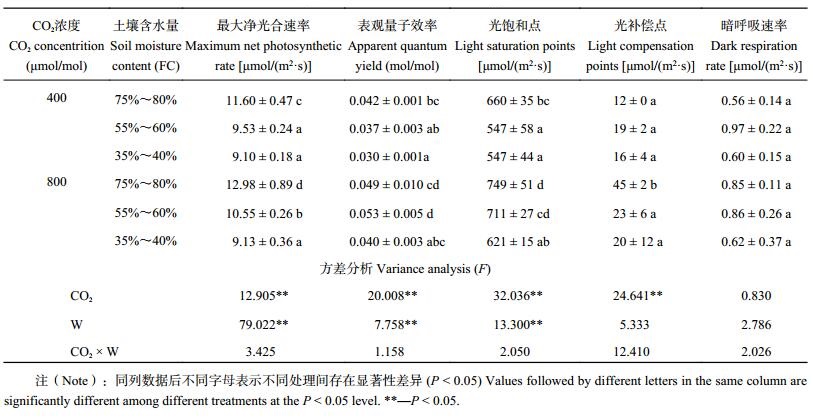 |
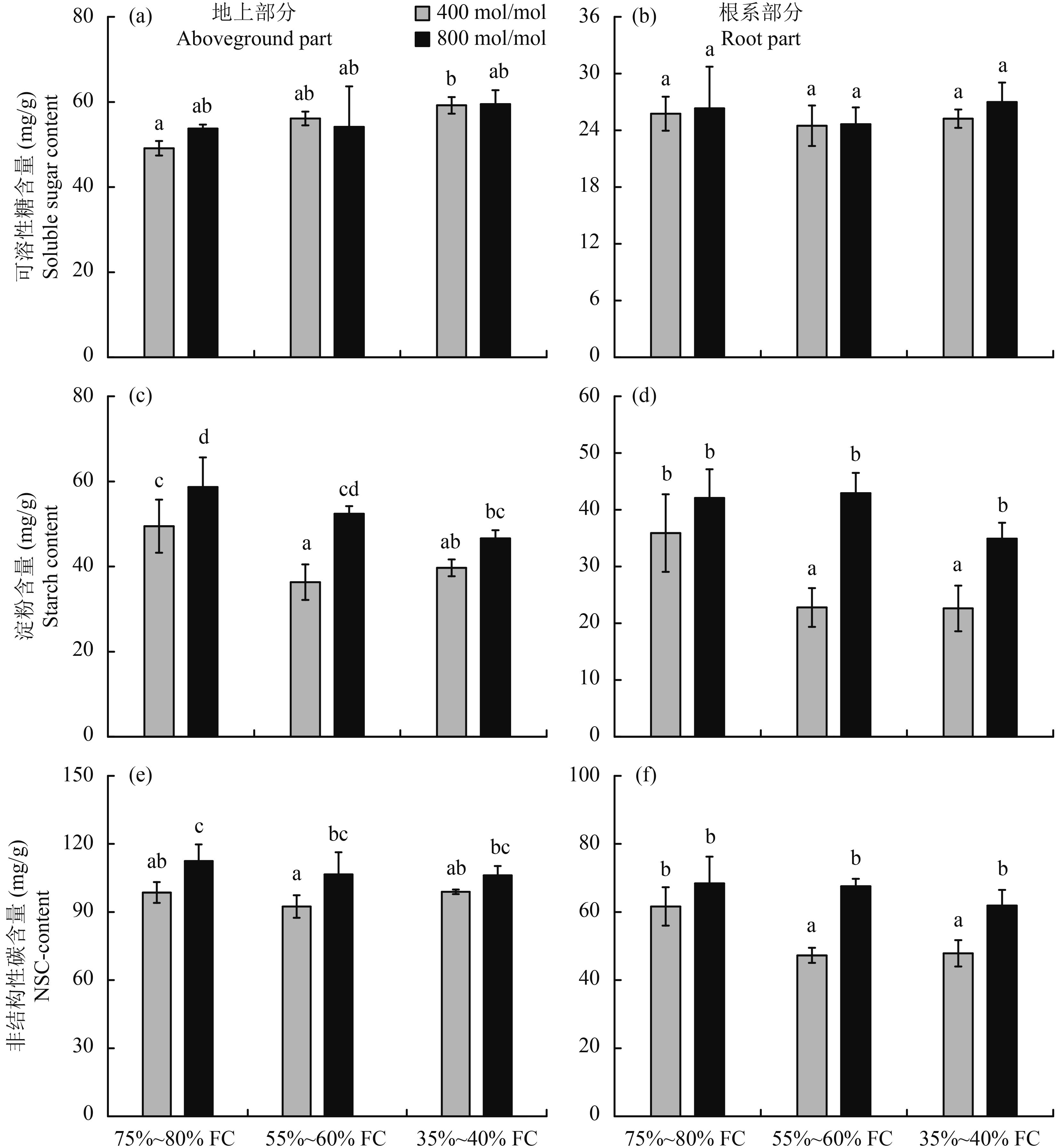
CO2 浓度倍增和干旱胁迫均提高了白羊草地上部分可溶性糖的含量,但这种提高作用只有在正常 CO2 浓度下,对照处理和重度干旱胁迫处理间达到显著性差异 (P < 0.05)(图 2a)。CO2 浓度和干旱胁迫对白羊草根系部分可溶性糖含量无显著影响 (P > 0.05)(表 2、图 2b)。CO2 浓度和干旱胁迫对白羊草地上部分和根系部分淀粉含量有极显著影响 (P < 0.01)(表 2)。在正常 CO2 浓度条件下,与对照相比,轻度干旱胁迫和重度干旱胁迫均显著降低了白羊草地上部分和根系部分淀粉含量,但轻度干旱胁迫和重度干旱胁迫处理间无显著性差异 (图 2c、d)。CO2 浓度倍增使对照、轻度干旱胁迫和重度干旱胁迫处理下白羊草地上部分淀粉含量分别提高了 17.4%、44.2% 和 18.7%, 根系部分淀粉含量分别提高了 17.3%、88.4% 和 54.4%。CO2 浓度倍增条件下,与对照相比,轻度干旱胁迫并未显著降低白羊草地上部分淀粉含量,而白羊草根系部分淀粉含量在干旱胁迫下并未显著降低 (图 2c、d)。干旱胁迫对白羊草地上部分非结构性碳水化合物含量无显著影响,对根系部分非结构性碳水化合物含量有显著影响 (表 2)。轻度和重度干旱胁迫均显著降低了正常 CO2 浓度条件下白羊草根系部分非结构性碳水化合物含量 (图 2f)。CO2 浓度倍增对白羊草地上部分和根系部分非结构性碳水化合物含量有极显著影响 (表 2)。CO2 浓度倍增显著提高了对照处理和轻度干旱胁迫处理下白羊草地上部分以及轻度干旱胁迫处理和重度干旱胁迫处理下白羊草根系部分非结构性碳水化合物含量 (图 2e、f)。
| 表2 CO2 浓度和水分处理对白羊草非结构性碳水化合物组分的双因素方差分析结果 Table 2 Results of multi-factor variance analysis of non-structural carbohydrate components ofBothriochloa ischaemum under different CO2 concentrations and water regimes |
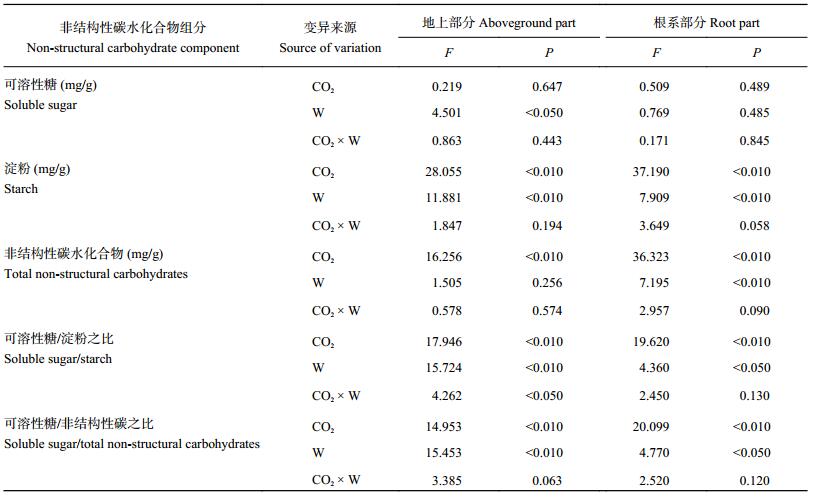 |
 |
|
图2
不同 CO2 浓度和水分条件下白羊草非结构性碳水化合物及其组分浓度
Fig. 2
Concentrations of non-structural carbohydrates (NSC) and components inBothriochloa ischaemun under different CO2 concentrations and water treatments
[注(Note):方柱上不同字母表示不同处理间存在显著性差异 (P < 0.05) Different letters abovethe bars are significantly different among different treatments at theP < 0.05 level.] |
CO2 浓度和干旱胁迫对白羊草地上部分和根系部分可溶性糖与淀粉之比有显著影响 (图 3)。在正常 CO2 浓度条件下,轻度干旱胁迫和重度干旱胁迫均显著提高了白羊草地上部分和根系部分可溶性糖与淀粉之比 (图 3a、b)。CO2 浓度倍增则导致白羊草地上部分和根系部分可溶性糖/淀粉之比的降低,并且在轻度干旱胁迫处理下白羊草地上部分,轻度干旱胁迫和重度干旱胁迫处理下白羊草根系部分可溶性糖/淀粉之比显著降低 (图 3a、b)。
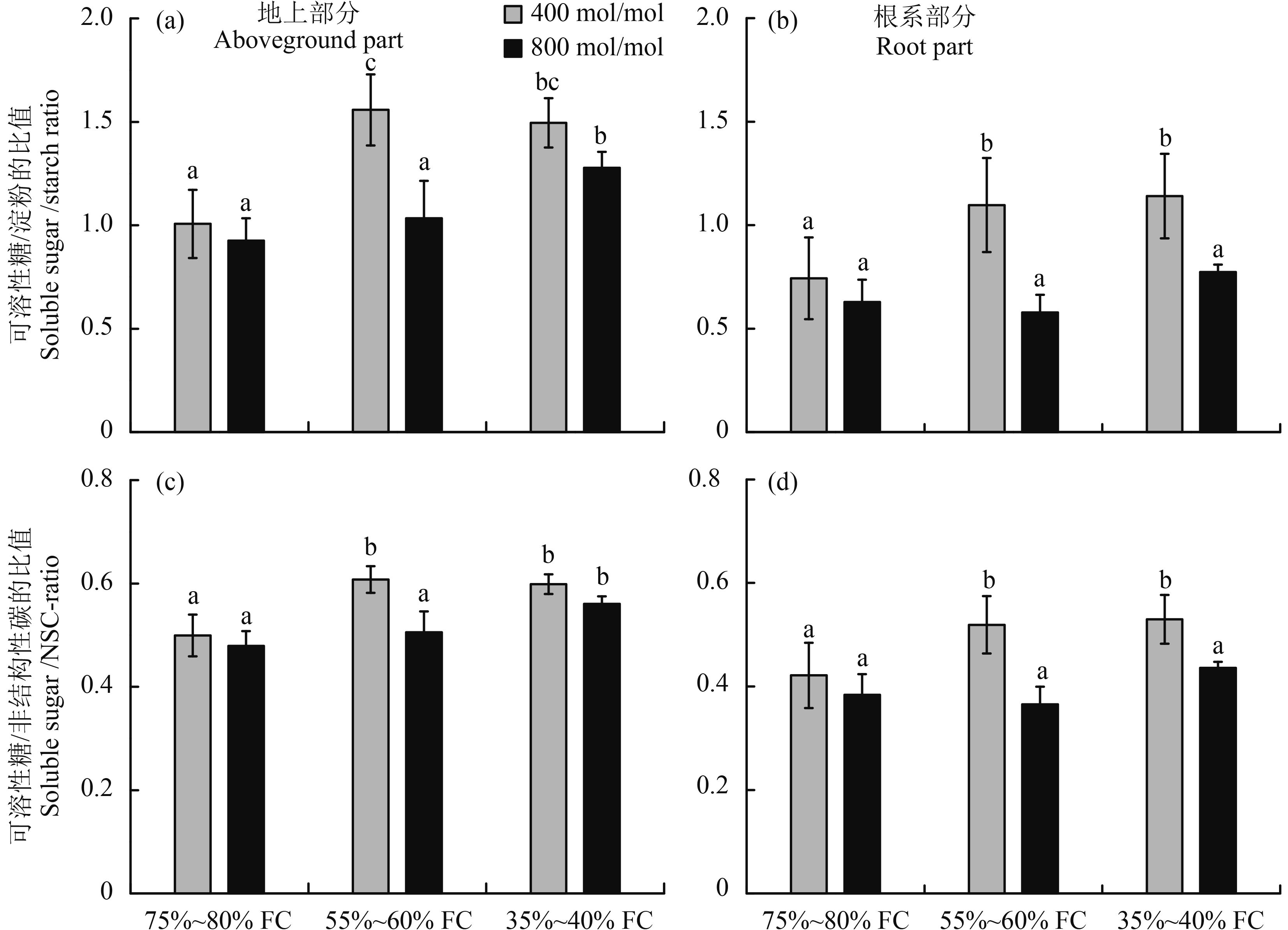 |
|
图3
不同 CO2 浓度和水分条件下白羊草可溶性糖与淀粉含量之比和可溶性糖与非结构性碳含量之比
Fig. 3
Ratio of soluble sugar content to starch content and soluble sugar content to non-structural carbohydrates inBothriochloa ischaemun under different CO2 concentrations and water treatments
[注(Note):方柱上不同字母表示不同处理间存在显著性差异 (P < 0.05) Different letters above the bars are significantly different among different treatments at theP < 0.05 level.] |
CO2 浓度和干旱胁迫对白羊草地上部分和根系部分可溶性糖含量与总 NSC 含量之比有显著影响 (表 3)。干旱胁迫提高了白羊草地上部分和根系部分可溶性糖含量与总 NSC 含量之比 (图 3c、d)。在正常 CO2 浓度下,轻度和重度干旱胁迫导致白羊草地上部分和根系部分可溶性糖含量与总 NSC 含量之比的显著提高,但二者之间无显著差异。在倍增 CO2 浓度下,重度干旱胁迫显著提高了白羊草地上部分可溶性糖含量与总 NSC 含量之比,而对照处理和轻度干旱胁迫处理无显著差异。同时,CO2 浓度倍增条件下,不同水分处理并未显著改变 NSC 含量的分配比例。
3 讨论CO2 和水是植物进行光合作用的底物,大量研究表明,CO2 浓度的升高能显著促进植物生长,提高植物的光合速率[24–25],干旱胁迫则显著降低植物的光合速率[25–26]。本研究中,CO2 浓度升高显著提高了植物的最大净光合速率、表观量子效率和光饱和点,而随着干旱胁迫的加剧,白羊草叶片的最大净光合速率、表观量子效率和光饱和点呈逐渐下降的趋势。在未来气候变化的背景下,CO2 浓度倍增能够在一定程度上减轻干旱胁迫造成的光合能力下降,维持植被正常的光合作用[15,17,19]。
非结构性碳水化合物是植物生长、代谢等一系列生理活动的能源物质,对于维持植物体正常的生理活动具有极其重要的作用[10],其在植物体内含量的变化不仅能反映植物的生理活动状况,而且还反映了植物对环境变化的响应[27]。非结构性碳水化合物参与了逆境条件下植物细胞的渗透调节过程[28]。可溶性糖是植物忍受干旱环境的重要渗透调节物质,是细胞渗透调节中的主要贡献者[29]。淀粉作为 NSC 的储存体[30],干旱胁迫加剧时可促进植物体内淀粉向可溶性糖转化,调节植物体内细胞的渗透势,使植物保持一定的含水量,维持一定的膨压,从而使植物在干旱胁迫下进行正常的生理活动来抵御并适应干旱胁迫[31–32]。Adams 等[33]对树木的研究发现从干旱开始至树木死亡的中期可溶性糖浓度上升淀粉浓度下降的现象。杜尧等[34]研究表明,兴安落叶松在干旱胁迫下叶片内可溶性糖浓度增加的同时淀粉浓度降低,通过淀粉水解成可溶性糖,从而维持正常的生理活动。在本研究中,随着干旱胁迫的加剧,白羊草地上部分可溶性糖含量显著增加,而地上部分和根系部分淀粉含量均显著下降,可溶性糖和淀粉含量的比值呈增大的趋势。这说明在干旱胁迫条件下,白羊草通过分解淀粉增加可溶性糖的方式,来维持细胞的水势和水分平衡,调节渗透势维持细胞活力,保障呼吸作用。因为在干旱胁迫下,生存比生长更重要,通过可溶性糖浓度的增加,可以增加渗透调节物质的浓度,使水分保持在细胞中,对干旱胁迫下的白羊草来说这是一种节省能量维持正常生理代谢的适应策略。
大气 CO2 浓度倍增提高了植物叶片光合速率和水分利用效率,削弱了水分胁迫对植物光合和生长产生的不利影响[15,17,19–20],从而促进了植物合成碳水化合物的速率,使其在液泡中浓度增大,导致细胞渗透势降低,提高了植物的抗逆性[3]。李青超等[35]研究发现,CO2 浓度升高显著增加了红桦幼苗根、茎、叶中总可溶性糖及淀粉的含量。董彦红等[3]研究发现,CO2 浓度倍增促进了黄瓜叶片中非结构性碳水化合物的积累。在本研究中,CO2 浓度升高显著提高了干旱胁迫条件下白羊草地上部分和根系部分的淀粉含量和非结构性碳的含量。CO2 浓度升高对干旱胁迫引起的白羊草光合能力下降有显著的补偿作用[19],促进白羊草光合作用合成非结构性碳水化合物。白羊草体内淀粉含量的积累,为持续干旱条件下白羊草体内可溶性糖的维持提供了来源,有利于维持植物体细胞正常的膨压,为白羊草叶片光合作用的正常进行以及根系从土壤中吸收水分提供了能量的来源,有利于维持干旱胁迫条件下白羊草正常的生理活动。
4 结论CO2 浓度倍增和干旱胁迫对白羊草光合特性及非结构性碳水化合物含量有显著影响。CO2 浓度倍增显著提高了白羊草叶片最大净光合速率,表观量子效率和光饱和点;而干旱胁迫则导致这些参数的显著降低。干旱胁迫降低了白羊草体内淀粉和非结构性碳水化合物含量,CO2 浓度倍增提高了白羊草地上部分和根系部分淀粉和非结构性碳水化合物含量。CO2 浓度倍增显著提高了干旱胁迫下白羊草体内可溶性糖的比例,为干旱胁迫下白羊草维持正常生理代谢活动提供了保障。总之,CO2 浓度倍增能缓解干旱胁迫造成的不利影响,提高白羊草叶片光合速率,促进白羊草体内非结构性碳水化合物的积累,维持正常的生理代谢活动,提高白羊草的耐旱性。这可为未来大气 CO2 浓度升高以及水分亏缺等逆境条件下植物适应机理提供科学依据。
| [1] | Smith T M, Karl T R, Reynolds R W. How accurate are climate simulations?[J]. Science, 2002, 296(5567): 483–484. DOI:10.1126/science.1070365 |
| [2] | IPCC, 2007. Summary for policymakers[A]. Solomon S, Qin D, Manning M,et al. Climate change 2007: The physical science basis. Contribution of working Group I to the fourth assessment report of the intergovernmental Panel on Climate Change[R]. Cambridge, UK and New York, NY: Cambridge University Press, 216—220. |
| [3] |
董彦红, 刘彬彬, 张旭, 等. 黄瓜幼苗非结构性碳水化合物代谢对干旱胁迫与CO2倍增的响应[J].
应用生态学报, 2015, 26(1): 53–60.
Dong Y H, Zhang B B, Zhang X, et al. Responses of non-structural carbohydrates metabolism of cucumber seedlings to drought stress and doubled CO2 concentration[J]. Chinese Journal of Applied Ecology, 2015, 26(1): 53–60. |
| [4] | Genthon Q, Jouzel J, Barnola J M, et al. Vostok ice core: climatic response to CO2 and orbital forcing changes over the last climatic cycle[J]. Nature, 1987, 329(6138): 414–418. DOI:10.1038/329414a0 |
| [5] | Dai A G. Drought under global warming: a review[J]. Wiley Interdisciplinary Reviews-Climate Change, 2011, 2(1): 45–65. DOI:10.1002/wcc.81 |
| [6] |
孙良杰, 齐玉春, 董云社, 等. 全球变化对草地土壤微生物群落多样性的影响研究进展[J].
地理科学进展, 2012, 31(12): 1715–1723.
Sun L J, Qi Y C, Dong Y S, et al. Research progresses on the effects of global change on microbial community diversity of grassland soils[J]. Progress in Geography, 2012, 31(12): 1715–1723. |
| [7] |
林碧英, 张瑜, 林一章, 等. 不同CO2浓度对豇豆光合特性和若干生理生化指标的影响[J].
植物营养与肥料学报, 2011, 17(4): 964–969.
Lin B Y, Zhang Y, Lin Y Z, et al. Effects of CO2 concentration on photosynthetic characteristics and physiological and biochemical indices of cowpea[J]. Journal of Plant Nutrition and Fertilizer, 2011, 17(4): 964–969. |
| [8] |
王建林, 温学发, 赵风华, 等. CO2浓度倍增对8种作物叶片光合作用、蒸腾作用和水分利用效率的影响[J].
植物生态学报, 2012, 36(5): 438–446.
Wang J L, Wen X F, Zhao F H, et al. Effects of doubled CO2 concentration on leaf photosynthesis, transpiration and water use efficiency of eight crop species[J]. Chinese Journal of Plant Ecology, 2012, 36(5): 438–446. |
| [9] |
曹逼力, 李炜蔷, 徐坤. 干旱胁迫下硅对番茄叶片光合荧光特性的影响[J].
植物营养与肥料学报, 2016, 22(2): 495–501.
Cao B L, Li W Q, Xu K. Effects of silicon on photosynthetic and fluorescence characteristics of tomato leaves under drought stress[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(2): 495–501. |
| [10] | Körner C. Carbon limitation in trees[J]. Journal of Ecology, 2003, 91(1): 4–17. |
| [11] | Li M H, Xiao W F, Wang S G, et al. Mobile carbohydrates in Himalayan treeline trees I. Evidence for carbon gain limitation but not for growth limitation[J]. Tree Physiology, 2008, 28(8): 1287–1296. DOI:10.1093/treephys/28.8.1287 |
| [12] |
印婧婧, 郭大立, 何思源, 等. 内蒙古半干旱区树木非结构性碳、氮、磷的分配格局[J].
北京大学学报: 自然科学版, 2009, 45(3): 519–527.
Yin J J, Guo D L, He S Y, et al. Non-structural carbohydrates, N, and P allocation patterns of two temperate tree species in a semi-arid region of Inner Mongolia[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2009, 45(3): 519–527. |
| [13] | Shi P L, Körner C, Hoch G. A test of the growth-limitation theory for alpine tree line formation in evergreen and deciduous taxa of the eastern Himalayas[J]. Functional Ecology, 2008, 22(2): 213–220. DOI:10.1111/j.1365-2435.2007.01370.x |
| [14] |
刘娟娟, 李吉跃, 张建国. 高CO2浓度和干旱胁迫对4种树苗光合特性的影响[J].
林业科学研究, 2015, 28(3): 339–345.
Liu J J, Li J Y, Zhang J G. Influences of drought stress on photosynthetic characteristics and water use efficiency of 4 tree species under elevated CO2 concentration[J]. Forest Research, 2015, 28(3): 339–345. |
| [15] | Vu J C V, Allen L H. Growth at elevated CO2 delays the adverse effects of drought stress on leaf photosynthesis of the C4 sugarcane[J]. Journal of Plant Physiology, 2009, 166(2): 107–116. DOI:10.1016/j.jplph.2008.02.009 |
| [16] | Kakani V G, Vu J C V, Allen L H, et al. Leaf photosynthesis and carbohydrates of CO2-enriched maize and grain sorghum exposed to a short period of sol water deficit during vegetative development[J]. Journal of Plant Physiology, 2011, 168(18): 2169–2176. |
| [17] |
李清明, 刘彬彬, 邹志荣. CO2浓度倍增对干旱胁迫下黄瓜幼苗光合特性的影响[J].
中国农业科学, 2011, 44(5): 963–971.
Li Q M, Liu B B, Zou Z R. Effects of doubled CO2 concentration on photosynthetic characteristics of cucumber seedlings under drought stresses[J]. Scientia Agricultura Sinica, 2011, 44(5): 963–971. |
| [18] | Vaz M, Cochard H, Gazarini L, et al. Cork oak (Quercus suber L.) seedlings acclimate to elevated CO2 and water stress: photosynthesis, growth, wood anatomy and hydraulic conductivity[J]. Trees, 2012, 26(4): 1145–1157. DOI:10.1007/s00468-012-0691-x |
| [19] |
张昌胜, 刘国彬, 薛萐, 等. 干旱胁迫和CO2浓度升高条件下白羊草的光合特征[J].
应用生态学报, 2012, 23(11): 3009–3015.
Zhang C S, Liu G B, Xue S, et al. Photosynthetic characteristics ofBothriochloa ischaemum under drought stress and elevated CO2 concentration[J]. Chinese Journal of Applied Ecology, 2012, 23(11): 3009–3015. |
| [20] |
樊良新, 刘国彬, 薛萐, 等. CO2浓度倍增及干旱胁迫对紫花苜蓿光合生理特性的协同影响[J].
草地学报, 2014, 22(1): 85–93.
Fan L X, Liu G B, Xue S, et al. Synergistic effects of doubled CO2 concentration and drought stress on the photosynthetic characteristics ofMedicago sativa[J]. Acta Agrestia Sinica, 2014, 22(1): 85–93. |
| [21] |
徐伟洲, 徐炳成, 段东平, 等. 不同水肥条件下白羊草光合生理生态特征研究II. 光响应曲线[J].
草地学报, 2010, 18(6): 773–779.
Xu W Z, Xu B C, Duan D P, et al. Study on the photosynthetic characteristics ofBothriochloa ischaemum under different water and nutrient conditions II. light-response curve[J]. Acta Agrestia Sinica, 2010, 18(6): 773–779. |
| [22] | Yemm E, Willis A. The estimation of carbohydrates in plant extracts by anthrone[J]. Biochemical Journal, 1954, 57(3): 508–514. |
| [23] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006.
Gao J F. Experimental guidance for plant physiology[M]. Beijing: Higher Education Press, 2006. |
| [24] |
施建敏, 郭起荣, 杨光耀. CO2浓度倍增下毛竹光合作用对光照强度的季节响应[J].
江西农业大学学报, 2007, 29(2): 215–219.
Shi J M, Guo Q R, Yang G Y. Seasonal photosynthetic responses ofPhyllostachys edulis to light under doubled CO2 concentration[J]. Acta Agriculturae Universitatis Jiangxiensis, 2007, 29(2): 215–219. |
| [25] |
孟凡超, 张佳华, 郝翠, 等. CO2浓度升高和不同灌溉量对东北玉米光合特性和产量的影响[J].
生态学报, 2015, 35(7): 2126–2135.
Meng F C, Zhang J H, Hao C, et al. Effects of elevated CO2 and different irrigation on photosynthetic parameters and yield of maize in Northeast China[J]. Acta Ecologica Sinica, 2015, 35(7): 2126–2135. |
| [26] |
徐俊增, 彭世彰, 魏征, 等. 不同供氮水平及水分调控条件下水稻光合作用光响应特征[J].
农业工程学报, 2012, 28(2): 72–76.
Xu J Z, Peng S Z, Wei Z, et al. Characteristics of rice leaf photosynthetic light response curve with different water and nitrogen regulation[J]. Transactions of the CASE, 2012, 28(2): 72–76. |
| [27] |
郑云普, 王贺新, 娄鑫, 等. 木本植物非结构性碳水化合物变化及其影响因子研究进展[J].
应用生态学报, 2014, 25(4): 1188–1196.
Zheng Y P, Wang H X, Lou X, et al. Changes of non-structural carbohydrates and its impact factors in trees: A review[J]. Chinese Journal of Applied Ecology, 2014, 25(4): 1188–1196. |
| [28] |
高英志, 王艳华, 王静婷, 等. 草原植物碳水化合物对环境胁迫的响应研究进展[J].
应用生态学报, 2009, 20(11): 2827–2831.
Gao Y Z, Wang Y H, Wang J T, et al. Research advances in the responses of carbohydrates in grassland plants to environmental stress[J]. Chinese Journal of Applied Ecology, 2009, 20(11): 2827–2831. |
| [29] | Iannucci A, Russo M, Arena L, et al. Water deficit effects on osmotic adjustment and solute accumulation in leaves of annual clovers[J]. European Journal of Agronomy, 2002, 16(2): 111–122. |
| [30] |
郭子武, 胡俊靖, 杨清平, 等. 林地覆盖经营对雷竹叶片非结构性碳水化合物与氮磷关系的影响[J].
应用生态学报, 2015, 26(4): 1064–1070.
Guo Z W, Hu J J, Yang Q P, et al. Influence of mulching management on the relationships between foliar non-structural carbohydrates and N, P concentrations inPhyllostachys violascens stand[J]. Chinese Journal of Applied Ecology, 2015, 26(4): 1064–1070. |
| [31] | Klein T, Hoch G, Yakir D, et al. Drought stress, growth and nonstructural carbohydrate dynamics of pine trees in a semi-arid forest[J]. Tree Physiology, 2014, 34(9): 981–992. DOI:10.1093/treephys/tpu071 |
| [32] | O'Brein M J, Leuzinger S, Philipson C D, et al. Drought survival of tropical tree seedlings enhanced by non-structural carbohydrate levels[J]. Nature Climate Change, 2014, 4(8): 710–714. |
| [33] | Adams H D, Germino M J, Breshears D D, et al. Nonstructural leaf carbohydrate dynamics ofPinus edulis during drought-induced tree mortality reveal role for carbon metabolism in mortality mechanism[J]. New Phytologist, 2013, 197(4): 1142–1151. DOI:10.1111/nph.12102 |
| [34] |
杜尧, 韩轶, 王传宽. 干旱对兴安落叶松枝叶非结构性碳水化合物的影响[J].
生态学报, 2014, 34(21): 6090–6100.
Du Y, Han Y, Wang C K. The influence of drought on non-structural carbohydrates in the needles and twigs ofLarix gmelinii[J]. Acta Ecologica Sinica, 2014, 34(21): 6090–6100. |
| [35] |
李青超, 张远彬, 王开运, 等. 大气CO2浓度升高对亚高山红桦碳水化合物含量及分配的影响[J].
西北林学院学报, 2008, 23(1): 1–5.
Li Q C, Zhang Y B, Wang K Y, et al. Effects of elevated CO2 concentration on carbohydrate contents and allocation inBetula albo-sinensis seedlings in sub-alpine forest area[J]. Journal of Northwest Forestry University, 2008, 23(1): 1–5. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

