氮是植物体内许多重要化合物的组成成分,包括氨基酸、蛋白质、核酸、叶绿素和一些植物激素,是作物生长发育需求量最大的营养元素[1]。为了提高产量,在过去 60 年里全世界用于农业生产的氮肥用量提高了几倍,而我国更是氮肥生产量和使用量最高的国家。然而,据统计超过一半的氮素通过农田生态系统流失,严重污染环境[2]。因此急需提高作物的氮素吸收、利用效率以提高产量和减少环境污染。玉米是世界上种植最为广泛的谷类作物,也是需求量最大的粮食作物[3]。前人研究表明[4–5],不同玉米品种氮素吸收效率不同,耐低氮胁迫的能力差异显著,推广种植耐低氮能力强的品种是提高玉米产量、减少环境污染和提高氮素吸收效率的重要途径。
植物根系不仅是水分和养分吸收的主要器官,而且可以通过调节根系构型、合成或分泌激素、有机酸和酶等物质来适应多变的土壤环境,调节根系对水分和养分的吸收、根系和地上植株的生长[6]。根系伤流是研究根系物质合成和运输形式等生理指标的重要材料,能准确地反映根系的生理活性和地上部生长的盛衰[7–8]。将根系伤流与养分供应联系起来,通过分析伤流液的强度和成分,可以判断植物根系活性的强弱,研究元素在植物体内的转运积累以及与植株其他部位的关系,对于揭示植物营养特性具有重要的理论意义[9–10]。殷春渊等[8]研究表明,水稻伤流液中物质含量的增加能够提高籽粒的充实度。氮素形态影响植株的伤流强度,且供氮水平还会影响伤流液中氨基酸的种类和浓度[11]。陈范骏等[12]指出不同玉米品种伤流液中氨基酸和 NH4+-N/NO3–-N 比值差异明显。周秀杰等[13]研究表明,混合氮处理下的玉米植株伤流强度较单一硝态氮和单一铵态氮形态处理的高,混合氮提高了玉米地上部分的水分运输能力。可见前人关于氮肥水平对玉米伤流强度及其成分的影响已有研究报道,但主要集中在北方地区,在西南丘陵区还十分鲜见,而关于低氮胁迫下不同耐低氮性玉米品种苗期伤流性状的研究更是未见报道。本研究以前期筛选出的耐低氮和低氮敏感品种为材料,研究了低氮胁迫对不同耐低氮性玉米品种苗期生长、伤流性状及根系活力的影响,以期为西南丘陵地区耐低氮玉米品种的选育提供理论依据。
1 材料与方法 1.1 供试材料试验材料为前期筛选的耐低氮玉米杂交种‘正红 311’、‘成单 30’和低氮敏感品种‘先玉 508’、‘三北 2 号’[14]。
1.2 试验设计水培试验于 2013 年在四川农业大学成都校区塑料大棚内进行。培养液氮素水平设为 5、0.5、0.05 和 0 mmol/L,依次记为 CK、N1、N2 和 N3。选取大小均匀、籽粒饱满的玉米种子用体积比为 10% 的 H2O2 溶液消毒 40 min,用蒸馏水清洗 3 遍后浸泡在蒸馏水中 12 h。然后将种子放在垫有湿润滤纸的培养皿中在室温黑暗条件下催芽,待种子根长到大约 1 cm 时,将幼苗移到装有珍珠岩的育苗盘中继续培养。当玉米幼苗长到两片展开叶时,去除胚乳在蒸馏水中培养 1 d,再移入装有 10 L 上述不同氮浓度的培养液的塑料盆中培养 (每盆 20 株),每处理 8 盆,共 128 盆。人工气候室昼夜时长为 14/10 h,温度为 28/22℃。光照时玉米冠层高度的光量子通量密度为 250~300 mmol/(m2·s)。营养液每 3 天换一次,每次营养液用 KOH 调节 pH 为 6.0 ± 0.1,用充气泵每天通气 6 h。样品随机摆放,每次更换营养液相互交换位置。
1.3 测定指标1.3.1 植株形态指标及干物质积累量的测定 分别于处理后 7 d 和 14 d,每次取 3 盆混匀后分 3 个重复,每重复 20 株,10 株用于形态指标测定,10 株用于根系活力测定。苗高为茎基部到叶片最高点的高度;叶面积采用长宽系数法测定,叶面积 = 长 × 宽 × 0.75;茎粗用游标卡尺测定,统一测定距茎基部 2 cm 处;叶绿素含量采用 SPAD-502 型便携式叶绿素仪于取样前测定,每处理测定 15 株。形态指标测定完后将样品分为地上部和地下部装入牛皮纸袋中,于 105℃ 下杀青 30 min,80℃ 烘干至恒重后称量,并计算根冠比。
1.3.2 根系活力的测定 取样方法同 1.3.1,采用 TTC 法[15]测定根系活力,根系吸收总面积和活跃吸收面积用亚甲基蓝吸附法[16]。
1.3.3 伤流液的收集及组分的测定 伤流强度采用称重法[15]测定,每处理测定 15 株。将脱脂棉塞入去盖离心管并称重 (m1),在处理后 7 d 和 14 d 玉米苗茎基部离地面约 2 cm 处用刀片切去地上部分,用离心管收集伤流并用封口膜封口,24 h 后取下并称重 (m2),采用差减法计算伤流液流量。
可溶性蛋白含量采用考马斯亮蓝法[15]测定;可溶性糖含量采用蒽酮比色法[15]测定;游离氨基酸含量采用茚三酮比色法[15]测定;硝态氮含量采用紫外分光光度法[15]测定。
1.4 数据处理与分析伤流强度 (g/d) = (m2 – m1)/t,t 为伤流液收集的时间。
伤流成分转运速度 (μg/d) = 伤流强度 × 成分浓度
采用 Excel 2007 和 DPS 7.05 分析软件进行统计分析。
2 结果与分析 2.1 低氮胁迫对不同耐低氮性玉米品种苗期生长的影响2.1.1 对玉米植株形态和叶绿素含量的影响 低氮胁迫下,玉米苗期茎粗、苗高、叶面积和相对叶绿素含量均显著降低 (表 1)。且随着氮浓度的降低和胁迫时间的延长,各指标的降幅加大。
| 表1 低氮胁迫对不同耐低氮性玉米品种苗期生长的影响 Table 1 Effects of the low nitrogen stress on growth of different maize cultivars at the seedling stage |
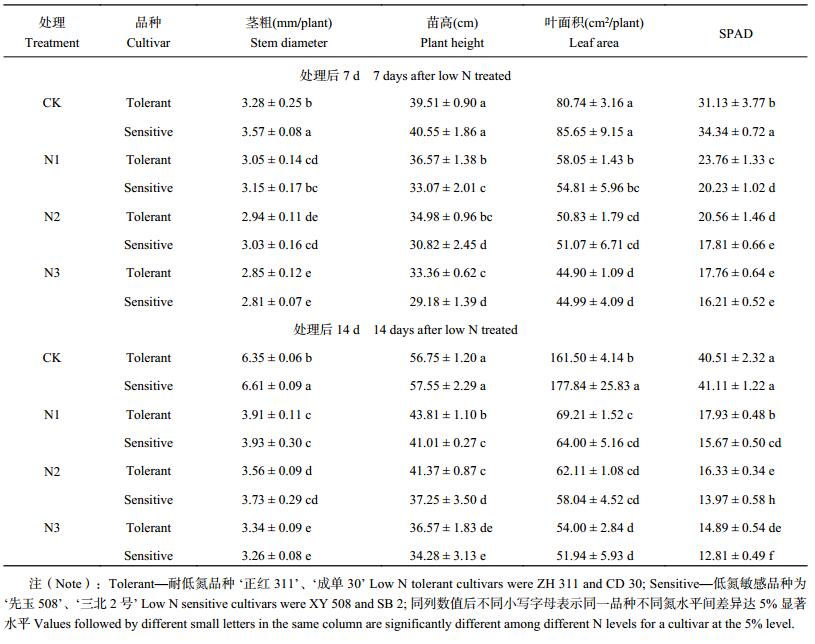 |
低氮胁迫下不同耐低氮性玉米品种茎粗、苗高、叶面积和 SPAD 降幅差异明显 (表 1)。处理后 7 d,N1 处理与 CK 相比,两个耐低氮品种的平均茎粗、苗高、叶面积和 SPAD 分别下降了 7.1%、7.5%、28.1% 和 23.7%,而低氮敏感品种分别下降了 11.9%、18.4%、36.0% 和 41.1%;N2 处理,耐低氮品种分别下降了 10.4%、11.5%、37.1% 和 34.0%,低氮敏感品种分别下降了 15.1%、24.0%、40.4% 和 48.1%;N3 处理下耐低氮品种下降了 13.3%、15.6%、44.4% 和 43.0%,低氮敏感品种下降了 21.4%、28.0%、47.5% 和 52.8%。低氮敏感品种的下降幅度均高于耐低氮品种,且随胁迫时间和程度的加剧两类品种降幅差异加大。
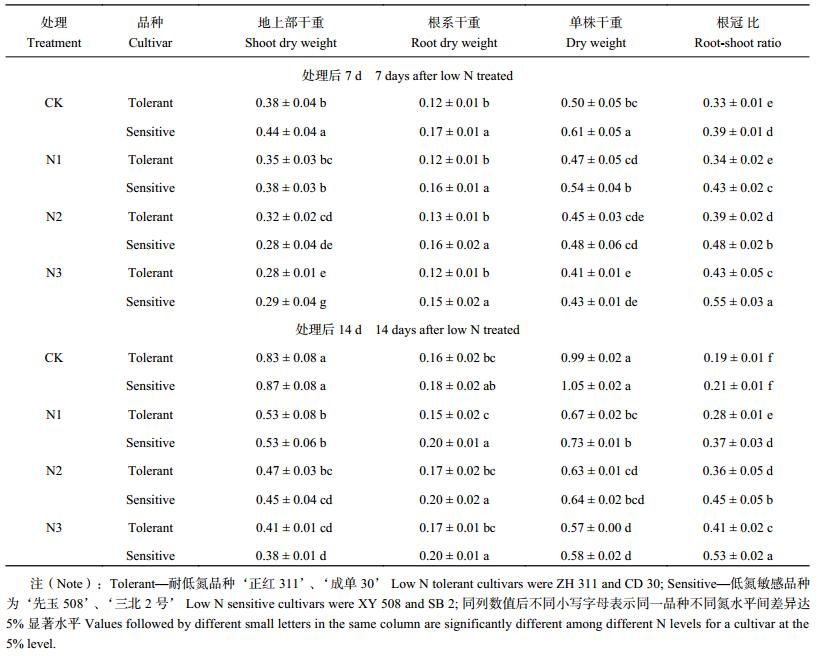
2.1.2 对生物量的影响 低氮胁迫下玉米苗期地上部干重和单株干重显著降低,根系干重在轻度胁迫 (N1) 下与对照差异不显著,重度胁迫 (N3) 下有所降低特别是处理后 14 d,但降低的幅度远小于地上部干重,导致根冠比显著升高 (表 2)。低氮胁迫下不同耐低氮性玉米品种地上部、地下部和单株干物质及根冠比变幅差异显著。处理后 7 d 和 14 d 平均,N1、N2 和 N3 处理与 CK 相比,耐低氮品种地上部干重分别下降了 27.2%、34.5% 和 42.7%;低氮敏感品种下降了 30.1%、41.1% 和 49.8%;耐低氮品种单株干重分别下降了 23.1%、27.2% 和 34.1%,低氮敏感品种下降了 23.2%、32.0% 和 39.1%;耐低氮品种根冠比分别升高了 19.7%、44.2% 和 62.1%,低氮敏感品种升高了 33.8%、57.4% 和 81.7%;耐低氮品种根系干重的N1处理降低了 5.4%,N2 和 N3 处理分别升高了 4.0% 和 2.5%,低氮敏感品种 N1、N2 和 N3 根系干重分别升高了 2.5%、2.1% 和 0.9%。低氮胁迫下低氮敏感品种地上部干重和单株干重的降幅及根冠比的增幅均高于耐低氮品种;且耐低氮品种根系干重在低氮胁迫下表现为先降低后增加,而低氮敏感品种表现为增加,随胁迫程度加剧增幅降低。
| 表2 低氮胁迫下不同氮敏感型玉米品种根系和地上部干重 (g/plant, DW) 及根冠比 Table 2 Root and shoot dry biomass and root–shoot ratios of different maize cultivars under low nitrogen stress |
 |
根系吸收面积和根系 TTC 还原量,是根系生理特性的重要指标[17]。由表 3可知,低氮胁迫主要影响根系的活力,对根系总吸收面积的影响较小。与 CK 相比,N1、N2 和 N3 处理后 7 d 和 14 d,玉米苗平均根系活力分别下降了 26.8%、41.5%、49.9% 和 38.6%、49.6%、55.3%。低氮胁迫对不同类型品种根系活力的影响程度有较大差异,耐低氮品种根系活力高于低氮敏感品种。N1、N2 和 N3 处理后 7 d 根系活力分别高出 39.9%、26.4% 和 27.9%;处理后 14 d 根系活力高出 62.8%、63.3% 和 79.0%。耐低氮品种在低氮胁迫下仍能保持较高的根系活力和总吸收面积。
| 表3 低氮胁迫下不同玉米品种根系活力和吸收面积 Table 3 Root activities and absorbing areas of different maize cultivars under low nitrogen stress |
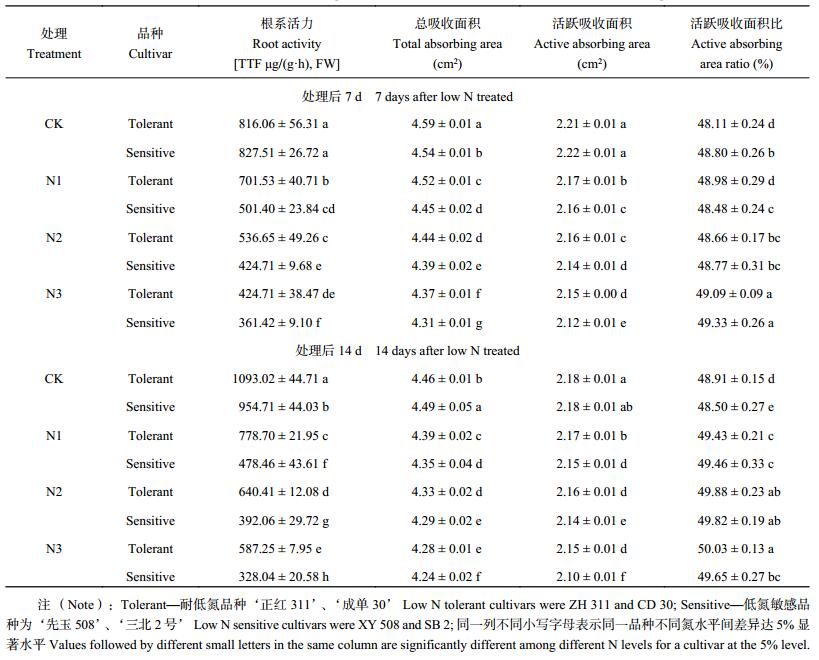 |
低氮胁迫下玉米根系的活跃吸收面积显著降低,活跃吸收面积比却有所增加。低氮胁迫下不同耐低氮性玉米品种根系活跃吸收面积比变幅差异不明显,但耐低氮品种根系活跃吸收面积降幅显著低于低氮敏感品种。N1、N2 和 N3 处理后 7 d 分别低了 13.5%、11.2% 和 13.4%,处理后 14 d 分别低了 18.8%、16.5% 和 19.7%。
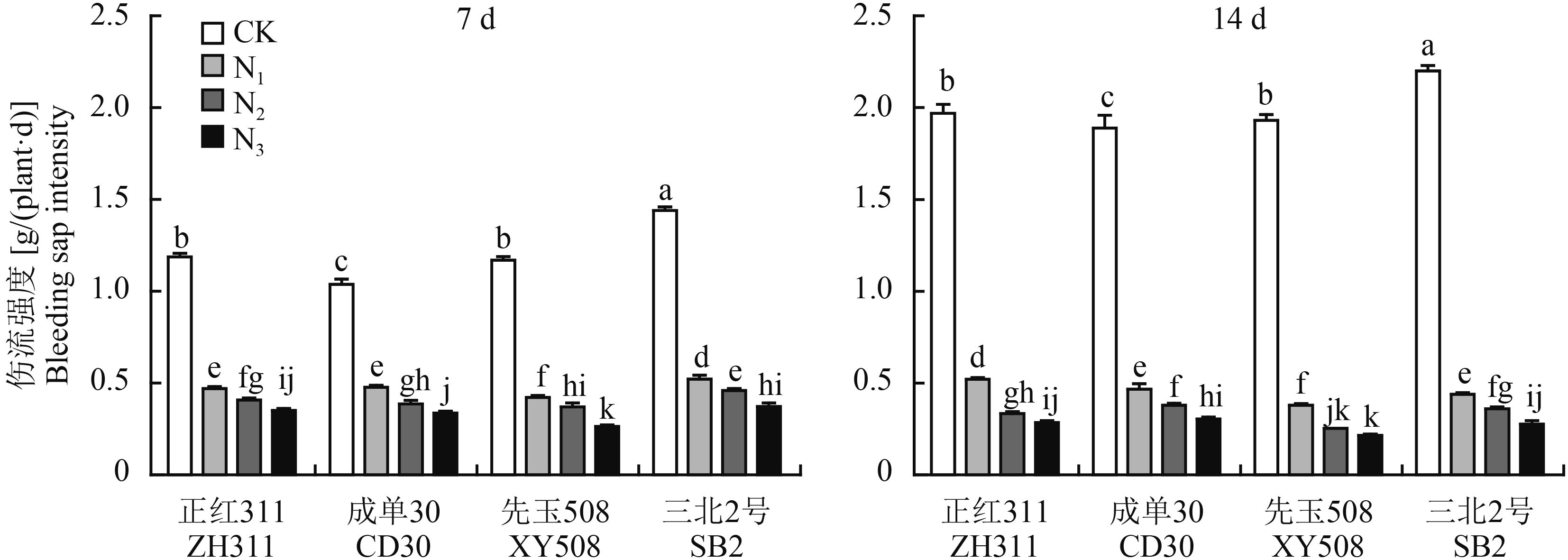
2.3 低氮胁迫对不同耐低氮性玉米品种苗期伤流性状的影响2.3.1 对根系伤流强度的影响图 1结果表明,低氮胁迫下玉米苗期根系伤流强度显著下降,4 品种平均处理后 7 d,N1、N2 和 N3 处理分别下降了 60.7%、66.3% 和 72.5%;处理后 14 d,分别下降了 77.4%、83.4% 和 86.4%,随胁迫时间和强度的加剧,伤流强度的降幅增大。正常氮处理下 (CK),耐低氮品种伤流强度较低氮敏感品种并无明显优势,但低氮胁迫下耐低氮品种伤流强度降幅明显低于低氮敏感品种。处理后 7 d,N1、N2 和 N3 处理与 CK 相比,耐低氮品种的伤流强度的降幅较低氮敏感品种分别低 6.4%、3.9% 和 6.7%;处理后 14 d 的降幅分别低 5.8%、3.6% 和 3.4%。
 |
|
图1
低氮胁迫对不同玉米品种根系伤流强度的影响
Fig. 1
Effects of the low nitrogen stress on root bleeding intensity of different maize cultivars
[注(Note):柱上不同小写字母表示同一品种不同氮水平间差异达 5% 显著水平 Different small letters above the bars are significantly different among different N levels for a cultivar at the 5% level.] |
2.3.2 对伤流液组分的影响 伤流液组分浓度的差异是根系对养分吸收和转化的结果[18],低氮胁迫对玉米苗期伤流液中可溶性蛋白、可溶性糖、游离氨基酸和硝态氮浓度有重要的影响。表 4结果表明,低氮胁迫后 7 d 伤流液中可溶性蛋白、可溶性糖、游离氨基酸和硝态氮浓度均显著下降,4 品种 3 低氮处理平均分别下降了 16.5%、30.2%、56.2% 和 98.3%;而处理后 14 d 则表现为可溶性蛋白和可溶性糖浓度分别升高 30.3% 和 227.0%,游离氨基酸和硝态氮浓度分别下降 75.2% 和 95.6%。表明低氮胁迫对玉米苗期伤流液中硝态氮浓度的影响最大,而氮代谢受损后会引起伤流液中可溶性糖的急剧增加。
| 表4 低氮胁迫不同玉米品种伤流液各组分浓度 (μg/mL) Table 4 The component contents in bleeding sap of different maize cultivars exposure to low nitrogen stress |
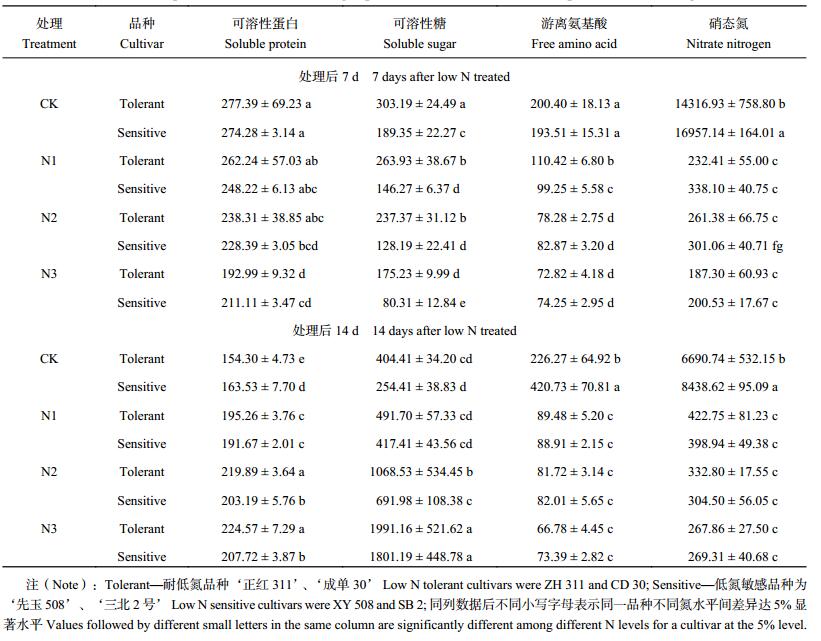 |
低氮胁迫下不同耐低氮性玉米品种苗期伤流液中可溶性蛋白和可溶性糖变幅差异明显。与 CK 相比,处理后 14 d 耐低氮品种 N1、N2 和 N3 处理可溶性蛋白浓度分别升高了 26.6%、42.5% 和 45.5%,低氮敏感品种分别升高了 17.2%、24.3% 和 27.0%;而处理后 7 d,耐低氮品种 N1、N2 和 N3 处理可溶性糖浓度较低氮敏感品种分别高 80.4%、85.2% 和 118.2%,处理后 14 d 分别高 17.8%、54.4% 和 10.6%。低氮胁迫下耐低氮品种伤流液中可溶性蛋白浓度增幅和可溶性糖浓度均显著高于低氮敏感品种。
根系伤流液中氨基酸与硝态氮比值的大小可以直接反映根部活性的高低和植株对硝态氮吸收、利用的能力[19]。低氮胁迫下伤流液中氨基酸与硝态氮比值显著升高 (表 4)。处理后 7 d 氨基酸/硝态氮增幅显著高于处理后 14 d。处理后 7 d,耐低氮品种氨基酸/硝态氮在 N1、N2 和 N3 处理下较低氮敏感品种分别高 36.5%、14.4% 和 16.3%;而处理后 14 d,耐低氮品种较低氮敏感品种分别低 2.5%、11.9% 和 10.3%。低氮胁迫下耐低氮品种氨基酸/硝态氮早期增幅高,后期降幅大,表明耐低氮品种较低氮敏感品种根系早期能更早对低氮胁迫做出反映,后期能维持更高的根系活力和硝态氮的吸收、利用能力。
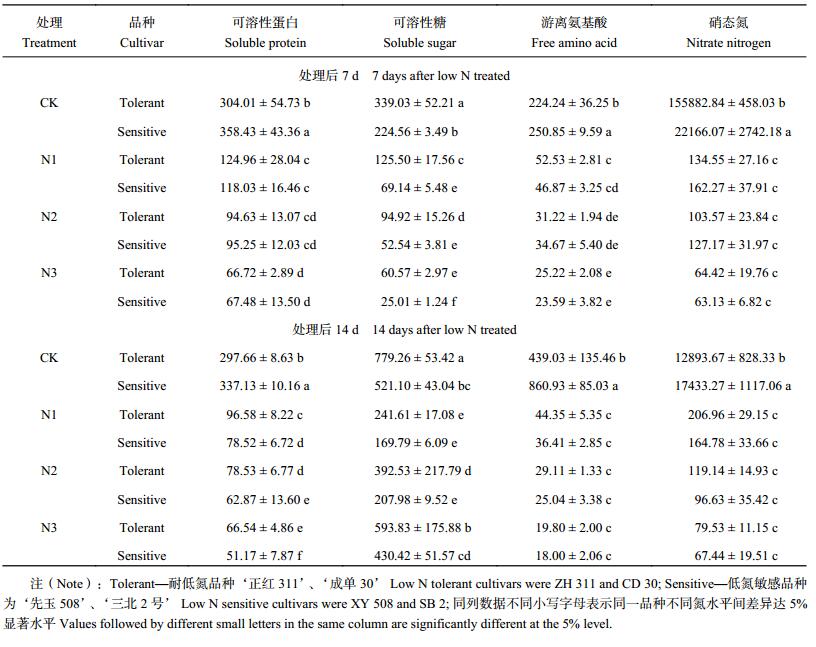
低氮胁迫下玉米苗期伤流液可溶性蛋白、可溶性糖、氨基酸和硝态氮的转运速度均显著下降 (表 5)。处理后 14 d,低氮胁迫下伤流液中可溶性蛋白和可溶性糖浓度均显著升高,但转运速度显著降低,表明伤流强度对伤流成分转运速度的影响较浓度的影响更大。与 CK 相比,处理后 7 d 各低氮处理,耐低氮品种可溶性蛋白、可溶性糖、氨基酸和硝态氮转运速度平均分别下降了 68.6%、72.4%、83.8% 和 99.4%,低氮敏感品种各处理分别下降了 73.9%、80.0%、86.0% 和 99.5%;处理后 14 d,耐低氮品种各处理分别下降了 72.9%、47.5%、92.9% 和 99.0%,低氮敏感品种下降了 81.0%、48.3%、96.9% 和 99.4%。耐低氮品种伤流液各组分转运速度下降幅度均低于低氮敏感品种。
| 表5 低氮胁迫对不同玉米品种伤流液组分转运速度的影响 (μg/d) Table 5 The component transport speeds in bleeding sap of different maize cultivars exposure to low nitrogen stress |
 |
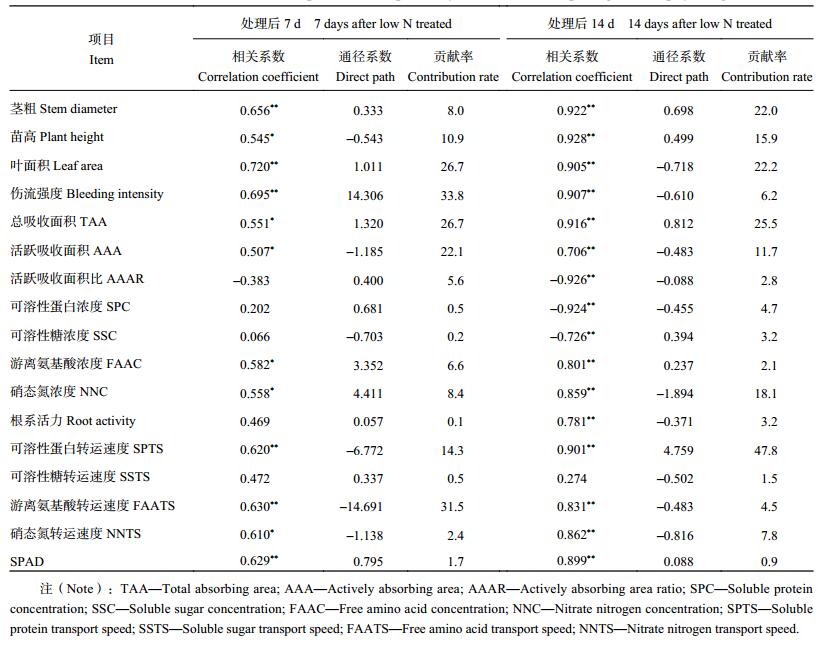
单株干重是玉米苗期生长状况的具体表现,其与主要形态和生理指标存在不同程度相关性 (表 6)。在形态指标中,单株干重与茎粗、苗高、叶面积、根系总吸收面积和活跃吸收面积呈正相关,相关系数都达到了显著或极显著水平,与根系活跃吸收面积比呈负相关,处理后 14 d 相关系数达极显著水平,无论是处理后 7 d 还是 14 d,对单株干重贡献最大的都是地上部的叶面积和根系的吸收面积;在生理指标中,除处理后 14 d 根系伤流的可溶性蛋白和可溶糖浓度与单株干重呈负相关外,其余各时期和各指标与单株干重均呈正相关,大多达到了显著或极显著水平,处理后 7 d 以伤流强度和伤流中游离氨基酸转运速度对单株干重的贡献最大,即单株干重主要受根系吸收、转运养分能力的影响,而处理后 14 d 则以伤流中可溶性蛋白转运速度对单株干重的贡献最大,其次为伤流中硝态氮浓度,即单株干重主要受根系吸收、同化氮素能力的影响。
| 表6 单株干重与形态、生理指标的相关和通径系数 Table 6 Correlation coefficients and direct path between plant dry biomass and morphological and physiological indices |
 |
根系活力是反映根系发育状况的一个重要指标,根系活力越强,植株吸收养分的能力越强;而根系吸收面积是根系活性指标之一,根系吸收面积越大,说明活性越强、吸收能力越大[20–21]。王彦荣等[22]研究指出低氮胁迫下植物的根系活力和根系吸收面积均有不同程度的下降。本试验结果表明,低氮胁迫下玉米苗期根系活力降低,总吸收面积和活跃吸收面积也有所下降,但降幅远小于根系活力,而活跃吸收面积比有所增加,表明低氮胁迫主要影响的是根系活力,对根系形态的影响相对较小。不同耐低氮性玉米品种根系活跃吸收面积比变幅差异不明显,但耐低氮品种总吸收面积和活跃吸收面积降幅均低于低氮敏感品种,表明低氮胁迫下耐低氮品种在保持与低氮敏感品种相同的活跃吸收面积比的同时,有效地降低了活跃吸收面积的降幅从而提高了其在低氮条件下的根系吸收能力。
3.2 低氮胁迫对不同耐低氮性玉米品种苗期伤流性状的影响由于低氮胁迫降低了根系活力和吸收面积,相应地降低了玉米幼苗的伤流强度,根系活力和伤流强度呈极显著正相关,处理后 7 d 和 14 d 的相关系数分别为 0.7288**和 0.8645** (n = 16)。不过不同类型品种根系伤流强度受低氮胁迫影响的程度有较大差异,耐低氮品种在低氮胁迫下根系伤流量的降幅较低氮敏感品种更低,这与谢孟林等[23]的研究结果一致。
根系伤流液中可溶性蛋白和可溶性糖含量可分别反映植株氮和碳代谢情况,因此二者与植株的氮代谢和碳代谢密切相关[24–25]。伤流液中的养分是根系吸收转化的结果,营养元素的供给水平对植株伤流成分有很大的影响[26]。本试验结果表明,低氮胁迫下玉米苗期根系伤流液中可溶性蛋白、可溶性糖、游离氨基酸和硝态氮的运转速度及游离氨基酸和硝态氮浓度均显著下降,而可溶性蛋白和可溶性糖浓度随胁迫时间的延长表现出先下降后升高的趋势。耐低氮品种各指标降幅均低于低氮敏感品种,而处理 14 d 可溶性蛋白和可溶性糖浓度增幅较低氮敏感品种更高,且在低氮胁迫下耐低氮程度均高于低氮敏感品种。表明低氮胁迫下耐低氮品种根系不仅吸收养分能力较低氮敏感品种强,而且向地上部转运养分的能力也高于低氮敏感品种,表明其适应低氮环境的能力更高。
伤流液中氨基酸/硝态氮浓度的比值变化是根系中氮循环的结果,能够很好的反映植株氮素代谢的整体适应性[12]。李俊霞[27]研究表明,随氮浓度的降低伤流液中氨基酸和硝态氮浓度均呈下降的趋势,而硝态氮的降幅远大于氨基酸,因此低氮胁迫下氨基酸/硝态氮浓度的比值显著升高。本试验不仅印证了这一结果,还进一步发现不同类型品种伤流液中氨基酸/硝态氮的比值受低氮胁迫影响的程度也有较大差异,耐低氮品种氨基酸/硝态氮比值较低氮敏感品种的低,低氮胁迫下该比值提高的幅度较低氮敏感品种大,进一步表明耐低氮品种在低氮胁迫条件下吸收、利用氮素的能力较低氮敏感品种更强,这是其耐低氮能力强的重要生理机制。
3.3 低氮胁迫对不同耐低氮性玉米品种苗期生长的影响低氮胁迫影响了玉米幼苗根系的活力及其吸收、转运和同化、利用养分的能力,进而影响植株的生长,导致苗高、茎粗、叶面积和干物质积累量的降低,胁迫时间越长、胁迫程度越高,影响的程度越大,其中地上部受影响的程度大于地下部,导致根冠比上升[28–29],这是玉米苗适应低氮胁迫的表现。在影响植株生长 (单株干物质积累量) 的因子中,在形态指标中最主要的是地下根系的吸收面积和地上部的叶面积;在生理指标中,低氮胁迫的早期 (处理后 7 d) 主要是影响伤流强度和游离氨基酸转运速度,即根系的吸收和转运营养物质能力,而后期 (处理后 14 d) 则主要是影响伤流中硝态氮含量和可溶蛋白转运速度,即根系的吸收和同化能力。不同类型品种幼苗生长受低氮胁迫影响的程度有较大差异,总体而言,耐低氮品种受影响的程度相对较小,在低氮胁迫下苗高、茎粗、叶面积和干物质积累量下降的幅度及根冠比上升的幅度较低氮敏感品种低,这是其适应低氮环境能力强的具体表现。
4 结论低氮胁迫下玉米苗期苗高、茎粗、叶面积、SPAD、单株干重、地上部干重、伤流强度,伤流液中可溶性蛋白和可溶性糖转运速度、氨基酸和硝态氮转运速度及浓度、根系活力、根系总吸收面积和根系活跃吸收面积均显著下降,且耐低氮品种这些指标的降幅均低于低氮敏感品种。根冠比、伤流液中氨基酸/硝态氮浓度比值均显著升高,而伤流液中可溶性蛋白和可溶性糖浓度则随胁迫时间表现出先降低后升高的趋势。耐低氮品种的根冠比、可溶性蛋白浓度和氨基酸与硝态氮浓度比值的增幅和可溶性糖浓度均低于低氮敏感品种,且耐低氮品种低氮胁迫下根系活力、伤流液中可溶性蛋白和可溶性糖浓度均显著高于低氮敏感品种,氨基酸/硝态氮浓度比值均低于低氮敏感品种。表明玉米苗能够通过改善物质分配来适应低氮胁迫,与低氮敏感品种相比,耐低氮品种通过保持较强的根系活力和较大的吸收面积,从而提高根系吸收、合成和转动营养物质的能力来适应缺氮环境。
| [1] |
刘春晓, 赵海军, 董树亭, 等. 玉米不同基因型双列杂交后代抽丝后氮素代谢特性[J].
中国农业科学, 2014, 47(1): 33–42.
Liu C X, Zhao H J, Dong S T, et al. Study on characteristics of nitrogen metabolism in diallel cross generation of different maize genotypes after silking[J]. Scientia Agricultura Sinica, 2014, 47(1): 33–42. |
| [2] | Wen Z H, Shen J B, Martin B, et al. Combined applications of nitrogen and phosphorus fertilizers with manure increase maize yield and nutrient uptake via stimulating root growth in a long-term experiment[J]. Pedosphere, 2016, 1: 1–17. |
| [3] | Cui L M, Wang X X, Xuan H D, et al. Changes in several physiological and biochemical indices of maize seedling roots caused by drought stress[J]. Plant Diseases and Pests, 2015, 6(4-5): 35–37, 43. |
| [4] |
王玲敏, 叶优良, 陈范骏, 等. 施氮对不同品种玉米产量、氮效率的影响[J].
中国生态农业学报, 2012, 20(5): 529–535.
Wang L M, Ye Y L, Chen F J, et al. Effect of nitrogen fertilization on maize yield and nitrogen efficiency of different maize varieties[J]. Chinese Journal of Eco-Agriculture, 2012, 20(5): 529–535. DOI:10.3724/SP.J.1011.2012.00529 |
| [5] |
刘建安, 米国华, 张福锁. 不同基因型玉米氮效率差的比较研究[J].
农业生物技术学报, 1999, 7(3): 246–252.
Liu J A, Mi G H, Zhang F S. Difference in nitrogen efficiency among maize genotypes[J]. Journal of Agricultural Biotechnology, 1999, 7(3): 246–252. |
| [6] |
杨建昌. 水稻根系形态生理与产量、品质形成及养分吸收利用的关系[J].
中国农业科学, 2011, 44(1): 36–46.
Yang J C. Relationships of rice root morphology and physiology with the formation of grain yield and quality and the nutrient absorption and utilization[J]. Scientia Agricultura Sinica, 2011, 44(1): 36–46. |
| [7] | Xu H Y, Zhou F J, Bai K D, et al. Effects of allantoin on the root growth and bleeding liquid of maize seedlings[J]. Journal of Agricultural and Biological Science, 2003, 22(1): 25–28. |
| [8] |
殷春渊, 杨海霞, 杜彦修, 等. 水稻不同部位伤流强度的差异及其与籽粒充实的关系[J].
作物学报, 2013, 39(1): 153–163.
Yin C Y, Yang H X, Du Y X, et al. Difference of bleeding intensity in different parts of rice plant and its relationship with grain plumpness[J]. Acta Agronomica Sinica, 2013, 39(1): 153–163. |
| [9] |
张玉姣, 徐克章, 陈展宇, 等. 不同年代大豆品种根系伤流液含氮化合物的变化[J].
中国油料作物学报, 2014, 36(4): 469–475.
Zhang Y J, Xu K Z, Chen Z Y, et al. Changes of nitrogen compounds in root bleeding sap of soybean cultivars released in different years[J]. Chinese Journal of Oil Crop Sciences, 2014, 36(4): 469–475. |
| [10] |
徐钰, 江丽华, 郑福利, 等. 调控措施对日光温室黄瓜伤流液及其养分含量的影响[J].
中国蔬菜, 2012, (20): 62–67.
Xu Y, Jiang L H, Zheng F L, et al. Effects of different control measures on cucumber bleeding sap and its nutrient contents in greenhouse[J]. China Vegetables, 2012, (20): 62–67. |
| [11] |
刘盼盼, 伍大利, 刘畅, 等. 淹涝和氮形态对苗期玉米伤流液流量及组分的影响[J].
华北农学报, 2013, (3): 133–138.
Liu P P, Wu D L, Liu C, et al. Effect of water-logging stress and nitrogen forms on amount and solutes concentration of bleeding sap in maize plants at seeding stage[J]. Acta Agriculturae Boreali-Sinica, 2013, (3): 133–138. |
| [12] |
陈范俊, 米国华, 刘建安. 玉米自交系木质部伤流液中氮素形态差异及其与氮效率的关系[J].
中国农业科学, 1999, 32(5): 133–138.
Chen F J, Mi G H, Liu J A. Genotypic difference of nitrogen form in xylem sap of maize inbred seedlings and its relation to nitrogen efficiency[J]. Scientia Agricultura Sinica, 1999, 32(5): 133–138. |
| [13] |
罗秀杰, 王海红, 束良佐, 等. 供氮形态与 部位对局部根区水分胁迫下玉米水分吸收与利用的影响[J].
西北植物学报, 2010, 30(7): 1426–1434.
Luo X J, Wang H H, Shu L Z, et al. Water uptake and utilization of maize under partial rootzone water stress with different nitrogen forms and application positions[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(7): 1426–1434. |
| [14] |
罗延宏. 玉米苗期耐低氮品种的筛选及其生理机制的初步研究[D]. 成都: 四川农业大学硕士学位论文, 2012.
Luo Y H. The primary research about the screening of low nitrogen tolerant maize variety and its physiological mechanism[D]. Chengdu: MS Thesis of Sichuan Agricultural University, 2012. |
| [15] |
熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003.
Xiong Q E. Plant physiology experiment report[M]. Chengdu: Sichuan Science and Technology Press, 2003. |
| [16] |
邹琦. 植物生理生化实验指导[M]. 北京: 农业出版社, 1995.
Zou Q. Plant physiology and biochemistry experiments guide[M]. Beijing: Agriculture Press, 1995. |
| [17] |
宋海星, 李生秀. 玉米生长空间对根系吸收特性的影响[J].
中国农业科学, 2003, 36(8): 899–904.
Song H X, Li S X. Effects of root growing space of on maize its absorbing characteristics[J]. Scientia Agricultura Sinica, 2003, 36(8): 899–904. |
| [18] |
宋海星, 李生秀. 水、氮供应对玉米伤流及其养分含量的影响[J].
植物营养与肥料学报, 2004, 10(6): 574–578.
Song H X, Li S X. Effects of water and N supply on maize bleeding sap and its nutrient contents[J]. Plant Nutrition and Fertilizer Science, 2004, 10(6): 574–578. |
| [19] |
禹婷, 王永熙, 刘航空. 3种果树伤流液中氮素形态分析[J].
西北林学院学报, 2006, 21(3): 34–36.
Yu T, Wang Y X, Liu H K. Analysis on nitrogen form in bleeding sap of three fruit trees[J]. Journal of Northwest Forestry University, 2006, 21(3): 34–36. |
| [20] |
吕小红, 陈温福, 宋玉婷, 等. 施氮条件下不同株型水稻品种的根系活力研究[J].
北方水稻, 2014, 44(4): 7–11.
Lü X H, Chen W F, Song Y T, et al. Study on root activity between different plant type rice under several nitrogen levels[J]. North Rice, 2014, 44(4): 7–11. |
| [21] | Liu J J, Wei Z, Li J H. Effects of copper on leaf membrane structure and root activity of maize seedling[J]. Botanical Studies, 2014, 55(1): 1–6. DOI:10.1186/1999-3110-55-1 |
| [22] |
王彦荣, 华泽田, 陈温福. 粳型超级杂交稻辽优3225根系生理特性研究[J].
中国水稻科学, 2003, 17(1): 37–41.
Wang Y R, Hua Z T, Chen W F. Root physiological characteristics of super japonica hybrid rice Liaoyou 3225[J]. Chinese Journal of Rice Science, 2003, 17(1): 37–41. |
| [23] |
谢孟林, 李强, 査丽, 等. 低氮胁迫对不同耐低氮性玉米品种幼苗根系形态和生理特征的影响[J].
中国农业生态学报, 2015, 23(8): 946–953.
Xie M L, Li Q, Zha L, et al. Effects of low nitrogen stress on the physiological and morphological traits of roots of different low nitrogen tolerance maize varieties at seedling stage[J]. Chinese Journal of Eco-Agriculture, 2015, 23(8): 946–953. |
| [24] |
周宇飞, 史振声, 吕德贵, 等. 种植密度对不同耐密性春玉米基部茎节维管束及根系伤流的影响[J].
西北植物学报, 2013, 33(3): 518–526.
Zhou Y F, Shi Z S, Lü D G, et al. Effects of planting densities on basal stem vascular bundles and root bleeding sap of different density-tolerant maize cultivars[J]. Acta Botanica Boreali-Occidentallia Sinica, 2013, 33(3): 518–526. |
| [25] |
王业建. 大豆对低氮胁迫的形态和生理学响应及介导低氮胁迫 miRNA 的鉴定[D]. 长沙: 中南大学博士学位论文, 2013.
Wang Y J. Morphological and biological responses of different soybean varieties to low nitrogen and identification of low nitrogen regulated miRNA[D]. Changsha: PhD Dissertation of Central South University, 2013. |
| [26] | 任思荣, 朱建国, 李辉信, 等. 大气CO2浓度升高对水稻伤流液中矿质元素的影响[J]. 农业环境科学学报, 2007, 26(5): 1849–1853. |
| [27] |
李俊霞. 不同玉米自交系氮效率差异的研究[D]. 北京: 中国农业科学院硕士学位论文, 2015.
Li J X. Studies on nitrogen utilization efficiency of different maize inbred lines[D]. Beijing: MS Thesis of Chinese Academy of Agricultural Sciences, 2015. |
| [28] |
刘婷婷, 樊明寿, 李春俭. 不同氮效率玉米自交系对氮素供应的反应[J].
华北农学报, 2005, 20(3): 83–86.
Liu T T, Fan M S, Li C J. Responses of maize inbred lines with contrasting N efficiency to different nitrogen supplies[J]. Acta Agriculturae Boreali-Sinica, 2005, 20(3): 83–86. |
| [29] |
王敬锋, 刘鹏, 赵秉强, 等. 不同基因型玉米根系特性与氮素吸收利用的差异[J].
中国农业科学, 2011, 44(4): 699–707.
Wang J F, Liu P, Zhao B Q, et al. Comparison of root characteristics and nitrogen uptake and use efficiency in different corn genotypes[J]. Scientia Agricultura Sinica, 2011, 44(4): 699–707. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

