磷是植物生长所必需的营养元素之一,在所有生命系统的代谢过程中起着关键作用。然而,由于土壤中的磷素大多以固定态形式存在,所以土壤中有效磷较为缺乏[1]。我国约 75% 的土壤缺磷,且土壤中 95% 以上的磷以无效形式存在,植物很难直接吸收利用[2],尤其是北方石灰性土壤,有效磷含量仅占全磷的 0.1% 左右[3]。施用磷肥是我国目前主要的增产措施,然而施入土壤中的磷肥除一小部分被植物吸收外,大约 70% 转化为 Ca-P、Fe-P 和 Al-P 等难以被植物吸收利用的形态而固定在土壤中[4-6],可见,挖掘利用这部分磷对于循环利用磷素资源,减少化学磷肥用量具有重要意义[7]。
施用溶磷微生物 (phosphate solubilizing microorganism, PSM) 可以提高土壤中可溶性磷的含量,增加植物对磷的吸收利用[8],是开发利用土壤中固定态磷的有效方式之一。但也有在小区和大田试验中施用溶磷菌效果不佳的报道[9-10]。其原因可能是多方面的,溶磷菌株在自然条件下缺乏竞争力,难以在植株根际成功定殖可能是重要原因之一[11],因此,研究溶磷菌在植物根际的生存优势以及适应根际环境的需求应当是筛选溶磷菌必需的关键步骤之一。溶磷微生物以群落的形式存在于自然环境中[12],而实验室中对溶磷菌的研究多以溶磷能力高的单菌为筛选对象,一些溶磷能力强的菌株往往由于在植物根际定殖时不具有竞争力而导致应用效果不佳。有研究者将溶磷菌和根瘤菌、产酸菌、产IAA菌等其他功能性菌株复合培养研究[13-14],发现功能性菌株与溶磷菌间存在一定互促作用,但对多种溶磷菌共同存在时其相互作用及作用机理研究较少。本研究通过室内无机磷培养基中溶磷能力较高的阴性菌株和在盆栽试验中根际定殖能力较高的阳性菌株配合作用,研究其对玉米生长的作用,探讨不同特性的菌株在溶磷功能上的发挥,以期为获得溶磷效果稳定的微生物菌剂提供理论依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株4 株荧光假单胞菌 CHA0,F113,Phl1c2,PF5 (G-),1 株巨大芽孢杆菌 X14 (G+)。5 株菌均可以在以 Ca3(PO4)2为难溶磷源的 NBRIP 液体培养基中生长溶磷,其中 X14 在培养基中溶磷能力较差,但定殖能力较强,盆栽应用效果较好[15]。
1.1.2 培养基LB 培养基:蛋白胨 10 g,酵母粉 5 g,NaCl 10 g,琼脂 25 g,pH 7.0,水 1000 mL。NBRIP (无机磷) 培养基[16]:葡萄糖 10 g,Ca3(PO4)25 g,MgCl2·6H2O 5 g,MgSO4·7H2O 0.25 g,KCl 0.2 g,(NH4)2SO40.1 g,蒸馏水 1000 mL,pH 7.0。
1.2 液体摇瓶实验 1.2.1 培养基可溶磷含量和 pH 值于 250 mL 三角瓶中装入以 Ca3(PO4)2为难溶磷源的无机磷培养基 (NBRIP) 50 mL,115℃、30 min 高压灭菌备用。将在 LB 液体培养基中过夜培养的细菌,离心收集菌体,用无菌水悬浮制成菌悬液 (OD600= 0.5),取 1% 的菌悬液接种于上述灭菌的 NBRIP 培养基中,以接入等体积无菌水为对照 (CK),每个处理重复 3 次,30℃、170 r/min 摇床培养 7 d,培养液经 10000 r/min 离心 10 min,上清分别用钼锑抗比色法和 pH 计测定溶磷量和 pH 值[17]。
1.2.2 菌生长量将菌液低速 (1500 r/min) 离心 3 min,然后取 2 mL 菌液用等体积 1 mol/L HCl 稀释,以去除上清液中残留的磷酸钙颗粒,600 nm 处测定细菌生长量[18]。
1.2.3 菌株发酵液中促生物质的检测IAA 和 GA:采用 ELISA 试剂盒酶联免疫间接竞争法检测 IAA 和 GA,酶标仪在 450 nm 波长下测定吸光度 (OD 值),计算样品浓度。铁载体:CAS 液体检测法。将细菌培养液过滤除菌后的上清液用去离子水稀释 4、6、8、10 倍,以不同稀释浓度的样品与 CAS 检测液等体积混合,充分反应后调 pH 至中性,分光光度计 630 nm 处测得吸光值 A;以去离子水和检测液等体积混合测得 Ar 为对照。A/Ar 代表铁载体的相对含量,该值越低,铁载体含量越高。
1.3 盆栽试验 1.3.1 供试土壤和作物土壤采自安徽省怀远县,含有机质 30.8 g/kg、全氮 1.37 g/kg、全磷 0.80 g/kg、速效磷 7.37 mg/kg、速效钾 110 mg/kg、pH 7.1。供试玉米品种苏玉 20 号。
1.3.2 试验设计试验设不接菌对照和接菌处理,接菌处理包括接种菌株组合及对应的单菌。各处理按 N 0.2 g/kg 土、K2O 0.2 g/kg 土施入氮、钾肥,重复 3 次,盆栽体系为 4 kg 土。每盆播种消毒催芽后的玉米种子 4 粒,7 d 后间苗,每盆留 2 株。将在 LB 液体培养基中培养的溶磷菌离心收集菌体,用无菌水悬浮制成菌悬液,采用浇根方式在玉米苗根际接入溶磷菌,接种量为 107cfu/g。接菌 30 d 后收获玉米,采集根际土壤,测定玉米株高和鲜重,105℃ 下杀青 30 min,75℃ 烘干至恒重后称其干重。植株样品粉碎后用 H2SO4-H2O2消煮,钼黄比色法测定全磷含量。
1.4 数据处理采用 Microsoft Office Excel 2007 进行数据处理,SPSS 17.0 软件进行统计分析和显著性检验。
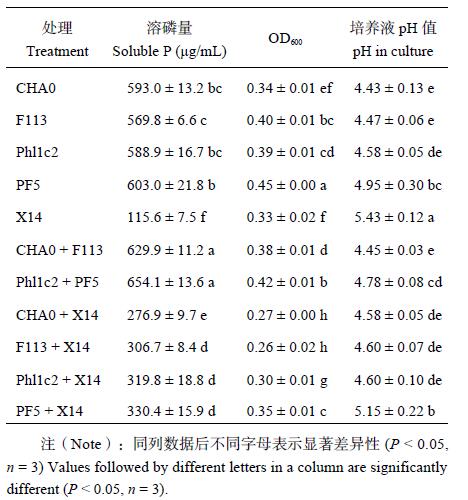
2 结果与分析 2.1 溶磷菌及其复配组摇瓶实验结果室内摇瓶试验中,分别测定了单株阴性菌、阳性菌、阴性菌与阴性菌组合以及阴性菌与阳性菌组合后,在 NBRIP 液体培养基中的溶磷量,OD600和 pH 值。结果表明 (表 1),各阴性菌发酵液中溶磷量均显著高于阳性菌株,其中最高为菌株 PF5 溶磷量可达到 603.0 μg/mL。比较生长量和培养基 pH 值发现,培养基中各阴性菌的增殖能力和降低 pH 的能力远高于阳性菌,其中菌株 PF5 生长最快 (OD600= 0.45),CHA0 降低介质 pH 能力最强 (pH = 4.43,初始值为 7.00)。将各阴性菌分别与和阳性菌 X14 组合后接种于培养基中,结果显示,发酵液中可溶磷含量均显著低于接种单株阴性菌的处理,且其生长量也明显降低。而不同阴性菌株相互组合后,其发酵液中可溶磷含量显著高于对应的阴性菌和阳性菌的处理。整体结果显示,在无机磷培养基中,阴性菌间的组合溶磷效果最优,其次是单株阴性菌,再次是阴性菌与阳性菌的组合,而阳性菌 X14 溶磷效果最差。
| 表1 溶磷菌对 Ca3(PO4)2的溶解能力 Table 1 Dissolving capacity of phosphorous dissolving bacteria on Ca3(PO4)2 |
 |
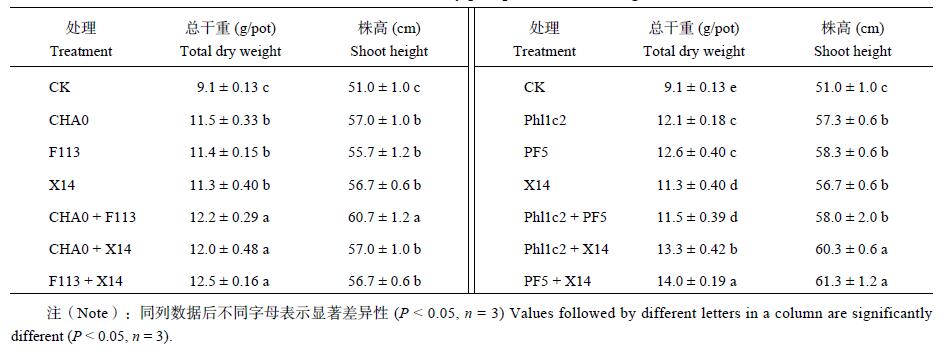
盆栽试验中接种单菌及菌株组合处理玉米,结果表明所有接菌处理的玉米植株其株高和干重均显著高于未接菌处理 (表 2),分别对比 CK 增加了 11.2%~20.2% 和 22.2%~53.8%,且接种不同菌的处理之间存在显著差异。比较接种单株菌的玉米总干重和株高结果可知,阳性菌 X14 与阴性菌 CHA0、F113 间差异均不显著,与菌株 Phl1c2 和 PF5 干重差异显著,株高差异不显著。接种组合菌株的处理中,CHA0、F113 分别与 X14 组合处理的玉米植株株高和总干重与 CHA0 和 F113 组合后的处理结果相近;接种 Phl1c2、PF5 分别与 X14 组合处理的玉米株高和总干重均显著高于 Phl1c2 和 PF5 组合后的处理,说明阳性菌 X14 在盆栽试验中发挥了重要的作用,且与阴性菌配合后效果更佳。而接种菌株 Phl1c2 和 PF5 组合处理的玉米,其效果却显著低于了菌株 Phl1c2、PF5 单独接种处理的玉米,说明该阴性菌株组合的盆栽应用效果并不理想。
| 表2 接种溶磷菌玉米生长指标 Table 2 Growth index of corn affected by phosphorous dissolving bacteria inoculation |
 |
测定玉米植株全磷吸收累积量 (图 1) 发现,接菌处理的玉米磷吸收量均显著高于未接菌处理。比较接种单菌处理的玉米全磷吸收量,阳性菌 X14 与阴性菌 F113、Phl1c2 差异不显著,与 CHA0、PF5 差异显著。接种阴性菌组合 CHA0 和 F113 的处理,其玉米全磷吸收量显著高于单菌 CHA0、F113 和 X14 的处理,且与 CHA0、F113 分别和阳性菌 X14 组合后的处理效果相近。接种阴性菌组合 Phl1c2 和 PF5 处理的玉米磷吸收量与接种单菌 PF5 的处理差异不显著,与接种 Phl1c2、X14 的处理差异显著,且该阴性菌组合处理的玉米磷吸收量显著低于了 Phl1c2、PF5 分别与阳性菌 X14 组合的处理。菌株 Phl1c2 和 PF5 无论是单菌处理还是与菌株 X14 组合处理,玉米磷吸收累积量的效果都尤为突出,但二者相互组合后效果却并不佳。在所有组合的处理当中,玉米磷的吸收累积量高低顺序依次为 PF5 + X14、Phl1c2 + X14、F113 + X14、CHA0 + F113、CHA0 + X14 和 Phl1c2 + PF5。
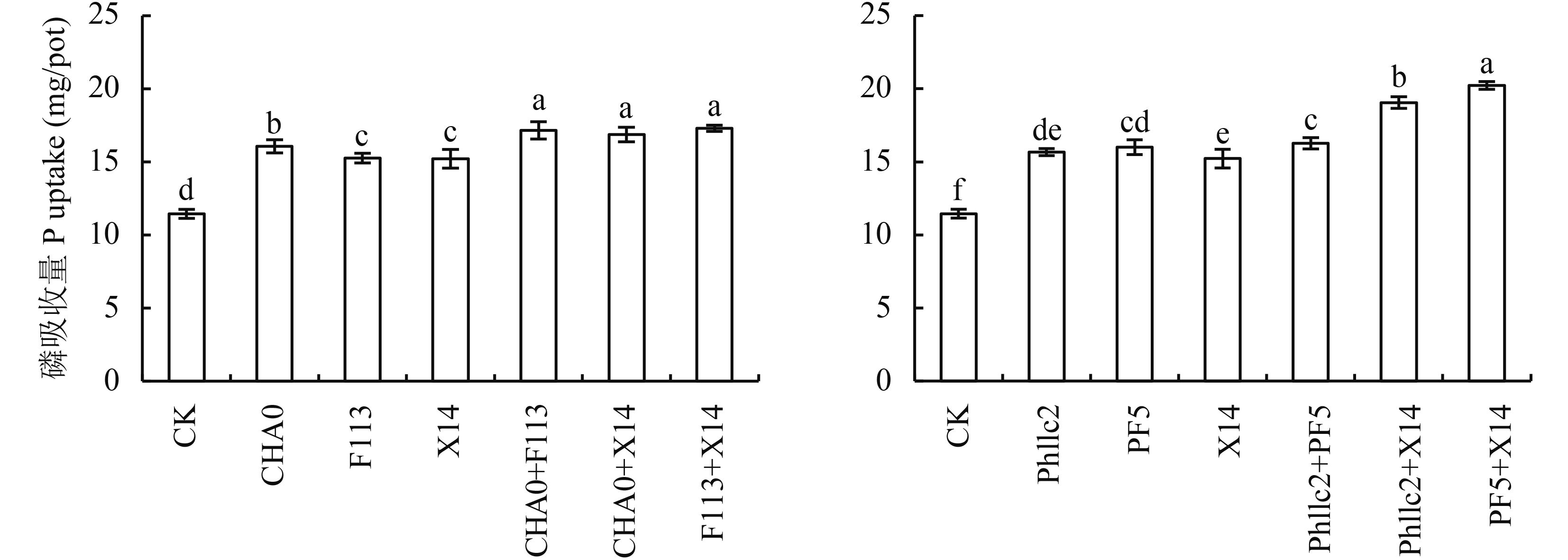 |
| 图1 接种不同溶磷菌玉米磷吸收累积量 Fig. 1 P uptake of corn inoculated with different phosphorous dissolving bacteria [注(Note):方柱上不同字母表示不同处理间差异达 0.05 显著水平 Different letters above the bars indicate significant difference at the 0.05 level.] |
接种 4 株阴性菌株的玉米总干重结果表明,菌株 PF5 促进玉米生长效果最好,而测定玉米植株根系干重发现,接种菌株 Phl1c2 和 PF5 的玉米根系较为发达 (图 2),其中接种 PF5 效果最为突出,根系占玉米植株总干重的比例可达 15.6%,其次为 Phl1c2 14.6%,F113 13.2%,而菌株 CHA0 对玉米根系生长的效应最弱,只有 12.3%。表明菌株 Phl1c2 和 PF5 对玉米根系生长的促进效应较为明显。
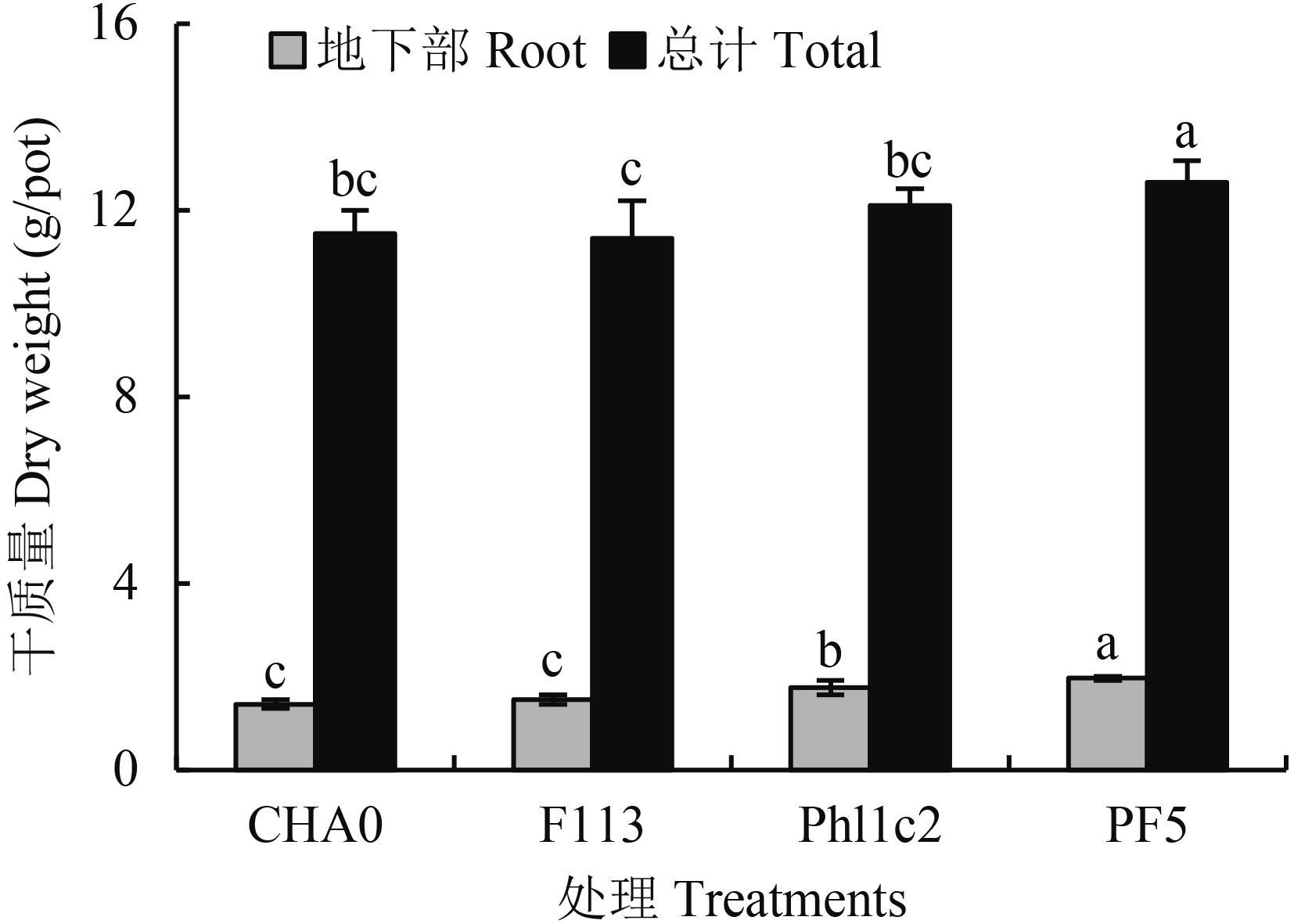 |
| 图2 接种阴性菌对玉米干质量的影响 Fig. 2 Effects of G-bacteria on dry weight of corn [注(Note):方柱上不同字母表示不同处理间差异达 0.05 显著水平 Different letters above the bars indicate significant difference at the 0.05 level.] |
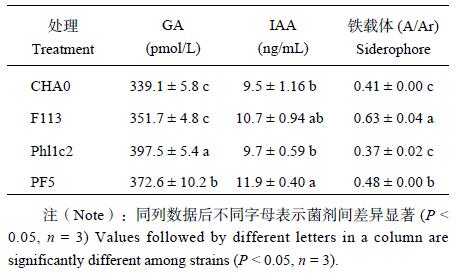
通过检测 4 株阴性菌株发酵液中的促生物质 (表 3),发现菌株 PF5 以产 IAA 和 GA 为主,其中 IAA 含量最高,GA 次之;铁载体 A/Ar 比值越低含量越高,Phl1c2 的 GA 和铁载体含量均为最高值;菌株 F113 和 CHA0 产 GA 和 IAA 均为中等水平,其中 CHA0 产铁载体的能力高于菌株 F113。生长素和赤霉素作为植物促生物质能够促进植物生长,且同时存在时有明显的协同效应,菌株通过分泌促生物质增加玉米根系生长,使其产生更多的玉米根系分泌物供根际微生物利用生长。
| 表3 阴性菌株分泌的促生物质 Table 3 Hormones excreted by G-bacteria |
 |
微生物以群落的形式存在于自然环境中,植物根际往往是由多个微生物群落共同作用,因此,筛选能够定殖于根际环境,并且稳定发挥溶磷功能的溶磷菌群是目前我们研究高效溶磷菌所应考虑的策略之一。在过往对溶磷菌的报道中,人们常以微生物在无机磷培养基中的溶磷能力大小作为筛选溶磷菌的重要指标,而阳性菌则因为其在摇瓶初筛的实验中较低的溶磷能力而常被低估。本研究中阳性菌 X14 在无机磷培养基中效果较差,但盆栽应用效果良好,所以目前现存的溶磷菌筛选方法还有待进一步优化。有施用溶磷菌在盆栽或大田试验中效果并不理想的报道,原因有多方面,重要原因之一可能菌株在植株根际无法有效定殖[11]。有研究发现,在实验室内具有较强溶磷能力和定殖能力的溶磷菌在盆栽试验中能够显著增加小麦产量和籽粒中磷的含量[19];张小兰等[15]也得到阳性菌 X14 与阴性菌虽然在室内摇瓶实验中溶磷能力存在较大差异,但在盆栽试验中该两类菌对玉米磷吸收累积量和对玉米生长的影响效果相近;而限菌砂培实验[15,19]的结果也证明菌株 X14 可以通过高效的定殖能力弥补其与阴性菌株在溶磷能力上的差异。溶磷菌的分布具有强烈的根际效应,赵小蓉等[2]研究表明,小麦和玉米根际土中溶磷菌的数量比非根际要多出 1~2 个数量级。吕德国等[20]将几株溶磷细菌接种至土壤,经过培养后发现溶磷菌大部分都定殖在本溪山樱根际,这种定殖规律可能是与根系分泌物有关。这些都说明根际定殖在微生物溶磷中发挥着不可忽视的作用。
实验室常以溶磷能力高的单菌为研究对象,但为了更好的适应根际环境,对溶磷菌的研究不再满足于单一菌群的研究,虽然也有溶磷菌与其他功能菌株配合作用的研究[13-14],但对其溶磷部分的研究则较少。本研究选用了两种不同特性的溶磷菌,即具有高效溶磷能力的4株荧光假单胞菌 CHA0、F113、Phl1c2、PF5 (G-) 和盆栽试验中溶磷应用效果良好的巨大芽孢杆菌 X14 (G+),并将这两类菌配合作用。虽然在室内溶磷实验中,阴性菌与阳性菌配合作用的效果较差,显著低于各阴性菌间相互组合的溶磷能力,但在盆栽试验中对玉米生长和全磷吸收累积量的影响效果却是相近的,有些甚至显著高于阴性菌相互组合的处理。通过阴性菌高效溶磷的能力和阳性菌高效定殖的能力相互配合,在玉米盆栽试验中取得了显著的促进效果。另外,接种菌株 Phl1c2 和 PF5 的玉米根系较为发达,说明这两株菌对玉米根系生长有较好的促进作用,使玉米根系能够分泌出更多微生物利用的资源。根系分泌物对植物根际促生菌 (PGPR) 根际定殖的影响及其影响机制是目前研究的热点[22-23],根系分泌物除了为根际微生物提供丰富的营养物质外,还通过诱导趋化性运动吸引微生物向根际聚集和定殖,从而影响微生物在植物根际的定殖[24-25]。张小兰[26]通过玉米根系分泌物对 X14 群游和趋化性的影响,证明菌株 X14 比其他菌株对玉米根系分泌物的趋化性和群游运动的效应更强,从而有利于其在根际定殖。本研究中,4 株阴性菌均能产生一些促生物质,其中阴性菌 Phl1c2 和 PF5 产促生物质较多,因此能促进玉米根系更好的生长,而相应地玉米根系分泌物也会增加,从而使对玉米根系分泌物趋化性较强的 X14 可以更加有效的在玉米根际定殖。综上所述,在筛选溶磷菌的过程中,溶磷菌的定殖能力是不可忽视的重要条件,且能够高效定殖的溶磷菌和对玉米根系生长有促进作用的高效溶磷菌相互配合作用,能够更好的适应根系环境并发挥高效溶磷的功能。
4 结论室内溶磷培养实验中,接种阴性菌单菌处理的培养基中可溶磷含量均显著高于阳性菌处理,接种阴性菌组合的处理溶磷量也显著高于对应的阴性菌与阳性菌组合处理。
盆栽试验中,接种阳性菌与部分阴性菌处理的玉米总干重和全磷含量结果相近;接种阳性菌与阴性菌组合的玉米植株总干重和全磷含量与接种阴性菌组合的处理相近,甚至显著高于某些阴性菌组合。
阳性菌与阴性菌组合具有显著的促溶磷和促生长效果,得益于阳性菌的定殖能力、阴性菌的高效溶磷能力和产促生物质的能力。
| [1] | Rodríguez H, Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnology Advances, 1999, 17(4-5): 319–339. DOI:10.1016/S0734-9750(99)00014-2 |
| [2] |
赵小蓉, 林启美, 孙焱鑫, 等. 玉米根际与非根际解磷细菌的分布特点[J].
生态学杂志, 2001, 20(6): 62–64.
Zhao X R, Lin Q M, Sun Y X, et al. Phosphobacteria distribution in rhizophere and nonrhizosphere soil of corn[J]. Chinese Journal of Ecology, 2001, 20(6): 62–64. |
| [3] | Zou X M, Binkley D, Doxtader K G. A new method for estimating gross phosphorus mineralization and immobilization rates in soils[J]. Plant and Soil, 1992, 147(2): 243–250. DOI:10.1007/BF00029076 |
| [4] | Vig A C, Dev G. Phosphorus adsorption characteristics of some acid and alkaline soils[J]. Journal of the Indian Society of Soil Science, 1984, 32(2): 235–239. |
| [5] | Bagyaraj D J, Krishnaraj P U, Khanuja S P S. Mineral phosphate solubilization:Agronomic implications, mechanism and molecular genetics[J]. Proceedings of the Indian National Science Academy, 2000, 66(2-3): 69–82. |
| [6] | Holford I C R. Soil phosphorus:its measurement and its uptake by plants[J]. Australian Journal of Soil Research, 1997, 35(2): 227–239. DOI:10.1071/S96047 |
| [7] |
张学军, 孙权, 陈晓群, 等. 不同类型菜田和农田土壤磷素状况研究[J].
土壤, 2005, 37(6): 649–654.
Zhang X J, Sun Q, Chen X Q, et al. Fractions of phosphorus in vegetable soils and farrmland soils[J]. Soils, 2005, 37(6): 649–654. |
| [8] | Hameeda B, Harini G, Rupela O P, et al. Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna[J]. Microbiological Research, 2008, 163(2): 234–242. DOI:10.1016/j.micres.2006.05.009 |
| [9] |
龚明波, 范丙全, 金振国, 等. 适应玉米生产的溶磷真菌筛选及其应用[J].
微生物学报, 2010, 50(12): 1619–1625.
Gong M B, Fan B Q, Jin Z G, et al. Screening and application of phosphate-dissolving microorganism suitable for corn production[J]. Acta Microbiologica Sinica, 2010, 50(12): 1619–1625. |
| [10] | Fernández L A, Zalba P, Gómez M A, et al. Phosphate-solubilization activity of bacterial strains in soil and their effect on soybean growth under greenhouse conditions[J]. Biology and Fertility of Soils, 2007, 43(6): 805–809. DOI:10.1007/s00374-007-0172-3 |
| [11] | Rodríguez H, Fraga R, Gonzalez T, et al. Genetics of phosphate solubilization and its potential applications for improving plant growth promoting bacteria[J]. Plant and Soil, 2006, 287(1-2): 15–21. DOI:10.1007/s11104-006-9056-9 |
| [12] |
曹鹏, 贺纪正. 微生物生态学理论框架初探[J].
生态学报, 2015, 35(22): 7263–7273.
Cao P, He J Z. A preliminary theoretical framework of microbial ecology[J]. Acta Ecologica Sinica, 2015, 35(22): 7263–7273. |
| [13] |
刘江, 黄学跃, 李天飞, 等. VA菌根真菌与根瘤菌和溶磷菌双接种对烟苗生长的影响[J].
烟草科技, 2000(2): 43–44.
Liu J, Huang X Y, Li T F, et al. Influence of dual inoculation of VA mycorrihizal fungus and phosphorus dissolving bacteria and rhizobia on the growth of tobacco seedlings[J]. Tobacco Science & Technology, 2000(2): 43–44. |
| [14] |
李玉娥, 姚拓, 荣良燕. 溶磷菌溶磷和分泌IAA特性及对苜蓿生长的影响[J].
草地学报, 2010, 18(1): 84–88.
Li Y E, Yao T, Rong L Y. Characteristics of IAA secretion and phosphate dissolving of phosphate-solubilizing bacteria and its effect on alfalfa growth[J]. Acta Agrestia Sinica, 2010, 18(1): 84–88. |
| [15] | Nautiyal C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiology Letters, 1999, 170(1): 265–270. DOI:10.1111/fml.1999.170.issue-1 |
| [16] |
胡晓峰, 郭晋云, 张楠, 等. 一株溶磷抑病细菌的筛选及其溶磷特性[J].
中国农业科学, 2010, 43(11): 2253–2260.
Hu X F, Guo J Y, Zhang N, et al. Screening of a phosphate solubilizing and disease inhibiting bacteria strain and studies on its P-solubilizing characteristics[J]. Scientia Agricultura Sinica, 2010, 43(11): 2253–2260. |
| [17] | Elizabeth P, Miguel S, Maria M, et al. Isolation and characterization of mineral phosphate-solubilizing bacteria naturally colonizing a limonitic crust in the south-eastern Venezuelan region[J]. Soil Biology & Biochemistry, 2007, 39: 2905–2914. |
| [18] | Harris J N, New P B, Martin P M. Laboratory tests can predict beneficial effects of phosphate-solubilising bacteria on plants[J]. Soil Biology and Biochemistry, 2006, 38(7): 1521–1526. DOI:10.1016/j.soilbio.2005.11.016 |
| [19] | Kamilova F, Validov S, Azarova T, et al. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria[J]. Environmental Microbiology, 2005, 7(11): 1809–1817. DOI:10.1111/emi.2005.7.issue-11 |
| [20] | Tan S Y, Yang C L, Mei X L, et al. The effect of organic acids from tomato root exudates on rhizosphere colonization of Bacillus amyloliquefaciens T-5[J]. Applied Soil Ecology, 2013, 64: 15–22. DOI:10.1016/j.apsoil.2012.10.011 |
| [21] | Ling N, Raza W, Ma J H, et al. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere[J]. European Journal of Soil Biology, 2011, 47(6): 374–379. DOI:10.1016/j.ejsobi.2011.08.009 |
| [22] | Lugtenberg B J J, Dekkers L, Bloemberg G V. Molecular determinants of rhizosphere colonization by Pseudomonas[J]. Annual Review of Phytopathology, 2001, 39: 461–490. DOI:10.1146/annurev.phyto.39.1.461 |
| [23] | Bais H P, Weir T L, Perry L G, et al. The role ofroot exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57: 233–266. DOI:10.1146/annurev.arplant.57.032905.105159 |
| [24] |
张小兰. 根际高效溶磷菌的筛选及其适应根际的机理研究[D]. 南京:南京农业大学硕士学位论文, 2014.
Zhang X L. Screening of rhizosphere efficient phosphate solubilizing bacteria and its mechanisms suitable for the rhizosphere[D]. Nanjing:MS thesis of Nanjing Agricultural University, 2014. |
| [25] |
张小兰, 韦中, 梅新兰, 等. 一种基于根际定殖能力筛选溶磷菌的方法[J].
南京农业大学学报, 2014, 37(2): 79–84.
Zhang X L, Wei Z, Mei X L, et al. A method for screening phosphate solubilizing bacteria based on the rhizosphere colonization ability of strains[J]. Journal of Nanjing Agricultural University, 2014, 37(2): 79–84. |
| [26] |
吕德国, 于翠, 秦嗣军, 等. 本溪山樱根部解磷细菌的定殖规律及其对植株生长发育的影响[J].
中国农业科学, 2008, 41(2): 508–515.
Lü D G, Yu C, Qin S J, et al. Colonization regulation pattern of phosphobacteria and its effect on the growth and development of cerasus sachalinensis[J]. Scientia Agricultura Sinica, 2008, 41(2): 508–515. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

