Na+常常被认为是造成作物盐碱危害的主要离子,其可通过渗透胁迫引起营养元素的缺乏,易造成活性氧清除酶(如SOD、POD等)失活,置换细胞膜中的Ca2+,引起膜脂、蛋白质、核酸等的降解,破坏细胞组分,进而影响植株生长发育[1-3]。但近年来研究表明,很多植株的生长需要一定量的Na+以维持渗透压、促进碳水化合物代谢等,且Na+能够提高一些作物的叶面积指数、增加光截获能力,以及具有替代植株其他营养元素(如K+)的作用[4-7]。前人研究已证实,Na+对作物的抑制作用与营养生理状况有很大关系,而缺氮胁迫是其中一个重要的因素[8-9]。由于土壤供给能力、氮肥利用效率及品种等方面的差异,作物缺氮胁迫现象时有发生[10-11]。缺氮胁迫下作物生长发育一方面会受到显著抑制,另一方面作物自身也会产生一系列生理生化的适应性变化[12-13]。由此可见,缺氮胁迫下Na+对作物生长发育的影响需要研究予以证实。
花生是我国重要的油料作物、经济作物,在国民生产中有重要的作用[14-15]。生产中,花生可通过肥料及土壤吸收一定量的Na+,特别是使用叶面施肥过程中,一些含Na+成分(EDTA-Na2、氯化钠、亚硫酸氢钠、四水八硼酸钠、复硝酚钠、硝普钠和葡萄糖酸钠等)随营养元素一起喷施在叶面而进入植株体内[16-19]。对此,大多数研究仅关注该肥料中营养元素(如N、P、K等)的吸收利用状况,而Na+对花生的真实影响却鲜有报道。Na+对花生的作用可能与其施入量(或浓度)有关,且较高Na+施入量会对花生生长造成不利影响[20-21]。这种不利影响可能首先表现在叶片受损、养分吸收受到抑制、光合产物下降,而地下部根系发育是否受到抑制还不明确。作者前期研究结果发现叶面喷施氮素能够显著改善花生的叶面积、SPAD值及净光合速率,这主要由于氮素是花生蛋白质和核酸的组成元素,又是光合作用所必需的叶绿素、各种代谢调控酶、激素的构成元素[22-23]。然而,叶面喷施Na+是否会对花生产生抑制作用以及这种抑制能否通过补施氮素缓解,有待于深入研究。
本文利用人工气候室盆栽试验,研究了缺氮素胁迫下含不同浓度Na+叶面肥对花生光合作用、干物质累积、根系形态及养分吸收的影响差异。同时,比较了补施氮素对各处理的作用效果,以探究叶面喷施氮肥能否消除或缓解Na+的影响,以及对花生的光合作用和生长发育的恢复效应。本研究的开展可为花生高效合理施肥提供理论依据。
1 材料与方法 1.1 试验材料花生品种为山东省花生研究所培育的花育20号,该品种为小花生类型。试验喷施液中钠来源于氢氧化钠,氮来源于尿素,磷、钾来源于磷酸二氢钾,三种化学试剂均为上海国药集团生产。供试土壤采自于山东省花生研究所莱西试验农场,土壤类型为棕壤,pH值为5.1、有机质11.6 g/kg、速效磷26.5 mg/kg、碱解氮56.3 mg/kg、速效钾70.0 mg/kg。
1.2 试验设计盆栽试验于2014年11月27日到2015年2月2日在山东省花生研究所人工气候室开展,气候室内昼夜温度为28℃/22℃、相对湿度65%/70%。试验盆钵直径15 cm、高20 cm,每盆用土2.1 kg,盆内土壤不施基肥。每盆播入3粒花生种,在齐苗后间苗,保留2棵长势均匀的花生苗。盆栽试验每2天浇水1次,按最大田间持水量的75%左右保持土壤含水量。
2014年12月22日(四叶期)开始叶面喷施含氢氧化钠及磷酸二氢钾溶液,每周喷1次,共喷施3次;试验喷施的Na及N、P、K含量状况见表 1。试验处理T0喷施液的pH值为5.0;T1处理以T0为基础,喷施液中加Na量为2.0 mg/pot (每次喷施Na 8.5 mL、0.08 mg/mL),喷施液pH值为6.0;T2处理加Na量为10.0 mg/pot (每次喷施Na 8.5 mL、0.4 mg/mL),喷施液pH值为7.0。其中,T2处理叶面肥中Na+浓度依据常见含钠叶面肥喷施状况(0.4‰)设定。从2015年1月12日(七叶期)开始,一半盆栽喷施蒸馏水(T0、T1和T2处理),一半盆栽喷施氮素(T0-N、T1-N和T2-N处理),每周1次,共喷施3次,各试验处理均重复3次。
| 表1 处理编号及叶面喷施元素量(mg/pot) Table 1 Treatment code and element for spraying solution |
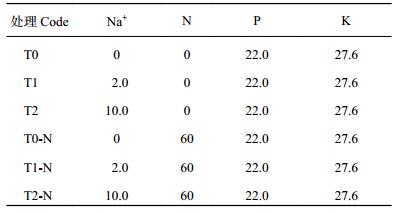 |
2015年2月2日先利用CIRAS-3光合仪(PP Systems公司,美国)测定花生叶片净光合速率。然后取整株花生,将其分为根部和茎叶部。根部用WinRHIZO根系分析系统(Regent Instruments公司,加拿大)测定根长度、根表面积、根体积等根系形态参数[24]。植株根和茎叶烘干后,测定干物重;然后样品粉碎磨细,用H2SO4-H2O2进行消化,依次测定N、P、K和Na含量[25]。
1.4 数据处理采用Sigmaplot10.0作图,花生干物重、根系形态特性、NPK和Na含量用SAS 8.0软件进行各处理之间差异显著性分析(ANOVA)和各指标之间相关显著性分析。
2 结果与分析 2.1 花生地上部干物质累积及净光合速率变化缺氮胁迫下,喷施高Na+叶面肥可显著抑制花生净光合速率及干物质累积(图 1)。T0处理净光合速率为CO2 11.4 μM/(m2·s),喷施Na+叶面肥显著下降到CO2 6.7~7.5 μM/(m2·s)(T1和T2处理)。花生地上部茎叶干物重随着Na+增加而逐渐下降,T0、T1和T2处理分别为6.4、5.7和5.3 g/pot。然而,补施氮素条件下,加入Na+处理T1-N和T2-N (8.4和8.1 g/pot)地上部茎叶干物重却显著高于不加Na+处理T0-N (6.7 g/pot)。同时,净光合速率各处理没有显著差异,且以T2-N较高。在缺氮胁迫条件下,随着叶面肥Na+增加,花生干物质重量受到显著抑制,而后期补充喷施氮素可缓解Na+的抑制,甚至表现出促进干物质累积的作用。
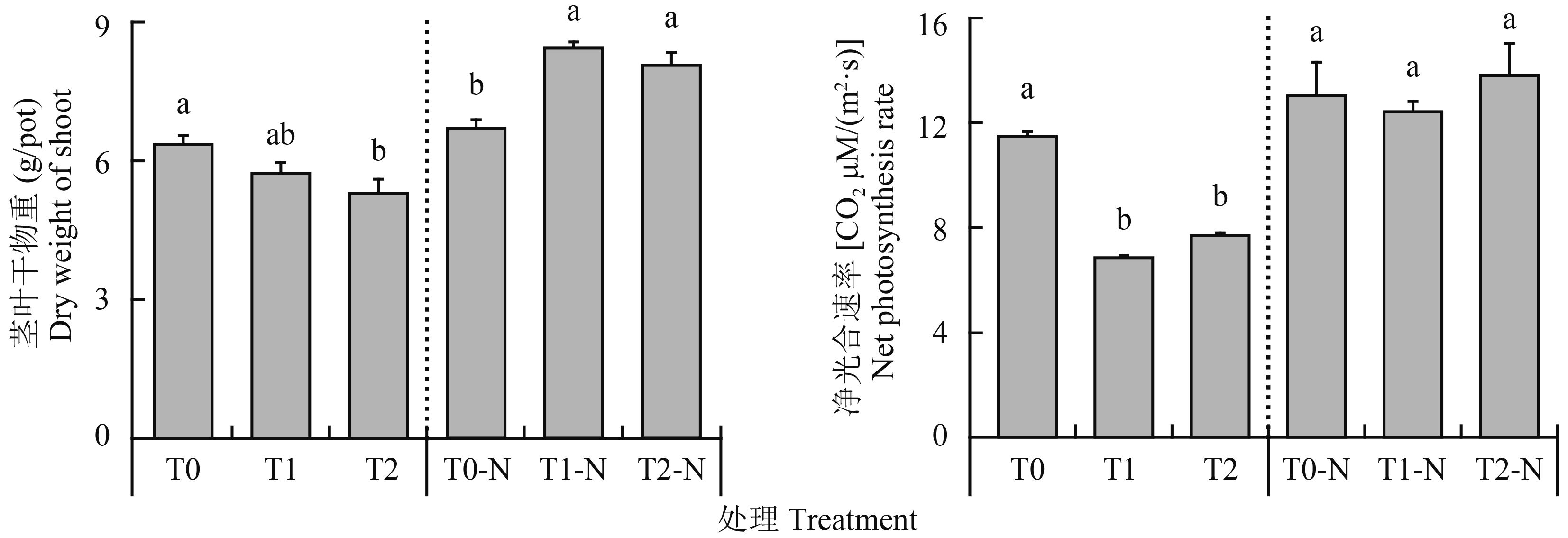 |
| 图1 花生茎叶干重及净光合速率变化 Fig. 1 Changes in dry weight of shoot and net photosynthesis rate [注(Note):柱上不同字母表示缺氮胁迫和补施氮肥各处理间差异达到5%显著性水平Different letters above the bars indicate significant differences at 5% level among different treatments without N supplement and with later supplement of N.] |
缺氮胁迫下,花生根重及形态对叶面肥中Na+的响应非常敏感(图 2)。根干重由T0的2.4 g/pot下降到T1的1.9 g/pot和T2的1.5 g/pot。补施氮素后,3个处理根干重T1-N高于T0-N和T2-N,T0-N降低到1.7 g/pot,而T1-N处理增加到2.1 g/pot,T2-N处理维持在1.5 g/pot。
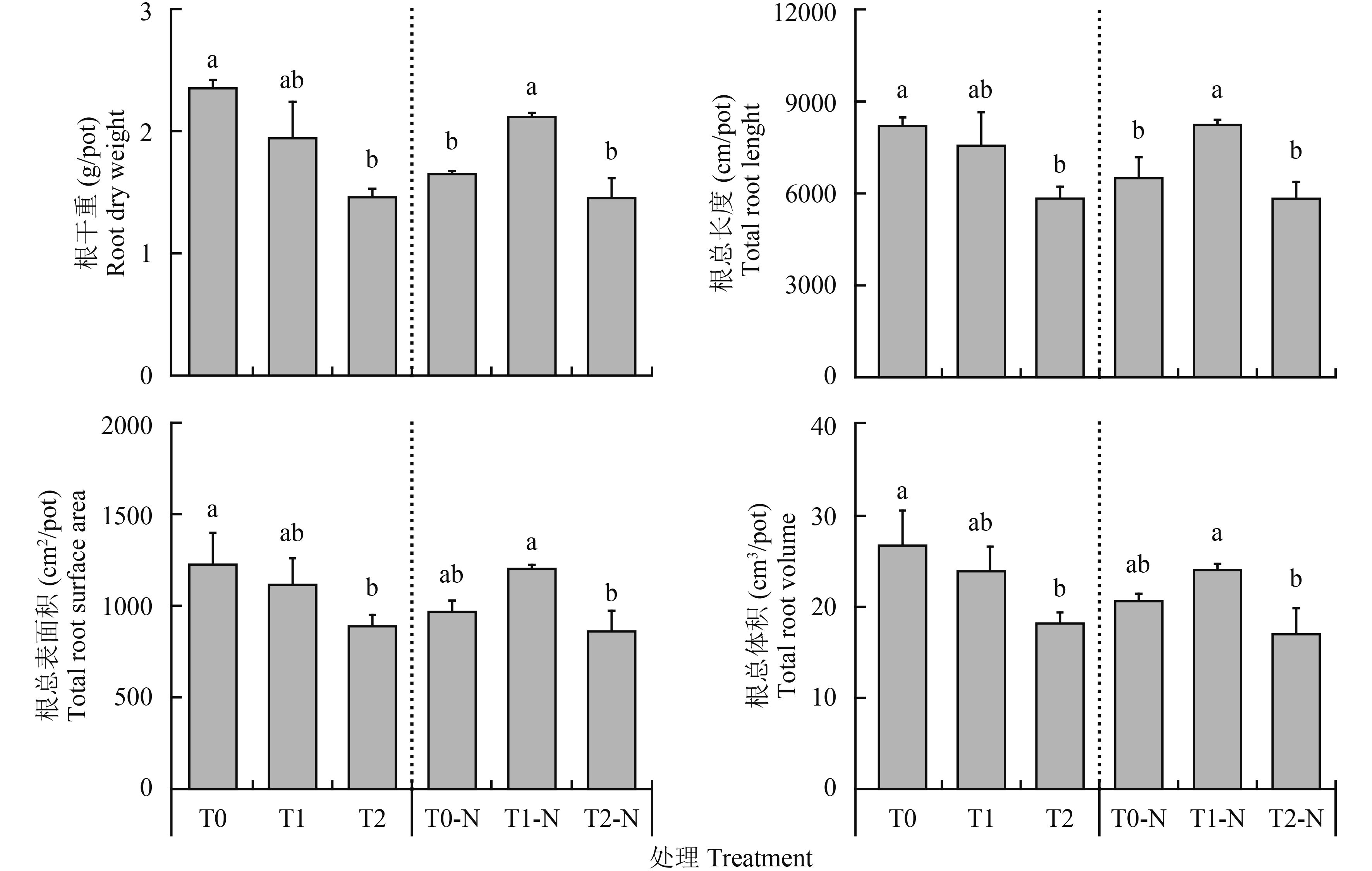 |
| 图2 花生根干重及总根系形态变化 Fig. 2 Changes in dry weight of root and root morphological peanut [注(Note):不同字母表示缺氮胁迫和补施氮肥各处理间差异达到5%显著性水平Different letters above the bars indicate significant differences at 5% level among different treatments without N supplement and with later supplement of N.] |
花生根系形态也有相同的变化特征(图 2)。在缺氮胁迫条件下,叶面肥加入Na+后,根总长度、根总表面积和根总体积都呈现下降趋势,T1比T0分别下降7.8%~10.5%,T2比T0分别显著下降了27.5%~31.8%。补施氮素后,T0-N根系形态受到抑制,根总长度、根总表面积和根总体积仍高于T2-N处理11.3%~21.4%,却比T1-N处理下降了14.2%~21.0%。
三个根系形态指标总量对叶面肥Na+的响应虽然相似,但从不同直径根系来看,在缺氮胁迫条件下,高Na+ (T2处理)对根长的抑制从细根( < 0.5 mm)开始,直径超过1.5 mm根系受其抑制作用较弱;而根表面积及根体积则从粗根( > 1.5 mm)开始,其受高Na+的抑制越来越大(图 3a1、图 3b1、图 3c1)。补施氮素下,低Na+ (T1-N)对根长的恢复也从细根( < 0.5 mm)开始,而根表面积和根体积的恢复则从粗根( > 1.5mm)开始(图 3a2、图 3b2、图 3c2)。
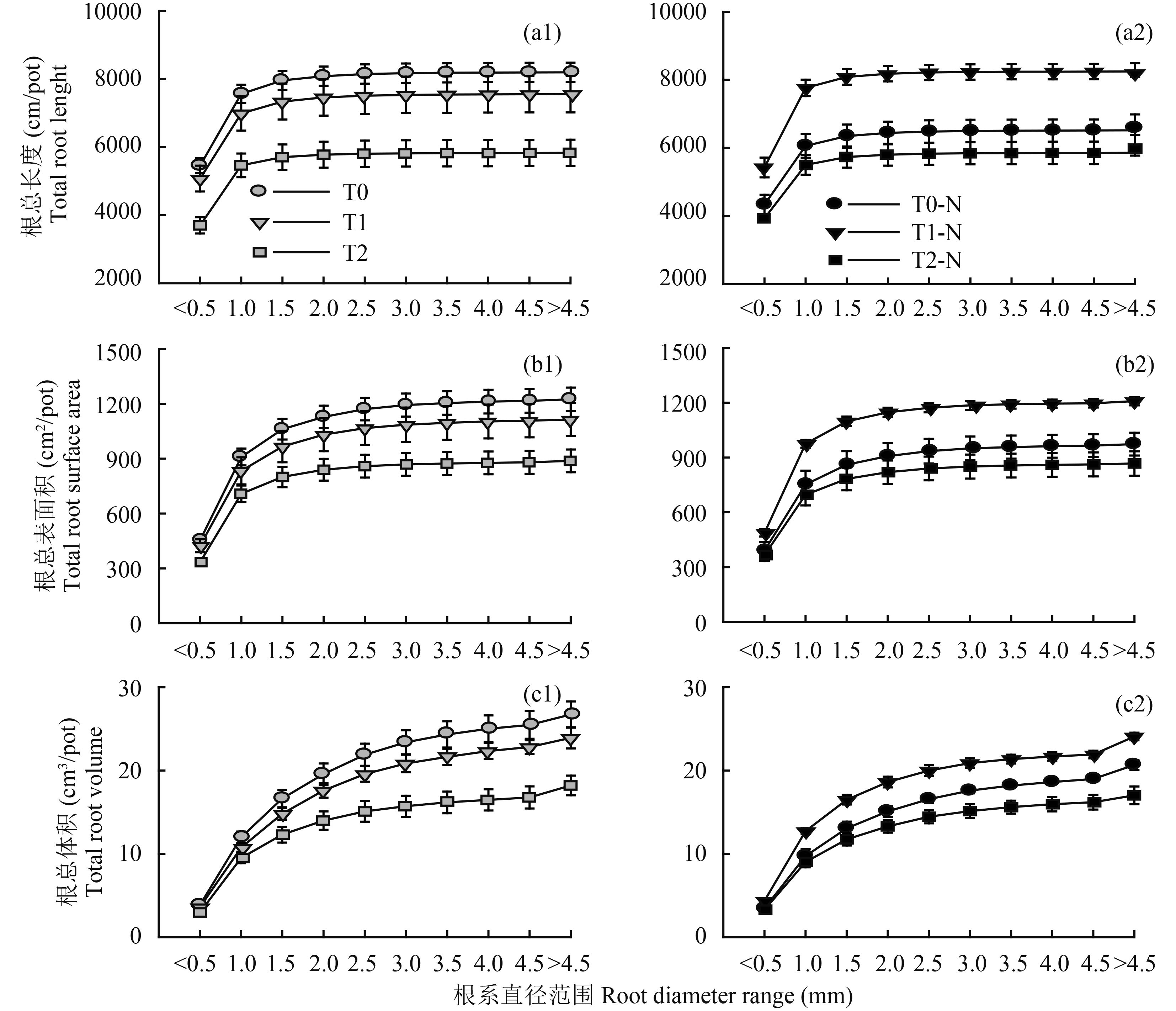 |
| 图3 花生根系在不同直径范围的累积动态变化 Fig. 3 Dynamics of root accumulations within different diameter range |
叶面喷施Na+显著提高了茎叶对钠的吸收,缺氮胁迫下高Na+处理(T2)茎叶钠吸收量显著高于T1和T0处理(图 4),补施氮素下植株钠含量表现为:T2-N > T1-N、T0-N。缺N胁迫下Na+对茎叶N的吸收也产生了显著影响,各处理茎叶氮素吸收量分别为T0 (144.1 mg/pot) > T1 (132.0 mg/pot) > T2 (115.4 mg/pot)。补施氮素后,三个处理茎叶氮吸收量都显著增加,而处理间以T1-N (251.1 mg/pot)最高,T2-N (230.0 mg/pot)次之,T0-N (210.7 mg/pot)最低。对于茎叶磷、钾,缺氮胁迫下T1和T2处理与T0处理相比有下降趋势,但没有达到显著差异水平。然而,补施氮素下施Na+处理尤其高Na+处理显著高于不喷Na+处理,T2-N处理比T0处理磷吸收量和钾吸收量分别显著增加42.3%和24.0%。
 |
| 图4 花生茎叶和根中钠及氮、磷、钾含量 Fig. 4 Contents of Na, N, P and K in shoot and root of peanut [注(Note):方柱上和方柱下不同字母分别表示缺氮胁迫和补施氮素后各处理间茎叶和根的含量差异达到5%显著性水平Different letters above the bars and below the bars indicate significant differences at 5% level among different treatments without N supplement and with later supplement of N for shoot and root, respectively.] |
在缺氮胁迫条件下,花生根系对Na的吸收量在喷施Na+后略有增加,但未达到显著差异;补施氮素后,各处理根的Na吸收量都下降至0.42 mg/pot左右。根系对N、P、K的吸收量与根干重相似,随着喷施Na+浓度增加呈下降趋势,T0处理根的N、P、K吸收量大于T1和T2处理。补施N素促进了低Na+处理(T1-N)根部对N、P、K的吸收,其吸收量总体高于其他两个处理(T0-N和T2-N)。
相关性分析表明,植株Na含量(根与茎叶总吸收量)与干物重在缺氮胁迫条件下呈显著负相关关系(r=0.69*),若每盆花生Na吸收量增加1.0 mg,干物重将下降1.2 g,同时花生氮、钾吸收量也显著下降26.6 mg和20.9 mg,而磷素的响应并不明显(图 5)。补施氮素下,花生植株干物重及营养状况与Na吸收却呈正相关关系,其中Na与植株干物重(r=0.65*)、磷含量(r=0.71*)和钾含量(r=0.80**)相关性达显著水平(P < 0.05)。
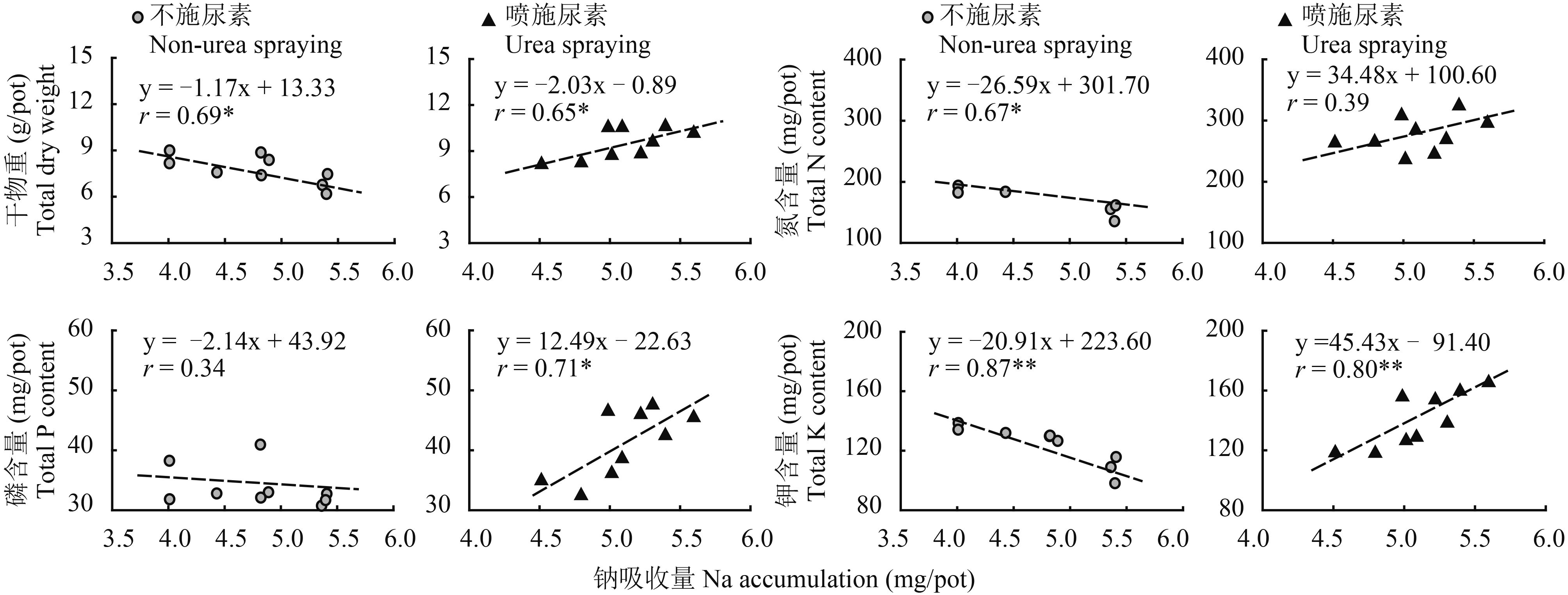 |
| 图5 花生钠吸收量与干物质累积及氮磷钾营养的相关关系 Fig. 5 Relations between Na accumulation and dry weight of plant and N, P, K contents in peanut |
含Na+叶面肥对花生的影响在缺氮胁迫条件下表现为抑制作用,且这种抑制对于高Na+量处理更为显著。喷施的Na+随气孔或胞间连丝进入植株体内,易产生渗透胁迫,致使植株体内的一些必需营养元素缺乏[1]。由于Na+与K+可竞争结合酶复合物的结合点位,以及Na+同带正电荷的K+、NH4+产生的阳离子易产生一定竞争作用[26],因而本研究中花生钠含量与氮、钾含量呈显著负相关关系,而与磷含量关系不显著(H2PO4-、HPO42-带负电荷)。笔者前期研究证实,喷施液由pH 5增加到pH 7后,花生磷的吸收浓度增加,而总磷吸收量没有显著增加[24]。随着植株吸收的钠量增加,花生氮、钾(尤其是氮素)吸收受抑制更为显著,这就使得花生的光合作用受限、净光合速率显著下降。事实上,不仅地上部茎叶在喷施含Na+溶液后干物重显著下降,地下部根系的发育也受到显著抑制,根的长度、表面积及体积也显著下降。茎叶及根系生长受到抑制除了上述原因外,Na累积能够导致花生体内蛋白质和核酸的代谢不能正常进行,从而使得一些有毒次生产物(如游离氨基酸、胺等)产生,进而影响花生生长发育及干物质累积,且这些抑制作用在缺氮胁迫下表现更为明显。
后期补充喷施氮素后,花生受Na+胁迫现象消除。叶面氮肥可通过增加叶绿素含量,提升光系统PSII反应中心内部光能转换效率等,促使叶片光合作用的恢复[23, 27]。同时,氮素是蛋白质、氨基酸、核酸等重要组成成分,叶面氮肥也显著改善了作物营养,从而促进了干物质的累积[28-31]。相关性分析表明,花生对Na的吸收在补施氮素下甚至与干物质累积,N、P、K含量呈正相关关系。对于茎叶的干物重,补施氮素和含Na+肥料比单独补施氮素显著增加,根的干物重也以喷施Na+溶液和氮素最高。有研究表明,Na+能够提高植株体中硝酸还原酶的活性及叶绿体对丙酮酸盐的吸收,推进光合磷酸化过程[6, 32-33]。另外,氮肥的施用在促进花生生长发育及干物质累积的同时,对植株体内Na+的抑制作用也起到一定的稀释效应。因而,喷施Na+结合氮肥显著促进了花生的干物质累积及养分吸收。可见,Na+对花生生长及养分吸收影响与氮素水平有很大关系,后期补施氮肥提高了植株对Na+的适应性,消除了Na胁迫的危害作用,产生“N-Na”协同效应。
4 结论叶面喷施含Na+肥料在缺氮胁迫条件下抑制了花生的光合作用、干物质累积及氮、钾养分吸收,这种抑制随着喷施Na+含量增加而更显著。后期补施氮肥后,这种抑制作用能够及时消除,花生的光合作用恢复、干物质累积和氮、磷、钾养分吸收显著增加。
| [1] |
曲元刚, 赵可夫. NaCl和Na2CO3对盐地碱蓬胁迫效应的比较[J].
植物生理与分子生物学报, 2003, 29(5): 387–394.
Qu Y G, Zhao K F. Comparision of the stress effects of NaCl and Na2CO3 on Suaeda salsa L[J]. Journal of Plant Physiology and Molecular Biology, 2003, 29(5): 387–394. |
| [2] | Surekha K A, Paul V, Zhu J K. Mechanisms of tolerance in plants [M]. Beijing: Tsinghua University Press, 2005: 44-45. |
| [3] |
蔡建一, 马清, 周向睿, 等. Na+在霸王适应渗透胁迫中的生理作用[J].
草业学报, 2011, 20(1): 89–95.
Cai J Y, Ma Q, Zhou X R, et al. Physiological role of Na+ in adaption of Zygophyllum xanthoxylum to osmotic stress[J]. Acta Prataculturae Sinica, 2011, 20(1): 89–95. |
| [4] | Sobbarao G V, Ito O, Berry W L, et al. Sodium-a functional plant nutrient[J]. Critical Reviews in Plant Sciences, 2003, 22: 391–416. |
| [5] |
郑小林, 钟炳辉, 陈荣清. 钾、钠离子对富钾植物离体叶片气孔运动的影响[J].
西北植物学报, 2004, 24(2): 320–323.
Zheng X L, Zhong B H, Chen R Q. Effect of K+, Na+ on isolated leaves' stomatal movement of rich potassium plants[J]. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(2): 320–323. |
| [6] |
李三相, 周向睿, 王锁民. Na+在植物中的有益作用[J].
中国沙漠, 2008, 28(3): 485–490.
Li S X, Zhou X R, Wang S M. Positive functions of sodium in plants[J]. Journal of Desert Research, 2008, 28(3): 485–490. |
| [7] |
雷晶, 郝艳淑, 王典, 等. 钠钾替代对不同基因型棉花钾利用效率的影响[J].
植物营养与肥料学报, 2015, 21(4): 962–968.
Lei J, Hao Y S, Wang D, et al. Substitution effect of sodium and potassium on potassium use efficiency of different cotton genotypes[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(4): 962–968. |
| [8] |
逄焕成, 杨劲松, 谢晓红. 氯化钠胁迫下施氮对冬小麦生长发育及体内氯、钠离子积累的影响[J].
植物营养与肥料学报, 2005, 11(5): 654–658.
Pang H C, Yang J S, Xie X H. Effects of nitrogen fertilization on growth and vivo Cl- and Na+ accumulation of winter wheat under NaCl stress[J]. Plant Nutrition and Fertilizer Science, 2005, 11(5): 654–658. |
| [9] |
张智猛, 万书波, 宁堂原, 等. 氮素水平对花生氮素代谢及相关酶活性的影响[J].
植物生态学报, 2008, 32(6): 1407–1416.
Zhang Z M, Wan S B, Ning T Y, et al. Effects of nitrogen on nitrogen metabolism and correlation enzyme activity in peanut[J]. Journal of Plant Ecology, 2008, 32(6): 1407–1416. |
| [10] |
赵平, 孙谷畴, 彭少麟. 植物氮素营养的生理生态学研究[J].
生态科学, 1998, 17(2): 37–42.
Zhao P, Sun G C, Peng S L. Ecophysiological research on nitrogen nutrition of plant[J]. Ecologic Science, 1998, 17(2): 37–42. |
| [11] |
曹翠玲, 李生秀, 苗芳. 氮素对植物某些生理生化过程影响的研究进展[J].
西北农业大学学报, 1999, 27(4): 96–101.
Cao C L, Li S X, Miao F. The research situation about effects of nitrogen on certain physiological and biochemical process in plants[J]. Acta Universitatis Agriculturalis Boreali-Occidentalis, 1999, 27(4): 96–101. |
| [12] |
林郑和, 陈荣冰, 陈常颂. 植物对氮胁迫的生理适应机制研究进展[J].
湖北农业科学, 2011, 50(23): 4761–4764.
Lin Z H, Chen R B, Chen C S. Research progress on physiological adaptability of plants to nitrogen deficiency[J]. Hubei Agricultural Sciences, 2011, 50(23): 4761–4764. |
| [13] |
李梁, 黄剑华, 陈志伟, 等. 作物耐低氮的相关生物学研究进展[J].
上海农业学报, 2012, 28(2): 117–122.
Li L, Huang J H, Chen Z W, et al. Progress of biological research on crops tolerant to low nitrogen[J]. Acta Agriculturae Shanghai, 2012, 28(2): 117–122. |
| [14] |
万书波.
中国花生栽培学
[M]. 上海: 上海科学技术出版社, 2003: 252-262.
Wan S B. China peanut cultivation [M]. Shanghai: Shanghai Scientific and Technical Press, 2003: 252-262. |
| [15] |
王才斌, 万书波.
花生生理生态学
[M]. 北京: 中国农业出版社, 2011.
Wang C B, Wan S B. Peanut physiological ecology [M]. Beijing: China Agriculture Press, 2011. |
| [16] |
胡哲森, 时忠杰, 许长钦. 亚硫酸氢钠对油茶光合机构的生理效应研究[J].
林业科学, 2001, 37(Special 1): 68–71.
Hu Z S, Shi Z J, Xu C Q. Phosiological effect of sodium bisulfate on photosynthetic apparatus of Camellia oleifera[J]. Scientia Silvae Sinicae, 2001, 37(Special 1): 68–71. |
| [17] |
李瑞海.不同配方叶面肥对作物生长的影响[D].南京:南京农业大学硕士学位论文. 2008.
Li R H. Effects of different formulas of foliar fertilizers on crop growth [D]. Nanjing: MS Thesis of Nanjing Agricultural University. 2008. |
| [18] |
李红利, 王俊玲, 薛占军, 等. 硝普钠对韭菜叶片硝酸盐累积及营养品质的影响[J].
河北农业大学学报, 2014, 37(4): 53–57.
Li H L, Wang J L, Xue Z J, et al. Effects of sodium nitroprusside (SNP) on nitrate accumulation and nutritional quality in the leaves of Chinese chive[J]. Journal of Agricultural University of Hebei, 2014, 37(4): 53–57. |
| [19] |
于会丽, 林治安, 李燕婷, 等. 喷施小分子有机物对小油菜生长发育和养分吸收的影响[J].
植物营养与肥料学报, 2014, 20(6): 1560–1568.
Yu H L, Lin Z A, Li Y T, et al. Effects of spraying low molecular organic compounds on growth and nutrients uptake of rape (Brassica Chinensis L.)[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(6): 1560–1568. |
| [20] |
杨劲松.作物对不同盐胁迫和调控条件的响应特征与抗盐性调控研究[D].南京:南京农业大学博士学位论文. 2006.
Yang J S. Characteristics of crop response on different salt stresses/management and the regulation of crop salt resistance [D]. Nanjing: PhD Dissertation of Nanjing Agricultural University. 2006. |
| [21] |
慈敦伟, 张智猛, 丁红, 等. 花生苗期耐盐性评价及耐盐指标筛选[J].
生态学报, 2015, 35(3): 805–814.
Ci D W, Zhang Z M, Ding H, et al. Evaluation and selection indices of salinity tolerance in peanut seedling[J]. Acta Ecologica Sinica, 2015, 35(3): 805–814. |
| [22] |
万书波.
花生品种改良与高产优质栽培
[M]. 北京: 中国农业出版社, 2008.
Wan S B. Peanut variety improvement and high-yield and high-quality cultivation [M]. Beijing: China Agriculture Press, 2008. |
| [23] |
罗盛, 杨友才, 沈浦, 等. 花生氮素吸收、根系形态及叶片生长对叶面喷施尿素的响应特征[J].
山东农业科学, 2015(10): 45–48.
Luo S, Yang Y C, Shen P, et al. Characteristics of peanut nitrogen uptake, root morphology and leaf growth to foliar-spraying urea[J]. Shandong Agricultural Sciences, 2015(10): 45–48. |
| [24] |
沈浦, 罗盛, 吴正锋, 等. 花生磷吸收分配及根系形态对不同酸碱度叶面磷肥的响应特征[J].
核农学报, 2015(12): 2418–2424.
Shen P, Luo S, Wu Z F, et al. Response of P absorption-allocation rate and root morphology of peanut to P foliar fertilizers with different acidities[J]. Journal of Nuclear Agricultural Sciences, 2015(12): 2418–2424. |
| [25] |
鲍士旦.
土壤农化分析
(第三版)[M]. 北京: 中国农业出版社, 2000.
Bao S D. Soil and agricultural chemistry analysis (3rd Edition)[M]. Beijing: China Agriculture Press, 2000. |
| [26] | Schachtman D P, Schroeder J I. Structure and transport mechanism of a high-affinity potassium uptake transporter from higher plants[J]. Nature, 1994, 370(6491): 655–658. DOI:10.1038/370655a0 |
| [27] |
许大全.
光合作用效率
[M]. 上海: 上海科学技术出版社, 2002.
Xu D Q. Photosynthesis efficiency [M]. Shanghai: Shanghai Science and Technology Press, 2002. |
| [28] |
李燕婷, 李秀英, 肖艳, 等. 叶面肥的营养机理及应用研究进展[J].
中国农业科学, 2009, 42(1): 162–172.
Li Y T, Li X Y, Xiao Y, et al. Advances in study on mechanism of foliar nutrition and development of foliar fertilizer application[J]. Scientia Agricultura Sinica, 2009, 42(1): 162–172. |
| [29] |
梁雄, 彭克勤, 杨毅. 叶面施肥对花生光合作用和植物激素的影响[J].
作物研究, 2011, 25(1): 15–18.
Liang X, Peng K Q, Yang Y. Effect of foliage spraying on photosynthetic indexes and plant hormones of peanut at blossom stage[J]. Crop Research, 2011, 25(1): 15–18. |
| [30] |
吴正锋.花生高产高效氮素养分调控研究[D].北京:中国农业大学博士学位论文, 2014.
Wu Z F. Nitrogen management for high yield and high efficiency of peanut [D]. Beijing: PhD Dissertation of China Agricultural University, 2014. |
| [31] |
李灿东, 郭泰, 王志新, 等. 叶面氮素施量对大豆氮素吸收与分配的影响[J].
植物营养与肥料学报, 2015, 21(5): 1361–1365.
Li C D, Guo T, Wang Z X, et al. Effects of leaf nitrogen application on soybean nitrogen uptake and distribution[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(5): 1361–1365. |
| [32] | Terry N, Ulrich A. Effects of potassium deficiency on the photosynthesis and respiration of leaves of sugar beet[J]. Plant Physiology, 1973, 51: 783–786. DOI:10.1104/pp.51.4.783 |
| [33] |
邹邦基. 钠的植物营养与生理生态[J].
植物生理学通讯, 1985, 5: 5–11.
Zou B J. Plant nutrition and physiological ecology of sodium[J]. Plant Physiology Communications, 1985, 5: 5–11. |
 2016, Vol. 22
2016, Vol. 22  doi:
doi: 

