有机磷为土壤磷库的重要组成部分,根据不同土壤类型,土壤中20%~80%的磷是以有机磷的形式存在,有机磷成为土壤磷库的重要组成部分,土壤有机磷主要为植酸、磷脂和核酸等形态,其中植酸态有机磷大约占50%左右[1-3]。植酸态有机磷不能被植物直接吸收利用,为无效态磷素,但研究表明,以植酸态磷为磷源时作物能正常生长,说明植酸态有机磷可作为作物吸收的潜在磷源[4-5]。目前,磷高效品种或基因型对土壤无机磷吸收利用特征的研究较为系统[6-8],而对土壤有机磷的研究仍有待探讨。
磷在土壤中主要以扩散方式移动,距离短,移动速率低,极易造成植物根际磷素亏缺[9]。根系作为植物养分吸收的主要器官,低磷胁迫下首先感受到胁迫信号。在磷素亏缺压力下,作物会做出一系列的适应机制来维持正常生长完成生命周期,如生长适应和生理适应[10-11]。生长适应性包括根系形态构型的改变,根系形态构型绝大程度上决定了根系在土壤中的空间分布和与土壤的直接接触面积,最大根长、根表面积、根密度、根轴角度等因素决定了作物的养分吸收效率[12-14]。Hammond等[14]对甘蓝根系形态构型的研究表明,低磷胁迫下磷素吸收与总根长、侧根长、侧根数量、根表面积和根体积有直接关系。根系生理性适应机制主要包括分泌质子、有机酸、磷酸酯酶等。该机制通过提高作物生长介质中的磷素有效性,提高作物对磷素的吸收效率,从而使得作物适应低磷胁迫[16-17]。低磷胁迫下,磷高效植物根系细胞内及分泌磷酸酯酶量较多,活性较高,利于提高根际微域内有机磷的矿化水解[8]。
综上所述,探讨有机磷处理条件下植物的根系响应特征对于提高植物吸收磷素能力具有重要意义。大麦是重要的谷类作物之一,种植遍布世界各地,在世界作物产量中排名第五位[18],种植面积约5600万公顷,总产约1.2亿吨,我国种植面积约为2438万亩[19],广泛应用于饲料及食品工业,也是酿造啤酒的主要原料[18, 20]。本研究在以前期筛选得到的两种不同磷效率基因型野生大麦为供试材料,以植酸钠为有机磷源,通过水培试验,在不同有机磷浓度下研究不同磷效率野生大麦不同径级根的长度、表面积、体积等形态指标,以及根系及其分泌的酸性磷酸酶、植酸酶活性等生理指标的变化,旨在探寻磷高效基因型野生大麦低磷胁迫下吸收利用植酸态有机磷的根系响应特征。
1 材料与方法 1.1 供试材料试验材料为野生大麦磷高效基因型IS-22-30、IS-22-25和磷低效利用基因型IS-07-07[21-22],由四川农业大学小麦研究所提供。
供试营养液为改良Hoagland营养液和阿农微量元素混合液,其中MgSO4·7H2O 0.65 mmol/L, KH2PO4 1 mmol/L, KCl 2 mmol/L, Ca (NO3)2·4H2O 2 mmol/L, K2SO4 0.75 mmol/L, H3BO3 1.0 × 10-3 mmol/L, MnSO4·H2O 1.0 × 10-3mmol/L, ZnSO4·7H2O 1.0 × 10-3 mmol/L, CuSO4·5H2O 5.0 × 10-4mmol/L, (NH4)6Mo7O24·4H2O 5.0 × 10-5 mmol/L和EDTA-Fe 0.1 mmol/L,均为分析纯试剂。有机磷源为植酸钠(分析纯),含P2O5 46.00%。
1.2 试验设计试验设5个供磷水平:0.1、0.2、0.3、0.4、0.5 mmol/L。有机磷源为植酸钠,每处理5次重复,随机排列。
提前将供试野生大麦种子在阳光下暴晒4 h。选取饱满一致的供试种子用体积分数10% H2O2表面消毒10 min,用蒸馏水洗净后温水浸种10 h。将种子铺在滤纸上置于恒温恒湿箱(温度35℃、湿度60%)中进行催芽,萌芽后的种子播于已消毒的珍珠岩育苗盘中,每天用一定量的蒸馏水浇灌,以保持一定湿度。出苗后用1/4浓度的营养液浇灌培养,二叶一心时选取长势一致幼苗去胚乳移栽至6 L塑料盆中,每盆5孔,每孔2株,用打孔的硬质泡沫板(厚度2 cm、孔径2 cm)和海绵固定幼苗,待幼苗生长正常时再间苗,每孔留苗1株。移入盆后,用1/2营养液培养,每7 d更换一次营养液并用气泵通气。三叶一心后改用完全营养液培养一周后按试验设计进行营养液培养。培养期间每5 d更换一次营养液,并每2小时间隙通气1次,每次2 h。同时每天用0.1 mol/L的HCl或NaOH调节营养液的pH到6左右,补充适量去离子水维持营养液体积为5 L。试验于2014年4~7月在四川农业大学教学科研农场有防雨设施的网室内进行。
1.3 样品采集与制备按试验设计处理后第30 d (拔节期)采样,自来水冲洗干净,蒸馏水润洗、擦干。样品分开处理,其中1株分为地上部和地下部,装入纸袋,于105℃下杀青30 min,70℃下烘至恒重,称重后粉碎制样,用于植株磷含量测定;1株完整根系作为鲜样,剪碎后在液氮中固定2 min,保存于-75℃冰箱,用于测定酸性磷酸酶和植酸酶活性;2株完整植株杀菌后分别用于收集根系分泌的酸性磷酸酶和根系分泌的植酸酶;1株完整根系,用于根系扫描。
1.4 测定项目及方法 1.4.1 植株样品磷浓度H2SO4-H2O2消化-钼锑抗比色法[23]。
1.4.2 根系酸性磷酸酶和植酸酶活性对硝基苯磷酸盐法和钼蓝比色法[24]。
1.4.3 根系分泌酸性磷酸酶和植酸酶活性对硝基苯磷酸盐法和钼蓝比色法[24]。
1.4.4根系形态Epson perfection V700 photo (Japan)扫描,WinRHIZO_Pro V2007d (Regent Instrument Inc., Canada)分析根系形态参数。
1.5 数据处理以不同部位干物质量与磷含量之积的总和表示植株磷素积累量。采用Microsoft Excel 2010和DPS v7.05软件对数据进行整理和统计分析,采用Duncan新复极差法进行差异显著性分析。用Origin 8.0软件绘图。
2 结果与分析 2.1 生物量和磷素积累量随着有机磷浓度增加,不同磷效率野生大麦生物量均有不同程度的增加(图 1)。当有机磷浓度达到0.4 mmol/L后,磷高效基因型IS-22-25和IS-22-30生物量不再随着有机磷浓度增加显著增加,而磷低效基因型IS-07-07在有机磷浓度为0.5 mmol/L时最大。各浓度条件下,磷高效基因型IS-22-25、IS-22-30生物量均显著高于低效基因型IS-07-07,高达33.7%~66.5%,而两高效基因型IS-22-30和IS-22-25间无差异。
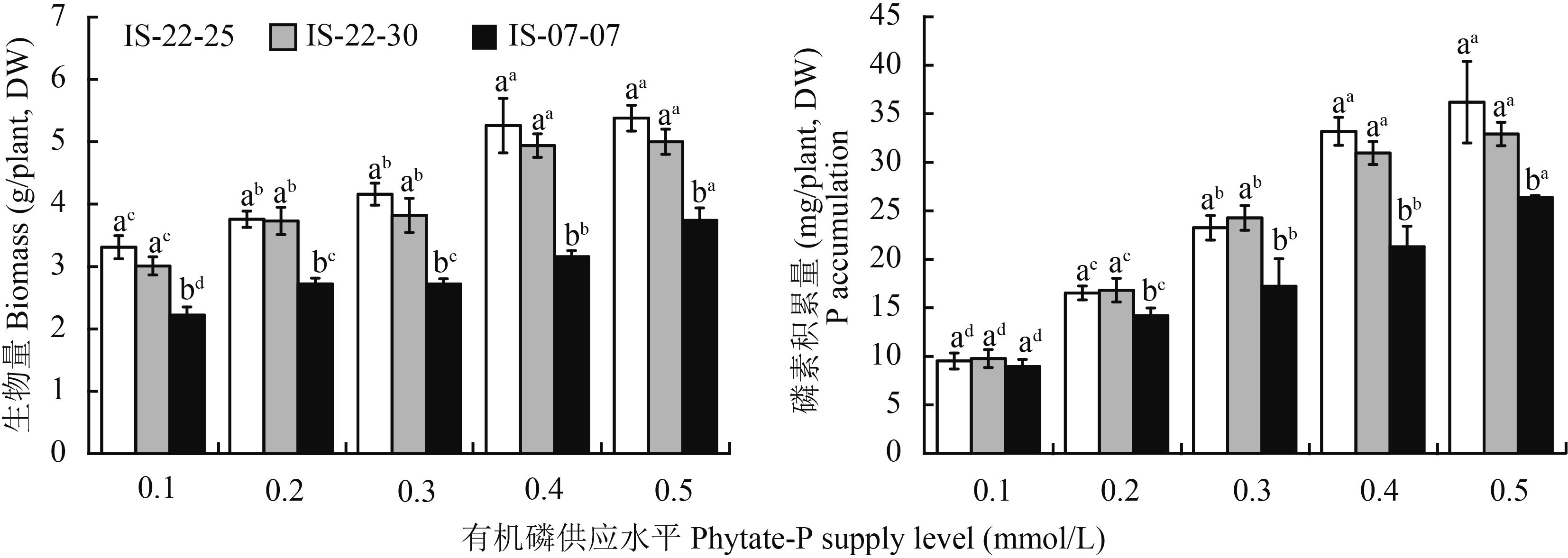 |
| 图1 不同有机磷供应水平下大麦生物量与磷素积累量 Fig. 1 Biomass and P accumulation of barley under different phytate-P supply levels [注(Note):柱上不同小写字母表示同一磷水平不同基因型间差异显著(P≤0.05),上标不同小写字母表示同一基因型不同磷水平差异显著(P≤0.05) Different small letters above the bars mean significant differences among genotypes at the same P concentration (P≤0.05), and different superscript small letters mean significant differences among P supply levels for the same genotype (P≤0.05).] |
随着有机磷浓度增加,不同磷效率野生大麦磷素积累量均有不同程度的增加,与生物量的增加趋势相似(图 1)。当有机磷浓度达到0.4 mmol/L,磷高效基因型IS-22-25和IS-22-30磷素积累量不再随着有机磷浓度增加显著增加,而磷低效基因型IS-07-07在有机磷浓度为0.5 mmol/L时最大。有机磷浓度为0.1 mmol/L时,不同磷效率野生大麦磷素积累量无显著性差异;其余磷供应水平下,磷高效基因型IS-22-25、IS-22-30均显著高于低效基因型IS-07-07,高出16.4%~55.7%。
2.2 根系形态特征 2.2.1 分级根长各有机磷浓度下,不同磷效率野生大麦根的总长度和不同分级范围内根的长度差异明显(表 1)。随着有机磷浓度增加,不同磷效率野生大麦根总长度逐渐减小,当有机磷浓度达到0.4 mmol/L后,磷高效基因型IS-22-25和IS-22-30根总长度不再随着有机磷浓度增加显著减小,而磷低效基因型IS-07-07在有机磷浓度为0.5 mmol/L时根总长度最小。不同磷效率野生大麦分级根长中均以直径(D) < 0.16 mm为主,占总根长的62.5%~70.1%,其次为0.16 mm≤D < 0.48 mm,D≥0.48 mm的根长占总根长比例最小。随着有机磷浓度增加,不同磷效率野生大麦三类分级根长均逐渐减小,当有机磷浓度达到0.4 mmol/L后,三类分级根长均不再显著减小。有机磷浓度为0.1、0.2和0.3 mmol/L时,磷高效基因型IS-22-25、IS-22-30根的总长度和不同分级范围内根的长度均显著高于低效基因型IS-07-07。磷高效基因型根的总长度较低效基因型高8.6%~60.4%,0.4 mmol/L和0.5 mmol/L时,不同基因型间根的总长度无显著性差异。基因型IS-22-25、IS-22-30和IS-07-07根总长度随着有机磷浓度增加分别减小了146.0%、139.7%和65.8%,D < 0.16 mm的根长分别减小了161.5%、156.8%和67.2%,0.16 mm≤D < 0.48 mm的根长分别减小了137.5%、132.3%和53.8%,D≥0.48 mm的根长分别减小了95.2%、88.0%和82.4%,磷高效基因型根总长度和不同分级范围内根长度的减小量明显高于低效基因型。可见,低浓度有机磷胁迫条件促进了野生大麦根系伸长,特别是D < 0.16 mm范围内的根,并且磷高效基因型野生大麦对低浓度有机磷反应的敏感性高于低效基因型。
| 表1 不同有机磷供应水平下大麦不同直径根长(mm) Table 1 Root length within different diameters of barley affected by phytate-P supply levels |
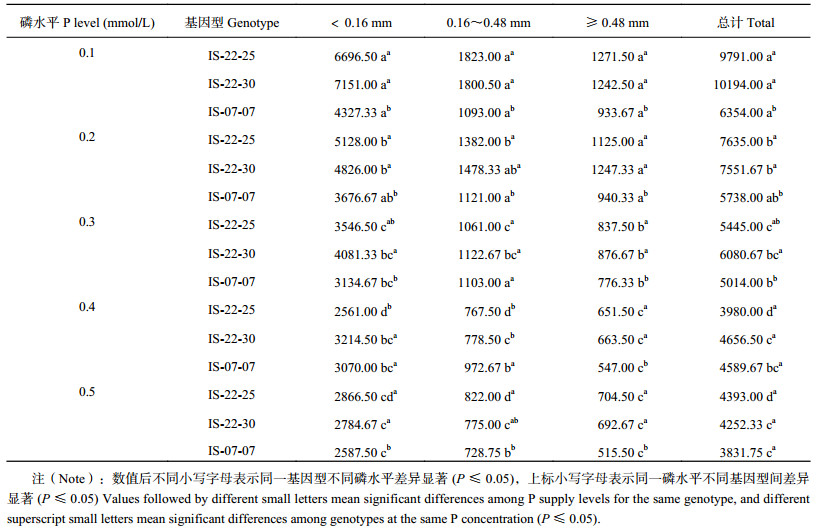 |
随着有机磷浓度增加,不同磷效率野生大麦根总表面积和不同分级范围内根表面积显著减小,当有机磷浓度达到0.4 mmol/L后,则不再呈现显著减小(表 2)。基因型IS-22-25、IS-22-30和IS-07-07根总表面积随着有机磷浓度增加分别减小了83.5%、117.5%和75.2%,D < 0.16 mm范围的根表面积分别减小了114.9%、147.1%和51.6%,0.16 mm≤D < 0.48 mm范围的根表面积分别减小了99.8%、152.4%和49.6%,D≥0.48 mm范围的根表面积分别减小了57.2%、75.6%和73.0%。磷高效基因型IS-22-25和IS-22-30在各有机磷浓度条件下根的总表面积均显著大于低效基因型IS-07-07,分别高出20.2%~36.8%和14.0%~46.4%。除了有机磷浓度为0.4 mmol/L,在其余各有机磷浓度时,磷高效基因型D < 0.16 mm范围的根表面积均显著大于低效基因型;有机磷浓度为0.1、0.2和0.3 mmol/L时,磷高效基因型0.16 mm≤D < 0.48mm范围的根表面积均显著大于低效基因型;各有机磷浓度条件下,磷高效基因型D≥0.48 mm范围的根表面积均显著大于低效基因型。可见,磷高效基因型野生大麦在低浓度有机磷胁迫条件下根系更为发达,根表面积增加,扩大了根系对水分和养分的接触空间,有利于对磷素的高效吸收。
| 表2 不同有机磷供应水平下大麦不同直径根表面积(cm2/plant) Table 2 Root surface areas within different diameters of barley affected by phytate-P supply levels |
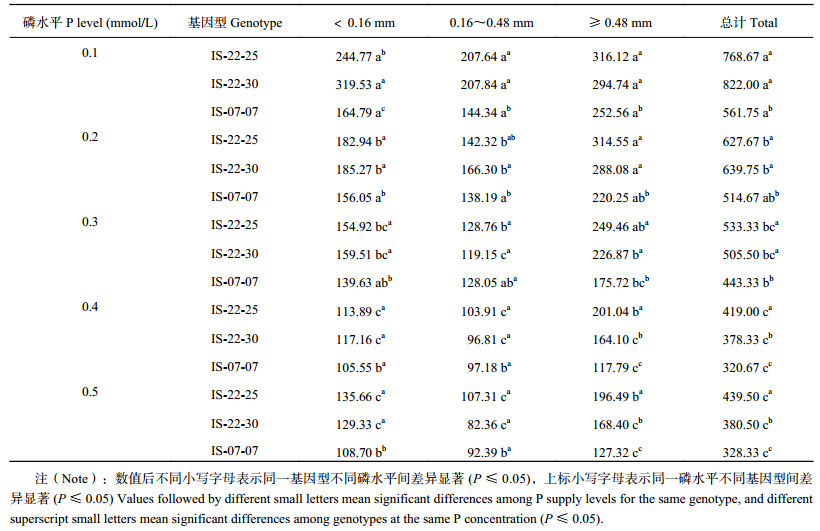 |
随着有机磷浓度增加,不同磷效率野生大麦根总体积和不同分级范围内根的体积逐渐减小(表 3)。当有机磷浓度达到0.4 mmol/L后,磷高效基因型IS-22-25和IS-22-30根总体积不再随着有机磷浓度增加显著减小,而磷低效基因型IS-07-07在有机磷浓度为0.5 mmol/L时根总体积最小。基因型IS-22-25、IS-22-30和IS-07-07根总体积随着有机磷浓度增加分别减小了80.7%、119.3%和342.1%,D < 0.16 mm范围的根体积分别减小了55.3%、170.6%和143.9%,0.16 mm≤D < 0.48 mm范围的根体积分别减小了63.1%、129.7%和100.7%,D≥0.48 mm范围的根体积分别减小了88.1%、55.7%和381.8%。各有机磷浓度下,磷高效基因型IS-22-25、IS-22-30根总体积和不同分级范围内根的体积均显著大于低效基因型IS-07-07。磷高效基因型IS-22-25和IS-22-30根总体积较低效基因型IS-07-07分别高20.5%~150.0%和19.6%~127.6%。可见,磷高效基因型野生大麦在低浓度有机磷胁迫条件根系更为发达,扩大了根系对水分和养分的接触空间,有利于对磷素的高效吸收。
| 表3 不同有机磷供应水平下大麦不同直径根体积(cm3/plant) Table 3 Root volume within different diameters of barely affected by phytate-P supply levels |
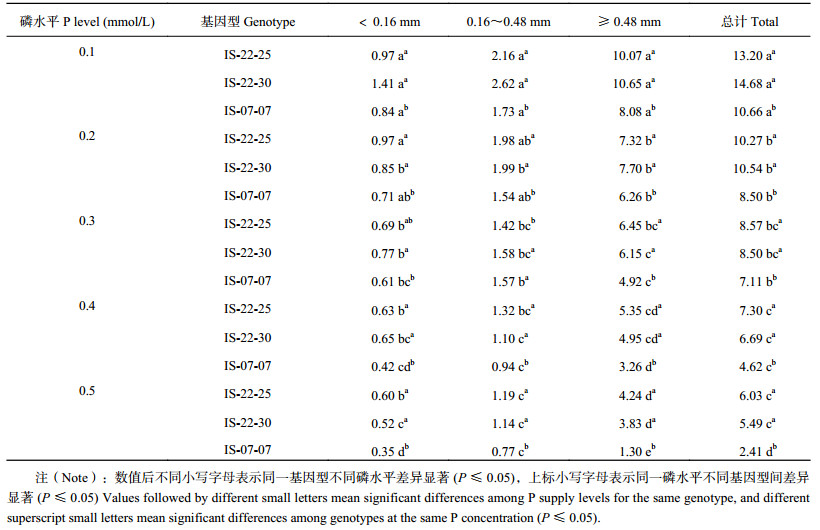 |
随着有机磷浓度增加,不同磷效率野生大麦根系酸性磷酸酶和植酸酶活性显著降低,有机磷浓度为0.4 mmol/L后,则不再呈现显著下降趋势(图 2)。0.1 mmol/L有机磷浓度与0.4 mmol/L相比,不同磷效率野生大麦根系酸性磷酸酶和植酸酶活性显著增大,基因型IS-22-30、IS-22-25和IS-07-07根系酸性磷酸酶活性增大172.2%、163.3%和128.9%,根系植酸酶活性增大121.2%、98.6%和73.9%。有机磷浓度为0.1~0.4 mmol/L时,磷高效基因型IS-22-30和IS-22-25根系酸性磷酸酶活性显著高于低效基因型IS-07-07,分别高出17.2%~39.3%和14.4%~41.2%。有机磷浓度为0.1~0.3 mmol/L时,磷高效基因型IS-22-30和IS-22-25根系植酸酶活性显著高于低效基因型IS-07-07,分别高出23.1%~37.2%和24.9%~34.8%。表明野生大麦在低浓度有机磷胁迫条件下能够通过增加根系酸性磷酸酶和植酸酶活性来提高自身对低磷环境的适应性,磷高效基因型野生大麦在此表现出明显优势。
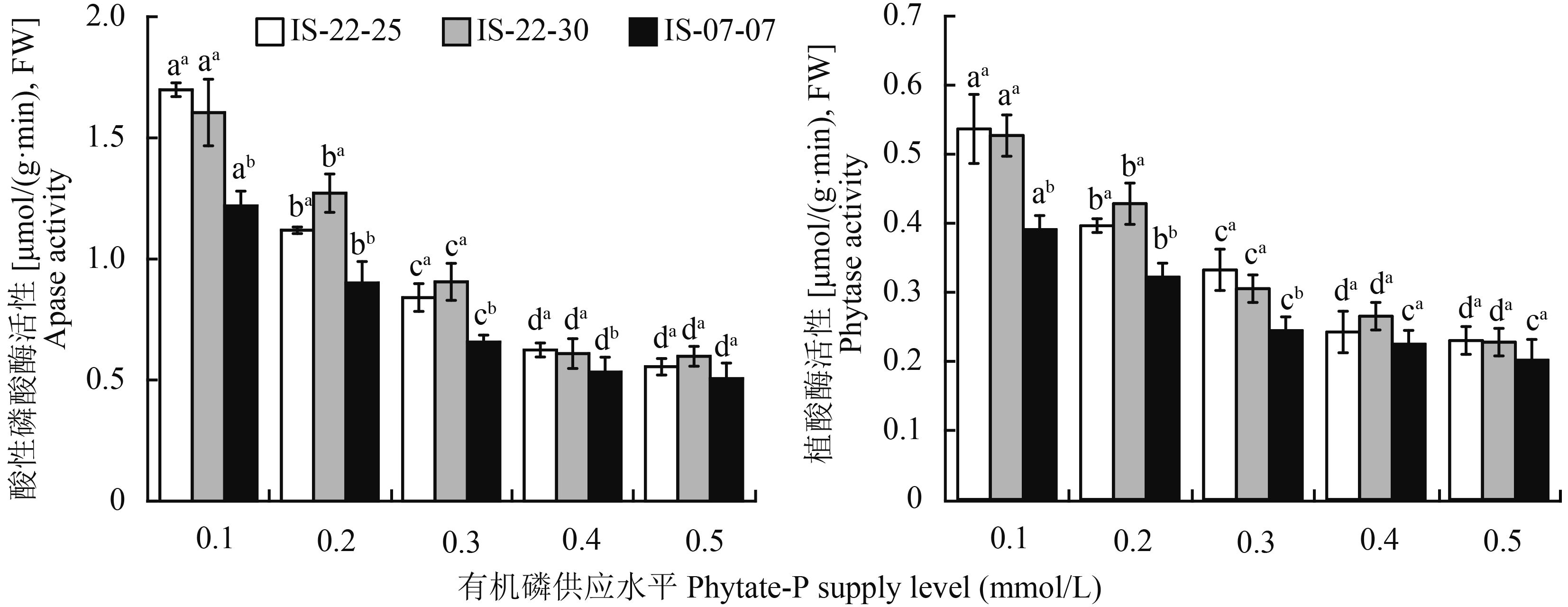 |
| 图2 不同有机磷浓度下大麦根系酸性磷酸酶和植酸酶活性 Fig. 2 Activity of APase and phytase in barley roots affected by phyate-P supply levels [注(Note):柱上不同小写字母表示同一基因型不同磷水平差异显著(P≤0.05),柱上上标小写字母表示同一磷水平不同基因型间差异显著(P≤0.05) Different small letters above the bars mean significant differences among P supply levels for the same genotype, and different superscript small letters mean significant differences among genotypes at the same P concentration (P≤0.05).] |
随着有机磷浓度增加,不同磷效率野生大麦根系分泌酸性磷酸酶和植酸酶活性显著降低(图 3)。磷高效基因型IS-22-30和IS-22-25根系分泌植酸酶活性在有机磷浓度达到0.4 mmol/L后不再呈现显著下降趋势,而低效基因型IS-07-07则继续呈现显著下降趋势。与0.4 mmol/L有机磷浓度相比,在0.1 mmol/L时不同磷效率野生大麦根系分泌酸性磷酸酶活性显著增大,基因型IS-22-30、IS-22-25和IS-07-07分别增大157.8%、193.4%和142.1%。有机磷浓度为0.1~0.4 mmol/L时,磷高效基因型IS-22-30和IS-22-25根系分泌酸性磷酸酶活性显著高于低效基因型IS-07-07,分别高出31.1%~39.6%和20.2%~45.7%。与0.4 mmol/L有机磷浓度相比,在0.1 mmol/L时磷高效基因型IS-22-30和IS-22-25根系分泌植酸酶活性分别增大183.4%和172.4%;与0.5 mmol/L有机磷浓度相比,在0.1 mmol/L时,磷低效基因型IS-07-07根系分泌植酸酶活性分别增大143.7%。有机磷浓度为0.1~0.3 mmol/L时,磷高效基因型IS-22-30和IS-22-25根系分泌植酸酶活性显著高于低效基因型IS-07-07,分别高出32.9%~42.5%和24.7%~51.4%。表明低浓度有机磷胁迫能促使野生大麦分泌更多的酸性磷酸酶和植酸酶,以提高环境中有机磷的生物有效性,增加磷素吸收效率,使之适应低磷环境,磷高效基因型野生大麦在此表现出较高根系分泌酸性磷酸酶和植酸酶活性优势。
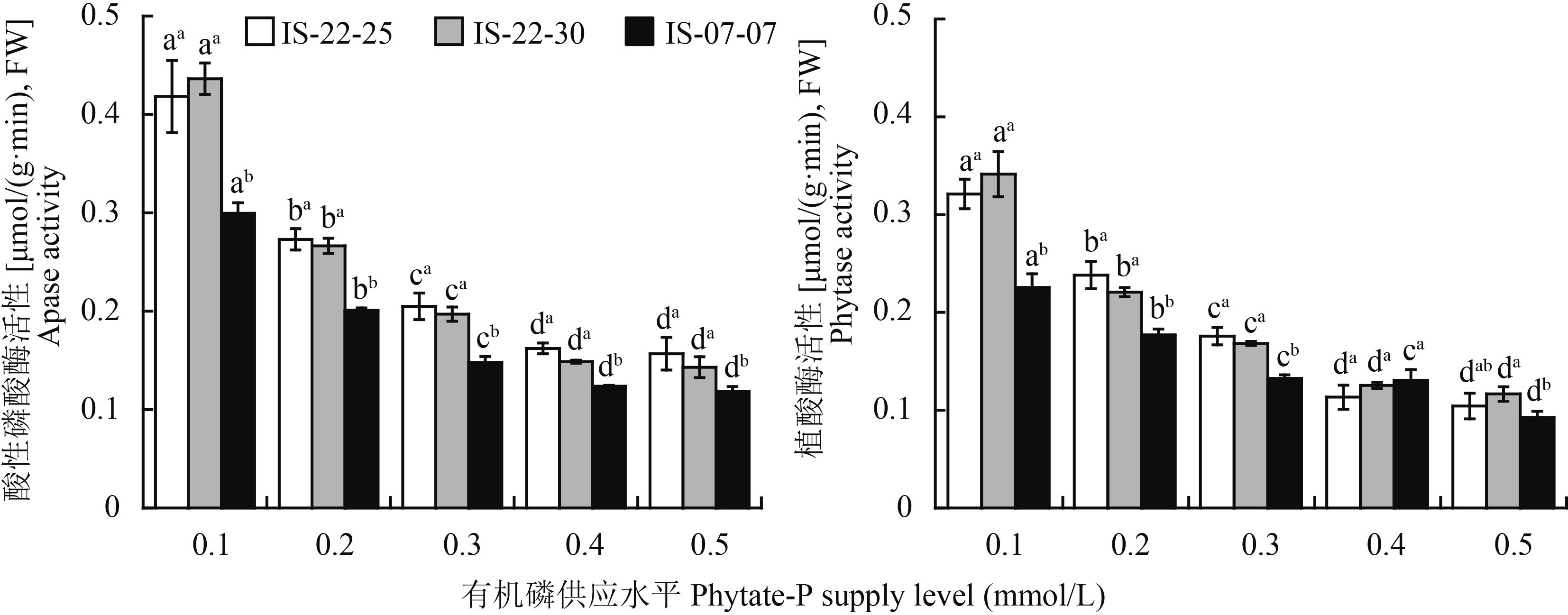 |
| 图3 不同有机磷浓度下野生大麦根系分泌液酸性磷酸酶和植酸酶活性 Fig. 3 Activities of APase and phytase in root exudates of wild barley genotypes affected by phyate-p supply levels 注(Note):柱上不同小写字母表示同一基因型不同磷水平差异显著(P≤0.05),柱上上标小写字母表示同一磷水平不同基因型间差异显著(P≤0.05) Different small letters above the bars mean significant differences among P supply levels for the same genotype, and different superscript small letters mean significant differences among genotypes at the same P concentration (P≤0.05). |
有机磷和无机磷营养都对植物生长发育具有重要的意义[25-26]。低磷胁迫时不同磷效率植物的物质生产能力在一定程度上可以反映植物对磷素吸收利用能力,磷高效基因型作物的生物学性状和磷素吸收积累能力优于低效基因型。阳显斌等[27]研究发现,不同无机磷水平下,磷高效基因型小麦物质生产和磷素吸收、积累和再利用能力均大于低效基因型,且磷低效基因型受低磷胁迫的影响程度要大于磷高效基因型。本研究结果表明,在水培条件下,不同磷效率野生大麦生物量和磷素积累量都随着有机磷浓度的增加呈显著增加趋势,有机磷浓度0.4 mmol/L是磷高效基因型IS-22-30和IS-22-25生长的最佳浓度。在本研究设置的不同有机磷浓度下,磷高效基因型IS-22-30和IS-22-25的生物量和磷素积累量显著高于低效基因型IS-07-07,表明磷高效基因型野生大麦物质生产和磷素吸收积累能力明显优于低效基因型,与土培条件下的结论一致[28]。
根系是作物吸收水分和养分的主要器官,对磷素缺乏尤为敏感,根长、根系表面积等形态学参数在作物获取养分方面具有重要作用[28-29]。作物根系形态决定了根系在土壤中的分布及与土壤的接触面积,因而根系形态的变化与作物养分吸收息息相关[30-31]。低磷胁迫诱导作物根系形态发生变化,其表现为根冠比、总根长和细根比例增加,扩大了根系接触土壤的体积,增加了对土壤磷素的吸收能力[32-34]。本研究结果表明,低有机磷浓度诱导不同磷效率野生大麦总根长、总表面积和总体积显著增加,这与低无机磷浓度胁迫环境下根系形态变化的结果相似[35-36]。低有机磷浓度下,磷高效基因型野生大麦总根长、总表面积和总体积显著高于低效基因型,并且磷高效基因型的各部位生物量和磷素积累量均显著高于低效基因型。根系形态在土壤中的生长具有可塑性,且随外界条件的改变而变化[37]。很多研究发现,植物通过增加侧根数和根毛数来适应低磷环境。有机磷胁迫下,植物体内磷含量急剧下降,刺激其通过增加根长度、根系吸收面积等进一步扩大对水分和养分的接触空间,以保证正常生长。根系形态相关参数的改变在根系摄取养分过程中起着至关重要的作用。同时,磷高效基因型大麦表现出更强的根系形态可塑性,从而使其具有更强的磷素物质积累能力。Fita等[38]和Zhang等[39]研究表明,低磷条件下,磷高效基因型具有更大的根长和根表面积等根系形态参数,更高的磷素吸收效率。本研究采用顾东祥等[40]的方法,提取同一处理下野生大麦细分枝根(D < 0.16 mm)、粗分枝根(0.16 mm≤D < 0.48 mm)和不定根(D≥0.48 mm)三类根的长度、表面积和体积。细分枝根是水分和养分吸收的主要器官,细分枝根比例的提高可增加根系比表面积,从而增加根系对水分和养分的接触空间[41]。小麦根系总根长以及直径 < 0.16 mm的细根长度与植株磷累积量之间呈极显著正相关关系,对提高植株吸收土壤磷具有重要的意义[42]。本研究结果表明,细分枝根的根长占总根长比例最大,制约着根系向介质的扩大范围。低有机磷浓度条件下,不同磷效率野生大麦细根的总根长、表面积和体积均显著增加,并且磷高效基因型细根的根系参数显著优于低效基因型。说明低有机磷浓度促使磷高效基因型野生大麦根轴变细,最终显著增加了细根的总根长、表面积和体积,从而有效扩大了磷高效基因型根系对磷素的高效吸收。粗分枝根可以拓展吸收空间以弥补不定根在数量和长度上的限制,从而影响根系对养分和水分的吸收,所以其根长占总根长的比例仅次于细分枝根。低有机磷浓度时,不同磷效率野生大麦粗分枝根的总根长、表面积和体积均显著增加,并且磷高效基因型细根的根系参数显著优于低效基因型。不定根作为固定植株与输导作用的主体,占总根长的比例最小。在低有机磷浓度时,不定根的参数变化与前二类根相似,磷高效基因型细根的根系参数显著优于低效基因型。由此可见,磷高效基因型野生大麦对有机磷的胁迫敏感性更强,根系形态更优,为磷素的高效吸收提供了充足的条件。
作物根系不仅会发展形成形态上的适应性来提高磷素吸收量,也会发展生理上的适应性来获得介质中的磷素,以达到减轻缺磷胁迫程度的目的。其中高效利用磷的生理方面的适应性变化包括根系分泌有机酸和质子酸化土壤、分泌磷酸酯酶水解有机磷化合物等[43]。磷酸酶作为作物根系能产生的众多酶类之一,是一种非特异性酶,能水解有机磷为无机磷从而提高作物磷素吸收量[44-45]。普遍认为,低磷胁迫诱导根系和根系分泌的磷酸酯酶活性增强,提高根际磷素的生物有效性,利于植物的磷素吸收[39]。本研究结果表明,低浓度有机磷诱导不同磷效率野生大麦根系和其分泌的酸性磷酸酶、植酸酶活性增强,此结果与Louw-Gaume等[46]的研究结果一致。由于低浓度有机磷环境下,作物生长受到抑制,刺激其通过分泌活性更强的酸性磷酸酶和植酸酶,从而矿化根际环境中的难溶态有机磷,进一步提高根系对磷素的吸收能力,保证其生长。同时,在不同作物之间以及同种作物不同基因型之间,由缺磷诱导的磷酸酯酶活性也存在很大差异。严宽等[47]研究在缺磷处理下不同磷效率水稻根系酸性磷酸酶活性变化,发现磷高效基因型酶活性显著高于低效基因型。磷高效品种或基因型通过向质外体或环境中分泌更多的酸性磷酸酶,进一步水解更多的有机磷,从而保证植物正常生长。本研究在低浓度有机磷条件下,磷高效基因型根系和其分泌的酸性磷酸酶、植酸酶活性显著高于低效基因型,且磷高效基因型生物量和磷素积累量均显著高于低效基因型。表明,低浓度有机磷诱导磷高效基因型野生大麦根系和其分泌的酸性磷酸酶、植酸酶活性增强,增加了营养液中有机磷水解数量,提高了供应根系吸收利用的有效磷含量,促进了磷高效基因型的生长和磷素吸收。因而,磷高效基因型野生大麦在低浓度有机磷条件下,对有机磷的利用能力具有明显的优势,可能是其高效吸收利用有机磷的机制之一。
| [1] | Tarafdar J C, Claassen N. Organic phosphorus compounds as a phosphorus source for higher plants through the activity of phosphatases produced by plant roots and microorganisms[J]. Biology and Fertility of Soils, 1988, 5: 308–312. |
| [2] | Tarafdar J C, Claassen N. Preferential utilization of organic and inorganic sources of phosphorus by wheat plant[J]. Plant and Soil, 2005, 275: 285–293. DOI:10.1007/s11104-005-2154-2 |
| [3] | Tarafdar J C, Jungk A. Phosphatase activity in the rhizosphere and its relation to the depletion of soil organic phosphorus[J]. Biology and Fertility of Soils, 1987, 3: 199–204. DOI:10.1007/BF00640630 |
| [4] | Steffens D, Leppin T, Luschin-Ebengreuth N, et al. Organic soil phosphorus considerably contributes to plant nutrition but is neglected by routine soil-testing methods[J]. Journal of Plant Nutrition and Soil Science, 2010, 173: 765–771. DOI:10.1002/jpln.v173:5 |
| [5] |
李永夫, 罗安程, 吴良欢, 等. 两个基因型水稻利用有机磷的差异及其与根系分泌酸性磷酸酶活性的关系[J].
应用生态学报, 2009, 20(5): 1072–1078.
Li Y F, Luo A C, Wu L H, et al. Difference in P utilization from organic phosphate between two rice genotypes and its relations with root-secreted acid phosphatase activity[J]. Chinese Journal of Applied Ecology, 2009, 20(5): 1072–1078. |
| [6] | Yang T, He J B, Zeng Y W, et al. Differentiation of barley genotypes with high phosphorus efficiency under low phosphorus stress[J]. Agricultural Science and Technology, 2013, 14(11): 1615–1619. |
| [7] | Ao X, Guo X H, Zhu Q, et al. Effect of phosphorus fertilization to P uptake and dry matter accumulation in soybean with different P efficiencies[J]. Journal of Integrative Agriculture, 2014, 13(2): 326–334. DOI:10.1016/S2095-3119(13)60390-1 |
| [8] |
张海伟, 黄宇, 叶祥盛, 等. 低磷胁迫下甘蓝型油菜酸性磷酸酶对磷效率的贡献分析[J].
中国科学(生命科学), 2010, 40(5): 418–427.
Zhang H W, Huang Y, Ye X S, et al. Analysis of the contribution of acid phosphatase to P efficiency in Brassica napus under low phosphorus condition[J]. Science China (Life Sciences), 2010, 40(5): 418–427. |
| [9] | Yao Y N, Sun H Y, Xu F S, et al. Comparative proteome analysis of metabolic changes by low phosphorus stress in two Brassica napus genotypes[J]. Planta, 2011, 233: 523–537. DOI:10.1007/s00425-010-1311-x |
| [10] | Talboys P J, Healey J R, Withers P J A, et al. Phosphate depletion modulates auxin transport in Triticum aestivum leading to altered root branching[J]. Journal of Experimental Botany, 2014, 65(17): 5023–5032. DOI:10.1093/jxb/eru284 |
| [11] |
严小龙, 廖红, 戈振扬, 等. 植物根构型特性与磷吸收效率[J].
植物学通报, 2000, 17(6): 511–519.
Yan X L, Liao H, Ge Z Y, et al. Root architectural characteristics and phosphorus acquisition efficiency in plants[J]. Chinese Bulletin of Botany, 2000, 17(6): 511–519. |
| [12] | Pang J Y, Ryan M H, Tibbett M, et al. Variation in morphological and physiological parameters in herbaceous perennial legumes in response to phosphorus supply[J]. Plant and Soil, 2010, 331: 241–255. DOI:10.1007/s11104-009-0249-x |
| [13] | Fita A, Nuez F, Pico B. Diversity in root architecture and response to P deficiency in seedlings of Cucumismelo L.[J]. Euphytica, 2011, 181: 323–339. DOI:10.1007/s10681-011-0432-z |
| [14] | Magalhães P C, de Souza T C, Cantão F R O. Early evaluation of root morphology of maize genotypes under phosphorus deficiency[J]. Plant Soil Environment, 2011, 57(3): 135–138. |
| [15] | Hammond J P, White P J. Sucrose transport in the phloem:integrating root responses to phosphorus starvation[J]. Journal of Experimental Botany, 2008, 59(1): 93–109. |
| [16] | Ramaekers L, Remans R, Rao I M, et al. Strategies for improving phosphorus acquisition efficiency of crop plants[J]. Field Crops Research, 2010, 117: 169–176. DOI:10.1016/j.fcr.2010.03.001 |
| [17] | Shen J B, Yuan L X, Zhang J L, et al. Phosphorus dynamics:from soil to plant[J]. Plant Physiology, 2011, 156: 997–1005. DOI:10.1104/pp.111.175232 |
| [18] | Feuillet C, Muehlbauer G J. Genetics and genomics of the Triticeae, plant genetics and genomics:crops and models [M]. Berlin: Springer, 2009: 7. |
| [19] | FAO of the United Nations. Fertilizer use by crop[M]. FAO, 2006. |
| [20] | Nevo E. Origin, evolution, population genetics and resources for breeding of wild barley Hordeum spontaneum in the fertile crescent[A]. Shewry P R. Barley: genetics, biochemistry, molecular biology and biotechnology[M]. Wallingford, UK: CAB International, 1992. 19-43. |
| [21] |
徐静, 张锡洲, 李廷轩, 等. 磷高效利用野生大麦基因型筛选及其根际土壤无机磷组分特征[J].
应用生态学报, 2013, 24(10): 2821–2830.
Xu J, Zhang X Z, Li T X, et al. Screening of wild barley genotypes with high phosphorus use efficiency and their rhizosphere soil inorganic phosphorus fractions[J]. Chinese Journal of Applied Ecology, 2013, 24(10): 2821–2830. |
| [22] |
徐静, 张锡洲, 李廷轩, 等. 野生大麦对土壤磷吸收及其酸性磷酸酶活性的基因型差异[J].
草业学报, 2015, 24(1): 88–98.
Xu J, Zhang X Z, Li T X, et al. Phosphorus absorption and acid phosphatase activity in wild barley genotypes with different phosphorus use efficiencies[J]. Acta Prataculturae Sinica, 2015, 24(1): 88–98. |
| [23] |
鲁如坤.
土壤农业化学分析方法
[M]. 北京: 中国农业科技出版社, 2000.
Lu R K. Analytical methods of soil and agrochemistry [M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [24] | Richardson A E, Hadobas P A, Hayes J E. Acid phosphomonoesterase and phytase activities of wheat (Triticum aestivum L.) roots and utilization of organic phosphorus substrates by seedlings grown in sterile culture[J]. Plant, Cell, Environment, 2000, 23: 397–405. DOI:10.1046/j.1365-3040.2000.00557.x |
| [25] | Priya P, Sahi S V. Influence of phosphorus nutrition on growth and metabolism of Duo grass (Duo festulolium)[J]. Plant Physiology and Biochemistry, 2009, 47(1): 31–36. DOI:10.1016/j.plaphy.2008.09.002 |
| [26] | Opala P A, Okalebo J R, Othieno C O, et al. Effect of organic and inorganic phosphorus sources on maize yields in an acid soil in western Kenya[J]. Nutrient Cycling in Agroecosystems, 2010, 86(3): 317–329. DOI:10.1007/s10705-009-9294-3 |
| [27] |
阳显斌, 张锡洲, 李廷轩, 等. 小麦磷素利用效率的品种差异[J].
应用生态学报, 2012, 23(1): 60–66.
Yang X B, Zhang X Z, Li T X, et al. Differences in phosphorus utilization efficiency among wheat cultivars[J]. Chinese Journal of Applied Ecology, 2012, 23(1): 60–66. |
| [28] | Miura K, Lee J, Gong Q, et al. SIZ1 regulation of phosphate starvation-induced root architecture remodeling involves the control of auxin accumulation[J]. Plant Physiology, 2011, 155: 1000–1012. DOI:10.1104/pp.110.165191 |
| [29] | Jin K, Shen J B, Ashton R W, et al. Wheat root growth responses to horizontal stratification of fertiliser in a water-limited environment[J]. Plant and Soil, 2015, 386: 77–88. DOI:10.1007/s11104-014-2249-8 |
| [30] | Yan H F, Li K, Ding H, et al. Root morphological and proteomic responses to growth restriction in maize plants supplied with sufficient N[J]. Journal of Plant Physiology, 2011, 168: 1067–1075. DOI:10.1016/j.jplph.2010.12.018 |
| [31] | Giehl R F H, Gruber B D, von Wirén N. It's time to make changes:modulation of root system architecture by nutrient signals[J]. Journal of Experimental Botany, 2014, 65: 769–778. DOI:10.1093/jxb/ert421 |
| [32] | Wang X R, Yan X L, Liao H. Genetic improvement for phosphorus efficiency in soybean:a radical approach[J]. Annals of Botany, 2010, 106: 215–222. DOI:10.1093/aob/mcq029 |
| [33] | Zhang Y, Zhou Z C, Yang Q. Genetic variations in root morphology and phosphorus efficiency of Pinus massoniana under heterogeneous and homogeneous low phosphorus conditions[J]. Plant and Soil, 2013, 364(1-2): 93–104. DOI:10.1007/s11104-012-1352-y |
| [34] |
季萌萌, 许海港, 彭玲, 等. 低磷胁迫下五种苹果砧木的磷吸收与利用特性[J].
植物营养与肥料学报, 2014, 20(4): 974–980.
Ji M M, Xu H G, Peng L, et al. Characteristics of phosphorus absorption and utilization in five apple rootstocks under low phosphorus stress[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(4): 974–980. |
| [35] | Wu P F, Ma X Q, Tigabu M, et al. Root morphological plasticity and biomass production of two Chinese fir clones with high phosphorus efficiency under low phosphorus stress[J]. Canadian Journal of Forest Research-revue, 2011, 41: 228–234. DOI:10.1139/X10-198 |
| [36] |
孙海国, 张福锁. 缺磷胁迫下的小麦根系形态特征研究[J].
应用生态学报, 2002, 13(3): 295–299.
Sun H G, Zhang F S. Morphology of wheat roots under low-phosphorus stress[J]. Chinese Journal of Applied Ecology, 2002, 13(3): 295–299. |
| [37] |
赵华, 徐芳森, 石磊. 植物根系形态对低磷胁迫应答的研究进展[J].
植物学通报, 2006, 23(4): 409–417.
Zhao H, Xu F S, Shi L. Advances in plant root morphology adaptability to phosphorus deficiency stress[J]. Chinese Bulletin of Botany, 2006, 23(4): 409–417. |
| [38] | Fita A, Nuez F, Pico B. Diversity in root architecture and response to P deficiency in seedlings of Cucumismelo L[J]. Euphytica, 2011, 181: 323–339. DOI:10.1007/s10681-011-0432-z |
| [39] | Zhang Y, Zhou Z C, Yang Q. Genetic variations in root morphology and phosphorus efficiency of Pinus massoniana under heterogeneous and homogeneous low phosphorus conditions[J]. Plant and Soil, 2013, 364(1-2): 93–104. DOI:10.1007/s11104-012-1352-y |
| [40] |
顾东祥, 汤亮, 曹卫星, 等. 基于图像分析方法的水稻根系形态特征指标的定量分析[J].
作物学报, 2010, 36(5): 810–817.
Gu D X, Tang L, Cao W X, et al. Quantitative analysis on root morphological characteristics based on image analysis method in rice[J]. Acta Agronomica Sinica, 2010, 36(5): 810–817. DOI:10.3724/SP.J.1006.2010.00810 |
| [41] | Péret B, Desnos T, Jost R, et al. Root architecture responses:in search of phosphate[J]. Plant Physiology, 2014, 166: 1713–1723. DOI:10.1104/pp.114.244541 |
| [42] |
陈磊, 王盛锋, 刘荣乐, 等. 不同磷供应水平下小麦根系形态及根际过程的变化特征[J].
植物营养与肥料学报, 2012, 18(2): 324–331.
Chen L, Wang S F, Liu R L, et al. Changes of root morphology and rhizosphere processes of wheat under different phosphate supply[J]. Plant Nutrition and Fertilizer Science, 2012, 18(2): 324–331. |
| [43] |
黄宇, 张海伟, 徐芳森. 植物酸性磷酸酶的研究进展[J].
华中农业大学学报, 2008, 27(1): 148–154.
Huang Y, Zhang H W, Xu F S. Research progress on plant acid phosphatase[J]. Journal of Huazhong Agricultural University, 2008, 27(1): 148–154. |
| [44] | Starnes D L, Padmanabhan P, Sahi S V. Effect of P sources on growth, P accumulation and activities of phytase and acid phosphatases in two cultivars of annual ryegrass (Lolium multiflorum L.)[J]. Plant Physiology Biochemistry, 2008, 46: 373, 580–589. |
| [45] | Bargaz A, Faghire M, Abdi N, et al. Low soil phosphorus availability increases acid phosphatases activities and affects P partitioning in nodules, seeds and rhizosphere of Phaseolus vulgaris[J]. Agriculture, 2012, 2(2): 139–153. |
| [46] | Louw-Gaume A E, Rao I M, Gaume A J, et al. A comparative study on plant growth and root plasticity responses of two Brachiaria forage grasses grown in nutrient solution at low and high phosphorus supply[J]. Plant and Soil, 2010, 328: 155–164. DOI:10.1007/s11104-009-0093-z |
| [47] |
严宽, 王昌全, 李焕秀, 等. 磷水平对杂交水稻及其亲本根系酸性磷酸酶活性的影响[J].
中国水稻科学, 2010, 24(1): 43–48.
Yan K, Wang C Q, Li H X, et al. Effects of phosphorus level on the activity of acid phosphatase in roots of hybrid rice and its parents[J]. Chinese Journal of Rice Science, 2010, 24(1): 43–48. |
 2016, Vol. 22
2016, Vol. 22  doi:
doi: 

