2. 山东省菏泽市曹县农业局, 山东曹县 274400
2. Caoxian Bureau of Agriculture, Heze, Shandong 274400, China
氮素是作物生长发育必需的大量元素之一。我国部分高产攻关田小麦氮肥用量达551 kg/hm2,而氮肥利用率仅为23%~28%[1]。随着全球人口的增加,为增加作物的产量,大量的氮肥资源投入农田,不仅降低了肥料利用率[2],造成了资源的浪费,还引发了严重的环境问题[3-4]。因此,培育高产、养分高效利用的新品种成为“第二次绿色革命”的重要目标。深入探讨氮效率相关性状的遗传基础是小麦氮养分效率遗传改良的前提[5]。
氮营养相关性状是典型的数量性状,数量性状基因座位(quantitative trait locus, QTL)分析可以把复杂的数量性状分解成不同的QTL,为复杂性状遗传控制的研究提供了一种有效的新方法[6]。到目前为止,与小麦氮素营养有关的QTL的分析主要集中在苗期或成熟期,涉及低氮或高氮处理。Quarrie等[7]在低氮胁迫的环境下检测到与产量性状相关的QTL,主要分布在4A、4B、6A、7A和7B染色体上。An等[8]在大田环境下共检测到17个与氮吸收效率有关的QTL,高氮和低氮环境下分别为8个和9个。2006年,Laperche等[9]在高氮和低氮水平下,检测到与籽粒产量、籽粒蛋白和氮含量相关的QTL,在4B和5A染色体上检测到2个与根干重相关的QTL,此外,在2B染色体上定位了1个与总干重有关的QTL。2007年,Laperche等[10]对产量、千粒重、收获指数等性状进行QTL分析,在高氮和低氮环境下检测到的QTL数分别为67个和51个,同时在两个环境中检测到的QTL为85个。由于QTL受试验环境的影响很大,这些QTL的稳定性需要进一步验证。特别是磷和钾与氮素的吸收利用效率存在复杂的交互效应[11],氮、磷、钾的吸收和利用可能受共同的QTL控制[12]。因此,研究不同磷、钾处理环境下的氮效率相关QTL对于深入理解氮、磷、钾相互关系及氮营养性状的QTL环境稳定性具有重要意义,也为氮营养性状的图位克隆及分子标记辅助选择育种(marker assistant selection, MAS)奠定基础。
本研究以小麦重组自交系群体(recombinant inbred lines, RIL)为研究材料,研究了不同浓度磷、钾处理对小麦苗期氮养分效率相关性状的影响并对所有氮养分效率相关性状进行了QTL分析。
1 材料与方法 1.1 试验材料本研究以“川35050 ×山农483”组合衍生的小麦重组自交系群体(recombinant inbred lines, RIL)(131个株系)为研究材料。川35050是中国西南冬麦区的小麦品系,穗大、强筋;山农483是黄淮麦区的小麦品系,中弱筋,丰产性好,该品系来自小麦种质和小麦育种的骨干亲本“矮孟牛”,“矮孟牛”在小麦育种中得到了广泛使用,以其为亲本已培育出十多个小麦新品种,累计推广3亿多亩,增产小麦100多亿公斤。
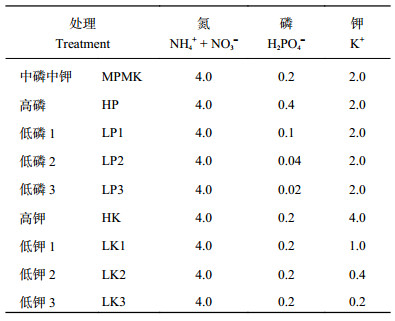
1.2 试验设计营养液培养试验在山东农业大学温室进行,采用随机区组设计,营养液以Hoagland营养液[13]为基础,根据小麦的生理特点对其进行了优化调整[12]。试验共设置9个处理,分别为中磷中钾(MPMK)、高磷(HP)、低磷1 (LP1)、低磷2 (LP2)、低磷3 (LP3),高钾(HK)、低钾1 (LK1)、低钾2 (LK2)、低钾3 (LK3),各处理重复3次,具体方案见表 1。
| 表1 不同试验磷、钾浓度(mmol/L) Table 1 P and K concentrations in the treatments |
 |
挑选大小一致的小麦重组自交系(RIL)和亲本种子,经10% H2O2灭菌5 min后用蒸馏水冲洗,充分吸胀后取出置于发芽网上发芽。7天后,每个株系选取长势一致的幼苗移栽到育苗盘上,每穴2株,重复3次,并用海绵固定好。之后将育苗盘固定在盛有20 L营养液、外侧不透光(保证根系健康生长并防止藻类的生长)的黑色长方形塑料盒中。移苗后用蒸馏水缓苗1天,之后每隔3天更换一次营养液,用0.5%的NaOH调节pH在6.0~6.2之间,并用充气泵不断向营养液充气,培养30天收获。
试验在日光温室进行,气温7.5℃~33.9℃,平均18.5℃;相对湿度10.1%~91.3%,平均51.4%;光照强度0~69.0 Klux,平均5.9 Klux。数据每隔10 min由ZDR系列记录仪记录。
1.3 测定项目及方法收获时,先将根系在蒸馏水中冲洗10 min后取出,用吸水纸吸干水分。将地上部和根系分别装入纸袋,置于60℃烘箱中烘干至恒重。用万分之一天平对单株根干重和单株地上部干重进行称重。单株总重为单株根和地上部的干重之和。
将烘干的小麦幼苗磨碎,称取适量加入浓H2SO4和H2O2消解至无色透明。用凯氏定氮法[14]测定根系氮浓度和地上部氮浓度。主要计算公式[15]:
总的氮浓度=(单株地上部干重×地上部氮浓度+单株根干重×根系氮浓度)/(单株根干重+地上部干重)
根系(地上部)氮累积量=单株根(地上部)干重×根系(地上部)氮浓度
总的氮累积量=根系氮累积量+地上部氮累积量
累积量根冠比=根系氮累积量/地上部氮累积量
根系(地上部)氮利用率=单株根(地上部)干重/根系(地上部)氮浓度
总氮利用率=单株总重/总的氮浓度
1.4 数据分析方差分析(ANOVA)、最小显著性差异(LSD)分析和性状间的相关系数分析均采用SAS软件。广义遗传率的相关数据由SAS软件中的GLM程序得到,计算公式为:
| $ h_B^2 = \frac{{\sigma _g^2 - \sigma _e^2}}{{\sigma _g^2 + \left( {n - 1} \right)\sigma _e^2}} $ |
式中,σg2为基因型方差,σe2为误差方差,n是重复数[16]。
本研究利用已构建的遗传图谱[17]进行QTL分析,该图谱包含21条染色体上的719个标记,图谱全长为4008.4 cM,标记密度为7.15 cM/位点。标记类型主要为DArT标记(多样性微阵列技术)、SSR标记(简单序列重复多态性)、EST-SSR标记(基于表达序列标签开发的重复多态性)。采用Windows QTL Cartographer 2.5软件[18]对目标性状进行QTL复合区间作图(composite-interval mapping)。检测步长为1 cM,每个QTL的认定峰值临界值为LOD≥3.0,并在P≤0.05[19]的情况下进行1000次置换检测,每个QTL区间入选临界值为LOD≥2.5[12]。Stoll等将染色体同一位置同时检测到2个或2个以上性状的QTL位点定义为一个QTL簇[20]。本研究将染色体同一位点定位到3个及以上不同性状的QTL,定义为一个QTL簇[12]。
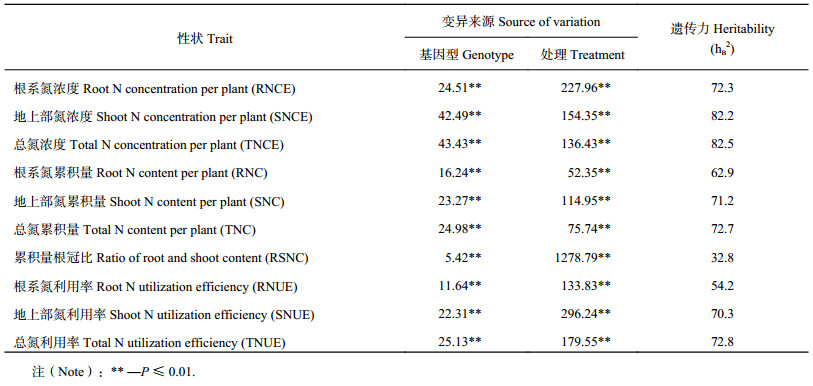
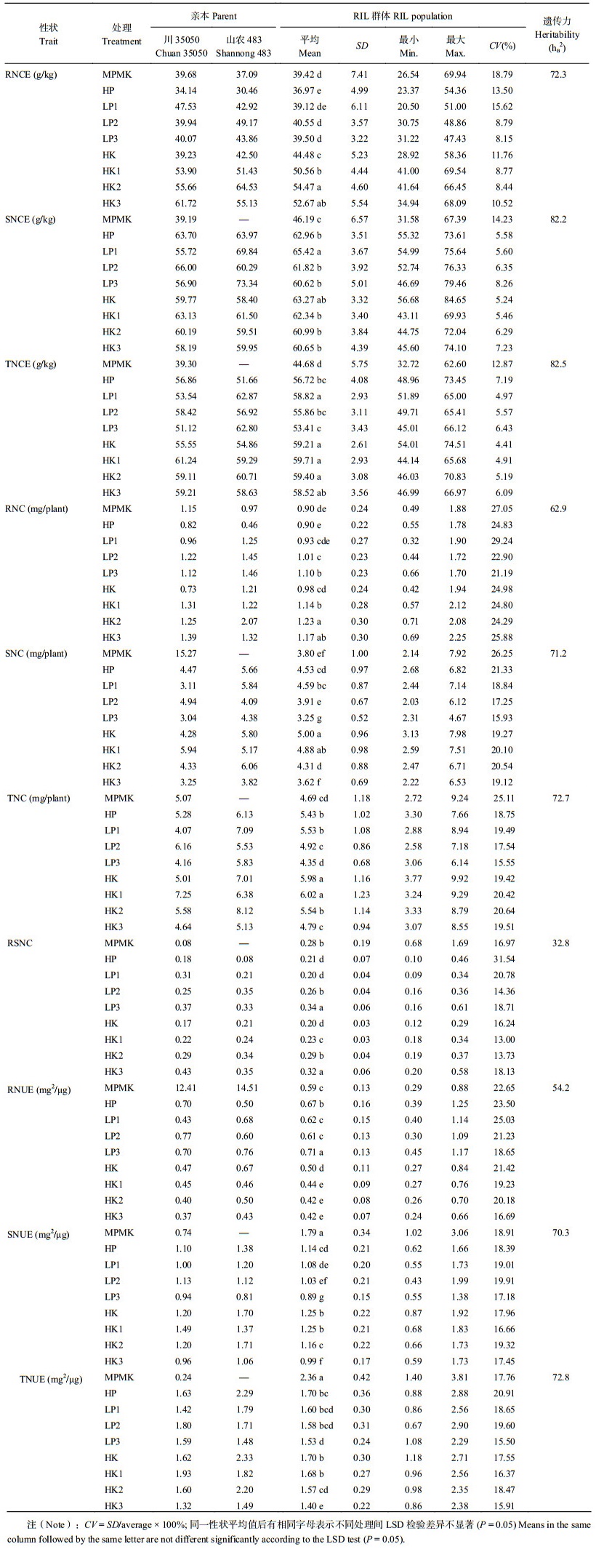
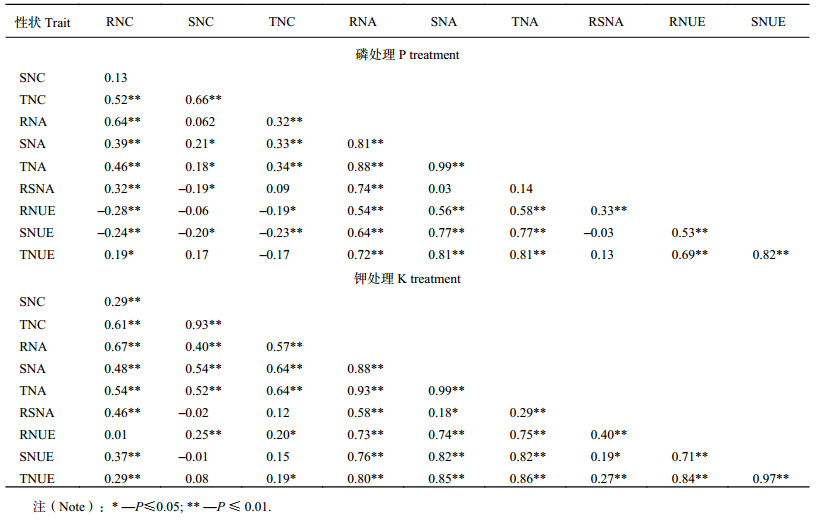
2 结果与分析 2.1 苗期小麦部分性状的表型变异及相关分析由表 2可以看出,10个性状的基因型和处理间变异都达到显著水平(P≤0.01),表明遗传因素和环境因素对氮效率相关性状的表型变异均有显著影响。LSD检测结果(表 3)表明,调查性状的平均值在9个处理下有比较大的差异。10个性状中除RSNC外,遗传力都在50%以上,其中遗传力最大为82.5% (TNCE),最小为32.8% (RSNC)。所有氮效率相关性状均表现出连续变异,变异系数大部分在15%以上,最大值为31.54% (RSNC, HP),最小值为4.41% (TNCE, HK)。除大部分营养含量性状与累积量性状呈显著负相关或不相关,SNC与RSNC负相关或不相关外,其他各性状表现出正相关或极显著正相关(表 4)。
| 表2 小麦苗期氮营养相关性状的方差分析 Table 2 Variance analysis (ANOVA) for the N related traits of wheat at seedling stage |
 |
| 表3 小麦苗期RIL群体及父母本性状测定结果 Table 3 Phenotypic performance for seedling traits of the RILs and their parents |
 |
| 表4 不同磷、钾处理下小麦苗期氮养分效率各相关性状间的相关系数 Table 4 Correlation coefficients (r) between N efficiency related traits under different P and K treatments |
 |
试验中小麦苗期9个处理下的10个性状共检测到160个QTL (单一QTL单一环境),将不同处理条件下检测到的相同QTL合并后共检测到137个QTL位点,位于小麦除3D外的20条染色体上。在7个氮营养吸收相关性状(RNCE、SNCE、TNCE、RNC、SNC、TNC、RSNC)和3个氮利用效率性状(RNUE、SNUE、TNUE)上分别定位到107个QTL和30个QTL。单个QTL可解释表型变异的6.4%~61.5%。有15个(10.95%) QTL可以在至少两个处理中被检测到,贡献率为7.4%~37%。其中,QRnue-1A.2, QSnue-1A.1和QTnue-1A.1这3个QTL可在至少4个处理中被检测到(表 5)。
| 表5 重要的QTL簇 Table 5 Important QTL clusters |
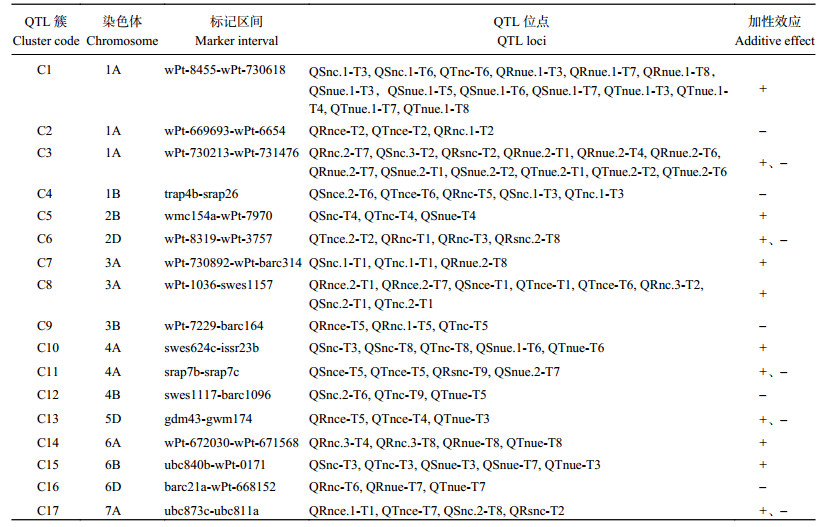 |
QTL具有成簇分布的特征,染色体同一位置同时检测到3个及以上不同性状的QTL形成QTL簇。本研究共定位到17个QTL簇(C1~C17),分别位于1A、1B、2B、2D、3A、3B、4A、4B、5D、6A、6B、6D和7A染色体上,共涉及66个QTL,占QTL总数的48.18% (表 5)。
C1和C3同时定位的QTL数目最多。C1位于1A染色体wPt-8455-wPt-730618区间,定位了5个QTL (QSnc.1、QTnc、QRnue.1、QSnue.1、QTnue.1)(表 5)。单个QTL能够解释表型变异的10.1%~18.0%。有3个QTL可以在至少3个处理中被定位到。该QTL簇中各位点加性效应均来自川35050,表现为正连锁关系。
C3位于1A染色体wPt-730213-wPt-731476区间,定位了6个QTL (QRnc.2、QSnc.3、QRsnc、QRnue.2、QSnue.2、QTnue.2)(表 5)。单个QTL能够解释表型变异的9.1%~23.2%。其中有3个QTL可在多个处理中被定位到。该QTL簇中仅有QRsnc的加性效应来自川35050,其他各位点加性效应均来自山农483。
3 讨论 3.1 不同磷、钾处理对氮效率性状的影响本研究中,与对照处理相比,在高磷处理下,地上部氮浓度(SNCE)、总氮浓度(TNCE)、地上部氮累积量(SNC)、总氮累积量(TNC)均增加,表明磷供应量增加可以促进小麦对氮的吸收。而低磷处理下,根系氮浓度(RNCE)、根系氮累积量(RNC)均显著增加。有研究表明缺磷使小麦根部生长素浓度提高,促进根分生组织细胞分裂[21],这会导致根系生长相对增加。而不同磷浓度下,地上部与根系含氮量的差异,一方面可能是因为低磷减少了幼苗对氮的吸收,另一方面,为缓解磷供应不足,植物会增加同化产物向根部的分配,以促进根系生长增加磷的吸收,这将导致氮被更多的用于根系生长,从而减少地上部的供应,随着磷浓度的升高,地上部氮含量和累积量会呈现增加的趋势[22]。
高钾处理下,地上部氮浓度(SNCE)、总氮浓度(TNCE)、地上部氮累积量(SNC)、总氮累积量(TNC)均增加。而低钾处理下,根系氮浓度(RNCE)、根系氮累积量(RNC)均显著增加。谭金芳等[23]的研究也表明,随着施钾量的增加,冬小麦的地上部氮素累积量呈逐渐增加趋势。其生理原因可能有两方面:一是光反应转化的能量有很大一部分用于氮素的同化,施钾提高了叶片含钾量从而提高了净光合速率,间接促进了氮素的吸收和积累;二是钾素提高了叶片蛋白酶的活性,从而提高了对氮素的吸收[24]。此外,钾可以促进物质的转运和高分子化合物的合成[25],缺钾造成植株体内氮运输受阻,在根系内积累较多的氮素。
低磷处理下,根系氮利用率(RNUE)显著增加,这主要是由于低磷会诱导根系生长,从而间接增加了氮素的利用效率。在低磷处理下,地上部氮利用率(SNUE)、总的氮利用率(TNUE)显著下降,这与Guo等[12]所得到的结果一致。这可能是因为低磷抑制地上部生长,增加根冠比,地上部氮素利用效率随之下降。在低钾处理下,根系氮利用率(RNUE)、地上部氮利用率(SNUE)、植株总氮利用率(TNCE)都有所下降,这与Guo等[12]在低钾处理下得到的结果一致。可见,钾素对于氮素利用效率的影响很大。以上结果表明,磷和钾的供应能够显著影响小麦的氮营养效率及其相关性状。
3.2 不同浓度磷、钾处理下,小麦苗期氮效率相关性状的QTL近年来,关于小麦氮营养效率相关性状QTL的研究已有一些报道。这些报道涉及不同的生长环境,如在高氮和低氮处理下,有液培试验[8-9]、盆栽试验[26]和大田试验[7-8, 10, 27-28]。但由于养分之间存在复杂的相互作用,且QTL受环境影响较大,而探讨不同养分处理对QTL影响的报道很少。本研究对不同P、K浓度,共9个处理条件下的10个苗期性状进行了QTL分析,共定位到137个QTL。其中有122个(89.05%)仅在一个处理中被检测到。不同处理条件下检测到的QTL数量存在很大差异,9个处理(MPMK、HP、LP1、LP2、LP3、HK、LK1、LK2、LK3)检测到的QTL (QTL-处理)数目分别为25、19、16、16、22、17、13、19和13个。其中对照处理检测到的QTL数目最多。表明磷、钾胁迫会显著影响N养分效率相关QTL的表达。许多研究也表明,不同营养环境下同一营养性状所检测到的QTL的数量和位置存在很大差异[8, 12, 26-27]。这表明控制小麦氮养分效率的QTL/基因系统在不同养分环境条件下有很大调整,需要从整体的概念去理解这种系统上的调整工程。
同时,我们也发现,有15个QTL至少在2~4个处理环境中被定位到,其中,QRnue-1A.2、QSnue-1A.1和QTnue-1A.1这3个QTL可在至少4个处理环境中被定位到(图 1),表明这3个QTL在不同磷、钾浓度环境中的表达频率较高。另外,在这15个相对稳定的QTL中,有5个可在低磷和低钾环境中同时被检测到,分别为QRnue-1A.1、QTnue-1A.1、QSnc-4A、QRnc-6A.3和QSnue-6B。说明这几个QTL在低磷和低钾胁迫的环境下均可以发挥作用。可见,这些QTL对植物在低磷和低钾条件下调控氮的利用效率均是有效的。其调控机理还需要更深入研究。这些表达相对稳定的QTL对作物育种具有重要意义,值得深入了解。
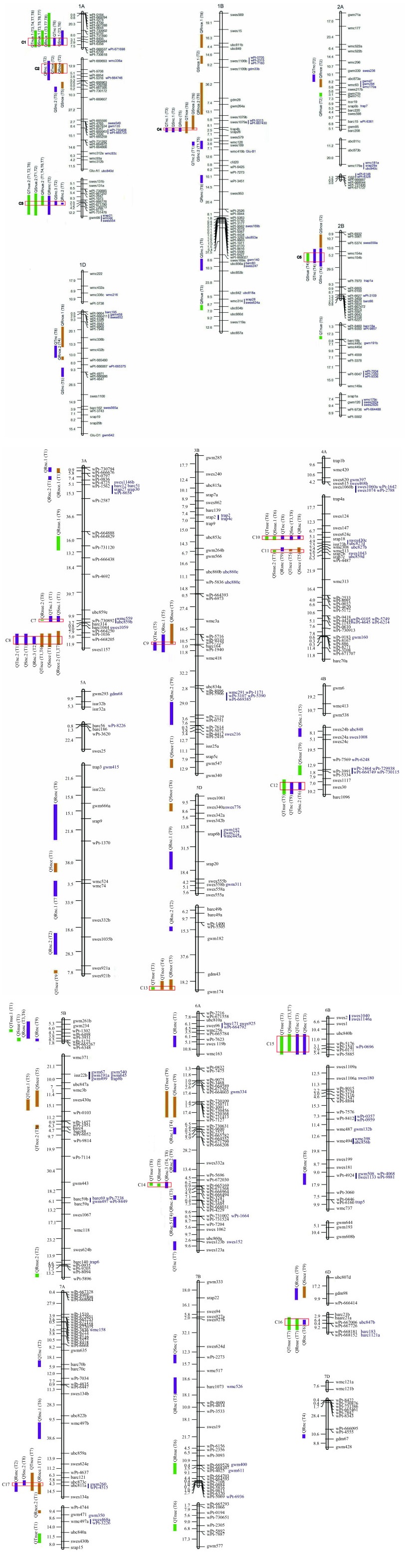 |
| 图1 小麦苗期QTL位点在遗传图谱上的位置 Fig. 1 Locations of QTLs for wheat seedling traits under different P and K treatments |
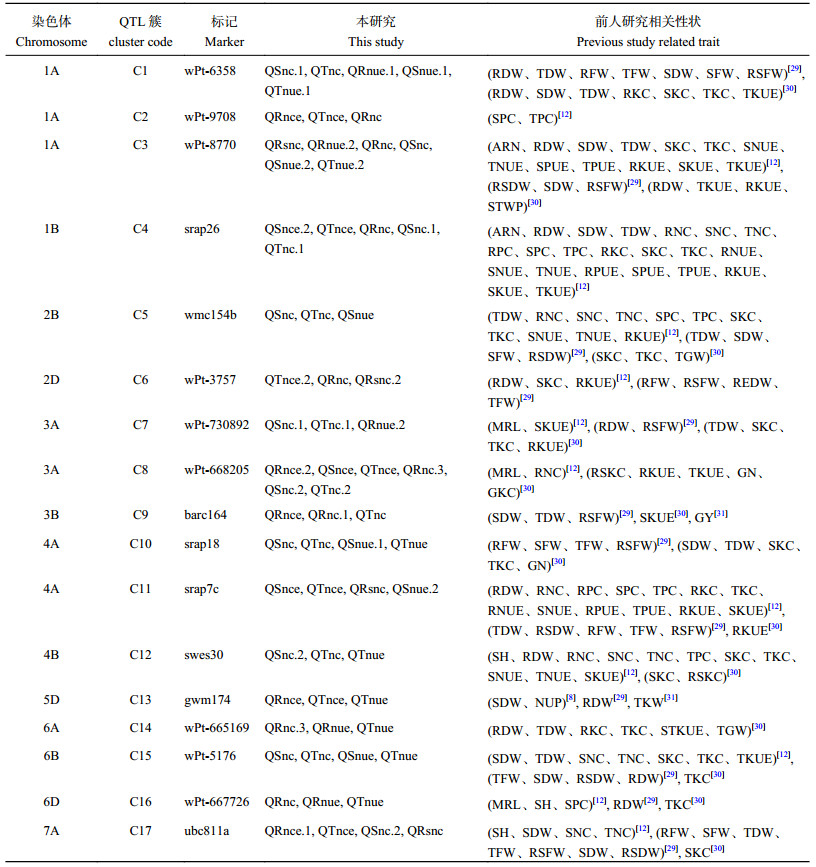
本试验检测到的许多QTL前人的试验中也在其他营养环境中检测到(表 6)[8, 12, 29-33],这些QTL的环境稳定性相对较好,也是值得关注的热点区域。
| 表6 本研究与前人研究所定位QTL位点与性状比较 Table 6 Comparison of the QTL location and trait between previous and this study |
 |
控制不同性状的QTL会定位到染色体相同的位点上,形成QTL簇。本研究共检测到76个染色体位点,其中有39个位点只定位到1个QTL,其余位点可在一个或几个环境中定位到几个不同性状的QTL,形成QTL簇。可见,QTL簇的形成是一个普遍现象,反映了一个QTL/基因在一个或几个环境中的不同作用。本试验共检测到与至少3个性状相关的17个QTL簇(C1~C17),由66个QTL组成,占QTL定位总数的48.18% (图 1,表 5)。这表明接近一半与氮效率性状相关的QTL主要集中在少数几个区域。
不同磷、钾处理条件对QTL簇也有很大影响。有些QTL簇仅在特定处理下存在,例如C5、C9、C13只在低磷下被检测到,C2只在高磷下被检测到,C16只在不同的钾处理中被检测到。然而,大多数的QTL簇在不同磷和钾处理中均能够被检测到。可见,有些QTL簇仅在植物适应低磷或者低钾处理时控制氮的养分效率,而有些位点则在低磷、低钾条件下均发挥作用,这些位点对进一步研究小麦氮营养均有一定的参考价值。
3.4 与其他性状有关的QTL簇热点区域通过与前人的研究结果进行对比,发现许多QTL簇位点也在不同环境中检测到与其他的一些性状相关(表 7)。例如,在1D染色体的wmc432标记附近,我们定位到了根系氮含量、总氮累积量性状的QTL;Guo等[12]定位到了主根数、株高、单株根干重、单株地上部干重、单株总重、地上部氮累积量、总氮累积量、地上部磷累积量、总磷累积量、根钾累积量、地上部钾累积量、总钾累积量、地上部氮利用率、总氮利用率、根磷利用率、地上部磷利用率、总磷利用率、根钾利用率、地上部钾利用率、总钾利用率性状的QTL;Sun等[29]定位到了单株总干重、单株总鲜重、单株地上部干重、单株根鲜重、单株地上部鲜重性状的QTL;Kong等[30]定位到了根系钾利用率、地上部钾利用率、千粒重、籽粒钾利用率性状的QTL;Xu等[31]定位到了株穗数性状的QTL。此外,位于2B染色体标记wmc154b附近的QTL簇C5,检测到与地上部氮累积量、总氮累积量、地上部氮利用率性状有关,而Guo等[12]检测到与单株总重、根氮累积量、地上部氮累积量、总氮累积量、地上部磷累积量、总磷累积量、地上部钾累积量、总钾累积量、地上部氮利用率、总氮利用率、根钾利用率性状有关;Sun等[29]检测到与单株总干重、单株地上部干重、单株地上部鲜重、根冠比性状有关;Kong等[30]检测到与地上部钾累积量、总钾累积量和千粒重性状有关。可见,这些热点区域不仅与小麦苗期氮素养分效率的控制有关,还同时与众多的其他元素营养性状及产量性状有关。这些位点可能包含在不同生育阶段均起作用的不同或相同基因。这些QTL热点区域,很可能是基因富集的区域,值得进一步研究。
| 表7 本研究与前人研究所定位QTL簇的比较 Table 7 Comparison of the QTL clusters between previous studies and this study |
 |
磷、钾的供应能够显著影响小麦苗期的氮素吸收利用及其相关QTL的表达。影响苗期小麦氮养分效率相关性状的QTL大多数仅在特定处理下被检测到,但是大多数QTL会被集中定位在特定染色体位点上形成QTL簇,构成了氮养分效率控制的QTL热点,这些热点区域也与前人定位的许多成株期性状有关,值得深入探讨。
| [1] |
张福锁, 崔振岭, 王激清. 中国土壤和植物养分管理现状与改进策略[J].
植物学通报, 2007, 24(6): 687–694.
Zhang F S, Cui Z L, Wang J Q. Current status of soil and plant nutrient management in China and improvement strategies[J]. Chinese Bulletin of Botany, 2007, 24(6): 687–694. |
| [2] | Schachtman D P, Shin R. Nutrient sensing and signaling:NPKS[J]. Annual Review of Plant Biology, 2007, 58: 47–69. DOI:10.1146/annurev.arplant.58.032806.103750 |
| [3] | Giles J. Nitrogen study fertilizes fears of pollution[J]. Nature, 2005, 433(7028): 791. DOI:10.1038/433791a |
| [4] | Davidson E A. The contribution of manure and fertilizer nitrogen to atmospheric nitrous oxide since 1860[J]. Nature Geoscience, 2009, 2(9): 659–662. DOI:10.1038/ngeo608 |
| [5] | Yan X, Wu P, Ling H, et al. Plant nutriomics in China:an overview[J]. Annals of Botany, 2006, 98(3): 473–482. DOI:10.1093/aob/mcl116 |
| [6] | Doerge R W. Mapping and analysis of quantitative trait loci in experimental populations[J]. Nature Reviews Genetics, 2002, 3(1): 43–52. DOI:10.1038/nrg703 |
| [7] | Quarrie S, Steed A, Calestani C, et al. A high-density genetic map of hexaploid wheat (Triticum aestivum L^) from the cross Chinese Spring×SQ1 and its use to compare QTLs for grain yield across a range of environments[J]. Theoretical and Applied Genetics, 2005, 110(5): 865–880. DOI:10.1007/s00122-004-1902-7 |
| [8] | An D, Su J, Liu Q, et al. Mapping QTLs for nitrogen uptake in relation to the early growth of wheat (Triticum aestivum L^)[J]. Plant and Soil, 2006, 284(1-2): 73–84. DOI:10.1007/s11104-006-0030-3 |
| [9] | Laperche A, Devienne-Barret F, Maury O, et al. A simplified conceptual model of carbon/nitrogen functioning for QTL analysis of winter wheat adaptation to nitrogen deficiency[J]. Theoretical and Applied Genetics, 2006, 113(6): 1131–1146. DOI:10.1007/s00122-006-0373-4 |
| [10] | Laperche A, Brancourt-Hulmel M, Heumez E, et al. Using genotype×nitrogen interaction variables to evaluate the QTL involved in wheat tolerance to nitrogen constraints[J]. Theoretical and Applied Genetics, 2007, 115(3): 399–415. DOI:10.1007/s00122-007-0575-4 |
| [11] | Fageria N K. The use of nutrients in crop plants [M]. Boca Raton: CRC Press, FL, 2009. |
| [12] | Guo Y, Kong F M, Xu Y F, et al. QTL mapping for seedling traits in wheat grown under varying concentrations of N, P and K nutrients[J]. Theoretical and Applied Genetics, 2012, 124(5): 851–865. DOI:10.1007/s00122-011-1749-7 |
| [13] | Hoagland D R, Arnon D I. The water-culture method for growing plants without soil[J]. Circular California Agricultural Experiment Station, 1950, 347: 32. |
| [14] | Kjeldahl J. A new method for the determination of nitrogen in organic matter[J]. Analytical and Bioanalytical Chemistry, 1883, 22(1): 366–382. |
| [15] | Siddiqi M Y, Glass A D. Utilization index:a modified approach to the estimation and comparison of nutrient utilization efficiency in plants[J]. Journal of Plant Nutrition, 1981, 4(3): 289–302. DOI:10.1080/01904168109362919 |
| [16] | Knapp S, Stroup W, Ross W. Exact confidence intervals for heritability on a progeny mean basis[J]. Crop Science, 1985, 25(1): 192–194. DOI:10.2135/cropsci1985.0011183X002500010046x |
| [17] | Wang Y Y, Sun X Y, Zhao Y, et al. Enrichment of a common wheat genetic map and QTL mapping for fatty acid content in grain[J]. Plant Science, 2011, 181(1): 65–75. DOI:10.1016/j.plantsci.2011.03.020 |
| [18] | Wang S, Basten C, Zeng Z. Windows QTL cartographer 2^5 [M]. Raleigh, NC: Department of Statistics, North Carolina State University, 2007. |
| [19] | Churchill G A, Doerge R W. Empirical threshold values for quantitative trait mapping[J]. Genetics, 1994, 138(3): 963–971. |
| [20] | Stoll M, Kwitek-Black A E, Cowley A W, et al. New target regions for human hypertension via comparative genomics[J]. Genome Research, 2000, 10(4): 473–482. DOI:10.1101/gr.10.4.473 |
| [21] |
孙海国, 张福锁. 小麦根系生长对缺磷胁迫的反应[J].
植物学报, 2000, 42(9): 913–919.
Sun H G, Zhang F S. Growth response of wheat roots to phosphorus deficiency[J]. Acta Botanica Sinica, 2000, 42(9): 913–919. |
| [22] | Yuan H, Liu D. Signaling components involved in plant responses to phosphate starvation[J]. Journal of Integrative Plant Biology, 2008, 50(7): 849–859. DOI:10.1111/jipb.2008.50.issue-7 |
| [23] |
谭金芳, 苗玉红, 张许, 等. 钾肥不同基追比对冬小麦产量、养分累积量及钾肥利用效率的影响[J].
江西农业学报, 2009, 21(12): 46–48.
Tan J F, Miao Y H, Zhang X, et al. Effects of ratio of basal to dressing application of potassium fertilizer on yield, nutrient accumulation of winter wheat and use efficiency of potassium fertilizer[J]. Acta Agriculturae Jiangxi, 2009, 21(12): 46–48. |
| [24] |
邹铁祥, 戴廷波, 姜东, 等. 钾素水平对小麦氮素积累和运转及籽粒蛋白形成的影响[J].
中国农业科学, 2006, 39(4): 686–692.
Zou T X, Dai T B, Jiang D, et al. Potassium supply affected plant nitrogen accumulation and translocation and grain protein formation in winter wheat[J]. Scientia Agricultura Sinica, 2006, 39(4): 686–692. |
| [25] | Servaites J C. Energy development loading of amino acids and sucrose into the phloem of soybeam[J]. Plant Physiology, 1979, 64(4): 546–550. DOI:10.1104/pp.64.4.546 |
| [26] | Habash D, Bernard S, Schondelmaier J, et al. The genetics of nitrogen use in hexaploid wheat:N utilisation, development and yield[J]. Theoretical and Applied Genetics, 2007, 114(3): 403–429. DOI:10.1007/s00122-006-0429-5 |
| [27] | Fontaine J X, Ravel C, Pageau K, et al. A quantitative genetic study for elucidating the contribution of glutamine synthetase, glutamate dehydrogenase and other nitrogen-related physiological traits to the agronomic performance of common wheat[J]. Theoretical and Applied Genetics, 2009, 119(4): 645–662. DOI:10.1007/s00122-009-1076-4 |
| [28] | Laperche A, Le Gouis J, Hanocq E, Brancourt-Hulmel M. Modelling nitrogen stress with probe genotypes to assess genetic parameters and genetic determinism of winter wheat tolerance to nitrogen constraint[J]. Euphytica, 2008, 161(1-2): 259–271. DOI:10.1007/s10681-007-9433-3 |
| [29] | Sun J J, Guo Y, Zhang G Z, et al. QTL mapping for seedling traits under different nitrogen forms in wheat[J]. Euphytica, 2013, 191(3): 317–331. DOI:10.1007/s10681-012-0834-6 |
| [30] | Kong F M, Guo Y, Liang X, et al. Potassium (K) effects and QTL mapping for K efficiency traits at seedling and adult stages in wheat[J]. Plant and Soil, 2013, 373(1-2): 877–892. DOI:10.1007/s11104-013-1844-4 |
| [31] | Xu Y, Wang R, Tong Y, et al. Mapping QTLs for yield and nitrogen-related traits in wheat:influence of nitrogen and phosphorus fertilization on QTL expression[J]. Theoretical and Applied Genetics, 2014, 127(1): 59–72. DOI:10.1007/s00122-013-2201-y |
| [32] | Li S S, Jia J Z, Wei X Y, et al. A intervarietal genetic map and QTL analysis for yield traits in wheat[J]. Molecular Breeding, 2007, 20(2): 167–178. DOI:10.1007/s11032-007-9080-3 |
| [33] | Su J Y, Zheng Q, Li H W, et al. Detection of QTLs for phosphorus use efficiency in relation to agronomic performance of wheat grown under phosphorus sufficient and limited conditions[J]. Plant Science, 2009, 176(6): 824–836. DOI:10.1016/j.plantsci.2009.03.006 |
 2016, Vol. 22
2016, Vol. 22  doi:
doi: 

