2. 河北农业大学河北省作物生长调控重点实验室,河北保定 071000;
3. 河北农业大学园林与旅游学院,河北保定 071000
2. Agricultural University of Hebei, Key Laboratory of Crop Growth Regulation of Hebei Province, Baoding, Hebei 071000, China;
3. College of Landscape and Tourism, Agricultural University of Hebei, Baoding, Hebei 071000, China
磷是植物生长发育必不可少的营养元素,它以多种途径参与植物代谢,是植物体内许多重要化合物的组成成分。植物所需的磷素主要来源于土壤,但大多数农业土壤中磷都是限制作物生长与产量的主要因素之一 [ 1] 。生产上主要通过施磷肥来满足作物的磷素营养,但作物对磷肥的利用率却很低。小麦是世界上主要粮食作物之一,因此研究根系对磷素的高效利用,对提高小麦产量及保障世界粮食安全具有重要意义。
根系是植物的活跃吸收器官和合成器官,也是最先感受土壤逆境胁迫因子信号的器官。在低磷胁迫下,小麦根系首先感受并传导胁迫信号,随后植株通过调整自身的生理机制来改变形态,进而影响内部的代谢过程,以完成在特定环境下的生命过程 [ 2] 。小麦根系生长量相对增加和根冠比增大是植物对低磷胁迫适应和耐低磷能力的标志 [ 3] 。根系适应低磷的生理变化包括根系分泌物的增加、根系活力提高、养分的吸收效率增强等方面。根系活力是一种客观地反映根系生命活动的重要生理指标 [ 4] 。研究表明,低磷条件下小麦的磷利用效率与其根系形态、吸收效率、酸性磷酸酶 (APase) 和核糖核酸酶 (RNase) 等生理生化特性密切相关 [ 5] 。APase 主要存在于植物根的表皮或叶的下表面,或由根分泌到外部的介质中,当小麦生长在低磷条件下,APase 活性显著升高,降解土壤中的有机磷,如核酸、磷脂和糖脂等,从而使有机磷转变为无机磷被作物吸收利用 [ 6] 。RNase 是一种 RNA 水解酶,低磷胁迫下,小麦叶片中 RNase 活性显著增强,核酸含量降低,表明在低磷逆境中,小麦为了适应这一特殊的环境,体内的适应性反应十分剧烈,导致植株 RNA 的大量合成,特别伴随着某些或某种适于低磷胁迫的特异 mRNA 的优先合成,以利于某些特异诱导蛋白或酶活性增强,使小麦能在低磷下最大限度地利用有限的磷素,确保植株完成其必要的生命过程 [ 7] 。小麦代换系是一个物种或品种的个别染色体代换另一个物种或品种相应染色体所产生的品系,是研究个别染色体遗传调控效应的理想材料。中国春 (CS)-Synthetic 6x 的 21 个代换系是将供体品种 Synthetic 6x 的 21 条染色体导入受体品种中国春所产生的,父本 Synthetic 6x 与母本中国春存在较大的遗传差异,父本的 A、B 染色体来自四倍体小麦 (硬粒小麦),D 染色体来自粗山羊草,该种蕴含着丰富的抗旱、抗虫、抗寒等优异基因,具有极其丰富的遗传多样性,在小麦遗传改良中具有良好的利用价值 [ 8- 9] 。近年来,我们已利用该代换系开展了低磷胁迫对其生理性状、产量性状的影响及染色体效应研究 [ 10- 12] ,但有关小麦代换系根系性状及生理特征的研究较少。因此,本研究以中国春 (CS)-Synthetic 6x 代换系为材料,研究小麦代换系幼苗期的根冠比、根系活力和 APase、RNase 活性对低磷胁迫的响应,并对小麦耐低磷胁迫特性基因进行染色体定位,为进一步研究小麦的耐低磷机制和耐低磷基因型的遗传改良提供理论依据。
1 材料与方法 1.1 试验材料中国春 (CS)-Synthetic 6x 小麦染色体代换系 (21 个基因型),母本 CS、父本 Synthetic 6x 由 John Innes Centre, Norwich Research Park, Colney, Norwich NR4 7UH, UK 提供,母本为磷低效品种,父本 Synthetic 6x 为磷高效品种 [ 12] 。
1.2 试验方法本试验于 2012~2013 年在河北农业大学河北省作物生长调控重点实验室进行。选取饱满、均匀的小麦代换系种子,经 70% 乙醇消毒 15 min,去离子水冲洗并浸泡 24 h 后,均匀摆放在铺有滤纸的培养皿中,置于 20 ± 2℃ 光照培养箱中培养,每天用去离子水浇灌,5 d 后选择生长势一致的健壮幼苗,去掉胚乳,后移入 pH = 6.0 左右的 Hoagland 营养液中进行培养,容器为 30 cm × 40 cm × 10 cm 长方形聚乙烯塑料盆,每基因型 6 盆,每盆中各基因型 30 株,随机排列。每三天通一次气,每七天更换一次营养液。待幼苗两叶一心时进行处理,设置对照 (磷浓度为 2 mmol/L) 和低磷胁迫 (磷浓度为 20 μmol/L) 两个处理 [ 13] ,每处理重复 3 次,四叶一心时对各个指标进行取样测定。相对值 = 低磷值/对照值。
1.2.1 根冠比分别选取 5 株长势一致生长健壮的小麦代换系,测定对照和低磷胁迫下根和地上部分的干物质重,采用烘干法测定干物重,3 次重复。
1.2.2 根系活力取正常与低磷条件幼苗根系,移至水管下缓慢冲洗至根系不附杂物,随机取不同处理的各代换系根尖,每份样本约 0.3 g,参照魏道智等 [ 14] 的方法测定根系活力,3 次重复。
1.2.3 根系 APase 活性参照孙海国等的方法 [ 15] 并加以修改。随机取不同处理的各代换系根尖 1 g,加入 8 mL 醋酸钠缓冲液 (pH = 5.8),冰浴研磨,用双层纱布过滤,滤液在 12000 × g 下离心 15 min。取上清液 1 mL,加入底物 (10 mmol ρ-Nitrophenyhphospahte) 2 mL,37℃ 水浴 30 min,加入 1 mol/L NaOH 2 mL 终止反应。3000 × g 离心 2 min 后在 405 nm 下比色,以吸光值作为其酸性磷酸酯酶活性的指标,3 次重复。
1.2.4 根系 RNase 活性参照李玉京等 [ 8] 的方法。随机取不同处理的各代换系根尖,每份 0.5 g,加入 4 mL 0.02 mol/L 磷酸缓冲液 ( pH = 7.0),研磨后在 10000 × g 冰冻离心 30 min,取上清液 0.1 mL 加入含有酵母核糖核酸 ( 2 mg/mL) 的 0.1 mol/L ( pH = 5.0 ) 醋酸缓冲液 1 mL,在 37℃ 水浴锅中保温 15 min 后加入 5 mL 95% 乙醇。以 0 h 加入乙醇者为对照。塞紧,摇匀,于冰箱 (4℃) 中放置过夜,反应液以 10000 × g 离心 10 min,取 600 mL 上清液加 3 mL 酒精稀释后在 260 nm 测定,1.0 OD 相当于 15 min 内核糖核酸酶分解 31.7 μg/mL 核糖核酸。3 次重复。
1.3 统计分析采用 Microsoft Excel 2010 和 DPSv9.50 软件对数据进行统计分析,采用 Duncan’s 新复极差法进行差异显著性检测。
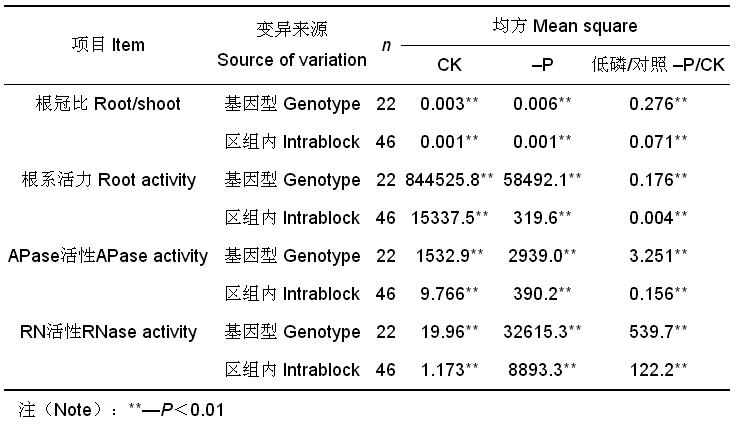
2 结果与分析 2.1 基因型间的差异显著性检验不同处理各基因型间及区组内间的根冠比、根系活力和 APase、RNase 活性均有极显著差异( P < 0.01) ( 表 1),表明可以利用该代换系进行根冠比、根系活力和 APase、RNase 活性的染色体定位。
| 表1 CS-Synthetic 6x 亲本及代换系根冠比、根系活力和 APase、RNase 活性方差分析 Table 1 Variation analysis of root-shoot ratio, root actvity, APase and RNase activity of CS-Synthetic 6x substitution lines and their parents |
 |
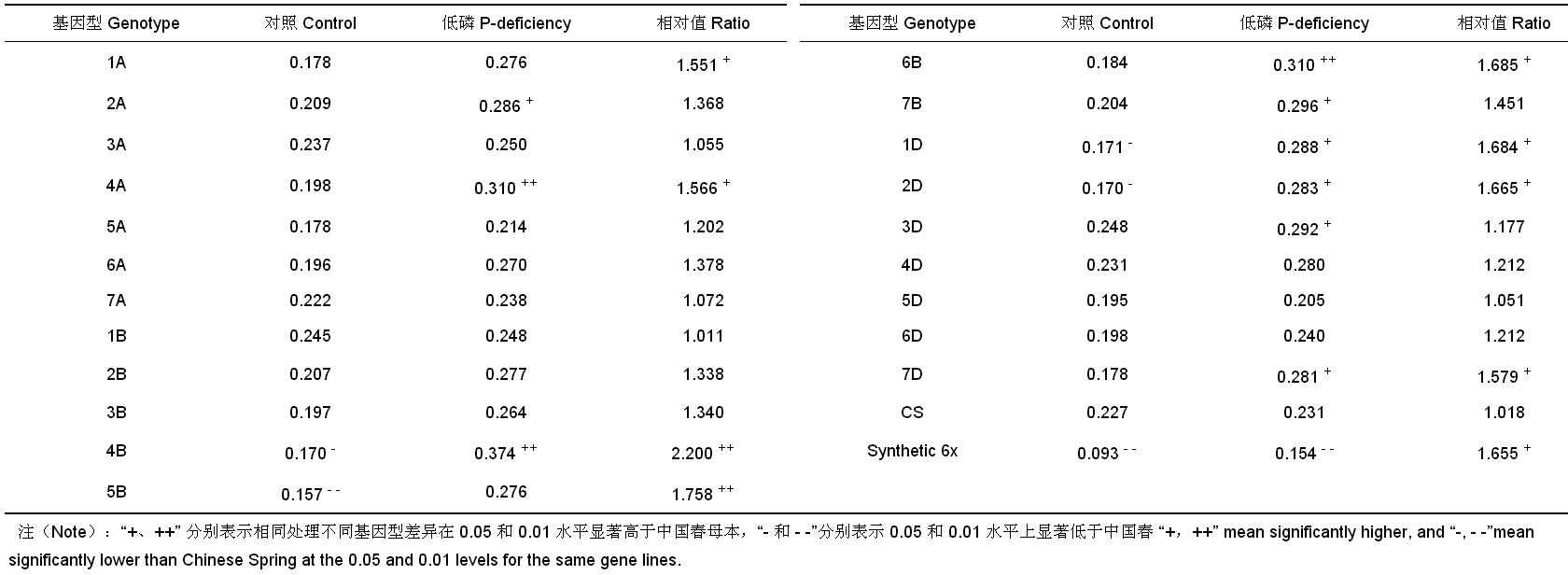
由 表 2 可以看出,对照各代换系根冠比较低,其比值位于 0.157(5B)~0.248(3D) 之间,除父本 Synthetic 6x 及 4B、5B、1D、2D 代换系根冠比显著或极显著低于母本外,其余代换系与母本之间无显著差异。在低磷胁迫下,所有代换系根冠比均明显高于对照,表明低磷胁迫刺激了小麦代换系根系生长。不同代换系之间存在明显差异,其比值位于 0.205(5D)~0.310(4A、6B) 之间。与母本相比,代换系 2A、4A、4B、6B、7B、1D、2D、3D 和 7D 根冠比显著或极显著增高,父本 Synthetic 6x 以及代换系 1A、4A、4B、5B、6B、1D、2D 和 7D 的相对根冠比亦显著或极显著增高。由此表明,Synthetic 6x 的 4A、4B、6B、1D、2D 和 7D 染色体上可能存在低磷胁迫下诱导根冠比增强的基因。
| 表2 低磷胁迫和对照条件下中国春-Synthetic 6x 代换系及亲本根冠比 Table 2 Root-shoot ratios of CS-Synthetic 6x substitution lines and their parents under low-phosphorus stress and control |
 |
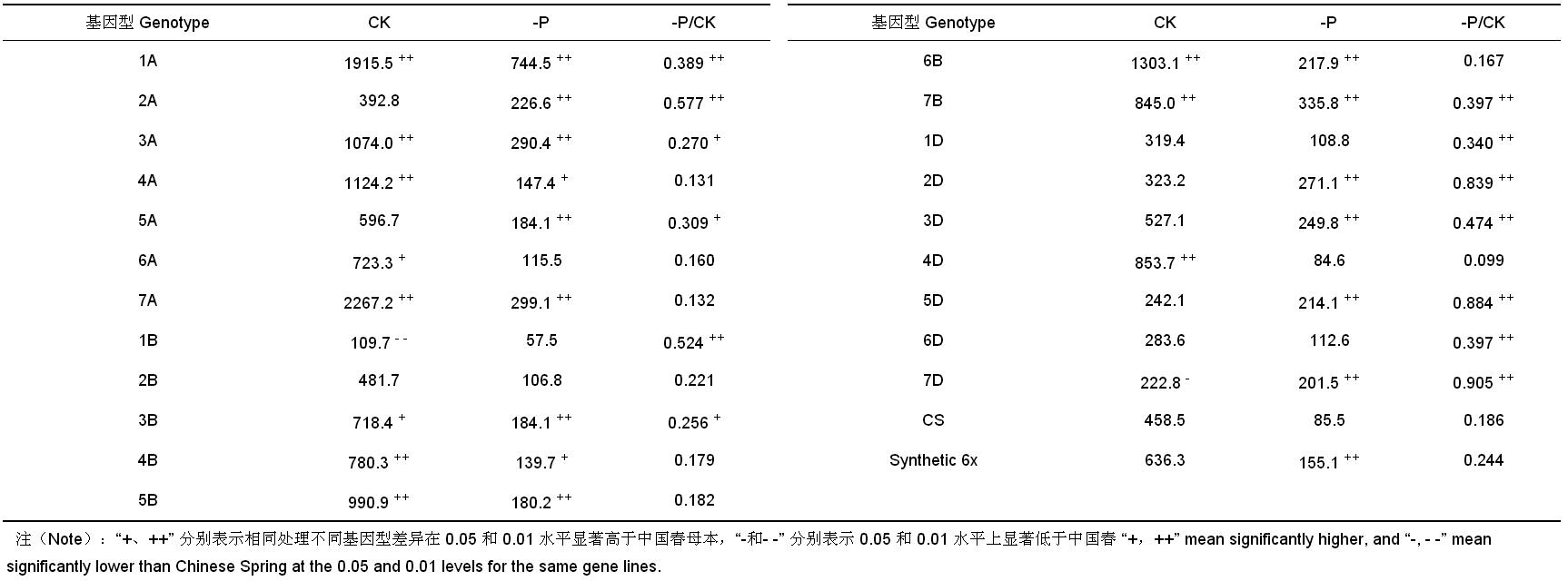
如 表 3 所示,对照各代换系根系活力较高,其含量位于 222.8 (7D)~1915.5 (1A) [TTFμg / (g·h), FW] 之间,除1A、3A、4A、6A、7A、3B、4B、5B、6B、7B、4D 代换系根冠比显著或极显著高于中国春外,其余代换系与母本之间无显著差异;低磷胁迫下,各代换系的根系活力都明显低于对照,表明低磷胁迫抑制了小麦根系活力。低磷胁迫下,不同代换系根系活力之间存在显著差异,4D 代换系根系活力最低,1A 代换系根系活力最高。供体 Synthetic 6x 的根系活力极显著高于受体中国春,1A、2A、3A、4A、5A、7A、3B、4B、5B、6B、7B、2D、3D、5D 和 7D 代换系根系活力显著或极显著高于母本中国春,1A、2A、3A、5A、1B、3B、7B、1D、2D、3D、5D、6D 和 7D 代换系的相对根系活力显著或极显著高于母本中国春。由此表明,Synthetic 6x 的 1A、2A、3A、5A、3B、7B、2D、3D、5D 和 7D 染色体上可能存在低磷胁迫下诱导根系活力增强的基因。
| 表3 低磷胁迫和对照中国春-Synthetic 6x 代换系及其亲本根系活力 [TTF μg/(g · h), FW] Table 3 Root activity of CS-Synthetic 6x substitution lines and their parents under low-phosphorus stress and control |
 |
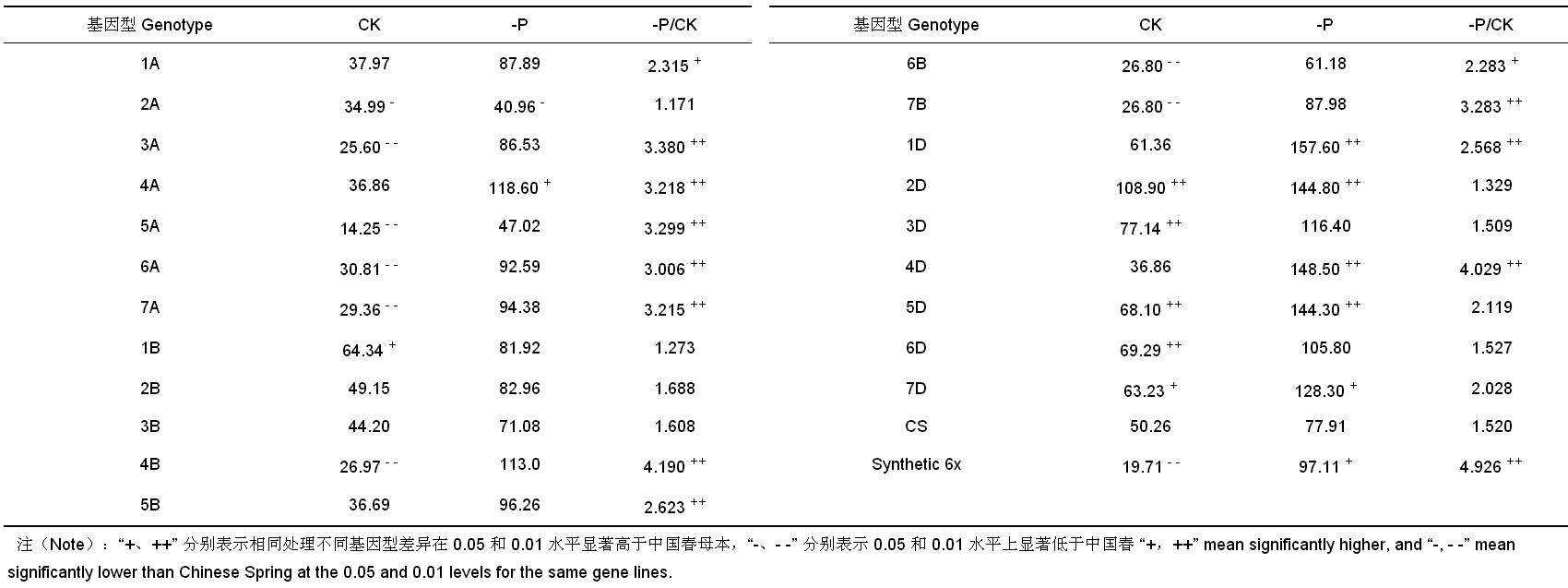
酸性磷酸酶 (APase) 是植物水解有机磷的一种诱导酶。正常情况下,植物根际分泌物中酸性磷酸酶的量很少,但是在缺磷情况下酸性磷酸酶的量将会增加,以此增加根际有效磷含量 [ 9] 。如 表 4所示,对照各代换系酸性磷酸酶活性较低,其含量位于 14.25 (5A)~108.90 (2D)[μmol / (mg · h)] 之间,除 1A、4A、2B、3B、5B、1D、4D 代换系外,其余代换系与中国春之间均呈现显著差异,供体 Synthetic 6x 显著低于母本中国春。低磷胁迫下,所有代换系的根系酸性磷酸酶活性都明显高于对照,表明小麦代换系主要通过提高根系的酸性磷酸酶活性来吸收土壤潜在磷,以适应低磷胁迫。此外,不同代换系之间存在显著差异,2A 代换系酸性磷酸酶活性最低,1D 代换系酸性磷酸酶活性最高。与母本中国春相比,供体 Synthetic 6x 的根系酸性磷酸酶活性和相对酸性磷酸酶活性均显著增高;4A、1D、2D、4D、5D 和 7D 代换系根系酸性磷酸酶活性显著或极显著增高;1A、3A、4A、5A、6A、7A、4B、5B、6B、7B、1D 和 4D 代换系的根系相对酸性磷酸酶活性显著或极显著增高。由此表明,Synthetic 6x 的 4A、1D 和 4D 染色体上可能存在低磷胁迫下诱导根系酸性磷酸酶活性增强的基因。
| 表4 低磷胁迫和对照中国春-Synthetic 6x 代换系及其亲本幼苗期根系酸性磷酸酶活性 [μmol/(mg · h)] Table 4 APase activity of CS-Synthetic 6x substitution lines and their parents under low-phosphorus stress and control at seedling stage |
 |
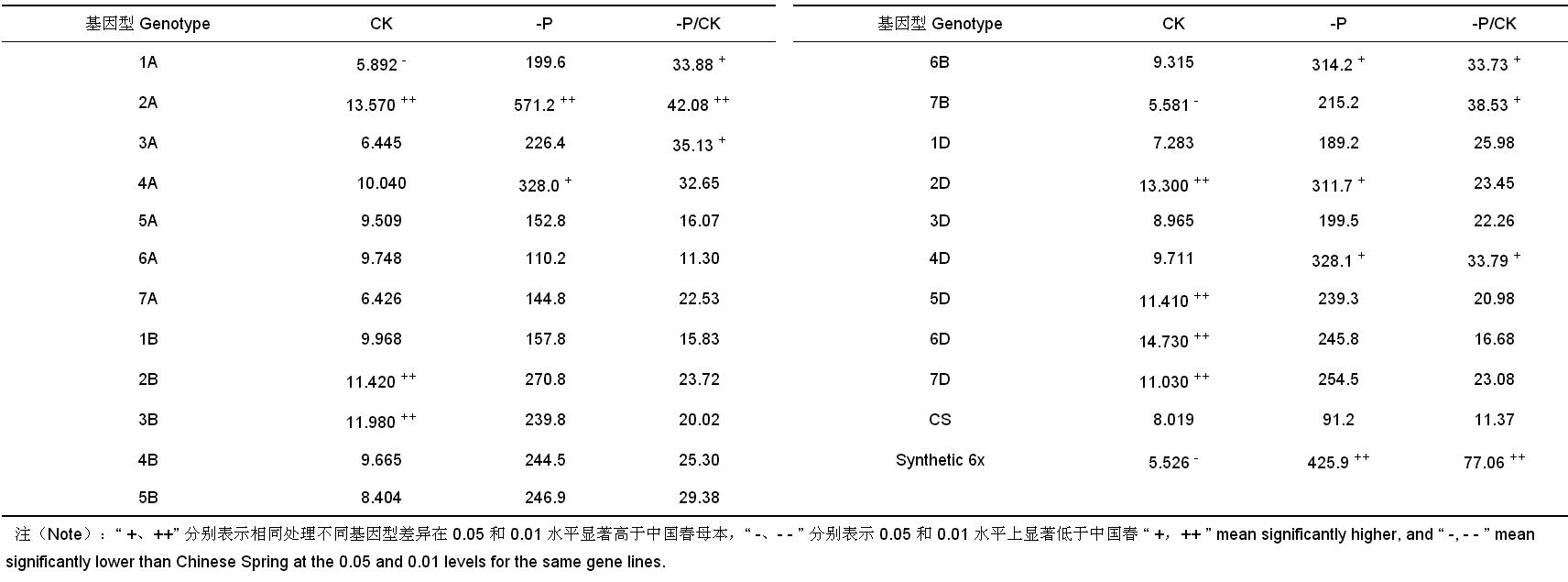
由 表 5 可以看出,对照条件下各代换系酸性磷酸酶活性较为接近,其含量位于 5.581 (7B)~14.73 (6D)[μg/(g · h), protein] 之间,除 2A、2B、3B、2D、5D、6D、7D 代换系显著或极显著高于中国春外,其余代换系与中国春之间无显著差异,供体 Synthetic 6x 的根系酸性磷酸酶活性较低,中国春较高,二者之间呈现显著差异。低磷胁迫下,所有代换系的根系 RNase 活性都高于对照,表明小麦受到低磷胁迫后,诱导产生 RNase 使体内 RNA 大量释放 PO 4 3-。低磷胁迫下,不同代换系之间存在显著差异,其活性位于 110.2 (6A)~571.2 (2A) 之间,供体 Synthetic 6x 的根系 RNase 活性和相对 RNase 活性均极显著高于受体中国春,2A、4A、6B 和 2D、4D 代换系根系 RNase 活性显著或极显著高于母本中国春,1A、2A、3A、6B、7B 和 4D 代换系的相对根系 RNase 活性显著或极显著高于母本中国春。即 Synthetic 6x 的 2A、6B 和 4D 染色体上可能存在低磷胁迫下诱导根系 RNase 活性增强的基因。
| 表5 低磷胁迫和对照中国春-Synthetic 6x 代换系及其亲本根系 RNase 活性 [μg/(g·h), protein] Table 5 RNase activity of CS-Synthetic 6x substitution lines and their parents under low-phosphorus stress and control |
 |
通过对以上相关性状进行染色体定位分析,发现在低磷胁迫下,诱导根冠比升高的基因可能位于 Synthetic 6x 的 4A、4B、6B、1D、2D 和 7D 染色体上,诱导根系活力增强的基因可能位于 1A、2A、3A、5A、3B,7B、2D、3D、5D 和 7D 染色体上,诱导根系酸性磷酸酶活性增强的基因可能位于 4A、1D 和 4D 染色体上,诱导根系 RNase 活性增强的基因可能位于 2A、6B 和 4D 染色体上。由此表明,除根系活力外,4A、4B 或 4D 染色体上具有诱导根冠比、根系酸性磷酸酶、 RNase 活性的基因,即 Synthetic 6x 第四染色体 (4A、4B 和 4D) 可能具有调控根系特性的关键基因。
3 讨论 3.1 低磷胁迫对小麦代换系根系生理性状的影响植物根系是感受土壤逆境胁迫因子信号的重要器官。植物感受逆境信号后就会产生相应的反应,如改变根系形态和分布、改变碳同化产物的分配比例和方向,在代谢途径上进行方向和强度的改变,在基因表达上进行时间和空间调整等,这些反应最终均通过根系来进行表达和实现 [ 16- 17] 。
APase 是一种诱导酶,能水解介质中的磷酯,使其中的磷活化为植物所吸收利用,其活性受植物供磷状况的影响,缺磷能诱导小麦根系 APase 活性显著升高,它是缺磷胁迫后植物最早和最为剧烈的反应之一,是小麦适应低磷胁迫的一种机制 [ 5, 20] 。低磷胁迫导致高等植物的特异RNA酶活性升高,RNase活性增强使RNA降解加剧,释放 PO 4 3-,这对于增强 PO 4 3- 在体内的流动性以及充分利用体内有效磷资源具有重要意义。李玉京等 [ 7] 以长穗偃麦草-中国春二体附加系为材料,对不同磷处理条件下的 APase 活性和 RNase 活性进行了研究,表明低磷条件下 APase 活性和 RNase 活性均显著提高。张恩和等 [ 6] 研究了低磷胁迫下不同小麦品种对磷胁迫的适应性反应,发现低磷胁迫显著提高了体内各部分 APase 活性。本试验结果表明,低磷胁迫下根系酸性磷酸酶活性和 RNase 活性升高,这是小麦代换系在生理上对低磷做出的一种响应。
3.2 低磷胁迫下小麦代换系根系生理性状的染色体效应近年来,有关小麦代换系耐低磷性状基因的染色体定位已成为国内外专家的研究热点 [ 21] 。曹红星等 [ 22] 利用小麦‘中国春-埃及红’代换系进行研究,发现染色体 7A 和 7D 可能携带对磷素利用有促进作用的基因。李振兴等 [ 23] 以小麦重组近交系群体 (农大 3338 * Altgold) 为材料,发现在低磷处理下与根干重相关的 2 个 QTL 位点分别位于 lA 和 2B 染色体上,与相对根干重相关的 2 个 QTL 位点位于 7D 染色体上。Bhdaie 等 [ 24] 研究认为小麦 lA、3D 和 5A 染色体携带有对干重起正效应的基因。本试验研究结果表明,低磷胁迫下,Synthetic 6x 的 4A、4B、6B、1D、2D 和 7D 染色体上可能存在诱导根冠比升高的基因。
目前,有关小麦根系活力的基因定位少有报道。沈波等 [ 25] 应用杂交稻重组自交系群体,对叶片性状和根系活力进行了遗传分析和基因定位,发现在很多检测到产量性状 QTL 的区间也检测到控制叶片性状和根系活力的 QTL。藤胜等 [ 26] 以典型籼粳交花培加倍的 DH 群体为材料,利用区间作图法在第 4 染色体的 RG449~RG809 之间检测到一个根系活力的 QTL。本试验研究结果显示,低磷胁迫下,1A、2A、3A、5A、3B,7B、2D、3D、5D 和 7D 染色体上可能存在诱导根系活力增强的基因。
李玉京等 [ 7, 27] 以中国春-长穗偃麦草二体异附加系与二体异代换系为材料,对低磷胁迫下 APase 及 RNase 活性进行了染色体定位,认为 4E 与 7E 附加系提高了 RNA 酶活性,7E 附加系提高了酸性磷酸酶活性;3E 染色体上含有编码酸性磷酸酶 (AcPh) 基因,4E 染色体上含有碱性磷酸酶 (APH) 基因。刘建中等 [ 28] 利用中国春—帝国黑麦二体异附加系根系为材料,发现 1R 染色体上具有编码酸性磷酸酶的基因。柳鹏等 [ 29] 以 9 个外援染色体异附加系小麦为材料,发现在低磷条件下其酸性磷酸酶的活性显著高于其亲本中国春,说明 Ha. Villosa lV 和 Ae. Peregrina 7S v 染色体中可能含有与根系酸性磷酸酶分泌有关的基因。Hart [ 30] 则将编码酸性磷酸酶的基因定位到 7R 染色体上。本试验结果显示,低磷胁迫下 4A、1D 和 4D 染色体上可能存在诱导根系酸性磷酸酶活性增强的基因,2A、6B 和 4D 染色体上可能存在诱导根系 RNase 活性增强的基因。
通过对以上相关性状进行染色体定位分析,发现在低磷胁迫下,除根系活力外,4A、4B 或 4D 染色体上具有诱导根冠比、根系酸性磷酸酶、RNase 活性基因,由此表明 Synthetic 6x 第四染色体 (4A、4B 和 4D) 可能具有调控根系特性的关键基因。
| [1] | Vance C P. Plant nutrition in a world of declining renewable resources[J]. Plant Physiology, 2001, 127 : 390 –397. |
| [2] |
李慧明, 高志强, 张永清, 苗果园. 不同基因型春小麦根系对低磷胁迫的生物学响应[J].
山西农业大大学报, 2006, 26 (2) : 138 –140.
Li H M, Gao Z Q, Zhang Y Q, Miao G Y. The biological response of root system of different genotypes spring wheat to low phosphorus stress[J]. Journal of Shanxi Agricultural University, 2006, 26 (2) : 138 –140. |
| [3] | Li C J, Pang X, Zhang F S. Comparison on responses of different phosphorus-efficient wheat varieties to phosphorus-deficiency stress[J]. Acta Botanica Sinca, 2003, 45 (8) : 936 –943. |
| [4] |
郭程瑾, 李宾兴, 周彦珍, 等. 不同磷效率小麦品种的磷吸收特性[J].
植物遗传资源学报, 2006, 7 (1) : 49 –53.
Guo C J, Li B X, Zhou Y Z, et al. Characteristics of phosphorus acquisition in wheat varieties with different P efficiencies[J]. Journal of Plant Genetic Resources, 2006, 7 (1) : 49 –53. |
| [5] | Teng W, Deng Y, Chen X, et al. Characterization of root response to phosphorus supply from morphology to gene analysis in field-grown wheat[J]. Journal of Experimental Botany, 2013, 64 : 1403 –1411. |
| [6] |
张恩和, 王惠珍, 阎秋洁. 不同基因型春小麦对磷胁迫的适应性反应[J].
麦类作物学报, 2006, 26 (2) : 117 –120.
Zhang E H, Wang H Z, Yan Q J. Adaptable effects of phosphorus stress on different genotypes of spring wheat[J]. Journal of Triticeae Crops, 2006, 26 (2) : 117 –120. |
| [7] |
李玉京, 李滨, 李继云, 李振声. 低磷营养胁迫条件下小麦RNA酶与酸性磷酸酶活性的变化[J].
西北植物学报, 1997, 17 (4) : 417 –425.
Li Y J, Li B, Li J Y, Li Z S. Changes of RNase and acid phosphatase in common wheat under phosphorus deficiency stress[J]. Acta Botanica Boreali Occidentalia Sinica, 1997, 17 (4) : 417 –425. |
| [8] |
贾继增, 张正斌, DevosK, GaleM D. 小麦21条染色体RFLP作图位点遗传多样性分析[J].
中国科学, 2001, 31 (1) : 13 –21.
Jia J Z, Zhang Z B, Devos K, Gale M D. Genetic diversity analysis of RFLP mapping loci in 21 wheat chromosomes[J]. Science in China, 2001, 31 (1) : 13 –21. |
| [9] |
靖姣姣, 张颖, 白志英, 李存东. 盐胁迫对小麦代换系幼苗叶片保护酶活性影响及染色体效应[J].
华北农学报, 2014, 25 (5) : 34 –38.
Jing J J, Zhang Y, Bai Z Y, Li C D. The effects of salt stress on protective enzyme activities and chromosome of wheat substitution lines[J]. Acta Agriculturae Boreali-Sinica, 2014, 25 (5) : 34 –38. |
| [10] |
郑金凤, 白志英, 李存东, 等. 低磷胁迫对小麦代换系保护酶活性和丙二醛含量的影响及染色体效应[J].
植物营养与肥料学报, 2010, 16 (6) : 1366 –1372.
Zheng J F, Bai Z Y, Li C D, et al. The effect of phosphorus deficiency stress on protective enzyme activity and MDA content and chromosome of wheat substitution lines[J]. Plant Nutrition and Fertilizer Science, 2010, 16 (6) : 1366 –1372. |
| [11] |
郑金凤, 白志英, 李存东, 等. 低磷胁迫对小麦代换系产量性状的影响及染色体效应[J].
植物遗传资源学报, 2010, 11 (2) : 233 –238.
Zheng J F, Bai Z Y, Li C D, et al. The effect of phosphorus deficiency stress on yield traits and chromosome of wheat substitution lines[J]. Journal of Plant Genetic Resources, 2010, 11 (2) : 233 –238. |
| [12] |
郑金凤, 米少艳, 婧姣姣, 等. 小麦代换系耐低磷相关性状的主成分分析及综合评价[J].
中国农业科学, 2013, 46 (10) : 1984 –1993.
Zheng J F, Mi S Y, Jing J J, et al. Principal component analysis and comprehensive evaluation on physiological traits of tolerance to low phosphorus stress in wheat substitution[J]. Scientia Agricultura Sinica, 2013, 46 (10) : 1984 –1993. |
| [13] |
路文静, 李瑞娟, 李小娟, 等. 小麦应答低磷的钙依赖蛋白激酶基因TaCPK1A和TaCPK10的克隆和表达[J].
作物学报, 2009, 35 (9) : 1749 –1754.
Lu W J, Li R J, Li X J, et al. Cloning and expression of calcium-dependent protein kinase genes TaCPK1A and TaCPK10 in response to deficient-Pi in wheat[J]. Acta Agronomica Sinica, 2009, 35 (9) : 1749 –1754. |
| [14] |
魏道智, 宁书菊, 林文雄. 小麦根系活力变化与叶片衰老的研究[J].
应用生态学报, 2004, 15 (9) : 1565 –1569.
Wei D Z, Ning S J, Lin W X. Relation between wheat root activity and leaf senescence[J]. Chinese Journal of Applied Ecology, 2004, 15 (9) : 1565 –1569. |
| [15] |
孙海国, 张福锁. 缺磷条件下的小麦根系酸性磷酸酶活性研究[J].
应用生态学报, 2002, 12 (3) : 379 –381.
Sun H G, Zhang F S. Effect of phosphorus deficiency on activity of acid phosphatase exuded by wheat roots[J]. Chinese Journal of Applied Ecology, 2002, 12 (3) : 379 –381. |
| [16] |
张淼, 赵书岗, 耿丽平, 等. 缺磷对不同作物根系形态及体内养分浓度的影响[J].
植物营养与肥料学报, 2013, 19 (3) : 577 –585.
Zhang M, Zhao S G, Geng L P, et al. Effects of phosphorus deficiency on root morphology and nutrients concentrations of different crops[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19 (3) : 577 –585. |
| [17] |
郭丽, 郭程瑾, 路文静, 等. 磷转运蛋白基因TaPht1; 4的染色体定位及其在低磷下与小麦吸磷能力的关系[J].
植物营养与肥料学报, 2014, 20 (4) : 877 –884.
Guo L, Guo C J, Lu W J, et al. Chromosome localization and regulation role in phosphorous uptake of phosphate transporter gene TaPht1; 4 under Pi deprivation in wheat[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20 (4) : 877 –884. |
| [18] |
庞欣, 李春俭, 张福锁. 部分根系供磷对小麦幼苗生长及同化物分配的影响[J].
作物学报, 2000 (6) : 721 –724.
Pang X, Li C J, Zhang F S. Effect of partial-root supply of P nutrient on the growth and assimilate distribution of wheat seedlings[J]. Acta Agronomica Sinica, 2000 (6) : 721 –724. |
| [19] |
任永哲. 低磷胁迫对不同基因型小麦品种苗期性状的影响[J].
中国农学通报, 2012, 28 (18) : 40 –44.
Ren Y Z. Effects of low phosphorus stress on different wheat varieties at seedling stage[J]. Chinese Agricultural Science Bulletin, 2012, 28 (18) : 40 –44. |
| [20] |
吴沂珀, 张锡洲, 李廷选, 等. 小麦不同磷效率品种对不同磷源的利用差异及酸性磷酸酶的作用[J].
核农学报, 2013 (3) : 95 –101.
Wu X X, Zhang X Z, Li T X, et al. Difference in P utilization from organic phosphate between two wheat varieties and its relations with acid phosphatase activity[J]. Acta Agriculturae Nucleatae Sinica, 2013 (3) : 95 –101. |
| [21] |
米少艳, 靖姣姣, 白志英, 李存东. 低磷对小麦代换系幼苗根系保护酶活性和丙二醛含量的影响及染色体效应[J].
华北农学报, 2013, 28 (2) : 91 –95.
Mi S Y, Jing J J, Bai Z Y, Li C D. Effects of phosphorus deficiency stress on protective enzyme activities, MDA content and chromosome of wheat wubstitution lines seedling roots[J]. Acta Agriculturae Boreali-Sinica, 2013, 28 (2) : 91 –95. |
| [22] |
曹红星, 张正斌, 孙程旭, 等. 小麦幼苗磷利用率及相关基因的染色体定位[J].
西北植物学报, 2009, 29 (12) : 2429 –2436.
Cao H X, Zhang Z B, Sun C X, et al. Chromosomal locations of the genes controlling phosphorususe efficiency and related traits in wheat seedling[J]. Acta Botanical Boreal-occidentalia Sinica, 2009, 29 (12) : 2429 –2436. |
| [23] |
李振兴, 倪中福, 彭惠茹, 等. 小麦根系性状对磷胁迫响应QTL定位[J].
自然科学进展, 2007, 17 (10) : 1352 –1359.
Li Z X, Ni Z F, Peng H R, et al. Mapping QTL for root traits of common wheat in P-deficiency[J]. Progress in Natural Science, 2007, 17 (10) : 1352 –1359. |
| [24] | Bhdaie B Waines J G. Chromosomal location of genes influencing plant characters and evapotranspiration in bread wheat[J]. Eaphytica, 1997, 96 : 363 –375. |
| [25] |
沈波, 庄杰云, 张克勤, 等. 水稻叶片性状和根系活力的QTL定位[J].
遗传学报, 2003, 30 (12) : 1133 –1139.
Shen B, Zhuang J Y, Zhang K Q, et al. QTLs mapping of leaf traits and root vitality in a recombinant inbred line population of rice[J]. Acta Genetica Sinica, 2003, 30 (12) : 1133 –1139. |
| [26] |
藤胜, 曾大力, 钱前, 等. 水稻根系活力的遗传分析[J].
中国水稻科学, 2002, 16 (2) : 119 –123.
Teng S, Zeng D L, Qian Q, et al. Genetic analysis of root vitality in rice[J]. Chinese Journal of Rice Science, 2002, 16 (2) : 119 –123. |
| [27] |
李玉京, 李滨, 刘建中, 等. 长穗偃麦草酸性磷酸酶与碱性磷酸酶编码基因的染色体定位[J].
遗传学报, 1998, 25 (5) : 449 –453.
Li Y J, Li B, Liu J Z, et al. Chromosomal location of the genes coding for acid phsophatase and alkaline phosphatase in Agropyron elongatum (2n=2x=14, EE)[J]. Journal of Genetics and Genomics, 1998, 25 (5) : 449 –453. |
| [28] |
刘建中, 李玉京, 李滨, 等. 黑麦基因组中不同染色体在缺磷胁迫下对普通小麦根系分泌酸性磷酸酶(Acph)遗传效应的研究[J].
遗传学报, 2000, 27 (1) : 39 –43.
Liu J Z, Li Y J, Li B, et al. Genetical effect of different rye chromosomes on the acid phosphatase (Acph) secretion of common wheat roots under phosphorus starvation conditions[J]. Journal of Genetics and Genomics, 2000, 27 (1) : 39 –43. |
| [29] |
柳鹏, 邓西平, 殷俐娜, 等. 小麦近缘染色体异附加系的磷效率及其机理研究[J].
麦类作物学报, 2014, 34 (9) : 1191 –1198.
Liu P, Deng X P, Yin L N, et al. Study on phosphorus efficiency and relative physiological mechanism of wheat alien chromosome addition lines[J]. Journal of Triticeae Crops, 2014, 34 (9) : 1191 –1198. |
| [30] | Hart G E. Chromosome location in wheat and evolution of isozyme structural genes in hexaploid wheat[J]. Heredity, 1977, 39 (2) : 263 –277. |
 2016, Vol. 22
2016, Vol. 22  doi:
doi: 

