文章信息
- 嵌合抗原受体NK细胞在淋巴瘤治疗中的研究进展
- Research Progress of Chimeric Antigen Receptor NK Cells in Treatment of Lymphoma
- 肿瘤防治研究, 2023, 50(12): 1243-1248
- Cancer Research on Prevention and Treatment, 2023, 50(12): 1243-1248
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0664
- 收稿日期: 2023-06-19
- 修回日期: 2023-07-17
淋巴瘤是血液系统最常见的恶性肿瘤之一,主要可分为非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)和霍奇金淋巴瘤(Hodgkin lymphoma, HL)[1],传统针对NHL和HL的治疗方法主要包括化学治疗、放射治疗以及造血干细胞移植(hematopoietic cell transplantation, HCT)等,但常规放化疗并不能完全根除肿瘤细胞,因此出现疾病复发的风险较高,而HCT治疗也因配型困难及众多并发症在一定程度上限制了其使用,因此亟需寻找更加安全有效的治疗方法解决这一难题。随着精准医疗时代的来临,包括单克隆抗体、免疫检查点抑制剂、嵌合抗原受体T细胞(chimeric antigen receptor T cell, CAR-T)、细胞因子治疗以及疫苗等治疗方法在一定程度上改善了淋巴瘤患者的预后[2]。目前已有多种CAR-T产品上市,然而,使用CAR-T细胞治疗常会引起细胞因子释放综合征(cytokine release syndrome, CRS)、移植物抗宿主反应(graft versus host disease, GVHD)、免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity syndrome, ICANS)等并发症[3]。自然杀伤细胞(natural killer cells, NK)细胞作为另一种重要的免疫细胞,在对抗肿瘤方面有着天然的优势。在基于CAR-T的基础上,现已被改造成CAR-NK用于肿瘤治疗,旨在克服CAR-T治疗的不足之处。本文将系统介绍CAR-NK在淋巴瘤治疗中的研究现状。
1 CAR-T产品及其适应证目前CAR-T产品主要针对于难治性或复发性大B细胞淋巴瘤(large B-cell lymphoma, LBCL)、滤泡型淋巴瘤(follicular lymphoma, FL)、B细胞急性淋巴细胞白血病(B lymphoblastic leukemia/lymphoma, B-ALL)以及多发性骨髓瘤(multiple myeloma, MM)的后线治疗,见表 1。
NK细胞是一种天然细胞毒性淋巴细胞,在机体的免疫监视中起关键作用[4]。NK细胞表面具有活化性杀伤细胞受体(killer activation receptor, KAR)和抑制性杀伤细胞受体(killer inhibitory receptor, KIR),受体通过与对应配体相互作用产生激活或抑制信号,二者的整合及平衡决定了NK细胞的激活状态[5]。例如,正常细胞不表达或表达低水平的NK细胞激活受体配体,但高表达主要组织相容性复合物Ⅰ类分子(major histocompatibility complexⅠ, MHC-Ⅰ), MHC-Ⅰ可与KIR相结合以保护它们免受NK细胞攻击;相反,肿瘤细胞因MHC-Ⅰ表达下调从而导致NK细胞活化[6]。活化的NK细胞可以与靶细胞形成免疫突触释放穿孔素和颗粒酶等细胞毒颗粒发挥杀伤作用[7],另外还可以通过Fas/FasL等死亡受体途径诱导肿瘤细胞凋亡[8]。抗体依赖性的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity, ADCC)也是NK细胞发挥细胞毒性作用的重要方式,NK细胞通过CD16与靶细胞上IgG的Fc段结合从而促进靶细胞裂解[9]。也正因NK细胞天然的抗肿瘤作用,使其成为CAR工程的候选细胞。
3 CAR-NK 3.1 CAR结构NK细胞上表达的功能性CAR分子由四部分组成[3]:细胞外结合域、铰链区、跨膜结构域和细胞内信号域。细胞外结合域的单链可变抗体片段(single chain antibody fragment, scFv)可与肿瘤抗原结合,是决定CAR-NK细胞特异性和功能的重要部分。铰链区与scFv共同组成了CAR细胞外结构区,可维持效应细胞CAR的稳定表达。跨膜结构域通过连接CAR的细胞外结构域和细胞内激活信号结构域,对细胞信号转导及稳定CAR结构起重要作用。基于细胞内信号结构域的不同目的,CAR-NK设计已经发展到第四代。第一代CAR使用CD3ζ作为单一细胞内信号结构域,第二、三代CAR结构引入了CD28、CD137(4-1BB)、DAP10等共刺激分子,旨在增加NK细胞活化效应以及杀伤活性。最近,携带IL-2或IL-15等“有效载荷分子”的第四代CAR已被设计出来,用于增强CAR-NK在体内的持久性和抗肿瘤作用[10-11]。
3.2 NK细胞获取相较于T细胞,NK细胞的来源更加丰富,包括NK细胞系(如NK92)、外周血单核细胞(peripheral blood mono nuclear cells, PBMCs)、脐带血(umbilical cord blood, UCB)及诱导多能干细胞(induced pluripotent stem cells, IPSCs)等[3, 11]。最初的CAR-NK细胞来源于NK细胞系,其中NK92细胞系由于缺乏KIR和淋巴细胞功能相关抗原-1的表达,导致其相较于外周血NK细胞具备更强的细胞毒性[12],且与其他繁琐和耗时的获取方式相比,NK细胞系更易于扩增和维持。但由于NK92细胞系属于非整倍体,具有潜在的恶变倾向,所以输注前必须经过辐照以抑制其在体内增殖及持久性[13]。从外周血中分离出NK细胞较为容易,且此时NK细胞已分化成熟,但此方法获取的NK细胞数量较少且转导效率低,长时间培养后可导致细胞毒性降低[14]。UCB来源的NK细胞的优势在于具有强大的增殖能力,然而与外周血的NK细胞相比常表现为不成熟表型,因此细胞毒性较差[15]。IPSC是另一种NK细胞来源,其规避了供体之间的细胞异质性带来的风险,且具有显著的扩增潜力,可产生大量具有强细胞毒性的均质NK细胞,这些细胞正常表达NKG2D、NKp46、Fas和TRAIL等激活受体,且KIR表达率低于外周血NK细胞[16],因此现在也被广泛用于CAR-NK细胞的制备。
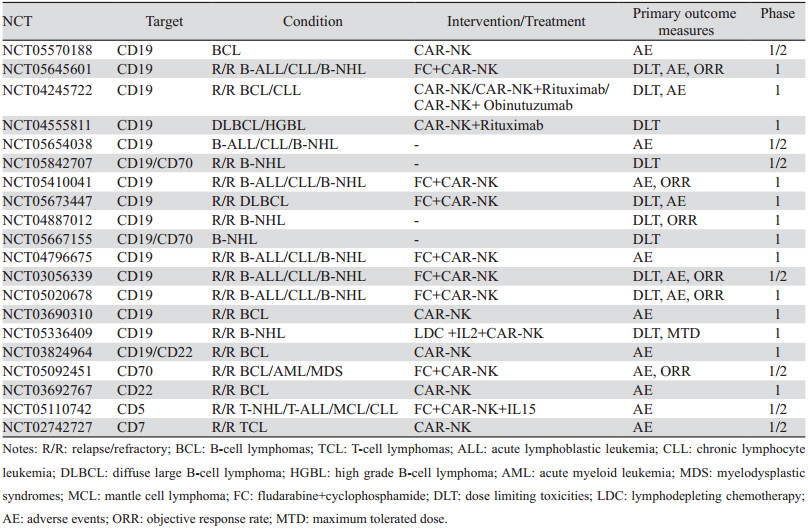
4 临床应用 4.1 B细胞淋巴瘤 4.1.1 CD19CD19在绝大多数B细胞恶性肿瘤中均有不同程度表达,并且在正常组织中的表达仅限于成熟B细胞、B细胞前体和浆细胞,是在B细胞淋巴瘤(B-cell lymphomas, BCL)中应用最常见的靶点。目前已有多种靶向CD19的CAR-T产品上市,但CAR-T带来的众多不良反应仍有待优化和解决。临床前研究已证明CD19 CAR-NK细胞的强大抗肿瘤作用,并且在对抗淋巴恶性肿瘤方面要优于CAR-T[17-18],目前已有众多CD19 CAR-NK细胞的临床试验在进行中,见表 2。FT596是IPSC衍生的靶向CD19 CAR-NK产品,其作为单一疗法以及与利妥昔单抗或奥妥珠单抗联合治疗的临床研究(NCT04245722)正在进行中。一例复发或难治性弥漫性大B细胞淋巴瘤(relapse/refractory diffuse large B-cell lymphoma, R/R DLBCL)患者纳入该项研究,首次予以低剂量CAR-NK细胞输注后取得部分缓解(partial response, PR),在经第二次输注后肿瘤减小50%并且肿瘤代谢较前降低70%,在≥3级的不良事件中仅观察到中性粒细胞减少,在随访期间得到解决[19]。另外Liu等进行的临床试验中,2例DLBCL和4例滤泡型淋巴瘤(follicular lymphoma, FL)患者接受CD19 CAR-NK细胞输注,治疗后完全缓解(complete response, CR)率达到67%。重要的是,所有患者均未观察到CRS、GVHD及ICANS等严重不良事件[20],这也进一步证明了CAR-NK在疗效相近的情况下,安全性方面要优于CAR-T。
另外,在使用CAR-T治疗过程中,通常会由于靶向抗原的下调和缺失或CAR-T细胞功能性失活而导致肿瘤复发,对于前者引起的肿瘤复发可以通过靶向一种以上的抗原来解决,如Martyniszyn等构建的CD19和CD20双特异性CAR-T细胞在BCL中展现出良好活性[21];而对于后者则可以重新制备并施用第二批CAR-T细胞解决问题,但由于CAR-T细胞制备的复杂性及患者自身T细胞数量不足和质量低下,使得此方法难以成功,因此选择获取及制备更加容易的NK细胞或许是解决办法之一。对此,Roex等制备了双重靶向CD19和BCMA CAR-NK细胞,除了直接发挥抗肿瘤作用外,尚未发现正常细胞或组织毒性,并且在重塑肿瘤微环境中也发挥着重要作用[22]。总体而言,在目前的临床前研究及临床研究中,CAR-NK在基于CD19的过继细胞疗法中展现出了优异的抗肿瘤作用,同时相较于CAR-T具有更低的细胞因子毒性、GVHD风险以及制造成本等优势,这也为患者提供了一种新的治疗选择。
4.1.2 CD20CD20是外周B细胞的重要标志物,表达于95%以上的BCL中。鉴于抗CD20单克隆抗体在BCL治疗中取得的成功,CD20被认为是CAR设计的理想靶点[23]。研究表明CD20 CAR-T作为补救治疗在利妥昔单抗治疗后的R/R B-NHL中取得不错疗效[24],而使用CAR-T治疗时,由于T细胞免疫检查点如PD-1的表达,抑制了CAR-T细胞的免疫活性,从而保护肿瘤细胞免于被杀死,而NK细胞的表面PD-1表达相对较低,并且CAR-NK可以通过多种机制识别肿瘤细胞,相较于CAR-T具有更高的靶向功效。此外,CD20 CAR介导的信号转导可以克服抑制性受体和HLA配体之间产生的抑制性信号,在一定程度上克服了肿瘤耐药性[25]。Chu等证明了其构建的CD20 CAR-NK可有效杀死CD20阳性Burkitt淋巴瘤(Burkitt lymphoma, BL)细胞,减轻小鼠肿瘤负荷并延长生存期,在其后续研究中发现了罗米吡嗪可通过NKG2D增加CD20 CAR-NK细胞毒性发挥协同抗肿瘤作用[25-26]。然而目前大多数用于NK细胞的CAR结构都是基于CAR-T细胞的结构而设计的,只能在个体化治疗的基础上使用,并且受到肿瘤微环境的限制,Liu等基于NKG2D-NKG2DL轴理论上设计了一种可溶性CD20 CAR-NK,其在BL等细胞系中已展现出强大抗肿瘤效应[27]。另外为降低脱靶效应及复发风险,构建双特异性CAR可能是解决方法之一,目前有多种双特异性CAR-T细胞进入了临床研究[28-30],该策略或许可应用于CAR-NK的后续研究。
4.1.3 CD22CD22是一种唾液酸结合免疫球蛋白样凝集素家族的一个成员,在绝大多数B细胞恶性肿瘤中表达,包括B细胞急性淋巴细胞白血病(B-cell acute lymphoblastic leukemia, B-ALL)、高级别B细胞淋巴瘤(high grade B-cell lymphoma,HGBL)、慢性淋巴细胞白血病(chronic lymphocyte leukemia, CLL)和毛细胞白血病(hairy cell leukemia, HCL)等[31]。一项回顾性分析表明CD22 CAR-T在NHL患者中的CR率可达64%(95%CI: 46%~81%),值得注意的是其中大部分患者经CD19 CAR-T治疗失败[32],这也表明CD22是一种具有治疗价值的靶点。除了单靶向CD22外,CD20和CD22双靶向的CAR-T细胞也已被证明可同时有效靶向具有不同水平表达的CD22和CD20的B-NHL,并且在体内外均表现出稳健的抗肿瘤活性[33]。最近Kim等构建了双重靶向CD19和CD22的CAR-NK-92细胞,发现其在体内外均能够有效消除DLBCL细胞,证明了双特异性CD19和CD20 CAR-NK细胞的治疗潜力[34]。目前在CAR-NK平台靶向CD22的研究并不多,基于在CAR-T细胞中的良好应用,CAR-NK临床试验NCT03824964和NCT03692767招募既往接受过至少一线治疗或HCT治疗的CD22阳性BCL患者,通过注射CAR-NK细胞评估其与治疗相关不良事件的发生情况,目前暂未公布相关研究结果。
4.2 T细胞淋巴瘤T细胞淋巴瘤(T-cell lymphomas, TCL)是一种高度异质性恶性肿瘤,占NHL比例不到15%[35]。目前针对TCL的CAR-T治疗仍处于初步阶段,研究表明,基于CAR-T的疗法具有一定内在挑战性,因为CAR-T细胞和恶性T细胞表达共同的目标抗原,这种现象会导致输注的CAR-T细胞攻击自身[36]。相较于CAR-T细胞,CAR-NK细胞缺乏T细胞标志物的表达,并且可以来源于同种异体,这为TCL的治疗提供无可替代的优势。T细胞常见的肿瘤标志物如CD3、CD4、CD5、CD7等已被用于CAR-NK的靶向构建。Chen等构建了第三代CD3 CAR-NK细胞,其在体内展现出对人外周T细胞淋巴瘤(peripheral T-cell lymphomas, PTCL)强大的抗肿瘤活性[37]。但是由于CAR-NK细胞的耐久性较差导致其在体内缺乏长期持久性,存在一定肿瘤复发风险,因此目前的CD3 CAR-NK细胞可用于其他方案治疗后残留T细胞肿瘤的消除。另外有研究发现靶向CD5的CAR-NK相较CD3具备更优的疗效[38],在Chen团队的另一项研究中,通过构建CD5 CAR-NK细胞也验证了其对抗PTCL的有效性[39],临床研究NCT05110742拟招募CD5表达大于30%的R/R TCL(包括PTCL、ALL、T-LBL等)患者,予以环磷酰胺和氟达拉滨的淋巴清除化疗后接受CAR-NK细胞及IL15输注,旨在评估其治疗相关不良事件发生率。除此之外,Pinz等使用CD4 CAR-NK靶向PTCL细胞,发现其在体内外均能有效消除肿瘤细胞[40]。除了以上靶点,临床试验NCT02742727通过招募各类型CD7阳性的TCL患者,旨在评估CD7 CAR-NK在TCL中的疗效及安全性。到目前为止,CAR-T或CAR-NK在TCL中的研究并未取得明显进展,原因在于T细胞肿瘤与正常T细胞拥有共同的抗原,如何跨越这一障碍是接下来研究的重点。
5 总结与展望自从CAR工程问世以来,过继细胞治疗领域取得显著发展,CAR-T细胞为基于CAR免疫疗法的未来发展奠定了基础。尽管在血液肿瘤中已取得巨大成功,但CAR-T细胞的缺点如制备的复杂性、高成本、长耗时及不良反应等在一定程度上限制了其临床适用范围。CAR-NK目前在血液肿瘤中的研究已初显光芒,其相较于CAR-T具备更多优势,比如更丰富的杀伤机制、更简单的获取方式以及更安全的不良反应等,目前在clinicaltrials.gov上已有数十项临床试验评估CAR-NK在淋巴瘤中的疗效及安全性。而CAR-NK在淋巴瘤的应用方面,绝大部分研究集中在BCL上,如何提高对TCL的疗效也是未来探索的重点。尽管如此,CAR-NK目前也面临着如CAR转导效率低下、体内持久性不足、免疫抑制肿瘤微环境等困难,对于CAR-NK的未来应用,需要优化基因修饰方法、预处理方案、细胞剂量以及联合免疫治疗或造血干细胞移植等提高CAR-NK治疗功效,这需要更多的研究来促进CAR-NK的临床转化。相信基于NK细胞天然的抗肿瘤血统,CAR-NK技术的不断发展,在不久的未来将会出现更加成熟、高效、安全的CAR-NK产品,为更多的淋巴瘤患者带来福音。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
胡润:文章构思、资料收集、数据分析及文章撰写
姚沛、李俊蒽、桂仁捷:文章修改
段华新:文章撰写及审校
| [1] |
Khanmohammadi S, Shabani M, Tabary M, et al. Lymphoma in the setting of autoimmune diseases: A review of association and mechanisms[J]. Crit Rev Oncol Hematol, 2020, 150: 102945. DOI:10.1016/j.critrevonc.2020.102945 |
| [2] |
Heyman B, Yang Y. New developments in immunotherapy for lymphoma[J]. Cancer Biol Med, 2018, 15(3): 189-209. DOI:10.20892/j.issn.2095-3941.2018.0037 |
| [3] |
Lu H, Zhao X, Li Z, et al. From CAR-T Cells to CAR-NK Cells: A Developing Immunotherapy Method for Hematological Malignancies[J]. Front Oncol, 2021, 11: 720501. DOI:10.3389/fonc.2021.720501 |
| [4] |
Zhou Y, Cheng L, Liu L, et al. NK cells are never alone: crosstalk and communication in tumour microenvironments[J]. Mol Cancer, 2023, 22(1): 34. DOI:10.1186/s12943-023-01737-7 |
| [5] |
Yoon SR, Kim TD, Choi I. Understanding of molecular mechanisms in natural killer cell therapy[J]. Exp Mol Med, 2015, 47(2): e141. DOI:10.1038/emm.2014.114 |
| [6] |
Cornel AM, Mimpen IL, Nierkens S. MHC Class I Downregulation in Cancer: Underlying Mechanisms and Potential Targets for Cancer Immunotherapy[J]. Cancers (Basel), 2020, 12(7): 1760. DOI:10.3390/cancers12071760 |
| [7] |
Chiossone L, Dumas PY, Vienne M, et al. Natural killer cells and other innate lymphoid cells in cancer[J]. Nat Rev Immunol, 2018, 18(11): 671-688. DOI:10.1038/s41577-018-0061-z |
| [8] |
Prager I, Watzl C. Mechanisms of natural killer cell-mediated cellular cytotoxicity[J]. J Leukoc Biol, 2019, 105(6): 1319-1329. DOI:10.1002/JLB.MR0718-269R |
| [9] |
Lo Nigro C, Macagno M, Sangiolo D, et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives[J]. Ann Transl Med, 2019, 7(5): 105. DOI:10.21037/atm.2019.01.42 |
| [10] |
Marofi F, Saleh MM, Rahman HS, et al. CAR-engineered NK cells; a promising therapeutic option for treatment of hematological malignancies[J]. Stem Cell Res Ther, 2021, 12(1): 374. DOI:10.1186/s13287-021-02462-y |
| [11] |
Gong Y, Klein Wolterink RGJ, Wang J, et al. Chimeric antigen receptor natural killer (CAR-NK) cell design and engineering for cancer therapy[J]. J Hematol Oncol, 2021, 14(1): 73. DOI:10.1186/s13045-021-01083-5 |
| [12] |
Maki G, Klingemann HG, Martinson JA, et al. Factors regulating the cytotoxic activity of the human natural killer cell line, NK-92[J]. J Hematother Stem Cell Res, 2001, 10(3): 369-383. DOI:10.1089/152581601750288975 |
| [13] |
Matosevic S. Viral and Nonviral Engineering of Natural Killer Cells as Emerging Adoptive Cancer Immunotherapies[J]. J Immunol Res, 2018, 2018: 4054815. |
| [14] |
Martín-Antonio B, Suñe G, Perez-Amill L, et al. Natural Killer Cells: Angels and Devils for Immunotherapy[J]. Int J Mol Sci, 2017, 18(9): 1868. DOI:10.3390/ijms18091868 |
| [15] |
Sarvaria A, Jawdat D, Madrigal JA, et al. Umbilical Cord Blood Natural Killer Cells, Their Characteristics, and Potential Clinical Applications[J]. Front Immunol, 2017, 8: 329. |
| [16] |
Goldenson BH, Zhu H, Wang YM, et al. Umbilical Cord Blood and iPSC-Derived Natural Killer Cells Demonstrate Key Differences in Cytotoxic Activity and KIR Profiles[J]. Front Immunol, 2020, 11: 561553. DOI:10.3389/fimmu.2020.561553 |
| [17] |
赵松柏, 韩志超, 安钢力, 等. 靶向CD19抗原的CAR-NK-92MI和CAR-CD19-T细胞对套细胞淋巴瘤的体外杀伤[J]. 中国肿瘤生物治疗杂志, 2018, 25(5): 455-461. [Zhao SB, Han ZC, An GL, et al. CAR-NK-92MI and CAR-CD19-T cells targeting CD19 antigen exhibit significant in vitro killing activity on mantle cell lymphoma[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi, 2018, 25(5): 455-461.] |
| [18] |
Liu E, Tong Y, Dotti G, et al. Cord blood NK cells engineered to express IL-15 and a CD19-targeted CAR show long-term persistence and potent antitumor activity[J]. Leukemia, 2018, 32(2): 520-531. DOI:10.1038/leu.2017.226 |
| [19] |
Bachanova V, Cayci Z, Lewis D, et al. Initial Clinical Activity of FT596, a First-in-Class, Multi-Antigen Targeted, Off-the-Shelf, iPSC-Derived CD19 CAR NK Cell Therapy in Relapsed/Refractory B-Cell Lymphoma[J]. Blood, 2020, 136(Supplement 1): 8. |
| [20] |
Liu E, Marin D, Banerjee P, et al. Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors[J]. N Engl J Med, 2020, 382(6): 545-553. DOI:10.1056/NEJMoa1910607 |
| [21] |
Martyniszyn A, Krahl AC, André MC, et al. CD20-CD19 Bispecific CAR T Cells for the Treatment of B-Cell Malignancies[J]. Hum Gene Ther, 2017, 28(12): 1147-1157. DOI:10.1089/hum.2017.126 |
| [22] |
Roex G, Campillo-Davo D, Flumens D, et al. Two for one: targeting BCMA and CD19 in B-cell malignancies with off-the-shelf dual-CAR NK-92 cells[J]. J Transl Med, 2022, 20(1): 124. DOI:10.1186/s12967-022-03326-6 |
| [23] |
Wen H, Lou X, Qu Z, et al. Pre-clinical efficacy of CD20-targeted chimeric antigen receptor T cells for non-Hodgkin's lymphoma[J]. Discov Oncol, 2022, 13(1): 122. DOI:10.1007/s12672-022-00588-w |
| [24] |
Cheng Q, Tan J, Liu R, et al. CD20-specific chimeric antigen receptor-expressing T cells as salvage therapy in rituximab-refractory/relapsed B-cell non-Hodgkin lymphoma[J]. Cytotherapy, 2022, 24(10): 1026-1034. DOI:10.1016/j.jcyt.2022.05.001 |
| [25] |
Chu Y, Hochberg J, Yahr A, et al. Targeting CD20+ Aggressive B-cell Non-Hodgkin Lymphoma by Anti-CD20 CAR mRNA-Modified Expanded Natural Killer Cells In Vitro and in NSG Mice[J]. Cancer Immunol Res, 2015, 3(4): 333-344. DOI:10.1158/2326-6066.CIR-14-0114 |
| [26] |
Chu Y, Yahr A, Huang B, et al. Romidepsin alone or in combination with anti-CD20 chimeric antigen receptor expanded natural killer cells targeting Burkitt lymphoma in vitro and in immunodeficient mice[J]. Oncoimmunology, 2017, 6(9): e1341031. DOI:10.1080/2162402X.2017.1341031 |
| [27] |
Liu R, Luo Q, Luo W, et al. A Soluble NK-CAR Mediates the Specific Cytotoxicity of NK Cells toward the Target CD20(+) Lymphoma Cells[J]. Aging Dis, 2022, 13(5): 1576-1588. DOI:10.14336/AD.2022.0415 |
| [28] |
Thieblemont C, Phillips T, Ghesquieres H, et al. Epcoritamab, a Novel, Subcutaneous CD3xCD20 Bispecific T-Cell-Engaging Antibody, in Relapsed or Refractory Large B-Cell Lymphoma: Dose Expansion in a PhaseⅠ/Ⅱ Trial[J]. J Clin Oncol, 2023, 41(12): 2238-2247. DOI:10.1200/JCO.22.01725 |
| [29] |
Budde LE, Assouline S, Sehn LH, et al. Single-Agent Mosunetuzumab Shows Durable Complete Responses in Patients With Relapsed or Refractory B-Cell Lymphomas: Phase Ⅰ Dose-Escalation Study[J]. J Clin Oncol, 2022, 40(5): 481-491. DOI:10.1200/JCO.21.00931 |
| [30] |
Shah NN, Johnson BD, Schneider D, et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: a phase 1 dose escalation and expansion trial[J]. Nat Med, 2020, 26(10): 1569-1575. DOI:10.1038/s41591-020-1081-3 |
| [31] |
Ereno-Orbea J, Sicard T, Cui H, et al. Molecular basis of human CD22 function and therapeutic targeting[J]. Nat Commun, 2017, 8(1): 764. DOI:10.1038/s41467-017-00836-6 |
| [32] |
Fergusson NJ, Adeel K, Kekre N, et al. A systematic review and meta-analysis of CD22 CAR T-cells alone or in combination with CD19 CAR T-cells[J]. Front Immunol, 2023, 14: 1178403. DOI:10.3389/fimmu.2023.1178403 |
| [33] |
Aranda-Orgilles B, Chion-Sotinel I, Skinner J, et al. Preclinical Evidence of an Allogeneic Dual CD20xCD22 CAR to Target a Broad Spectrum of Patients with B-cell Malignancies[J]. Cancer Immunol Res, 2023, 11(7): 946-961. DOI:10.1158/2326-6066.CIR-22-0910 |
| [34] |
Kim H, Han M, Kim M, et al. CD19/CD22 bispecific chimeric antigen receptor-NK-92 cells are developed and evaluated[J]. Oncol Lett, 2023, 25(6): 236. DOI:10.3892/ol.2023.13822 |
| [35] |
陈定宝. T细胞淋巴瘤研究进展[J]. 诊断病理学杂志, 2022, 29(8): 681-686. [Chen DB. Advance of T cell lymphoma[J]. Zhen Duan Bing Li Xue Za Zhi, 2022, 29(8): 681-686.] |
| [36] |
Safarzadeh Kozani P, Safarzadeh Kozani P, Rahbarizadeh F. CAR-T cell therapy in T-cell malignancies: Is success a low-hanging fruit?[J]. Stem Cell Res Ther, 2021, 12(1): 527. DOI:10.1186/s13287-021-02595-0 |
| [37] |
Chen KH, Wada M, Firor AE, et al. Novel anti-CD3 chimeric antigen receptor targeting of aggressive T cell malignancies[J]. Oncotarget, 2016, 7(35): 56219-56232. DOI:10.18632/oncotarget.11019 |
| [38] |
Voynova E, Hawk N, Flomerfelt FA, et al. Increased Activity of a NK-Specific CAR-NK Framework Targeting CD3 and CD5 for T-Cell Leukemias[J]. Cancers (Basel), 2022, 14(3): 524. DOI:10.3390/cancers14030524 |
| [39] |
Chen KH, Wada M, Pinz KG, et al. Preclinical targeting of aggressive T-cell malignancies using anti-CD5 chimeric antigen receptor[J]. Leukemia, 2017, 31(10): 2151-2160. DOI:10.1038/leu.2017.8 |
| [40] |
Pinz KG, Yakaboski E, Jares A, et al. Targeting T-cell malignancies using anti-CD4 CAR NK-92 cells[J]. Oncotarget, 2017, 8(68): 112783-112796. DOI:10.18632/oncotarget.22626 |
 2023, Vol. 50
2023, Vol. 50