文章信息
- 胸腺瘤手术后新发重症肌无力的研究进展
- Recent Advances in Post-operatively New Onset Myasthenia Gravis in Thymoma Patients
- 肿瘤防治研究, 2023, 50(10): 941-945
- Cancer Research on Prevention and Treatment, 2023, 50(10): 941-945
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0469
- 收稿日期: 2023-05-04
- 修回日期: 2023-05-19
重症肌无力(myasthenia gravis, MG)是一种以肌无力和疲劳为特征,由乙酰胆碱受体抗体(anti-acetylcholine receptor binding antibody,ARAb)介导,细胞免疫依赖、补体参与的神经肌接头处传递障碍的获得性自身免疫性疾病。在MG患者中,75%~90%患者伴有胸腺异常,其中85%为胸腺增生(non-thymoma MG, NT-MG),10%~15%为胸腺瘤(thymoma MG, T-MG)[1],以AB和B型胸腺瘤常见;而30%~45%的胸腺瘤患者合并MG[2]。对于合并胸腺瘤的MG患者,胸腺瘤及胸腺切除手术是首选治疗方案,在治疗肿瘤的同时,肿瘤负荷的减少有助MG症状改善。文献报道,28%~34%的MG患者行胸腺切除术后MG症状得到明显改善[3]。
但是,临床发现部分术前不合并MG的患者会在胸腺瘤切除术后产生MG症状,即本文所称的术后新发MG(post-operatively new onset MG, ponoMG)。与常规的MG一样,ponoMG也可表现为全身症状甚至威胁生命,但由于胸腺瘤本身的少见性,ponoMG更罕见,人们尚未对其有全面深入的了解。为帮助胸外科医师提高对ponoMG的认识和警惕,本文结合近年文献、现有研究,对ponoMG的发生率、发病机制、预测因素、防治策略等作一综述。
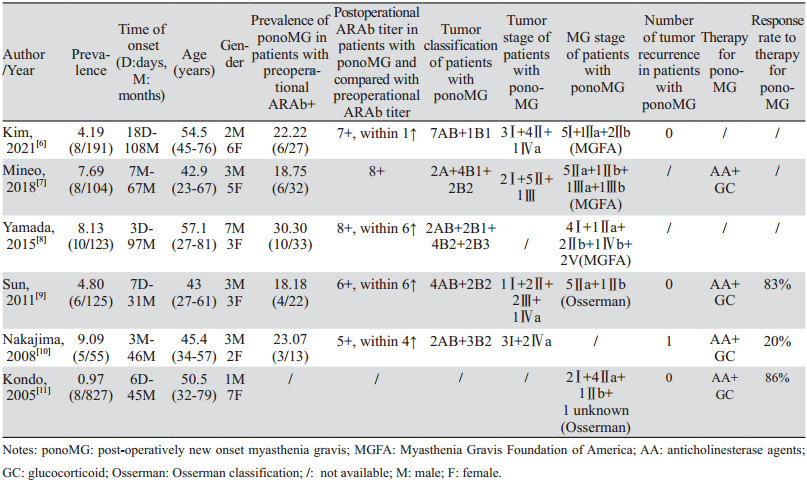
1 发生率1951年Fershtand等首次报道ponoMG[4]。Zhao等的系统文献综述显示,1960—2019年共有407篇文献报道了507个病例、123种胸腺瘤的副肿瘤综合征(paraneoplastic syndrome, PNS),其中21%的患者术后出现了PNS的复发或者新发,其中最常见的PNS即为MG[5]。在主流医学数据库PUBMED、EMBASE中以关键词“post operational myasthenia gravis”搜索近20年回顾性研究,报道ponoMG的发病率为1.0%~9.1%,术后MG新发时间从3天到约9年,手术后的早期和远期均有观察到MG新发[6-11],见表 1。除Kondo等的研究为多中心回顾性研究外,其余均为单中心回顾性研究。总之,由于胸腺瘤本身的少见性,ponoMG更显罕见,数据偏倚客观存在,虽然罕见但也值得临床医生警惕。
手术是胸腺瘤治疗的基石[12]。部分研究者首先怀疑导致ponoMG的原因是手术过程中胸腺切除不彻底。Kim和Yamada等均观察到部分胸腺切除、不完全切除是ponoMG的危险因素(Kim: 单因素Cox, P=0.007; Yamada: Log rank, P=0.008)[6, 8]。但也有全胸腺切除的患者术后新发MG[7, 11]。事实上,ponoMG可能有多种机制,是多种因素共同作用的结果。
(1)ponoMG可能不是真的“新”发。Kim等提出部分ponoMG患者在术前就已经处于MG的“亚临床”“隐匿”阶段。其理论依据是ARAb与T-MG高度特异相关,而部分ponoMG患者在术前已出现ARAb阳性[6]。如果对这一人群在术前进行更全面的辅助检查,如药理学试验、电生理检查,则可能激发和发现重症肌无力的征象。这一点得到了其他回顾性研究的支持,他们均发现术前ARAb阳性患者ponoMG发病率远高于术前ARAb阴性患者。如Yamada等报道33例术前ARAb阳性患者中10例发生ponoMG,发病率高达30.30%,而90例术前ARAb阴性患者中无ponoMG发生[8];Sun等发现22例术前ARAb阳性患者中有4例发生ponoMG(18.18%),而103例术前ARAb阴性的患者中只有2例发生ponoMG,发病率 < 2%[9]。这些发现提示了术前ARAb与ponoMG的密切关系,提示了ponoMG术前“潜伏”的可能性。
(2)手术虽然完整摘除了胸腺,但可能并未清除体内的异常T细胞。Hoffacker和Buckley等的研究表明,胸腺瘤能够将成熟的自身抗原特异性T细胞主动输出到外周血中,这些细胞可以持续存在多年[13-15]。它们具备产生ARAb的能力,可能在机体遭受手术打击,免疫系统受到扰动之后表现出来。
(3)另外,一项前瞻性的尸体解剖发现,人体的异位胸腺并不罕见,且极难完整去除[16]。此结果提示了ponoMG的一种可能机制,即胸腺瘤患者的原位、异位胸腺均存在异常,切除胸腺瘤去除了内分泌调节网络原先对胸腺组织的抑制,致使尚存的异位胸腺能够生成和释放ARAb。
(4)手术还可能通过其他间接方式导致ponoMG。调控正常人体抗原-抗体反应的CD4+调节T细胞(Treg)产生于胸腺之中,研究发现胸腺切除术后30天,Treg细胞数量下降了80%,这可能造成Treg等调节细胞对免疫反应调控作用的减弱,造成免疫失衡,诱发自身免疫病[9, 17]。手术用药也有可能造成影响:李鉴等观察到术中使用的氨基糖苷类抗生素和非去极化肌松药可能导致ponoMG[18]。
(5)晚发ponoMG可能与胸腺瘤复发相关。Gurowich等发现ponoMG发生的时间呈现术后早期(< 6月)和晚期(> 6月)双峰,而复发病例几乎都发生在晚发患者中[19]。不少研究者认为晚发ponoMG与肿瘤复发有关[4, 19-21]。但已有的长期回顾性研究尚无证据支持这一猜想[6, 9-11],见表 1,需要更长随访时间和更大规模的队列研究。
3 预测因素研究者对ponoMG的预测因素有如下假设和研究:
(1)术前ARAb血清滴度是一致性最好的ponoMG预测因子,见表 1。各回顾性研究中,术前ARAb阳性患者ponoMG发病率均远高于该研究中的全体患者。其中,Kim等计算出术前ARAb血清滴度的危险比(HR)为2.267,P=0.002[6],Yamada等则计算出术前ARAb血清滴度的HR为1.15,P < 0.001[8]。
(2)部分研究者提出术后ARAb血清滴度也是ponoMG预测因子。Kim等报道术后ARAb阳性者ponoMG的发病率为77.8%(HR为1.506,P < 0.001)[6]。然而,各研究中术后ARAb滴度数据缺失情况均较严重,降低了其作为预测因子的证据力度。
(3)部分研究者认为预测ponoMG时应该考虑血清ARAb滴度在手术前后的变化。Sun等[9]结合Nakajima[10]和Kondo等[11]的报道,发现ponoMG患者大多会出现术后ARAb增高,而如果术后ARAb不增高,即便是术前ARAb阳性,术后也不会新发MG,因此认为ARAb的增高才是真正的ponoMG预测因素。
(4)Tang等的一篇最新Meta分析显示,术前ARAb阳性、开放手术、非完整切除、B型胸腺瘤及术后肺部炎性反应是ponoMG的危险因素[22]。
另外,Mineo等对研究对象进行了PET随访,发现在14例高SUVmax胸腺瘤患者中,3例发生ponoMG,而17例低SUVmax胸腺瘤患者中只有1例ponoMG。提示胸腺瘤的SUVmax也可能对ponoMG有预测作用[7]。
4 防治策略文献中关于ponoMG防治策略有如下经验值得注意:一是胸腺瘤术后患者可能需要更长的随访时间。Zhao等的系统文献综述显示,在1960—2019年的407篇报道中,术后平均随访时间,仅胸腺瘤复发的患者为78个月,仅PNS复发的患者为80个月,胸腺瘤和PNS均复发的患者为127个月。这提示我们应该对胸腺瘤术后患者进行更长时间的随访,哪怕在相当长一段时间内均未观察到PNS复发或新发,也应当继续进行随访[5];二是应对胸腺瘤患者进行术前ARAb测定,如果不能进行,至少也应该在术后补做ARAb测定。术前及术后血清ARAb阳性的患者术后应针对MG进行更谨慎的随访;三是ponoMG发生之后,治疗方案主要为激素和抗胆碱酯酶药,如有必要可加用免疫抑制剂。这与首发症状MG患者类似。采用类似方案的已有报道治疗缓解率为20%~86%[9-11],见表 1。
已有回顾性研究显示,并未有证据证实更大的切除范围(全胸腺切除术vs.非全胸腺切除术)具有对ponoMG的预防作用[6-11]。Papadimas等的Meta分析也显示,在8项研究共2 568例患者中,全胸腺切除和部分胸腺切除相比,新发MG率为4.3%: 4.7%,差异无统计学意义[23]。但因为全胸腺切除术具有肿瘤学获益,对于相应的胸腺瘤患者仍应进行全胸腺切除术[24-27]。
有研究指出,未完全切除肿瘤的患者,其MG症状无法由常规抗MG药物缓解时,对化疗药物环磷酰胺+多柔比星+长春新碱有良好反应[20]。这提示辅助治疗降低肿瘤负荷和活性进而能够降低MG风险。因此,对于不完全切除的患者,术后辅助治疗不仅有助于肿瘤学,也有助于预防MG的获益。另有Mineo等报道,对随访新出现前纵隔高SUVmax占位的ponoMG患者行手术切除,能够实现ponoMG症状的完全缓解[7]。提示二次手术可以作为肿瘤复发引起的肌无力症状的治疗措施。
5 总结与展望受制于胸腺瘤本身的罕见性,已有的ponoMG回顾性研究缺乏一致性。ARAb的阳性截断值有的选取0.2 nmol/L,有的选取0.3 noml/L。由于时代、观念等的局限性,ARAb的测量数据也有不同程度的缺失。对于ponoMG的诊断,尚未提出明确的标准,因而可能存在将术前已经产生的MG归为术后新发。在治疗方面,对ponoMG缓解程度和持续时间的判定鲜有明确统一的标准,因此已有的回顾性研究在疗效的评估和统计上可能存在误差。明确的诊断、治疗、评估、随访标准,严格的临床诊疗流程是更进一步研究的基础。
ponoMG发病机制暂无定论,与胸腺瘤未完全切除、异位胸腺组织、胸腺瘤在体时向外周输入缺陷T细胞并长期存在,持续产生ARAb、手术诱导免疫平衡破坏等可能均有一定关系。总结文献,有以下关于ponoMG的建议:(1)胸腺瘤ponoMG值得警惕;(2)所有怀疑胸腺瘤的患者术前都应该进行血清ARAb滴度测定。如果不能实现,至少应在术后补测;(3)病理为B型胸腺瘤、开放手术、较大和较晚的胸腺瘤应当更加警惕ponoMG;(4)ponoMG的治疗方案可以参考常规MG,可采取抗胆碱酯酶药+激素方案,必要时还可以使用免疫抑制剂;(5)非R0切除的胸腺瘤患者术后应积极进行辅助治疗,不仅是为了肿瘤学结果,也是为了降低ponoMG风险;(6)胸腺瘤需要更长期的术后随访,特别是对ARAb滴度高、MG好发分型的患者;(7)强调胸腺瘤的MDT诊疗策略,特别是神经科医师的加入。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
刘浩然:资料收集与整理、文献检索及论文撰写
方文涛:论文指导
谷志涛:论文修改及审阅
| [1] |
Gilhus NE. Myasthenia Gravis[J]. N Engl J Med, 2016, 375(26): 2570-2581. DOI:10.1056/NEJMra1602678 |
| [2] |
Álvarez-Velasco R, Gutiérrez-Gutiérrez G, Trujillo JC, et al. Clinical characteristics and outcomes of thymoma-associated myasthenia gravis[J]. Eur J Neurol, 2021, 28(6): 2083-2091. DOI:10.1111/ene.14820 |
| [3] |
Marx A, Willcox N, Leite MI, et al. Thymoma and paraneoplastic myasthenia gravis[J]. Autoimmunity, 2010, 43(5-6): 413-427. DOI:10.3109/08916930903555935 |
| [4] |
Fershtand JB, Shaw RR. Malignant tumor of the thymus gland, myasthenia gravis developing after removal[J]. Ann Intern Med, 1951, 34(4): 1025-1035. DOI:10.7326/0003-4819-34-4-1025 |
| [5] |
Zhao J, Bhatnagar V, Ding L, et al. A systematic review of paraneoplastic syndromes associated with thymoma: Treatment modalities, recurrence, and outcomes in resected cases[J]. J Thorac Cardiovasc Surg, 2020, 160(1): 306-314. DOI:10.1016/j.jtcvs.2019.11.052 |
| [6] |
Kim A, Choi SJ, Kang CH, et al. Risk factors for developing post-thymectomy myasthenia gravis in patients with thymoma[J]. Muscle Nerve, 2021, 63(4): 531-537. DOI:10.1002/mus.27169 |
| [7] |
Mineo TC, Tamburrini A, Schillaci O, et al. Onset and Evolution of Clinically Apparent Myasthenia Gravis After Resection of Non-myasthenic Thymomas[J]. Semin Thorac Cardiovasc Surg, 2018, 30(2): 222-227. DOI:10.1053/j.semtcvs.2018.02.027 |
| [8] |
Yamada Y, Yoshida S, Iwata T, et al. Risk factors for developing postthymectomy myasthenia gravis in thymoma patients[J]. Ann Thorac Surg, 2015, 99(3): 1013-1019. DOI:10.1016/j.athoracsur.2014.10.068 |
| [9] |
Sun XG, Wang YL, Liu YH, et al. Myasthenia gravis appearing after thymectomy[J]. J Clin Neurosci, 2011, 18(1): 57-60. DOI:10.1016/j.jocn.2010.05.018 |
| [10] |
Nakajima J, Murakawa T, Fukami T, et al. Postthymectomy myasthenia gravis: relationship with thymoma and antiacetylcholine receptor antibody[J]. Ann Thorac Surg, 2008, 86(3): 941-945. DOI:10.1016/j.athoracsur.2008.04.070 |
| [11] |
Kondo K, Monden Y. Myasthenia gravis appearing after thymectomy for thymoma[J]. Eur J Cardiothorac Surg, 2005, 28(1): 22-25. DOI:10.1016/j.ejcts.2005.03.039 |
| [12] |
中国免疫学会神经免疫分会. 中国重症肌无力诊断和治疗指南(2020版)[J]. 中国神经免疫学和神经病学杂志, 2021, 28(1): 1-12. [Neuroimmunology Branch of Chinese Society for Immunology. Chinese guidelines for the diagnosis and treatment of myasthenia gravis (2020 version)[J]. Zhongguo Shen Jing Mian Yi Xue He Shen Jing Bing Xue Za Zhi, 2021, 28(1): 1-12. DOI:10.3969/j.issn.1006-2963.2021.01.001] |
| [13] |
Sims GP, Shiono H, Willcox N, et al. Somatic hypermutation and selection of B cells in thymic germinal centers responding to acetylcholine receptor in myasthenia gravis[J]. J Immunol, 2001, 167(4): 1935-1944. DOI:10.4049/jimmunol.167.4.1935 |
| [14] |
Buckley C, Douek D, Newsom-Davis J, et al. Mature, long-lived CD4+ and CD8+ T cells are generated by the thymoma in myasthenia gravis[J]. Ann Neurol, 2001, 50(1): 64-72. DOI:10.1002/ana.1017 |
| [15] |
Hoffacker V, Schultz A, Tiesinga JJ, et al. Thymomas alter the T-cell subset composition in the blood: a potential mechanism for thymoma-associated autoimmune disease[J]. Blood, 2000, 96(12): 3872-3879. DOI:10.1182/blood.V96.12.3872 |
| [16] |
Klimek-Piotrowska W, Mizia E, Kuzdzał J, et al. Ectopic thymic tissue in the mediastinum: limitations for the operative treatment of myasthenia gravis[J]. Eur J Cardiothorac Surg, 2012, 42(1): 61-65. DOI:10.1093/ejcts/ezr268 |
| [17] |
Song F, Guan Z, Gienapp IE, et al. The thymus plays a role in oral tolerance in experimental autoimmune encephalomyelitis[J]. J Immunol, 2006, 177(3): 1500-1509. DOI:10.4049/jimmunol.177.3.1500 |
| [18] |
李鉴, 张德超, 汪良骏, 等. 胸腺瘤切除术后重症肌无力的临床分析[J]. 中华外科杂志, 2004, 42(9): 540-542. [Li J, Zhang DC, Wang LJ, et al. Myasthenia gravis occurring after resection of thymoma[J]. Zhonghua Wai Ke Za Zhi, 2004, 42(9): 540-542. DOI:10.3760/j:issn:0529-5815.2004.09.008] |
| [19] |
Gurowich L, Yiin G, Maxwell A, et al. Post-thymectomy myasthenia gravis: a case report and systematic review of literature[J]. BMJ Case Rep, 2021, 14(12): e246005. DOI:10.1136/bcr-2021-246005 |
| [20] |
Kosmidis PA, Iliopoulos E, Pentea S. Combination chemotherapy with cyclophosphamide, adriamycin, and vincristine in malignant thymoma and myasthenia gravis[J]. Cancer, 1988, 61(9): 1736-1740. DOI:10.1002/1097-0142(19880501)61:9<1736::AID-CNCR2820610903>3.0.CO;2-T |
| [21] |
Green RA, Booth CB. The development of myasthenia gravis after removal of thymoma[J]. Am J Med, 1958, 25(2): 293-302. DOI:10.1016/0002-9343(58)90035-4 |
| [22] |
Tang M, Shao Y, Dong J, et al. Risk factors for postoperative myasthenia gravis in patients with thymoma without myasthenia gravis: A systematic review and meta-analysis[J]. Front Oncol, 2023, 13: 1061264. DOI:10.3389/fonc.2023.1061264 |
| [23] |
Papadimas E, Tan YK, Luo H, et al. Partial Versus Complete Thymectomy in Non-Myasthenic Patients With Thymoma: A Systematic Review and Meta-Analysis of Clinical Outcomes[J]. Heart Lung Circ, 2022, 31(1): 59-68. DOI:10.1016/j.hlc.2021.08.003 |
| [24] |
Uzawa A, Kanai T, Oda F, et al. Frequency and features of myasthenia gravis developing after thymectomy[J]. Eur J Neurol, 2020, 27(1): 175-180. DOI:10.1111/ene.14052 |
| [25] |
Comacchio GM, Marulli G, Mammana M, et al. Surgical Decision Making: Thymoma and Myasthenia Gravis[J]. Thorac Surg Clin, 2019, 29(2): 203-213. DOI:10.1016/j.thorsurg.2018.12.007 |
| [26] |
Gu Z, Fu J, Shen Y, et al. Thymectomy versus tumor resection for early-stage thymic malignancies: a Chinese Alliance for Research in Thymomas retrospective database analysis[J]. J Thorac Dis, 2016, 8(4): 680-686. DOI:10.21037/jtd.2016.03.16 |
| [27] |
Nakagawa K, Asamura H, Sakurai H, et al. Does the mode of surgical resection affect the prognosis/recurrence in patients with thymoma?[J]. J Surg Oncol, 2014, 109(3): 179-183. DOI:10.1002/jso.23499 |
 2023, Vol. 50
2023, Vol. 50