文章信息
- 抗体偶联药物在小细胞肺癌中的研究进展
- Research Progress of Antibody-drug Conjugates in Small-cell Lung Cancer
- 肿瘤防治研究, 2023, 50(11): 1139-1144
- Cancer Research on Prevention and Treatment, 2023, 50(11): 1139-1144
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0447
- 收稿日期: 2023-04-27
- 修回日期: 2023-08-05
2. 730000 兰州,兰州大学第一医院放疗科;
3. 730000 兰州,兰州大学第一医院肿瘤外科
2. Department of Radiotherapy, First Hospital of Lanzhou University, Lanzhou 730000, China;
3. Department of Oncology Surgery, First Hospital of Lanzhou University, Lanzhou 730000, China
肺癌的发病率在全球范围内呈上升趋势,尽管最近其治疗取得了一些进展,但这种疾病仍然是所有癌症类型中5年生存率最低的疾病之一[1]。肺癌根据组织学可以分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)。随着靶向疗法和免疫治疗的出现,NSCLC的治疗已经取得了重大进展,相比之下,SCLC的生存并未取得明显改善,这与其有限的治疗进展相关[2]。化疗一直是广泛期SCLC(extensive stage small cell lung cancer, ES-SCLC)主要的治疗方法,铂类联合依托泊苷是首选的一线治疗方案。尽管患者早期对药物非常敏感,但大多数会在6个月内复发并普遍产生耐药[3]。一般来说,肿瘤一线治疗中加入免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)能使全身治疗效果得到改善。然而,SCLC患者通过联用ICI获得的生存改善十分有限[4]。
分子生物学和遗传学的进步促进了抗癌药物的研发。将毒素附着在抗体上,使药物直接击中预定的目标细胞以提高其治疗特异性——抗体偶联药物(antibody-drug conjugates, ADCs)的诞生为肿瘤治疗带来新希望[5]。近几十年SCLC的研究中已经发现了一些潜在的靶点,并以ADCs的形式进行充分评估,这些靶点或许能够成为打破SCLC治疗瓶颈的突破点。
1 ADC的基本原理及作用机制ADC由单克隆抗体、有效载荷和连接子三部分组成[6]。目前FDA已经批准了4种用于治疗实体肿瘤的ADC[7]:靶向人表皮生长因子受体2(Her2)的曲妥珠单抗美坦新(Trastuzumab emtansine)和曲妥珠单抗德鲁替康(Trastuzumab deruxtecan);维汀恩弗妥单抗(Enfortumab vedotin)靶向细胞粘附分子4(Nectin-4);戈沙妥珠单抗(Sacituzumab govitecan)对人滋养细胞表面抗原2(Trop-2)有效。
1.1 靶点和抗体的选择有价值的靶点和抗原的识别对于高效ADC的开发至关重要。理想的目标抗原应在肿瘤组织中高表达,但在正常组织或给定的组织类型中表达有限[8]。抗体与循环ADC的单抗部分结合后,通过内化或(和)非内化或“旁观者效应”[9]介导抗体依赖性细胞毒作用[10]、补体依赖性细胞毒性和(或)抗体依赖的细胞吞噬作用杀死细胞。所有已开发或目前在临床试验中ADC所用的抗体均为人类免疫球蛋白G(IgG)分子。
1.2 连接子连接子的作用是保证ADC最大限度地减少药物在血浆中的过早释放[11]、调节偶联物的理化性质同时决定药物-抗体比(drug-antibody ratio, DAR)。目前常用的连接方式有两种,化学偶联和酶偶联[12]。根据载荷释放机制的不同,连接子可分为可切割和不可切割两大类。可切割连接子利用癌细胞与正常组织之间的差异,如低pH值、蛋白酶和高谷胱甘肽浓度[13];不可切割连接子则通过不可还原键连接单抗的氨基酸残基和有效载荷,具有较高的等离子体稳定性[8]。
1.3 有效载荷有效载荷是影响ADC活性和疗效的关键因素。高效微管作用化合物,如美登素类化合物(DM1、DM4v和奥瑞他汀类衍生物(包括MMAE和MMAF))已是临床批准的部分ADCs的有效载荷。DNA结合型细胞毒素则通过与DNA的双螺旋小槽结合来发挥作用[13]。
1.4 作用机制ADC通常需要靶细胞对其进行加工和代谢才能完全呈现活性。其作用机制包括:(1)进入血浆后,ADC识别并与肿瘤细胞表面的特异性抗原结合;(2)一旦进入肿瘤细胞,ADC-抗原复合物会与内涵体融合;(3)内涵体分解复合物进行抗原循环并将ADC转运至溶酶体;(4)ADC经历各种溶酶体降解以释放细胞毒性载荷与其靶标结合;(5)有效载荷导致细胞死亡或凋亡。ADC会以偶联物(绝大部分)、裸抗体和游离有效载荷分子的形式存在于循环中[14],其吸收、分布、代谢和排泄特性受单抗、靶抗原、连接子、偶联位点、DAR和有效载荷的影响[11]。
2 ADC在SCLC中的研究进展 2.1 靶向DLL3Notch通路是一种高度保守的细胞信号通路,与恶性转化、细胞增殖、周期阻滞、细胞凋亡、上皮间质转化以及神经内分泌分化抑制有关[15]。Delta样配体3(DLL3)是Notch信号通路的抑制性配体,超过80%的SCLC表达DLL3 mRNA和蛋白并且细胞质和膜染色在肿瘤细胞间高度同质[16]。通过免疫组织化学分析DLL3在SCLC样本中的表达,发现DLL3高表达的患者生存较差[17]。DLL3的作用机制以及肿瘤细胞与正常细胞之间的差异性表达使其成为ADC的理想靶点[18]。
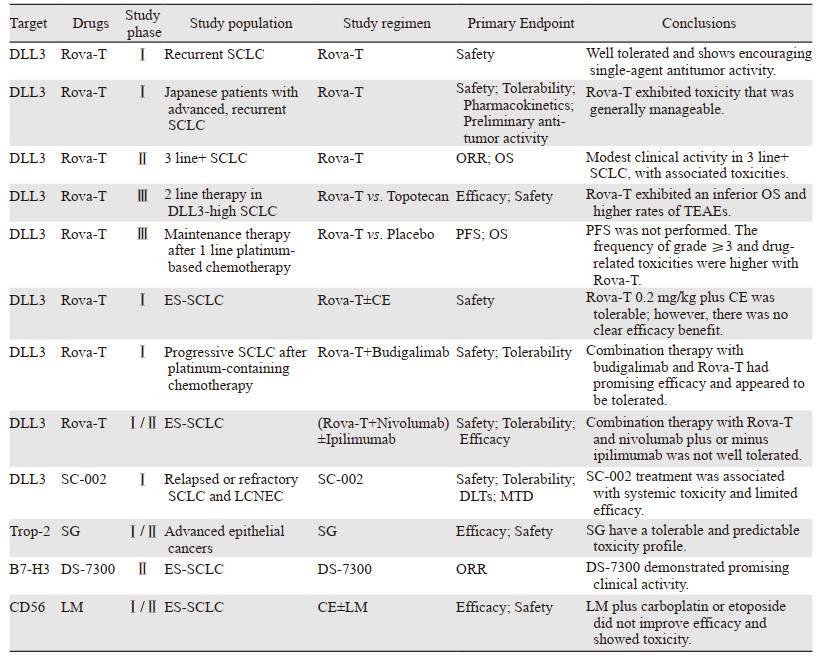
Rovalpituzumab tesirine(Rova-T)是首个靶向DLL3的ADC。由单克隆抗体SC16,DNA交联剂SC-DR002和一种蛋白酶可切割连接子组成,平均DAR为2[19]。Rova-T利用DLL3配体,结合并向表达受体的细胞递送细胞毒性载荷。内化后,细胞毒性载荷被释放并引起DNA损伤,抑制过表达靶受体的肿瘤细胞增殖[18]。目前正在研究几种不同的DLL3靶向模式,包括ADC、T细胞接合物和嵌合抗原受体T细胞[20]。Rova-T已在SCLC及其他神经内分泌肿瘤中以单药和(或)联合的方式充分评估。
首次人体Ⅰ期研究[19]结果显示出良好的单药抗肿瘤活性且安全性可控,在三线SCLC治疗中尤其令人鼓舞。同时,日本晚期复发SCLC患者中的安全性和药代动力学暴露的初步数据也支持在全球研究中进一步探索Rova-T治疗日本患者[21]。初步研究结果似乎有足够的希望促进Rova-T其他研究的启动,包括TRINITY研究和两项Ⅲ期研究(TAHOE, MERU)。
TRINITY研究[22]评估Rova-T在三线及以上(3L+)表达DLL3的SCLC患者的疗效和安全性。所有患者的ORR为12.4%,中位OS为5.6个月。最常见的治疗相关不良事件(treatment emerged adverse events, TEAEs)为疲劳38%、光敏反应36%、胸腔积液32%、外周水肿31%和食欲下降30%。这项试验的结果表明,Rova-T在3L+SCLC中有适度的临床活性并伴有相关毒性。TAHOE研究[23]发现Rova-T组比拓扑替康组的中位OS短(6.3 vs. 8.6个月)。MERU研究[24]是另一项评估Rova-T作为一线化疗后维持疗效的Ⅲ期临床试验。该研究显示Rova-T组≥3级的TEAEs高于安慰剂组。虽然Rova-T组患者表现出更长的PFS,但是并未发现OS的获益。据推测,Rova-T的独特毒性与连接物的过早裂解,导致细胞毒性载荷全身释放有关[25]。此外,一些研究也尝试将Rova-T与其他抗癌药物如铂类和ICI联合,但是结果同样令人失望。
评估Rova-T单独或联合铂类化疗在ES-SCLC一线治疗中的疗效[26],结果表明低剂量的Rova-T(0.2 mg/kg)联合铂类化疗是可耐受的,但是在一线化疗中加入Rova-T并没有益处。ICI与ADC联合[27]使用可能是一种有吸引力的治疗方法。31例患者接受了布格利单抗和Rova-T的联合治疗,结果显示其疗效与SCLC其他治疗方案的结果类似。在最近的一项研究中,Rova-T联合纳武利尤单抗联合或不联合伊匹木单抗被发现在复发性ES-SCLC中具有令人鼓舞的抗肿瘤活性[28]。遗憾的是,在评估的剂量水平下患者耐受性不佳导致该研究终止。
尽管Rova-T的开发不幸终止,但是DLL3在SCLC中仍然是一个高价值靶点。CBL0137是一种实验药物,靶向在肿瘤中高水平表达的组蛋白伴侣FACT。CBL0137能够增加Rova-T在SCLC中对肿瘤起始细胞的靶向疗效,并且这种治疗策略在体内有效[29]。这可能代表一种新的药物组合,能够预防肿瘤复发并产生更持久的反应。
SC-002作为单药治疗复发和(或)难治性SCLC和大细胞神经内分泌癌患者的试验[30],结果同样令人失望,存在全身毒性并且疗效有限。SC-002具有与Rova-T相同的抗体和有效载荷,可向表达DLL3的细胞递送SC-DR002。
2.2 靶向Trop-2Trop-2通过各种信号通路控制癌症的生长和扩散,是许多癌症的预后因子。Trop-2在肿瘤组织中表达增强而在正常组织中表达极低,这表明它可能是精确治疗的独特靶点[31]。
Sacituzumab govitecan(SG)是Trop-2的人源化抗体与拓扑异构酶Ⅰ抑制剂(TOPO-Ⅰ)的结合物[31]。CL2A-SN-38偶联抗Trop-2抗体被命名为IMMU-132,后被美国命名委员会(USAN)命名为Sacituzumab govitecan[32]。与Sacituzumab结合的肿瘤细胞通过细胞内摄取SN-38而死亡,邻近的肿瘤细胞通过“旁观者效应”而被杀死[33]。关于SG的临床研究始于2012年,最初包括结直肠癌、胃癌、肝细胞癌、NSCLC、SCLC、卵巢癌、胰腺癌、前列腺癌、三阴性乳腺癌和尿路上皮癌[34]。一项报告总结了IMMU-132-01篮子试验[35]的最终结果,发现SCLC队列的ORR为17.7%,有11例PR无CR。PFS在各队列中相似但在结直肠癌患者中最长(3.9个月),其次是SCLC(3.7个月)。
2.3 靶向B7-H3B7同源3蛋白(B7-H3)是B7家族中的1型跨膜蛋白,在肿瘤组织中广泛表达[36]。一种结合4个TOPO-Ⅰ颗粒的B7-H3特异性ADC[35]DS-7300在一项Ⅰ/Ⅱ期研究中表现出良好的临床活性,78%可评估的重度预处理SCLC患者实现了缓解[37]。第2阶段研究预计将于2024年6月完成。
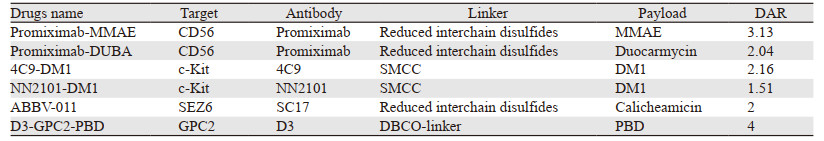
2.4 靶向CD56Lorvotuzumab mertansine(LM)由抗CD56人源化单克隆抗体通过二硫键与DM1偶联组成[38]。一旦与靶细胞表面的CD56结合,LM内化、连接子被切割后DM1得以释放,从而抑制微管蛋白聚合并导致细胞死亡[38]。在临床前研究中,LM联合铂类[39]化疗在CD56+的小鼠模型中表现出强大的抗肿瘤活性,甚至优于单独化疗。但是,在先前未经治疗的ES-SCLC患者中联合组并未带来显著的PFS或OS优势,而且显示出严重的毒性和更高的感染概率[40]。
Promiximab-MMAE对CD56+细胞系(NCI-H524、NCI-H526和NCI-H69)具有有效的抗增殖作用[41]。Promiximab-DUBA在NCI-H526异种移植模型中注射3次,5 mg/kg和10 mg/kg即可实现肿瘤消退,并且HE染色显示给药后无明显全身毒性风险[42]。以上两种ADC在体内外均表现出较强的抗肿瘤活性,是治疗CD56+SCLC的潜在候选药物。
ADC在SCLC中的部分临床研究结果见表 1。
有研究开发出一种完全针对c-Kit的人源化抗体,验证其结合特异性并使用各种体内外模型检测其抗肿瘤活性,结果表明4C9-DM1(微管抑制剂DM1与SMCC偶联)对c-Kit阳性细胞株的活性比对c-Kit阴性细胞株高4~300倍以上,并且能够诱导细胞周期阻滞,从而导致SCLC细胞凋亡[43]。为了克服酪氨酸激酶抑制剂耐药,他们开发了NN2101-DM1。NN2101-DM1对SCLC细胞表现出明显高于标准一线化疗方案的抗癌作用,尽管c-Kit不是介导SCLC的发病机制[44]。
转录谱和免疫组织化学均显示癫痫发作相关同源体6(SEZ6)在原发SCLC标本和SCLC的PDX模型中特异性表达且靶向该靶点的抗体在与受体结合后能够迅速内化。以SEZ6为靶点的ADC—ABBV-011能够在体内外有效驱动肿瘤消退[45]。目前Ⅰ期临床试验正在进行。
D3-GPC2-PBD是将人GPC2抗体D3连接到PBD二聚体的ADC,可以通过诱导DNA损伤、凋亡和旁观者效应诱导持续性神经母细胞瘤和SCLC消退,并且没有观察到相关体内毒性迹象[46]。该研究为支持靶向GPC2 ADC的临床转化提供了临床前数据。
以上临床前实验结果见表 2。
为了进一步提高疗效,也有研究尝试替换ADC成分中的一种或几种,在达到靶向效果的同时减少药物相关不良反应。考虑到抗体治疗的限制,一种靶向SCLC上过表达的细胞表面受体的微型药物偶联物有可能迅速在远离血管的肿瘤组织深处积累有效载荷[47]。以生长抑素受体2(SSTR2)为靶点的肽偶联药物PEN-221能够在几种表达SSTR2的异种移植模型中诱导肿瘤退化[48],该药物目前正在临床试验中进行评估。SSTR2在原发性SCLC和细胞系及高级别神经内分泌癌中发挥重要的促生长作用[49]。PEN-221的快速肿瘤积累和持久肿瘤暴露是对肿瘤产生活性的关键[47]。
新型纳米复合物TPP1NP-EP在体内外实验中均显示出对SCLC良好的抗肿瘤作用。同时,TPP1NP-EP具有优良的生物相容性和良好的体内安全性,对主要器官的组织细胞损伤和血液生化参数无明显影响[50]。
近红外光免疫疗法(NIR-PIT)是一种新近开发的肿瘤治疗方法。单克隆抗体和光敏剂IR700偶联后用近红外光照射诱导癌细胞快速死亡。抗MRP1抗体-IR700偶联物(Mab-IR700)[51]可用于治疗过表达MRP1的耐药SCLC H69AR细胞。为治疗耐药SCLC提供了一种有前景的方法,值得进一步研究。DLL3靶向的NIR-PIT[52]仅损伤表达DLL3的细胞并且能够显著抑制小鼠模型中SCLC的生长并提高生存率。
细胞黏附分子轴突蛋白1(NRXN1)是SCLC中一个有前途的靶点,富含NRXN1的SCLC可以从NRXN1介导的ADC中受益[53]。
二烯神经节苷GD2亚型在正常组织中表达有限,但在肿瘤中过表达。除了神经母细胞瘤,GD2靶向治疗目前正在研究用于治疗多种表达GD2的肿瘤,包括成人SCLC、儿童和成人骨肉瘤、胶质瘤、软组织肉瘤、尤文肉瘤、视网膜母细胞瘤和黑色素瘤[54]。
ADC通过限制正常组织暴露于有效载荷来减少脱靶毒性并提高疗效,与传统化疗相比拓宽了潜在的治疗窗口。令人遗憾的是,尽管有大量的肿瘤相关抗原被提出作为癌症治疗策略的候选靶点,但是适合用作ADC定向干预的靶点数量要有限得多,尤其在SCLC中。
4 小结ADCs为传统药物的缺陷提供了一种潜在的解决方案,作为一种新型的治疗方式才刚刚开始展现出前景。ADCs领域的发展仍然需要不断努力改进靶点选择,开发具有不同作用机制和较强活性的有效载荷,创新设计生物偶联策略以提高药物的活性和稳定性。同时,在设计合理有效ADCs的基础上,积极尝试与其他药物的联合使用或许能够提高疗效。本临床前研究提供的信息有限,但是这些探索为SCLC的治疗提供了新思路和新靶点。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
韩晶:文献查阅、论文撰写
陈雅蕊:思路设计、归类总结
王松:资料整理、数据分析
关泉林:论文修改及审阅
| [1] |
Bade BC, Dela Cruz CS. Lung Cancer 2020: Epidemiology, Etiology, and Prevention[J]. Clin Chest Med, 2020, 41(1): 1-24. DOI:10.1016/j.ccm.2019.10.001 |
| [2] |
Howlader N, Forjaz G, Mooradian MJ, et al. The Effect of Advances in Lung-Cancer Treatment on Population Mortality[J]. N Engl J Med, 2020, 383(7): 640-649. DOI:10.1056/NEJMoa1916623 |
| [3] |
Dingemans AC, Früh M, Ardizzoni A, et al. Small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2021, 32(7): 839-853. DOI:10.1016/j.annonc.2021.03.207 |
| [4] |
Rudin CM, Brambilla E, Faivre-Finn C, et al. Small-cell lung cancer[J]. Nat Rev Dis Primers, 2021, 7(1): 3. DOI:10.1038/s41572-020-00235-0 |
| [5] |
Strebhardt K, Ullrich A. Paul Ehrlich's magic bullet concept: 100 years of progress[J]. Nat Rev Cancer, 2008, 8(6): 473-480. DOI:10.1038/nrc2394 |
| [6] |
Lambert JM, Berkenblit A. Antibody-Drug Conjugates for Cancer Treatment[J]. Annu Rev Med, 2018, 69: 191-207. DOI:10.1146/annurev-med-061516-121357 |
| [7] |
Criscitiello C, Morganti S, Curigliano G. Antibody-drug conjugates in solid tumors: a look into novel targets[J]. J Hematol Oncol, 2021, 14(1): 20. DOI:10.1186/s13045-021-01035-z |
| [8] |
Dan N, Setua S, Kashyap V, et al. Antibody-Drug Conjugates for Cancer Therapy: Chemistry to Clinical Implications[J]. Pharmaceuticals (Basel), 2018, 11(2): 32. DOI:10.3390/ph11020032 |
| [9] |
Abdollahpour-Alitappeh M, Lotfinia M, Gharibi T, et al. Antibody-drug conjugates (ADCs) for cancer therapy: Strategies, challenges, and successes[J]. J Cell Physiol, 2019, 234(5): 5628-5642. DOI:10.1002/jcp.27419 |
| [10] |
Reuss JE, Gosa L, Liu SV. Antibody Drug Conjugates in Lung Cancer: State of the Current Therapeutic Landscape and Future Developments[J]. Clin Lung Cancer, 2021, 22(6): 483-499. DOI:10.1016/j.cllc.2021.07.011 |
| [11] |
Leung D, Wurst J, Liu T, et al. Antibody Conjugates-Recent Advances and Future Innovations[J]. Antibodies(Basel), 2020, 9(1): 2. |
| [12] |
Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries[J]. Protein Cell, 2018, 9(1): 33-46. DOI:10.1007/s13238-016-0323-0 |
| [13] |
Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody–drug conjugates[J]. Nat Rev Drug Discov, 2017, 16(5): 315-337. DOI:10.1038/nrd.2016.268 |
| [14] |
Drago JZ, Modi S, Chandarlapaty S. Unlocking the potential of antibody-drug conjugates for cancer therapy[J]. Nat Rev Clin Oncol, 2021, 18(6): 327-344. DOI:10.1038/s41571-021-00470-8 |
| [15] |
Leonetti A, Facchinetti F, Minari R, et al. Notch pathway in small-cell lung cancer: from preclinical evidence to therapeutic challenges[J]. Cell Oncol (Dordr), 2019, 42(3): 261-273. |
| [16] |
Owen DH, Giffin MJ, Bailis JM, et al. DLL3: an emerging target in small cell lung cancer[J]. J Hematol Oncol, 2019, 12(1): 61. DOI:10.1186/s13045-019-0745-2 |
| [17] |
Furuta M, Sakakibara-Konishi J, Kikuchi H, et al. Analysis of DLL3 and ASCL1 in Surgically Resected Small Cell Lung Cancer (HOT1702)[J]. Oncologist, 2019, 24(11): e1172-e1179. DOI:10.1634/theoncologist.2018-0676 |
| [18] |
Lashari BH, Vallatharasu Y, Kolandra L, et al. Rovalpituzumab Tesirine: A Novel DLL3-Targeting Antibody-Drug Conjugate[J]. Drug R D, 2018, 18(4): 255-258. DOI:10.1007/s40268-018-0247-7 |
| [19] |
Rudin CM, Pietanza MC, Bauer TM, et al. Rovalpituzumab tesirine, a DLL3-targeted antibody-drug conjugate, in recurrent small-cell lung cancer: a first-in-human, first-in-class, open-label, phase 1 study[J]. Lancet Oncol, 2017, 18(1): 42-51. DOI:10.1016/S1470-2045(16)30565-4 |
| [20] |
Yao J, Bergsland E, Aggarwal R, et al. DLL3 as an Emerging Target for the Treatment of Neuroendocrine Neoplasms[J]. Oncologist, 2022, 27(11): 940-951. DOI:10.1093/oncolo/oyac161 |
| [21] |
Udagawa H, Akamatsu H, Tanaka K, et al. Phase Ⅰ safety and pharmacokinetics study of rovalpituzumab tesirine in Japanese patients with advanced, recurrent small cell lung cancer[J]. Lung Cancer, 2019, 135: 145-150. DOI:10.1016/j.lungcan.2019.07.025 |
| [22] |
Morgensztern D, Besse B, Greillier L, et al. Efficacy and Safety of Rovalpituzumab Tesirine in Third-Line and Beyond Patients with DLL3-Expressing, Relapsed/Refractory Small-Cell Lung Cancer: Results From the Phase Ⅱ TRINITY Study[J]. Clin Cancer Res, 2019, 25(23): 6958-6966. DOI:10.1158/1078-0432.CCR-19-1133 |
| [23] |
Blackhall F, Jao K, Greillier L, et al. Efficacy and Safety of Rovalpituzumab Tesirine Compared With Topotecan as Second-Line Therapy in DLL3-High SCLC: Results From the Phase 3 TAHOE Study[J]. J Thorac Oncol, 2021, 16(9): 1547-1558. DOI:10.1016/j.jtho.2021.02.009 |
| [24] |
Johnson ML, Zvirbule Z, Laktionov K, et al. Rovalpituzumab Tesirine as a Maintenance Therapy After First-Line Platinum-Based Chemotherapy in Patients With Extensive-Stage-SCLC: Results From the Phase 3 MERU Study[J]. J Thorac Oncol, 2021, 16(9): 1570-1581. DOI:10.1016/j.jtho.2021.03.012 |
| [25] |
Thomas A, Teicher BA, Hassan R. Antibody-drug conjugates for cancer therapy[J]. Lancet Oncol, 2016, 17(6): e254-e262. DOI:10.1016/S1470-2045(16)30030-4 |
| [26] |
Hann CL, Burns TF, Dowlati A, et al. A Phase 1 Study Evaluating Rovalpituzumab Tesirine in Frontline Treatment of Patients With Extensive-Stage SCLC[J]. J Thorac Oncol, 2021, 16(9): 1582-1588. DOI:10.1016/j.jtho.2021.06.022 |
| [27] |
Calvo E, Spira A, Miguel M, et al. Safety, pharmacokinetics, and efficacy of budigalimab with rovalpituzumab tesirine in patients with small cell lung cancer[J]. Cancer Treat Res Commun, 2021, 28: 100405. DOI:10.1016/j.ctarc.2021.100405 |
| [28] |
Malhotra J, Nikolinakos P, Leal T, et al. A Phase 1-2 Study of Rovalpituzumab Tesirine in Combination With Nivolumab Plus or Minus Ipilimumab in Patients With Previously Treated Extensive-Stage SCLC[J]. J Thoracic Oncol, 2021, 16(9): 1559-1569. DOI:10.1016/j.jtho.2021.02.022 |
| [29] |
Lindner DJ, Wildey G, Parker Y, et al. CBL0137 increases the targeting efficacy of Rovalpituzumab tesirine against tumour-initiating cells in small cell lung cancer[J]. Br J Cancer, 2021, 124(5): 893-895. DOI:10.1038/s41416-020-01192-x |
| [30] |
Morgensztern D, Johnson M, Rudin CM, et al. SC-002 in patients with relapsed or refractory small cell lung cancer and large cell neuroendocrine carcinoma: Phase 1 study[J]. Lung Cancer, 2020, 145: 126-131. DOI:10.1016/j.lungcan.2020.04.017 |
| [31] |
Goldenberg DM, Stein R, Sharkey RM. The emergence of trophoblast cell-surface antigen 2 (TROP-2) as a novel cancer target[J]. Oncotarget, 2018, 9(48): 28989-29006. DOI:10.18632/oncotarget.25615 |
| [32] |
Goldenberg DM, Sharkey RM. Antibody-drug conjugates targeting TROP-2 and incorporating SN-38: A case study of anti-TROP-2 sacituzumab govitecan[J]. MAbs, 2019, 11(6): 987-995. DOI:10.1080/19420862.2019.1632115 |
| [33] |
Bardia A, Mayer IA, Vahdat LT, et al. Sacituzumab Govitecan-hziy in Refractory Metastatic Triple-Negative Breast Cancer[J]. N Engl J Med, 2019, 380(8): 741-751. DOI:10.1056/NEJMoa1814213 |
| [34] |
Starodub AN, Ocean AJ, Shah MA, et al. First-in-Human Trial of a Novel Anti-Trop-2 Antibody-SN-38 Conjugate, Sacituzumab Govitecan, for the Treatment of Diverse Metastatic Solid Tumors[J]. Clin Cancer Res, 2015, 21(17): 3870-3878. DOI:10.1158/1078-0432.CCR-14-3321 |
| [35] |
Bardia A, Messersmith WA, Kio EA, et al. Sacituzumab govitecan, a Trop-2-directed antibody-drug conjugate, for patients with epithelial cancer: final safety and efficacy results from the phaseⅠ/Ⅱ IMMU-132-01 basket trial[J]. Ann Oncol, 2021, 32(6): 746-756. DOI:10.1016/j.annonc.2021.03.005 |
| [36] |
Kontos F, Michelakos T, Kurokawa T, et al. B7-H3: An Attractive Target for Antibody-based Immunotherapy[J]. Clin Cancer Res, 2021, 27(5): 1227-1235. DOI:10.1158/1078-0432.CCR-20-2584 |
| [37] |
Paz-Ares L, Johnson ML, Girard N, et al. 1550TiP PhaseⅡ, multicenter, randomized, open-label study of DS-7300 in patients (pts) with pre-treated extensive-stage small cell lung cancer (ES-SCLC)[J]. Ann Oncol, 2022, 33: S1255-S1256. |
| [38] |
Berdeja JG. Lorvotuzumab mertansine: antibody-drug-conjugate for CD56+ multiple myeloma[J]. Front Biosci (Landmark Ed), 2014, 19(1): 163-170. DOI:10.2741/4202 |
| [39] |
Whiteman KR, Johnson HA, Mayo MF, et al. Lorvotuzumab mertansine, a CD56-targeting antibody-drug conjugate with potent antitumor activity against small cell lung cancer in human xenograft models[J]. MAbs, 2014, 6(2): 556-566. DOI:10.4161/mabs.27756 |
| [40] |
Socinski MA, Kaye FJ, Spigel DR, et al. Phase 1/2 Study of the CD56-Targeting Antibody-Drug Conjugate Lorvotuzumab Mertansine (IMGN901) in Combination With Carboplatin/Etoposide in Small-Cell Lung Cancer Patients With Extensive-Stage Disease[J]. Clin Lung Cancer, 2017, 18(1): 68-76. DOI:10.1016/j.cllc.2016.09.002 |
| [41] |
Yu L, Yao Y, Wang Y, et al. Preparation and anti-cancer evaluation of promiximab-MMAE, an anti-CD56 antibody drug conjugate, in small cell lung cancer cell line xenograft models[J]. J Drug Target, 2018, 26(10): 905-912. DOI:10.1080/1061186X.2018.1450413 |
| [42] |
Yu L, Lu Y, Yao Y, et al. Promiximab-duocarmycin, a new CD56 antibody-drug conjugates, is highly efficacious in small cell lung cancer xenograft models[J]. Oncotarget, 2018, 9(4): 5197-5207. DOI:10.18632/oncotarget.23708 |
| [43] |
Kim KH, Kim JO, Park JY, et al. Antibody-Drug Conjugate Targeting c-Kit for the Treatment of Small Cell Lung Cancer[J]. Int J Mol Sci, 2022, 23(4): 2264. DOI:10.3390/ijms23042264 |
| [44] |
Kim J, Kim K, Baek EJ, et al. A novel anti-c-Kit antibody-drug conjugate to treat wild-type and activating-mutant c-Kit-positive tumors[J]. Mol Oncol, 2022, 16(6): 1290-1308. DOI:10.1002/1878-0261.13084 |
| [45] |
Wiedemeyer WR, Gavrilyuk J, Schammel A, et al. ABBV-011, A Novel, Calicheamicin-Based Antibody-Drug Conjugate, Targets SEZ6 to Eradicate Small Cell Lung Cancer Tumors[J]. Mol Cancer Ther, 2022, 21(6): 986-998. DOI:10.1158/1535-7163.MCT-21-0851 |
| [46] |
Raman S, Buongervino SN, Lane MV, et al. A GPC2 antibody-drug conjugate is efficacious against neuroblastoma and small-cell lung cancer via binding a conformational epitope[J]. Cell Rep Med, 2021, 2(7): 100344. DOI:10.1016/j.xcrm.2021.100344 |
| [47] |
Whalen KA, White BH, Quinn JM, et al. Targeting the Somatostatin Receptor 2 with the Miniaturized Drug Conjugate, PEN-221: A Potent and Novel Therapeutic for the Treatment of Small Cell Lung Cancer[J]. Mol Cancer Ther, 2019, 18(11): 1926-1936. DOI:10.1158/1535-7163.MCT-19-0022 |
| [48] |
White BH, Whalen K, Kriksciukaite K, et al. Discovery of an SSTR2-Targeting Maytansinoid Conjugate (PEN-221) with Potent Activity in Vitro and in Vivo[J]. J Med Chem, 2019, 62(5): 2708-2719. DOI:10.1021/acs.jmedchem.8b02036 |
| [49] |
Lehman JM, aMassion PP. Somatostatin receptor 2 targeting in small cell lung carcinoma: perspectives[J]. Oncotarget, 2019, 10(46): 4727-4730. DOI:10.18632/oncotarget.27107 |
| [50] |
Tao Z, Kuai X, Wang G, et al. Combination of chemotherapy and immune checkpoint therapy by the immunoconjugates-based nanocomplexes synergistically improves therapeutic efficacy in SCLC[J]. Drug Deliv, 2022, 29(1): 1571-1581. DOI:10.1080/10717544.2022.2039803 |
| [51] |
Li F, Mao C, Yeh S, et al. MRP1-targeted near infrared photoimmunotherapy for drug resistant small cell lung cancer[J]. Int J Pharm, 2021, 604: 120760. DOI:10.1016/j.ijpharm.2021.120760 |
| [52] |
Isobe Y, Sato K, Nishinaga Y, et al. Near infrared photoimmunotherapy targeting DLL3 for small cell lung cancer[J]. EBioMedicine, 2020, 52: 102632. DOI:10.1016/j.ebiom.2020.102632 |
| [53] |
Yotsumoto T, Maemura K, Watanabe K, et al. NRXN1 as a novel potential target of antibody-drug conjugates for small cell lung cancer[J]. Oncotarget, 2020, 11(39): 3590-3600. DOI:10.18632/oncotarget.27718 |
| [54] |
Nazha B, Inal C, Owonikoko TK. Disialoganglioside GD2 Expression in Solid Tumors and Role as a Target for Cancer Therapy[J]. Front Oncol, 2020, 10: 1000. DOI:10.3389/fonc.2020.01000 |
 2023, Vol. 50
2023, Vol. 50