文章信息
- 伊尼妥单抗治疗HER2阳性乳腺癌肝寡转移1例并文献复习
- Inetetamab Treatment for Liver Oligometastases of HER2-Positive Breast Cancer: A Case Report and Literature Review
- 肿瘤防治研究, 2023, 50(10): 1029-1034
- Cancer Research on Prevention and Treatment, 2023, 50(10): 1029-1034
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0430
- 收稿日期: 2023-04-23
- 修回日期: 2023-08-15
2. 518116 深圳,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院病理科
2. Pathology Department of National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital & Shenzhen Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Shenzhen 518116, China
根据2020年全球癌症报告数据,乳腺癌已成为全球第一高发恶性肿瘤,其中全球18.4%乳腺癌新发病例在中国[1]。HER2阳性乳腺癌约占所有乳腺癌的15%~20%,它侵袭性更高,更容易发生肝、肺等内脏转移,预后更差[2-3]。肝转移是乳腺癌常见的远处转移之一,约占所有转移患者的30%[4]。寡转移被定义为转移数量和转移器官部位有限的、处于局限期和广泛性转移癌症之间的状态[4]。本文通过回顾一例HER2阳性晚期乳腺癌肝寡转移患者的诊治过程,探讨HER2阳性乳腺癌肝寡转移的综合治疗手段,以期改善该类患者的生活质量,提高总生存期。
1 病例资料患者女,初诊时29岁,2017年8月29日因“发现左侧乳腺肿块20天”就诊于外院,行左乳肿物空心针穿刺活检示:(左乳肿物)浸润性导管癌,免疫组织化学结果显示:ER(+)、PR(-)、HER2(+++),Ki-67(30%+)。2017年09月08日开始行多西他赛(75 mg/m2)+卡铂(AUC 5)+曲妥珠单抗(初始负荷剂量8 mg/kg,维持剂量6 mg/kg)3周方案新辅助治疗5周期,治疗后左乳肿块明显缩小,临床评估疗效达部分缓解(PR)。2018年1月10日于外院行全麻下左侧乳腺癌保乳根治术+左乳房整复术,术后病理示:左乳腺浸润性导管癌,Ⅱ级,浸润性癌最大径17 mm,癌旁组织脉管内未见癌栓,未见癌组织侵犯神经;左侧腋窝淋巴结未见癌(0/17);治疗反应:RCB分级Ⅱ级。免疫组织化学结果显示:ER(TS 8分),PR(-),HER2(+),Ki-67(3%)。术后诊断:左乳浸润性导管癌,ypT1cN0M0,ⅠA期。术后继续行多西他赛(75 mg/m2)+卡铂(AUC 5)+曲妥珠单抗(6 mg/kg)3周方案辅助治疗1周期,之后予曲妥珠单抗(6 mg/kg)3周方案辅助靶向治疗满1年。2018年3月12日行左侧胸壁及淋巴引流区域放射治疗,处方剂量为50 Gy/25次。同时行戈舍瑞林(3.6 mg)+依西美坦(25 mg)辅助内分泌治疗。期间每三个月定期复查一次,未见复发及转移。
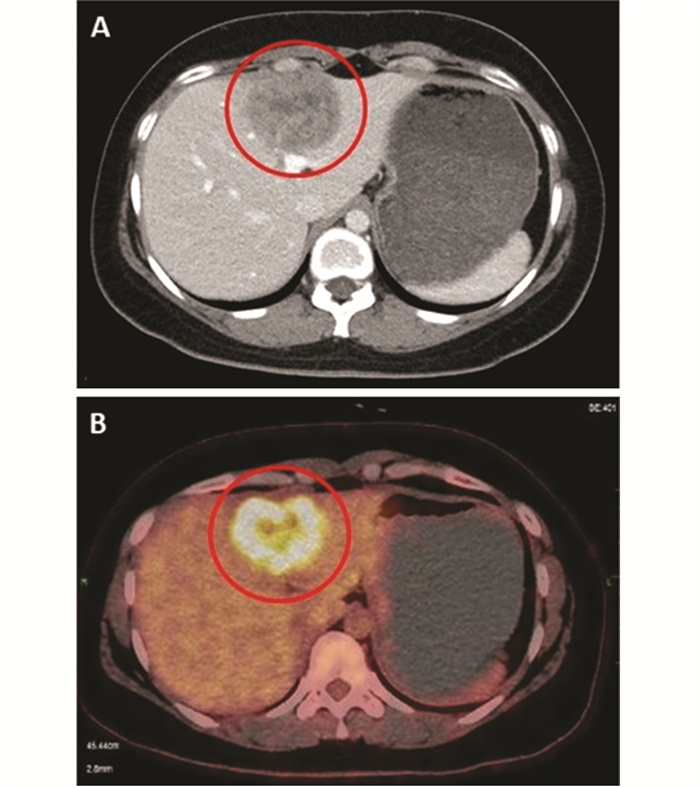
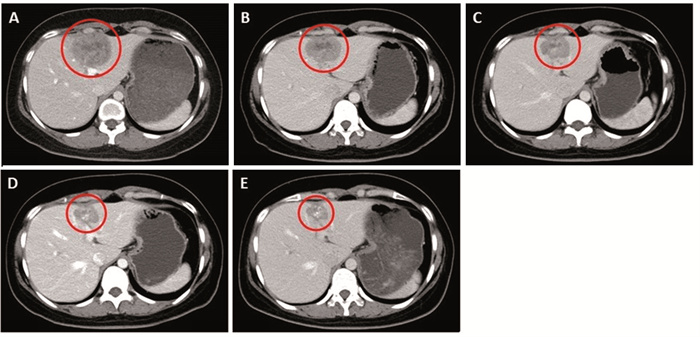
2021年5月1日外院复查,肝胆胰脾彩超显示肝转移。2021年5月12日首次来我院就诊,体格检查:ECOG 0分,左腋下可见一长约3 cm手术疤痕,左乳晕上缘可见一长约3 cm弧形疤痕,愈合良好,双乳未扪及肿块。胸上腹CT示:肝左叶肿块,不均匀强化,肿块最大径为5.5 cm,侵及肝包膜,考虑转移瘤,见图 1A。2021年5月19日行PET/CT示:肝左内叶S4高代谢肿物,病灶最大径为5.5 cm,最大SUV 9.9,考虑恶性,结合临床首先考虑转移瘤,见图 1B;余处未见复发及转移。颅脑MRI未见转移。实验室检查:血常规、生化、肿瘤标志物(CEA、CA125、CA153)未见异常。诊断:左乳浸润性导管癌,5周期新辅助治疗后,左侧保乳根治术+左侧腋窝淋巴结清扫术后,辅助化放疗,辅助靶向治疗及内分泌治疗后,肝转移,cTxN0M1,Ⅳ期。晚期一线行伊尼妥单抗(初始负荷剂量8 mg/kg,维持剂量6 mg/kg)+吡咯替尼(初始为400 mg,1周后反复出现Ⅱ级腹泻自第2周期开始调整为320 mg)+白蛋白结合型紫杉醇(260 mg/m2)3周方案治疗8周期,同时予戈舍瑞林(3.6 mg)抑制卵巢功能。期间出现Ⅰ级白细胞减少、Ⅱ级中性粒细胞减少、Ⅱ级腹泻,对症治疗及药物减量后症状缓解。2周期和4周期治疗后复查颈胸腹盆CT示:肝左叶转移瘤,较前略缩小,最大径分别为5.1 cm和4.2 cm,临床评估疗效为疾病稳定(SD),见图 2B、2C。6周期和8周期治疗后复查颈胸腹盆CT均示:肝左叶转移瘤,较前明显缩小,最大径分别为3.4 cm和3.1 cm,临床评估疗效为部分缓解(PR),见图 2D、2E。
|
| A: CT scan showing liver metastases; B: PET/CT scan showing liver metastases with hypermetabolism. 图 1 乳腺癌肝转移CT和PET/CT Figure 1 CT and PET/CT of liver metastases of breast cancer in the patient |
|
| A, B, C, D, E: baseline, 2 cycles, 4 cycles, 6 cycles, and 8 cycles of examination of liver metastases. 图 2 治疗不同周期后肝转移瘤CT变化 Figure 2 CT of liver metastases during treatment in the patient |
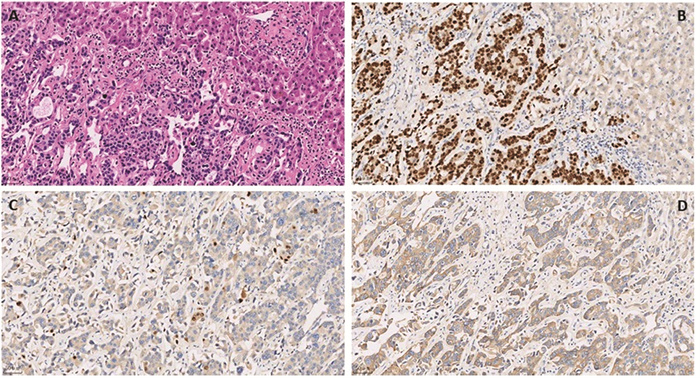
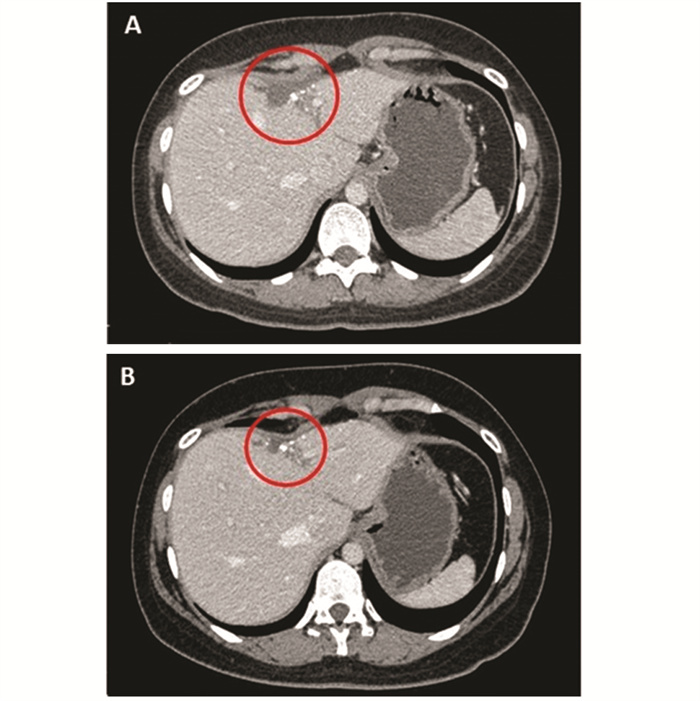
2021年12月1日于我院全麻下行4K荧光腹腔镜下肝S3/4b段切除术+肠粘连松解术,术后病理示:结合免疫组织化学结果,符合乳腺癌肝转移,组织学分级为Ⅱ级,转移瘤最大径2.8 cm,累及肝被膜,可见神经侵犯,未见明确脉管瘤栓;肿瘤细胞部分退变、间质可见纤维化及钙化,符合治疗后反应;周围肝未见明显异常;肝断端未见癌;免疫组织化学结果显示:ER(+,90%强阳),PR(+,1%中弱阳),HER2(+),Ki-67(5%+),见图 3。2021年12月21日开始行伊尼妥单抗(6 mg/kg)+吡咯替尼(320 mg)+长春瑞滨软胶囊(80 mg/m2)3周方案维持治疗至今,同时继续给予戈舍瑞林抑制卵巢功能治疗。期间出现Ⅰ级白细胞减少、Ⅱ级中性粒细胞减少、Ⅰ级腹泻,对症治疗后恢复。临床评估疗效为完全缓解,见图 4。
|
| A: Pathological examination of liver lesion after hepatectomy showing poor differentiated adenocarcinoma (HE ×200); B: Estrogen receptor (90%, +, strongly positive, Envision ×200); C: Progesterone receptor (1%, +, weak-moderately positive, Envision ×200); D: Human epidermal growth factor receptor-2 (1+, Envision ×200). 图 3 肝转移瘤术后病理学结果 Figure 3 Pathological examination of liver lesion after hepatectomy in the patient |
|
| A: postoperative effusion (February 15, 2022); B: postoperative effusion (December 15, 2023). 图 4 肝转移瘤术后CT Figure 4 CT of liver after surgery in the patient |
HER2阳性乳腺癌约占所有乳腺癌的15%~20%,具有易发生肝肺等内脏转移、预后差、生存期短的特点。但随着抗HER2治疗药物的不断更新,HER2阳性晚期乳腺癌患者的预后也得到了显著改善。因此针对HER2阳性晚期乳腺癌,抗HER2靶向治疗尤为重要。目前抗HER2药物主要包括大分子单克隆抗体、小分子酪氨酸激酶抑制剂(TKI)、抗体偶联药物(ADC),抗HER2治疗策略包括曲妥珠单抗联合帕妥珠单抗(Herceptin+Pertuzumab, HP)、曲妥珠单抗联合TKI(H+TKI)、ADC等。CLEOPATRA研究发现HP双靶治疗疗效显著超越曲妥珠单抗单靶治疗,中位无进展时间(PFS)达18.7个月、中位总生存时间(OS)达57.1个月,奠定了HP双靶一线抗HER2治疗的标准地位[5]。除此之外,PERUSE研究提示一线HP联合紫杉类药物治疗HER2阳性晚期乳腺癌中位PFS为20.7个月、中位OS为65.3个月[6]。H+TKI优势互补、内外呼应,联合使用可双重阻断HER2信号通路,同时发挥两者优势从而提高抗肿瘤作用,也是HER2阳性晚期乳腺癌抗HER2可选择的方案之一。已有多项研究证实H+TKI在早期以及晚期乳腺癌的疗效及安全性。Cher.LOB研究提示新辅助治疗阶段经曲妥珠单抗+拉帕替尼+化疗治疗,5年患者无复发生存(RFS)达85.8%,其中获得pCR的患者较未获得pCR的患者具有更长RFS和OS[7]。另外一项Ⅱ期探索性研究证实曲妥珠单抗+吡咯替尼+紫杉醇(白蛋白结合型)显著提高pCR率、安全性可[8]。HER2CLIMB研究显示图卡替尼+曲妥珠单抗+化疗显著延长既往多线抗HER2治疗后晚期乳腺癌患者的OS(18.1个月),显著降低脑转移颅内进展或死亡风险,提高生存率[9]。2022年ESMO大会公布了Ⅲ期随机对照研究PHILA的结果,吡咯替尼联合曲妥珠单抗及多西他赛治疗显著延长HER2阳性晚期乳腺癌患者的PFS(24.3个月),接受或未接受曲妥珠单抗(新)辅助治疗人群均保持一致的获益,该研究证实了在HER2阳性晚期乳腺癌的一线治疗中,PFS受益于双重HER2抑制,有望开创HER2阳性乳腺癌晚期一线治疗新格局。从CLEOPATRA以及PHILA等研究可以看出双靶包括HP、曲妥珠单抗联合吡咯替尼在HER2阳性晚期乳腺癌一线治疗中均可带来PFS长期获益。HP联合紫杉类OS为57.1个月,曲妥珠单抗联合吡咯替尼及多西他赛OS数据尚不成熟。对于既往曲妥珠单抗治疗敏感者,目前CSCO指南(2023)将HP联合紫杉类药物作为1B级推荐、曲妥珠单抗联合吡咯替尼及紫杉类药物作为2A级推荐,那么HP双靶以及H+TKI双靶在一线时应如何选择?除了考虑疗效外,帕妥珠单抗目前在晚期乳腺癌中自费、吡咯替尼最常见可感知不良反应腹泻也是需要充分衡量的因素。
国内外指南均鼓励对初次复发转移患者的复发转移病灶进行再活检病理检测,以协助病灶来源以及乳腺癌分子分型的再评估。对于该病例,原则上应进行肝病灶的再活检,但实际中经患者个人考虑后拒绝活检。基于疾病一元论、乳腺癌肝转移临床特点、肝病灶影像学特点,临床考虑乳腺癌肝转移。本病例初诊时空心针穿刺活检显示HER2为+++,在早期阶段原发灶术后病理HER2由+++转变为+,而在复发转移阶段肝转移灶切除后HER2仍为+,可见肿瘤异质性强。根据《2019年中国抗癌协会乳腺癌诊治指南与规范》,当原发灶和转移灶不一致时,只要有一次HER2阳性,就应推荐相应的抗HER2治疗。因此,该病例复发转移阶段仍然按HER2阳性分子分型进行治疗。伊尼妥单抗作为CSCO乳腺癌诊疗指南推荐的H药物之一,是我国第一个自主研发的创新抗HER2单抗,它经过Fc段改造,具有更强的ADCC效应、半衰期延长、免疫原性更低,疗效更佳、安全性更高,HOPES研究证实了伊尼妥单抗在HER2阳性晚期乳腺癌中的疗效及安全性[10]。另外动物实验提示伊尼妥单抗联合吡咯替尼在动物体内肿瘤抑制作用优于HP双靶方案,目前也有探索伊尼妥单抗联合吡咯替尼疗效的临床研究正在进行中。回顾该病例治疗过程,早期阶段经含曲妥珠单抗方案新辅助治疗后未达pCR,根据目前循证医学证据应给予恩美曲妥珠单抗强化治疗,以进一步降低复发转移风险;晚期阶段,伊尼妥单抗联合吡咯替尼带来了显著临床疗效,其生存获益值得期待,治疗过程中吡咯替尼因为出现Ⅱ级腹泻减量至能够耐受剂量。
6%~7%的乳腺癌患者在初诊时即发生转移[11],早期乳腺癌中20%~30%最终进展为晚期乳腺癌[12]。肝转移作为晚期乳腺癌常见转移部位之一,一旦发生,通常预后较差,自然中位OS仅4~8个月,即使对于全身治疗有效的患者,自诊断之日起,中位OS也仅为18~24个月[13]。研究数据表明,年龄小、浸润性导管癌、较高的病理学分级以及三阴型和HER2阳性亚型是发生肝转移的危险因素[14]。目前乳腺癌肝转移的治疗原则仍然以全身抗肿瘤治疗为主,在此基础上,根据疾病情况决定是否可联合局部治疗。据第5版ESO-ESMO国际晚期乳腺癌共识指南(ABC5):对于仅有肝脏寡转移、全身一般情况良好的乳腺癌患者,在接受足够的全身系统治疗控制疾病后,有可能通过局部治疗配合全身治疗来达到完全缓解和长期生存,目前尚无在手术、立体放疗、肝内化疗之中选择最佳局部治疗方案的临床证据[15]。多项研究表明,晚期肝转移患者中的寡转移人群可从局部治疗中获益。一项回顾性研究分析了43例乳腺癌肝转移灶手术切除的病例,术后死亡率为0,术后并发症发生率为16.27%,能显著改善生存的因素为激素受体阳性、原发乳腺癌淋巴结无转移、肝孤立转移灶、转移灶直径≤5厘米[16]。Margonis等的一项多中心回顾性研究发现,90.8%患者可行R0级切除,手术死亡率和并发症发生率分别为0和22.8%,中位OS为53.4个月[17]。研究显示对于乳腺癌肝转移全身治疗效果好、肿瘤负荷低、转移瘤体积小、激素受体阳性、无病生存间期长的患者,局部手术是安全且有效的治疗手段,但目前多是Ⅱ期临床研究或者回顾性研究,仍需更多前瞻性以及随机对照研究进一步明确乳腺癌肝转移灶手术切除的有效性、安全性以及适宜人群。对于局部治疗时机,目前并无标准推荐,且争议较大,有研究者认为在全身治疗疾病控制时根据患者的情况个体化选择局部介入时机[18],也有研究者认为如果DFS时间比较长且肝转移灶单一以及易于切除者,应尽早手术再进行全身系统治疗,若肝转移灶大或者个数多且DFS短,可先进行2~3个月全身系统治疗再局部介入,对全身治疗的反应不作为是否进行肝转移局部治疗的前提条件[19-20]。仍需更多的研究对最佳局部治疗时间进行探索。该病例在全身治疗获益情况下联合肝脏局部手术治疗,最终达到临床CR,目前PFS已超过24个月,实现病灶的长期缓解。
对于HER2+/HR+的三阳型晚期乳腺癌,一线解救治疗后如何选择维持治疗方案及维持时长?内分泌治疗以及化疗,谁是抗HER2靶向治疗最佳搭档?目前暂无头对头研究可以回答这些问题。SYSUCC-002研究结果显示,对于HER2+/HR+晚期乳腺癌患者,曲妥珠单抗联合内分泌治疗(SERMs或AIs)的疗效不劣于曲妥珠单抗联合化疗,而且不良反应更少。而在亚组分析中可见无病间期 > 24个月的患者,曲妥珠单抗联合内分泌治疗可能获益更多[21]。Tolaney研究结果显示,阿贝西利+曲妥珠单抗±氟维司群与曲妥珠单抗+化疗相比,可显著改善HER2+/HR+晚期乳腺癌患者的PFS,安全性良好[22]。但目前抗HER2靶向治疗联合CDK4/6抑制剂相关研究主要处于Ⅰ期和Ⅱ期、集中于经多线治疗患者,并且目前CDK4/6抑制剂报销范围为HR+/HER2-患者,因此并未得到指南或者共识的推荐。尽管Tolaney、MonarcHER等研究证实抗HER2靶向治疗联合内分泌治疗从疗效上并不亚于抗HER2靶向治疗联合化疗,而且安全性佳,但是从这个病例中也看到了抗HER2靶向治疗联合使用方便、疗效佳、毒性低的口服化疗药物也可以带来良好的获益以及耐受性。何者更优仍需大型的Ⅲ期随机对照研究提供更强的循证医学证据。ABC5指出对于晚期HER2阳性晚期乳腺癌若维持治疗方案有效,应持续至疾病进展、出现不可耐受的毒性或者患者自行要求退出。对于达到CR数年的患者,可综合考虑药物毒性、经济状况决定停药时机。因此该病例在目前维持长PFS且耐受性良好的情况下,可不更换治疗方案,而抗HER2靶向治疗联合内分泌治疗可作为进展后选择方案之一。
回顾该病例通过Fc段改造的大分子单抗伊尼妥单抗联合TKI胞外胞内双重抗HER2的大胆设计,在全身获益情况下,晚期不弃刀,通过多学科合作,在有效的全身治疗基础上,针对“寡转移”的病灶提供高质量的局部巩固治疗,极大改善患者的长期生存和提升生活质量,更有可能治愈这部分患者。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
谢小凤:资料收集及论文撰写
白雪、蓝晓凤、李木丽:资料收集、图片整理及论文修订
杜彩文:论文指导、审阅与修订
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene[J]. Science, 1987, 235(4785): 177-182. DOI:10.1126/science.3798106 |
| [3] |
Cameron D, Piccart-Gebhart MJ, Gelber RD, et al. 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial[J]. Lancet, 2017, 389(10075): 1195-1205. DOI:10.1016/S0140-6736(16)32616-2 |
| [4] |
Hellman S, Weichselbaum RR. Oligometastases[J]. J Clin Oncol, 1995, 13(1): 8-10. DOI:10.1200/JCO.1995.13.1.8 |
| [5] |
Swain SM, Miles D, Kim SB, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study[J]. Lancet Oncol, 2020, 21(4): 519-530. DOI:10.1016/S1470-2045(19)30863-0 |
| [6] |
Miles D, Ciruelos E, Schneeweiss A, et al. Final results from the PERUSE study of first-line pertuzumab plus trastuzumab plus a taxane for HER2-positive locally recurrent or metastatic breast cancer, with a multivariable approach to guide prognostication[J]. Ann Oncol, 2021, 32(10): 1245-1255. DOI:10.1016/j.annonc.2021.06.024 |
| [7] |
Guarneri V, Dieci MV, Griguolo G, et al. Trastuzumab-lapatinib as neoadjuvant therapy for HER2-positive early breast cancer: Survival analyses of the CHER-Lob trial[J]. Eur J Cancer, 2021, 153: 133-141. DOI:10.1016/j.ejca.2021.05.018 |
| [8] |
Zhong X, He P, Chen J, et al. Neoadjuvant pyrotinib plus trastuzumab and nab-paclitaxel for HER2-positive early or locally advanced breast cancer: an exploratory phase Ⅱ trial[J]. Gland Surg, 2022, 11(1): 216-225. DOI:10.21037/gs-21-911 |
| [9] |
Murthy RK, Loi S, Okines A, et al. Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer[J]. N Engl J Med, 2020, 382(7): 597-609. DOI:10.1056/NEJMoa1914609 |
| [10] |
边莉, 徐兵河, 邸立军, 等. 重组抗HER2人源化单克隆抗体联合长春瑞滨治疗HER2阳性转移性乳腺癌随机对照Ⅲ期临床研究[J]. 中华医学杂志, 2020, 30: 2351-2357. [Bian L, Xu BH, Di LJ, et al. Phase Ⅲ randomized controlled, multicenter, prospective study of recombinant anti-HER2 humanized monoclonal antibody (Cipterbin) combined with vinorelbine in patients with HER2 positive metastatic breast cancer: the HOPES Study[J]. Zhonghua Yi Xue Za Zhi, 2020, 30: 2351-2357. DOI:10.3760/cma.j.cn112137-20200116-00105] |
| [11] |
Khodari W, Sedrati A, Naisse I, et al. Impact of loco-regional treatment on metastatic breast cancer outcome: a review[J]. Crit Rev Oncol Hematol, 2013, 87(1): 69-79. DOI:10.1016/j.critrevonc.2012.12.005 |
| [12] |
Clements ME, Johnson RW. PREX1 drives spontaneous bone dissemination of ER+ breast cancer cells[J]. Oncogene, 2020, 39(6): 1318-1334. DOI:10.1038/s41388-019-1064-3 |
| [13] |
Cristofanilli M, Hortobagyi GN. New horizons in treating metastatic disease[J]. Clin Breast Cancer, 2001, 1(4): 276-287. DOI:10.3816/CBC.2001.n.002 |
| [14] |
Ji L, Cheng L, Zhu X, et al. Risk and prognostic factors of breast cancer with liver metastases[J]. BMC Cancer, 2021, 21(1): 238. DOI:10.1186/s12885-021-07968-5 |
| [15] |
Cardoso F, Paluch-Shimon S, Senkus E, et al. 5th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 5)[J]. Ann Oncol, 2020, 31(12): 1623-1649. DOI:10.1016/j.annonc.2020.09.010 |
| [16] |
Bacalbasa N, Dima SO, Purtan-Purnichescu R, et al. Role of surgical treatment in breast cancer liver metastases: a single center experience[J]. Anticancer Res, 2014, 34(10): 5563-5568. |
| [17] |
Margonis GA, Buettner S, Sasaki K, et al. The role of liver-directed surgery in patients with hepatic metastasis from primary breast cancer: a multi-institutional analysis[J]. HPB(Oxford), 2016, 18(8): 700-705. |
| [18] |
Feng Y, He XG, Zhou CM, et al. Comparison of hepatic resection and systemic treatment of breast cancer liver metastases: A propensity score matching study[J]. Am J Surg, 2020, 220(4): 945-951. DOI:10.1016/j.amjsurg.2020.02.047 |
| [19] |
Ruiz A, van Hillegersberg R, Siesling S, et al. Surgical resection versus systemic therapy for breast cancer liver metastases: Results of a European case matched comparison[J]. Eur J Cancer, 2018, 95: 1-10. DOI:10.1016/j.ejca.2018.02.024 |
| [20] |
Adam R, Aloia T, Krissat J, et al. Is liver resection justified for patients with hepatic metastases from breast cancer?[J]. Ann Surg, 2006, 244(6): 897-907. DOI:10.1097/01.sla.0000246847.02058.1b |
| [21] |
Hua X, Bi XW, Zhao JL, et al. Trastuzumab Plus Endocrine Therapy or Chemotherapy as First-line Treatment for Patients with Hormone Receptor-Positive and HER2-Positive Metastatic Breast Cancer (SYSUCC-002)[J]. Clin Cancer Res, 2022, 28(4): 637-645. DOI:10.1158/1078-0432.CCR-21-3435 |
| [22] |
Tolaney SM, Wardley AM, Zambelli S, et al. Abemaciclib plus trastuzumab with or without fulvestrant versus trastuzumab plus standard-of-care chemotherapy in women with hormone receptor-positive, HER2-positive advanced breast cancer (monarcHER): a randomised, open-label, phase 2 trial[J]. Lancet Oncol, 2020, 21(6): 763-775. DOI:10.1016/S1470-2045(20)30112-1 |
 2023, Vol. 50
2023, Vol. 50


