文章信息
- 柠檬苦素通过调节JAK2/STAT3信号通路对非小细胞肺癌细胞恶性生物学行为的影响
- Influence of Limonin on Malignant Biological Behavior of Non-small Cell Lung Cancer Cells by Regulating JAK2/STAT3 Signaling Pathway
- 肿瘤防治研究, 2023, 50(12): 1191-1196
- Cancer Research on Prevention and Treatment, 2023, 50(12): 1191-1196
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0399
- 收稿日期: 2023-04-14
- 修回日期: 2023-06-27
肺癌是全球癌症相关死亡率较高的恶性肿瘤之一,5年生存率(诊断后)低于20%,其中非小细胞肺癌(NSCLC)占所有肺癌的85%[1-2]。尽管NSCLC的治疗取得了重大进展,但其复发率和死亡率仍然很高,仍需要更加全面地研究NSCLC的潜在机制[3]。越来越多的研究已证明JAK2/STAT3信号通路是促进各种恶性肿瘤细胞生长和进展的关键信号通路,通过靶向抑制JAK2/STAT3通路将是治疗NSCLC的好方法[4]。
目前,对NSCLC的治疗主要以靶向治疗、手术和化疗相结合的方法,但这些治疗方法的不良反应强,严重影响患者生活质量。天然化合物可辅助治疗肿瘤,并有不良反应少的优点[5]。柠檬苦素是柑橘类水果中的重要生物活性物质,具有抗癌、抗病毒、抗炎、抗动脉粥样硬和保护肝脏等作用[6]。研究发现,柠檬苦素通过在各种人类肿瘤细胞系中诱导细胞凋亡而表现出抗癌潜力,如结肠癌细胞、口腔癌细胞、黑色素瘤和骨肉瘤细胞等[7]。值得注意的是,已有研究发现柠檬苦素可抑制肺癌细胞A549的活力,诱导细胞凋亡,表现出抗肺癌的潜力[8]。然而,柠檬苦素对NSCLC的影响机制尚未完全阐明。因此本研究基于JAK2/STAT3信号通路探讨柠檬苦素对NSCLC细胞恶性生物学行为的影响和作用机制。
1 材料与方法 1.1 实验材料人NSCLC细胞系A549获自中国科学院上海细胞库。
1.2 实验试剂柠檬苦素(SC11812)购自北京凯诗源生物科技有限公司;JAK2激活剂Coumermycin A1(HY-N7452)和JAK2抑制剂AG490(HY-12000)购自美国MCE公司;Annexin V FITC Apoptosis Kit凋亡试剂盒(556547)购自美国BD公司;抗体白介素-6(IL-6,ab233706)、JAK2(ab108596)、STAT3(ab68153)、E-钙黏蛋白(E-Cadherin,ab1416)、N-钙黏蛋白(N-Cadherin,ab76011)、波形蛋白(Vimentin,ab92547)、GAPDH(ab8245)和辣根过氧化物酶(HRP)偶联的二抗(ab6721)购自英国Abcam公司;抗体p-JAK2(PA5-37618)和p-STAT3(MA5-11189)购自美国ThermoFisher公司。
1.3 细胞培养RPMI 1640培养基含有10%胎牛血清、100 U/ml青霉素和100 µg/ml链霉素,细胞培养于含5% CO2的37℃细胞培养箱中。2~3 d换液一次,待细胞生长至对数生长期进行实验。
1.4 CCK-8法检测细胞增殖情况将细胞以每孔1×104个的密度培养于96孔板,每孔加入100 µl细胞悬液。A549细胞分别用0、5、10、25、50、75、100 µmol/L柠檬苦素[8]干预24 h。之后每孔加入10 μl CCK-8试剂,置于37℃、5%CO2的培养箱中孵育2 h后使用酶标仪在450 nm波长处检测各孔吸光度值。
1.5 细胞分组将各组细胞分为NC组(正常培养A549细胞),柠檬苦素低剂量组(10 µmol/L柠檬苦素干预A549细胞24 h)、柠檬苦素中剂量组(25 µmol/L柠檬苦素干预A549细胞24 h)、柠檬苦素高剂量组(50 µmol/L柠檬苦素干预A549细胞24 h)、Coumermycin A1组[9](10 μmol/L JAK2激活剂Coumermycin A1+50 μmol/L柠檬苦素干预A549细胞24 h)、AG490组[10](10 μmol/L JAK2抑制剂AG490+50 μmol/L柠檬苦素干预A549细胞24 h)。
1.6 克隆形成实验检测各组细胞克隆情况将各组细胞以每孔1 000个的密度接种到六孔板中,并置于37℃、5%CO2培养箱中培养,10 d后取出六孔板,用4%多聚甲醛固定细胞30 min,0.1%结晶紫溶液染色,洗涤,光学显微镜下计数 > 50个细胞的克隆数。
1.7 Transwell小室检测各组细胞迁移和侵袭将100 μl基质胶稀释液预涂在上室中,使用无血清培养基悬浮各组细胞使其浓度为5×104个/毫升,200 µl细胞液接种到上室,下室加入600 µl含有10%FBS的培养基,然后将细胞在37℃、5%CO2培养箱中培养24 h。下室细胞使用4%多聚甲醛固定30 min后用0.5%结晶紫染色。拍照,并使用Image J软件计数侵袭细胞数。
细胞迁移实验无需基质胶稀释液孵育,直接向上室中加入细胞液,其余过程同侵袭实验。
1.8 流式细胞术检测细胞凋亡情况收集各组细胞,洗涤后使用100 μl缓冲液重悬细胞,再分别用5 μl Annexin V-FITC和PI染液,室温下避光染色15 min,使用流式细胞仪在染色1 h内检测细胞凋亡情况。
1.9 Western blot检测蛋白表达各组细胞用RIPA裂解液裂解提取总蛋白,并使用BCA法检测总蛋白浓度。使用10%SDS-PAGE分离20 µl总蛋白,然后转移至PVDF膜上。将膜用5%脱脂牛奶封闭,然后与一抗IL-6、JAK2、p-JAK2、STAT3、p-STAT3、E-Cadherin、N-Cadherin、Vimentin和GAPDH在4℃下孵育过夜。然后将膜与HRP偶联的二抗在室温下孵育2 h。TBST洗涤后,使用ECL显色观察蛋白质条带,并使用Image J软件量化蛋白的灰度值。
1.10 统计学方法统计分析使用SPSS 25.0软件,数据以平均值±标准差(x±s)表示。使用单因素方差分析不同组之间的差异,两组间差异使用SNK-q检验。P < 0.05为差异有统计学意义。
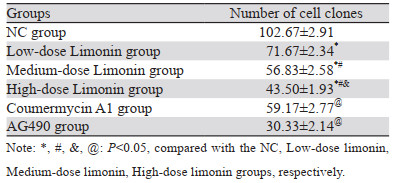
2 结果 2.1 不同浓度柠檬苦素对A549细胞增殖的影响与0 μmol/L柠檬苦素组相比,5、10、25、50、75、100 µmol/L柠檬苦素干预A549细胞,细胞存活率呈剂量依赖性降低(均P < 0.001),IC50为(45.16±1.66)μmol/L。综合考虑,后续选取10、25、50 μmol/L的柠檬苦素剂量组作为实验低、中、高剂量组,见表 1。
|
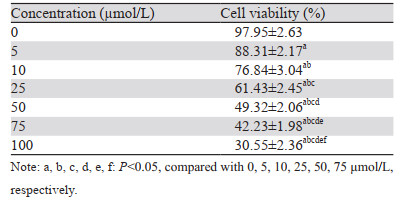
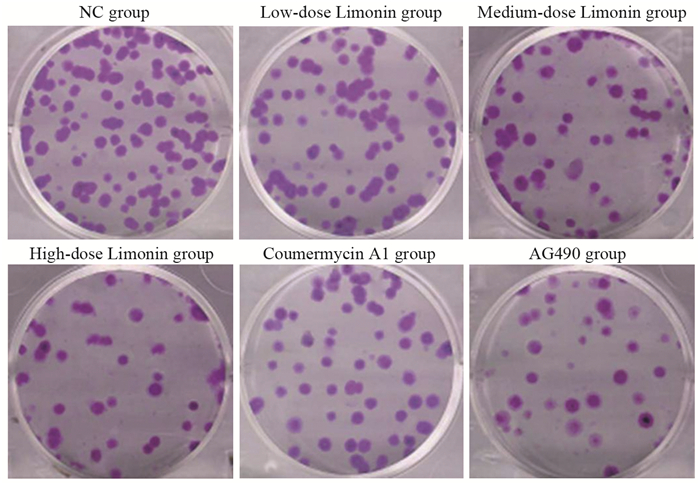
与NC组相比,不同柠檬苦素剂量组细胞克隆数呈剂量依赖性降低(均P < 0.001);与柠檬苦素高剂量组相比,Coumermycin A1组细胞克隆个数增加(P < 0.001),AG490组进一步降低了细胞克隆数(P < 0.001),见图 1、表 2。
|
| 图 1 柠檬苦素对A549细胞克隆形成的影响 Figure 1 Effect of limonin on clonogenic ability of A549 cells |
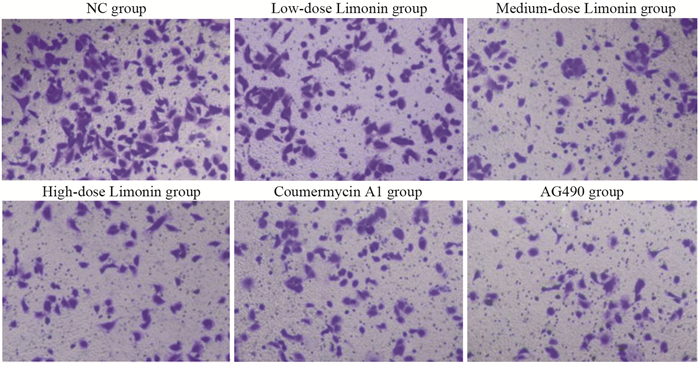
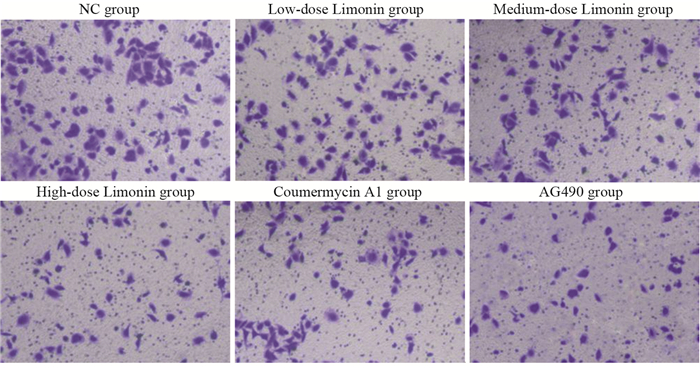
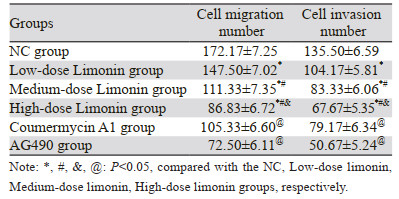
与NC组相比,不同柠檬苦素剂量组细胞迁移数和侵袭数呈剂量依赖性降低(均P < 0.001);与柠檬苦素高剂量组相比,Coumermycin A1组细胞迁移数和侵袭数增加(均P < 0.001),AG490组进一步降低了细胞迁移数和侵袭数(均P < 0.001),见图 2、3和表 3。
|
| 图 2 柠檬苦素对A549细胞迁移的影响 Figure 2 Effect of limonin on migration of A549 cells |
|
| 图 3 柠檬苦素对A549细胞侵袭的影响 Figure 3 Effect of limonin on invasion of A549 cells |
|
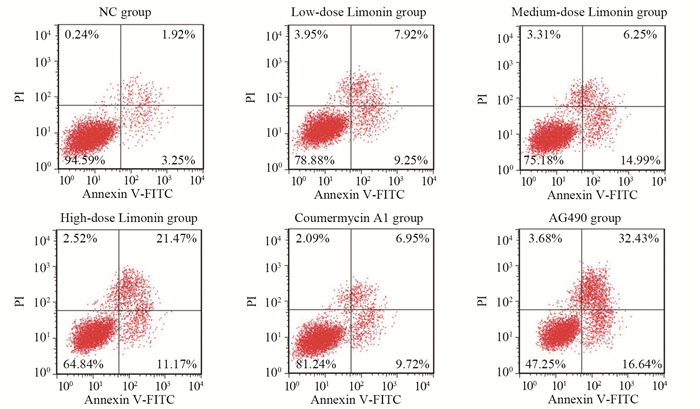
与NC组相比,柠檬苦素不同剂量组凋亡率呈剂量依赖性上升(均P < 0.001);与柠檬苦素高剂量组相比,Coumermycin A1组凋亡率下降(均P < 0.001),而AG490组凋亡率进一步升高(均P < 0.001),见图 4。
|
| 图 4 柠檬苦素对A549细胞凋亡的影响 Figure 4 Effect of limonin on apoptosis of A549 cells |
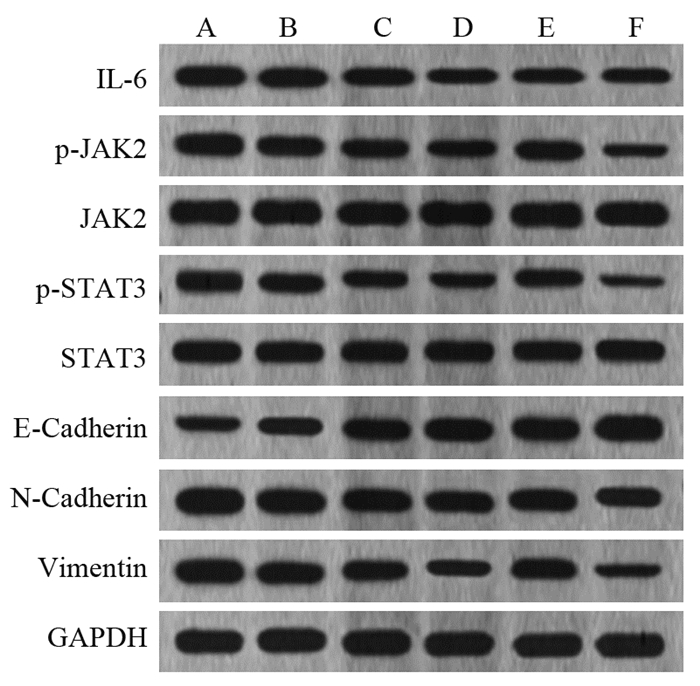
与NC组相比,不同柠檬苦素剂量组IL-6、p-JAK2、p-STAT3、N-Cadherin和Vimentin蛋白表达降低,E-Cadherin表达升高(均P < 0.01);与柠檬苦素高剂量组相比,Coumermycin A1组p-JAK2(P < 0.001)、p-STAT3(P < 0.001)、N-Cadherin(P=0.030)和Vimentin(P < 0.001)蛋白表达升高,E-Cadherin表达降低(P=0.011),IL-6表达差异无统计学意义(P=0.974),而AG490组p-JAK2(P < 0.001)、p-STAT3(P < 0.001)、N-Cadherin(P=0.030)和Vimentin(P < 0.001)蛋白表达进一步降低,E-Cadherin表达进一步升高(P=0.018),IL-6表达差异无统计学意义(P=0.867),见图 5(数据表请扫描本文OSID码)。
|
| A: NC group; B: Low-dose limonin group; C: Medium-dose limonin group; D: High-dose limonin group; E: Coumermycin A1 group; F: AG490 group. 图 5 柠檬苦素对A549细胞IL-6、JAK2、p-JAK2、STAT3、p-STAT3、E-cadherin、N-cadherin和Vimentin蛋白表达的影响 Figure 5 Effects of limonin on IL-6, JAK2, p-JAK2, STAT3, p-STAT3, E-cadherin, N-cadherin, and vimentin protein expression in A549 cells |
转移是肿瘤细胞的一个连续的、周期性的过程,包括生长、迁移和侵袭。其中,EMT被认为是肿瘤转移的初始过程,在此过程中上皮细胞转化为间充质表型,导致细胞间黏附减少并伴随更高的细胞迁移和侵袭现象[11]。EMT过程通常伴随着间充质细胞标志物如Vimentin和N-Cadherin的过度表达和上皮细胞标志物如E-Cadherin的下调[12]。柠檬苦素是一种存在于柑橘类水果中的四环三萜类化合物,具有广泛的药理活性[13]。多方面研究报道柠檬苦素能够抑制多种癌细胞生长,在癌症防治方面具有很大潜力[14]。本研究通过体外细胞实验探讨柠檬苦素对NSCLC细胞恶性生物学行为影响,结果发现柠檬苦素可抑制A549细胞增殖、侵袭和迁移以及EMT过程,并诱导细胞凋亡,这一结果与Fan等[15]结果基本一致,表示柠檬苦素可抑制NSCLC恶性生物学行为。值得注意的是,本研究前期预实验通过检测实验浓度的柠檬苦素对正常肺上皮细胞(Beas-2B)的作用,结果显示,实验浓度的柠檬苦素对正常肺上皮细胞(Beas-2B)的增殖几乎无影响,可说明柠檬苦素对细胞无毒。后续进一步探究柠檬苦素对NSCLC的作用机制。
研究发现柠檬苦素可通过多种方式抑制癌细胞增殖、侵袭和迁移。柠檬苦素可通过阻断VEGF与VEGFR2的结合抑制乳腺癌细胞的增殖并抑制肿瘤转移[16],也可通过激活p53信号通路诱导细胞凋亡,起到抗卵巢癌作用[17]。另外,柠檬苦素也可抑制STAT3转录活性抑制鼻咽癌细胞增殖迁移能力[18]。JAK2/STAT3信号通路主要参与细胞增殖、分化、凋亡和免疫调节。在正常组织中,JAK2/STAT3信号通路受到严格调控,STAT处于非活动状态[1]。当被激活时,JAK会诱导细胞质中单体STAT分子的磷酸化,形成STAT二聚体并将它们转移到细胞核以调节基因表达[19]。研究表明,JAK2/STAT3信号通路异常激活发生在肺癌等肿瘤组织和肿瘤细胞中,参与肿瘤的发生、发展、转移和侵袭,促进癌症浸润、转移和EMT[3]。因此认为抑制JAK2/STAT3通路持续性激活是癌症化疗过程中一个有希望的靶点[20]。研究显示IL-6的分泌和JAK2/STAT3通路的异常激活与多种癌症的发展和进展相关,IL-6能通过结合细胞表面上的IL-6受体(IL-6R)来导致JAK2激活,进而增加肿瘤细胞存活率,促进肿瘤细胞迁移和侵袭能力[21]。本研究进一步研究了柠檬苦素抑制A549细胞增殖可能的作用机制,结果发现柠檬苦素可抑制IL-6、p-JAK2和p-STAT3的蛋白水平,提示柠檬苦素可能是通过抑制JAK2/STAT3通路发挥抗肺癌作用,其可能通过抑制细胞因子IL-6的分泌进一步抑制JAK2/STAT3通路,最终抑制癌细胞恶性生物学行为。进一步通过功能回复实验进行验证,结果发现JAK2激活剂Coumermycin A1会逆转柠檬苦素对A549细胞增殖、迁移、侵袭和EMT过程抑制作用,然而使用JAK2抑制剂AG490与柠檬苦素共同作用时,增强了柠檬苦素对NSCLC细胞恶性生物学行为的抑制作用,增强了细胞凋亡水平,证明了JAK2/STAT3通路在柠檬苦素抑制NSCLC细胞恶性生物学行为发挥的作用。
综上所述,柠檬苦素可通过抑制JAK2/STAT3通路,抑制NSCLC细胞增殖、迁移、侵袭等恶性生物学行为,本研究进一步丰富了柠檬苦素抑制NSCLC细胞恶性生物学行为的潜在机制,并为以JAK2/STAT3通路为靶点研究新的治疗NSCLC的药物提供了实验依据。但本研究仍存在不足之处,柠檬苦素抑制JAK2/STAT3通路的具体作用机制还需进一步研究。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
胡会杰:课题设计、实验操作、文章撰写及修改
郑晓璐、雷立峰:数据及文献汇总分析
| [1] |
Hernandez D, Cheng CY, Hernandez-Villafuerte K, et al. Survival and comorbidities in lung cancer patients: Evidence from administrative claims data in Germany[J]. Oncol Res, 2023, 30(4): 173-185. |
| [2] |
Alduais Y, Zhang H, Fan F, et al. Non-small cell lung cancer (NSCLC): A review of risk factors, diagnosis, and treatment[J]. Medicine (Baltimore), 2023, 102(8): e32899. DOI:10.1097/MD.0000000000032899 |
| [3] |
Chen Q, Wu B, Ge P, et al. Ubenimex Combined with Pemetrexed Upregulates SOCS1 to Inhibit Lung Adenocarcinoma Progression via the JAK2-STAT3 Signaling Pathway[J]. Dis Markers, 2022, 2022: 5614939. |
| [4] |
Kang DY, Sp N, Lee JM, et al. Antitumor Effects of Ursolic Acid through Mediating the Inhibition of STAT3/PD-L1 Signaling in Non-Small Cell Lung Cancer Cells[J]. Biomedicines, 2021, 9(3): 297. DOI:10.3390/biomedicines9030297 |
| [5] |
Aung TN, Qu Z, Kortschak RD, et al. Understanding the Effectiveness of Natural Compound Mixtures in Cancer through Their Molecular Mode of Action[J]. Int J Mol Sci, 2017, 18(3): 656. DOI:10.3390/ijms18030656 |
| [6] |
Chen Y, Liang J, Liang X, et al. Limonin induces apoptosis of HL-60 cells by inhibiting NQO1 activity[J]. Food Sci Nutr, 2021, 9(4): 1860-1869. DOI:10.1002/fsn3.2109 |
| [7] |
Akihisa T, Yokokawa S, Ogihara E, et al. Melanogenesis-Inhibitory and Cytotoxic Activities of Limonoids, Alkaloids, and Phenolic Compounds from Phellodendron amurense Bark[J]. Chem Biodivers, 2017, 14(7): e1700105. DOI:10.1002/cbdv.201700105 |
| [8] |
Gong C, Qi L, Huo Y, et al. Anticancer effect of Limonin against benzo(a)pyrene-induced lung carcinogenesis in Swiss albino mice and the inhibition of A549 cell proliferation through apoptotic pathway[J]. J Biochem Mol Toxicol, 2019, 33(12): e22374. DOI:10.1002/jbt.22374 |
| [9] |
Zhang T, Chen Y, Cai J, et al. SOCS2 Inhibits Mitochondrial Fatty Acid Oxidation via Suppressing LepR/JAK2/AMPK Signaling Pathway in Mouse Adipocytes[J]. Oxid Med Cell Longev, 2020, 2020: 3742542. |
| [10] |
Wang Z, Wei Y, Lei L, et al. RANKL expression of primary osteoblasts is enhanced by an IL-17-mediated JAK2/STAT3 pathway through autophagy suppression[J]. Connect Tissue Res, 2021, 62(4): 411-426. DOI:10.1080/03008207.2020.1759562 |
| [11] |
Zhang Y, Ma P, Duan Z, et al. Ginsenoside Rh4 Suppressed Metastasis of Lung Adenocarcinoma via Inhibiting JAK2/STAT3 Signaling[J]. Int J Mol Sci, 2022, 23(4): 2018. DOI:10.3390/ijms23042018 |
| [12] |
Qiu Z, Zhong Z, Zhang Y, et al. Human umbilical cord mesenchymal stem cell-derived exosomal miR-335-5p attenuates the inflammation and tubular epithelial-myofibroblast transdifferentiation of renal tubular epithelial cells by reducing ADAM19 protein levels[J]. Stem Cell Res Ther, 2022, 13(1): 373. DOI:10.1186/s13287-022-03071-z |
| [13] |
Li Y, Yang M, Lin H, et al. Limonin Alleviates Non-alcoholic Fatty Liver Disease by Reducing Lipid Accumulation, Suppressing Inflammation and Oxidative Stress[J]. Front Pharmacol, 2022, 12: 801730. DOI:10.3389/fphar.2021.801730 |
| [14] |
Chidambara Murthy KN, Jayaprakasha GK, Safe S, et al. Citrus limonoids induce apoptosis and inhibit the proliferation of pancreatic cancer cells[J]. Food Funct, 2021, 12(3): 1111-1120. DOI:10.1039/D0FO02740E |
| [15] |
Fan CW, Tang J, Jiang JC, et al. Pentagalloylglucose suppresses the growth and migration of human nasopharyngeal cancer cells via the GSK3β/β-catenin pathway in vitro and in vivo[J]. Phytomedicine, 2022, 102: 154192. DOI:10.1016/j.phymed.2022.154192 |
| [16] |
Chen J, Liu BX, Shen Q, et al. Limonin inhibits angiogenesis and metastasis of human breast cancer cells by suppressing the VEGFR2/IGFR1-mediated STAT3 signaling pathway[J]. Transl Cancer Res, 2020, 9(11): 6820-6832. DOI:10.21037/tcr-20-1992 |
| [17] |
Bae JR, Park WH, Suh DH, et al. Role of limonin in anticancer effects of Evodia rutaecarpa on ovarian cancer cells[J]. BMC Complement Med Ther, 2020, 20(1): 94. DOI:10.1186/s12906-020-02890-y |
| [18] |
Gao L, Sang JZ, Cao H. Limonin enhances the radiosensitivity of nasopharyngeal carcinoma cells via attenuating Stat3-induced cell stemness[J]. Biomed Pharmacother, 2019, 118: 109366. DOI:10.1016/j.biopha.2019.109366 |
| [19] |
姜姗, 刘淼, 张黎, 等. 蟛蜞菊内酯通过抑制JAK2/STAT3信号通路诱导人肺腺癌A549细胞凋亡[J]. 华中科技大学学报(医学版), 2021, 50(4): 488-492. [Jiang S, Liu M, Zhang L, et al. Wedelolactone induces apoptosis of human lung adenocarcinoma a 549 cells via inhibiting JAK2/STAT3 pathway[J]. Hua Zhong Ke Ji Da Xue Xue Bao (Yi Xue Ban), 2021, 50(4): 488-492.] |
| [20] |
Hou J, Lv A, Deng Q, et al. TROP2 promotes the proliferation and metastasis of glioblastoma cells by activating the JAK2/STAT3 signaling pathway[J]. Oncol Rep, 2019, 41(2): 753-764. |
| [21] |
Huang B, Lang X, Li X. The role of IL-6/JAK2/STAT3 signaling pathway in cancers[J]. Front Oncol, 2022, 12: 1023177. |
 2023, Vol. 50
2023, Vol. 50