文章信息
- T细胞活化与肿瘤负荷比对肝细胞癌患者抗PD-1免疫治疗反应的预测
- Prediction of Responses of Patients with Hepatocellular Carcinoma to Anti-PD-1 Immunotherapy by T-cell Invigoration to Tumour Burden Ratio
- 肿瘤防治研究, 2023, 50(11): 1103-1108
- Cancer Research on Prevention and Treatment, 2023, 50(11): 1103-1108
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0375
- 收稿日期: 2023-04-10
- 修回日期: 2023-08-07
2. 350001 福州,福建省肿瘤转化医学重点实验室;
3. 350001 福州,福建医科大学附属协和医院肿瘤科
2. Fujian Key Laboratory of Translational Cancer Medicine, Fuzhou 350001, China;
3. Department of Oncology, Fujian Medical University Union Hospital, Fuzhou 350001, China
肝细胞肝癌是全世界常见的消化系统肿瘤之一,2020年全球有905 677人被诊断患有肝癌,有830 180人因罹患肝癌死亡,癌症死亡原因全球排名第三[1],2015年中国肝癌发病人数37万,死亡人数32.6万[2]。免疫疗法在肝细胞癌、晚期黑色素瘤、非小细胞肺癌(NSCLC)等肿瘤患者中有一定的治疗效果[3],其中以PD-1/PD-L1抑制剂为代表,使抗PD-1治疗成为最有前景的免疫疗法之一[4]。靶向PD-1/PD-L1的药物可以重新激活机体的抗肿瘤免疫,并实现对多种肿瘤的长期控制。然而,如何预测患者对免疫治疗的敏感度,提高肿瘤人群抗PD-1治疗的应答率仍不清楚,同时免疫疗法可能有严重的不良反应,生物标志物可以筛选出最有可能受益的人群。肿瘤浸润T细胞可作为各种癌症的较理想的预后指标[5],某些情况下,PD-L1在肿瘤中的表达也与T细胞反应相关[6];一些研究表明,肿瘤突变负荷(tumor mutation burden, TMB)高的NSCLC患者更有可能受益于抗PD-1单克隆抗体免疫治疗[7]。然而,这些生物标志物的分析依赖于肿瘤组织样本,肿瘤组织活检是有创检测,存在一定的肿瘤异质性,不能反映整体情况,且无法连续检测。其他免疫治疗标志物包括循环肿瘤DNA(ctDNA)[8]、循环肿瘤细胞(CTC)上的TMB检测和PD-L1[9]的表达,对免疫治疗反应的预测价值也在积极探索中。本研究中,我们检测记录了肝细胞癌(HCC)患者免疫治疗之前或期间的血液学指标,以反映患者的免疫状态,并进一步探讨了这些免疫参数对肝细胞癌患者抗PD-1免疫治疗效果的预测价值。
1 资料与方法 1.1 临床资料收集2019年10月—2020年10月福建医科大学附属协和医院经组织学、细胞学确诊为肝细胞癌并使用抗PD-1治疗的85例患者。入组人群中16例曾接受外科手术治疗,45例曾接受介入治疗,其中72例为接受规律抗病毒治疗的乙肝病毒感染患者。
签署患者知情同意书、充分告知后采集空腹外周血。使用人体组织样本的实验获得了福建医科大学附属协和医院临床研究伦理委员会的批准。
研究对象纳入标准:经病理、影像学等检查确诊为肝细胞癌,满足接受PD-1单抗治疗入组标准(甲状腺功能、皮质醇、心肌酶检测正常,无间质性肺病影像学表现,无感染,未正在接受抗感染治疗,无风湿免疫相关疾病,无1型糖尿病,无严重心血管疾病等),予抗PD-1免疫治疗3周期以上的患者;前期未接受过任何免疫治疗的患者;有影像学可观察的靶病灶,用于免疫治疗临床疗效的客观评价。排除标准:病理诊断不明确的患者;近期接受其他可能影响检测结果的免疫治疗;自身免疫性疾病患者;没有可测量的靶病灶。
1.2 治疗方法入组患者均接受抗PD-1免疫治疗,治疗前及用药3周期后予影像学检查评估疗效。具体用药方案如下:帕博利珠单抗200 mg,每3周一次。每3周期进行一次疗效评价。患者在接受免疫药物治疗的同时可联合或不联合其他靶向治疗方案,直至疾病进展或出现不可耐受的不良反应。
1.3 免疫治疗评价标准免疫相关反应标准(immune-related response criteria, irRC):(间隔至少4周的两次连续观察点)完全缓解(CR),所有靶病灶消失;部分缓解(PR),总肿瘤负荷较基线负荷下降50%及以上;病变进展(PD),总肿瘤负荷较基线至少增加25%;病变稳定(SD),总肿瘤负荷较基线下降不足50%,或增加不足25%。新发现可测量病灶需要纳入总肿瘤负荷评价是否进展,新发现不可测量病灶不定义是否进展。
入组肿瘤患者在接受抗PD-1免疫治疗前,均有基线检查结果,其中包括血常规、血生化、肿瘤标志物等结果,头颅、胸部、腹部、肝脏MR或CT及PET-CT等临床检查结果,用于全面综合评估肿瘤病情。用药每3周期再进行上述相关的临床检验和检查,用于评价免疫治疗临床疗效。根据实体瘤疗效评价标准,患者至少存在一个可测量靶病灶,通过上述影像学方法,测量并记录各靶病灶最大垂直径。85例肝细胞癌患者均经电话随访、微信随访、门诊复查、住院检查随访等,随访截至2022年6月。本研究采用美国癌症联合委员会(AJCC)和国际癌症控制联盟(UICC)开发的肝癌TNM分期系统(2017年AJCC第8版)。
目前影像学评估仍为接受免疫治疗患者疗效评估的最重要手段。肿瘤负荷(tumor burden, TB):可测量的总肿瘤负荷定义为治疗前影像学报告中所有可测量各靶病灶两最大垂直径乘积,病灶总数不超过5个(每个器官不超过2个)。
1.4 主要仪器流式抗体购自美国Biolegend公司,台式多功能高速冷冻离心机购自德国Eppendorf公司,BD FACSCanto Ⅱ流式细胞仪(美国BD公司)。
1.5 实验方法使用台式多功能高速冷冻离心机将外周血单个核细胞(PBMCs)进行分离,细胞表面及胞内抗体孵育及细胞染色,将细胞重新放置在鞘液中上流式细胞仪进行分析。
1.6 统计学方法应用SPSS24.0,GraphPad Prism 8.0和X-tile version 3.6.1软件统计分析。T细胞活化与肿瘤负荷比与临床病理的关系通过卡方检验计算。X-tile对生存分析相关外周血生物指标取截断值,Kaplan-Meier法进行生存分析,多因素Cox回归评估预后影响因素。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料本实验共纳入85例肝细胞癌患者,其中女37例、男48例。患者年龄最大95周岁,最小27周岁,平均年龄55岁。经过三周期免疫治疗,15例被评估为疾病进展(PD),为治疗无应答组;51例被评估为疾病稳定(SD),13例为疾病缓解(PR),6例为完全缓解(CR),这70例为应答组。85例HCC患者从免疫治疗开始计算生存时间,截至2022年6月,随访时间12~36个月,平均24个月。随访期内死亡21例(24.7%)。结果显示:患者生存时间与年龄、有无转移、ECOG(PS)评分有关,差异有统计学意义(P < 0.05),见表 1。
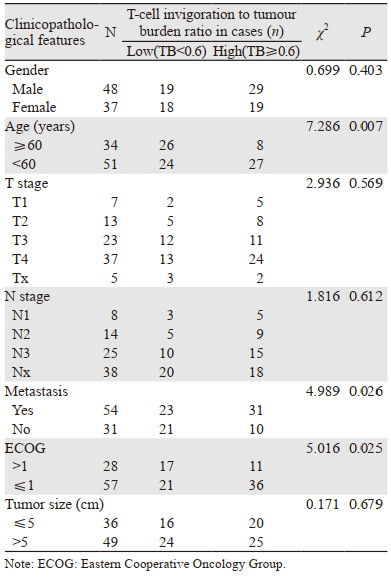
|
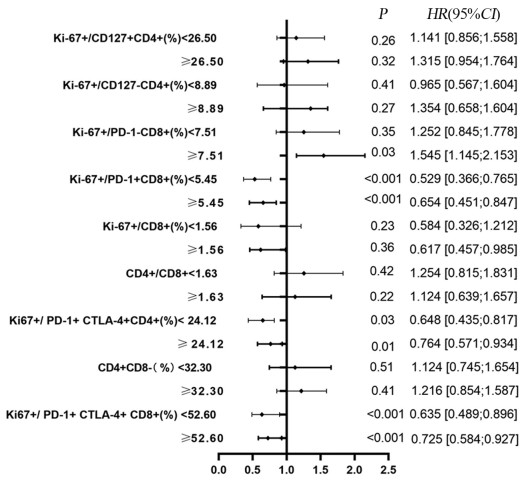
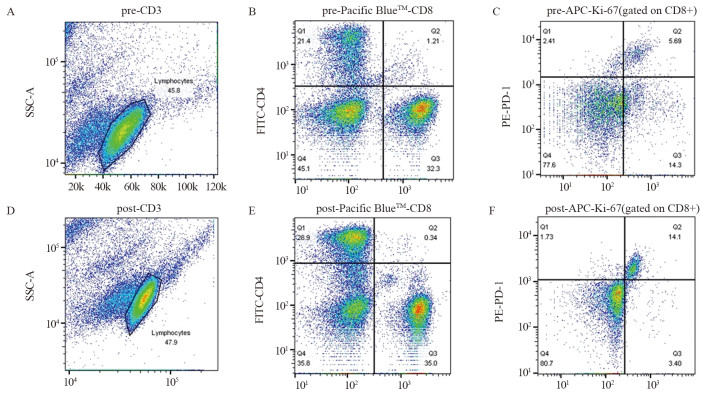
单因素及多因素分析提示Ki-67+/PD-1+CD8+(%)、Ki-67+/PD-1+CTLA-4+CD4+(%)、Ki-67+/PD-1+CTLA-4+CD8+(%)可能与无进展生存期(PFS)独立相关(P < 0.05),见图 1。治疗过程中(第1~3次抗PD-1免疫治疗前),Ki-67表达的增加在PD-1+CD8+ T细胞和PD-1-CD8+ T细胞中差异最显著(P < 0.0001),见图 2。与PD-1-亚群相比,PD-1+亚群的Ki-67应答在治疗1周期后达到高峰(P < 0.0001),大多数肿瘤患者(85例中的55例)在治疗后其PD-1+CD8+T细胞中Ki-67有生物学意义的增加。治疗周期中,免疫治疗应答组PD-1+/CD8+T细胞Ki-67表达率的最大倍数变化高于无应答组(P < 0.001)。
|
| 图 1 患者无进展生存时间与临床免疫参数特征的关系 Figure 1 Relationship between progression-free survival and clinicopathological features |
|
| A: the information was obtained from a HCC patient. CD3+ T cells before therapy were assessed in pre-CD3; B: CD4+ and CD8+ T cells were evaluated in regions Q1 and Q3; C: Ki-67+/PD-1+CD8+ T cells were detected in region Q2; D: CD3+ T cells after therapy were assessed in post-CD3; E: CD4+ and CD8+ T cells were evaluated in regions Q1 and Q3; F: Ki-67+/PD-1+CD8+ T cells were detected in region Q2. 图 2 治疗前与治疗1周期时PD-1+CD8+ T细胞中Ki-67的表达 Figure 2 Ki-67 expression in PD-1+CD8+ T cells before and at the first cycle of treatment |
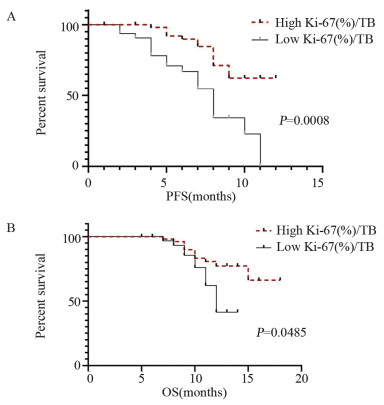
X-tile对生存分析相关外周血生物指标Ki-67(%)/TB取截断值为0.6,治疗3周后PD-1+CD8+T细胞Ki-67表达率与肿瘤负荷比的无进展生存期(PFS)、总生存期(OS),见图 3。免疫治疗三周后Ki-67(%)/TB≥0.6患者较Ki-67(%)/TB < 0.6的患者PFS延长(7.3月 vs. 5.9月,P=0.0008);免疫治疗三周后Ki-67(%)/TB≥0.6患者较Ki-67(%)/TB < 0.6的患者OS延长(11.4月 vs. 9.8月,P=0.0485)。
|
| 图 3 治疗后PD-1+CD8+ T细胞Ki-67表达率与肿瘤负荷比的无进展生存分析(A)和总体生存分析(B) Figure 3 Progress-free survival(A) and overall survival(B) for Ki-67 expression in PD-1+CD8+ T cells after treatment to tumor burden ratio |
针对程序性细胞死亡蛋白(PD)-1的免疫检查点阻滞剂(ICBs)已被用于肝癌的治疗[10],免疫治疗中的生物标志物不仅用于筛选免疫治疗潜在获益人群,而且有助于预测免疫疗效和制定后续治疗方案。生物指标如转移灶的解剖位置、PD-L1的表达、TMB、外周血循环肿瘤DNA(ctDNA)[11]、循环肿瘤细胞(CTC)上的PD-L1表达[12]等可能对免疫治疗预后有一定的预测作用。肿瘤组织的获取和检测分析仍有局限性,尤其是内脏肿瘤患者,考虑到肿瘤的异质性及组织标本采集的有创性,这些预测因子仍不十分理想。外周血的分析更容易重复进行,提供了一个完整系统的免疫治疗反应观察,识别相关的反应细胞类型,可能有助于初步了解持续临床反应的潜在免疫机制。
Ki-67是一种与核糖体RNA转录相关的核蛋白,由MKI67基因编码,是细胞增殖的标志物。它可以在细胞分裂周期的所有阶段被检测到,如果活跃的细胞周期中的Ki-67被去除会导致mRNA和蛋白表达的快速下调,可引起细胞暂时或永久地进入静止状态。这种细胞增殖和Ki-67蛋白表达的相关性表明Ki-67在细胞生长或分裂中发挥的作用,使该蛋白的表达成为检测某一细胞亚群生长情况的理想标志物。在分裂活跃的癌细胞中Ki-67呈强表达,Ki-67阳性表达的肿瘤细胞存在提示生存和预后不良[13]。本研究将Ki-67用于T细胞再生活化的标志物,对抗PD-1疗效进行预测研究。
在临床前模型中,肿瘤负荷是抗PD-1免疫治疗后T细胞衰竭和再生严重程度的关键决定因素,阻断PD-1通路可部分激活临床前模型中的Tex细胞[14-15],并在包括黑色素瘤在内的许多人类癌症中产生临床反应[16]。在进行免疫检查点阻断的小鼠模型中[14]以及在接受抗CTLA-4治疗联合放射治疗的患者中[15],Ki-67是一种细胞增殖和T细胞再生的标志物。有研究认为外周血PD-1+ CD8+ T细胞的第一周增殖反应(Ki-67 D7/D0)可以预测实体瘤抗PD-1治疗的反应[17]。基于肿瘤负荷的预后判断提示,肿瘤负荷高的患者接受PD-1治疗的预后相对较差,可能是由PD-1抑制剂诱导的恢复活力的CD8+T细胞数量不足,无法启动足够的细胞杀伤反应。使用特定靶点的免疫抑制剂可释放T细胞对抗肿瘤,这些细胞的活性呈现出比其他癌症疗法更有利的重要特征,包括特异性、适应性和记忆性等[18-19]。
对抗PD-1治疗产生应答的CD8+ T细胞与疫苗接种致急性感染的减毒活病毒诱导的效应细胞具有许多共同特征,如Bcl-2、CCR7和CD45RA的低表达,以及抗原特异性CD8+ T细胞,且对抗PD-1治疗有特殊反应。衰竭型CD8+ T细胞表达包括PD-1在内的多个抑制性受体,阻断PD-1受体可改善此类T细胞的反应[14]。CD8+ T细胞可以对许多人类癌症类型,特别是那些具有更高突变负荷的癌症类型产生反应[20]。不同研究中,肿瘤细胞或肿瘤浸润的外周血细胞上PD-L1表达与临床对PD-1免疫治疗的反应有关,预先存在的肿瘤T细胞浸润可能是多种肿瘤的一个预后良好的指标[21]。此外,PD-L1在肿瘤中的表达在某些情况下与T细胞反应有关[22]。这些衰竭型CD8+ T细胞反应常常不能根除肿瘤,细胞会变得功能失调或衰竭,与效应T细胞和记忆CD8+ T细胞相比,外周血衰竭型T细胞的效应功能较弱,并且分化模式发生了改变,这类衰竭型细胞也受到包括PD-1在内的抑制性受体的调控抑制[23]。
临床中部分肿瘤患者,接受抗PD-1治疗不能获得较好的临床治疗效果,可能是由于不能诱导免疫恢复,也可能由于T细胞活力恢复和肿瘤负荷之间的不平衡,与治疗前肿瘤负荷相关的循环衰竭型T细胞恢复活力的大小与临床疗效相关[24]。本研究结果提示预先存在的与肿瘤负荷相关的CD8+ T细胞应答反应,通过抗PD-1治疗增强。这说明肿瘤负荷是抗PD-1免疫治疗后T细胞衰竭和再生程度的关键决定因素。同时,对抗PD-1免疫治疗不同反应的患者,PD-1+CD8+ T细胞Ki-67在治疗周期中表达率的最大倍数变化比较,应答组更高。外周血中CD8+ T细胞反应一般不持续,仅在一两个时间点能被检测到。这些发现可能表明,被抑制信号阻断激活的PD-1+ CD8+ T细胞会扩张,在治疗后的几周内可以在外周血中检测到循环,但随后会迁移到肿瘤或炎性反应部位。
本研究中Ki-67+ CD8+ T细胞在抗PD-1治疗1周期后明显增加,与PD-1-亚群相比,PD-1+亚群的Ki-67应答在治疗1周期后达到高峰,大多数肿瘤患者在治疗后其PD-1+ CD8+ T细胞中Ki-67有生物学意义的增加。已知PD-1不仅由衰竭型T细胞表达,而且由效应细胞、效应记忆和中央记忆CD8+ T细胞[25]表达,比较该类细胞与上述T细胞亚群的Ki-67的表达差异,衰竭型T细胞有更高的增殖及Ki-67、PD-1+ CD8+ T细胞的表达率。细胞再生和肿瘤负荷之间的关系表明,免疫系统对抗原负荷的反应是经机体“校准”的,如果肿瘤负荷高,即使是强有力的抗PD-1治疗也可能在临床上无效。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
吴慧:实验设计与实施、数据分析、论文撰写及修改
孙丽娜:数据收集、统计学分析及流式细胞检测
潘璋驰:实验设计、临床数据筛选
施纯玫:课题设计、数据审核及指导论文撰写
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Ma W, Gilligan BM, Yuan J, et al. Current status and perspectives in translational biomarker research for PD-1/PD-L1 immune checkpoint blockade therapy[J]. J Hematol Oncol, 2016, 9(1): 47. DOI:10.1186/s13045-016-0277-y |
| [4] |
Sharma P, Allison JP. The future of immune checkpoint therapy[J]. Science, 2015, 348(6230): 56-61. DOI:10.1126/science.aaa8172 |
| [5] |
Liu Z, Meng X, Tang X, et al. Intratumoral tertiary lymphoid structures promote patient survival and immunotherapy response in head neck squamous cell carcinoma[J]. Cancer Immunol Immunother, 2023, 72(6): 1505-1521. DOI:10.1007/s00262-022-03310-5 |
| [6] |
Dolina JS, Van Braeckel-Budimir N, Thomas GD, et al. CD8(+) T Cell Exhaustion in Cancer[J]. Front Immunol, 2021, 12: 715234. DOI:10.3389/fimmu.2021.715234 |
| [7] |
沈仕俊, 王巧丽, 杨金江, 等. 肿瘤突变负荷对PD-1/PD-L1抑制剂治疗非小细胞肺癌临床疗效预测的Meta分析[J]. 肿瘤防治研究, 2021, 48(3): 281-287. [Shen SJ, Wang QL, Yang JJ, et al. Predictive Value of Tumor Mutation Burden for PD-1/PD-L1 Inhibitors Treatment on Non-small Cell Lung Cancer: A Meta-analysis[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(3): 281-287. DOI:10.3971/j.issn.1000-8578.2021.20.0765] |
| [8] |
许晶, 金顺花. 循环肿瘤DNA在消化系统肿瘤中的应用进展[J]. 医学研究生学报, 2022, 35(8): 883-888. [Xu J, Jin SH. Advances in the application of circulating tumor DNA in digestive system tumors[J]. Yi Xue Yan Jiu Sheng Xue Bao, 2022, 35(8): 883-888.] |
| [9] |
王亚东, 杨笑盈, 贾梓淇, 等. 循环肿瘤细胞PD-L1表达在非小细胞肺癌免疫治疗中的应用[J]. 中国胸心血管外科临床杂志, 2021, 28(1): 110-115. [Wang YD, Yang XY, Jia ZQ, et al. Clinical utility of PD-L1 expression in circulating tumor cells in non-small cell lung cancer patients treated with immunotherapy[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2021, 28(1): 110-115.] |
| [10] |
Pinter M, Jain RK, Duda DG. The Current Landscape of Immune Checkpoint Blockade in Hepatocellular Carcinoma: A Review[J]. JAMA Oncol, 2021, 7(1): 113-123. DOI:10.1001/jamaoncol.2020.3381 |
| [11] |
Khagi Y, Goodman AM, Daniels GA, et al. Hypermutated Circulating Tumor DNA: Correlation with Response to Checkpoint Inhibitor-Based Immunotherapy[J]. Clin Cancer Res, 2017, 23(19): 5729-5736. DOI:10.1158/1078-0432.CCR-17-1439 |
| [12] |
Yue C, Jiang Y, Li P, et al. Dynamic change of PD-L1 expression on circulating tumor cells in advanced solid tumor patients undergoing PD-1 blockade therapy[J]. Oncoimmunology, 2018, 7(7): e1438111. DOI:10.1080/2162402X.2018.1438111 |
| [13] |
Bullwinkel J, Baron-Lühr B, Lüdemann A, et al. Ki-67 protein is associated with ribosomal RNA transcription in quiescent and proliferating cells[J]. J Cell Physiol, 2006, 206(3): 624-635. DOI:10.1002/jcp.20494 |
| [14] |
Blackburn SD, Shin H, Haining WN, et al. Coregulation of CD8+ T cell exhaustion by multiple inhibitory receptors during chronic viral infection[J]. Nat Immunol, 2009, 10(1): 29-37. DOI:10.1038/ni.1679 |
| [15] |
Twyman-Saint Victor C, Rech AJ, Maity A, et al. Radiation and dual checkpoint blockade activate non-redundant immune mechanisms in cancer[J]. Nature, 2015, 520(7547): 373-377. DOI:10.1038/nature14292 |
| [16] |
Marei HE, Hasan A, Pozzoli G, et al. Cancer immunotherapy with immune checkpoint inhibitors (ICIs): potential, mechanisms of resistance, and strategies for reinvigorating T cell responsiveness when resistance is acquired[J]. Cancer Cell Int, 2023, 23(1): 64. DOI:10.1186/s12935-023-02902-0 |
| [17] |
Kim KH, Cho J, Ku BM, et al. The First-week Proliferative Response of Peripheral Blood PD-1+CD8+ T Cells Predicts the Response to Anti-PD-1 Therapy in Solid Tumors[J]. Clin Cancer Res, 2019, 25(7): 2144-2154. DOI:10.1158/1078-0432.CCR-18-1449 |
| [18] |
Sharma P, Allison JP. Immune checkpoint targeting in cancer therapy: toward combination strategies with curative potential[J]. Cell, 2015, 161(2): 205-214. DOI:10.1016/j.cell.2015.03.030 |
| [19] |
Hack SP, Zhu AX, Wang Y. Augmenting Anticancer Immunity Through Combined Targeting of Angiogenic and PD-1/PD-L1 Pathways: Challenges and Opportunities[J]. Front Immunol, 2020, 11: 598877. DOI:10.3389/fimmu.2020.598877 |
| [20] |
Wang W, Green M, Choi JE, et al. CD8(+) T cells regulate tumour ferroptosis during cancer immunotherapy[J]. Nature, 2019, 569(7755): 270-274. DOI:10.1038/s41586-019-1170-y |
| [21] |
Yi L, Huang P, Zou X, et al. Integrative stemness characteristics associated with prognosis and the immune microenvironment in esophageal cancer[J]. Pharmacol Res, 2020, 161: 105144. DOI:10.1016/j.phrs.2020.105144 |
| [22] |
Guo W, Tan F, Huai Q, et al. Comprehensive Analysis of PD-L1 Expression, Immune Infiltrates, and m6A RNA Methylation Regulators in Esophageal Squamous Cell Carcinoma[J]. Front Immunol, 2021, 12: 669750. DOI:10.3389/fimmu.2021.669750 |
| [23] |
Chi H, Zhao S, Yang J, et al. T-cell exhaustion signatures characterize the immune landscape and predict HCC prognosis via integrating single-cell RNA-seq and bulk RNA-sequencing[J]. Front Immunol, 2023, 14: 1137025. DOI:10.3389/fimmu.2023.1137025 |
| [24] |
Huang AC, Postow MA, Orlowski RJ, et al. T-cell invigoration to tumour burden ratio associated with anti-PD-1 response[J]. Nature, 2017, 545(7652): 60-65. DOI:10.1038/nature22079 |
| [25] |
Bengsch B, Seigel B, Ruhl M, et al. Coexpression of PD-1, 2B4, CD160 and KLRG1 on exhausted HCV-specific CD8+ T cells is linked to antigen recognition and T cell differentiation[J]. PLoS Pathog, 2010, 6(6): e1000947. DOI:10.1371/journal.ppat.1000947 |
 2023, Vol. 50
2023, Vol. 50


