文章信息
- 薯蓣皂苷靶向泛素-蛋白酶体的抗肿瘤活性研究
- Dioscin Inhibits Ubiquitin-Proteasome System in Cancer Cells
- 肿瘤防治研究, 2023, 50(6): 567-572
- Cancer Research on Prevention and Treatment, 2023, 50(6): 567-572
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0326
- 收稿日期: 2023-03-28
- 修回日期: 2023-05-15
泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是一种高效的蛋白质降解途径,该途径能够选择性地降解蛋白质,精确地调控细胞内各种蛋白质的降解,对于维持细胞的生物学功能有着极其重要的作用[1]。UPS作用机制由底物蛋白质的泛素化和蛋白酶体降解两个过程构成。泛素(ubiquitin, Ub)蛋白是由76个氨基酸残基组成的高度保守的多肽链,通过一系列酶级联反应以异肽键的形式与底物蛋白的赖氨酸残基连接,这一过程称为泛素化[2]。当底物蛋白被特定长度的多聚泛素链标记后,将会被26S蛋白酶体特异性识别并降解[3]。
相较于正常细胞,肿瘤细胞生长速度快、同时细胞周期调控存在缺陷,这些特性导致肿瘤细胞更加依赖UPS的调控。近年来,泛素-蛋白酶体途径失调与恶性肿瘤的相关研究表明,靶向干预该途径有望成为理想的抗肿瘤治疗策略[4]。目前已有蛋白酶体抑制剂硼替佐米在临床上用于多发性骨髓瘤的治疗[5]。但是临床上蛋白酶体抑制剂种类和适应证均非常有限,亟需开发新型UPS靶向小分子抑制剂[6]。
薯蓣皂苷(dioscin, Dio)是一种有生物活性的天然皂苷,可从薯蓣科植物中提取,研究表明薯蓣皂苷具有强效的抗肿瘤作用,但是作用机制尚不明确[7-9]。本研究基于UbG76V-GFP报告系统筛选发现薯蓣皂苷是新型的UPS抑制剂,能够显著抑制细胞内去泛素化酶活性,增强蛋白泛素化水平,进而抑制肿瘤细胞增殖。本研究为靶向UPS开发新型抗肿瘤药物提供基础和指导,为薯蓣皂苷抗肿瘤研究提供数据支持。
1 材料与方法 1.1 实验材料 1.1.1 细胞株人胚肾细胞HEK 293T(货号:GNHu17)、人结肠癌细胞HCT116(货号:TCHu99)、人结肠腺癌细胞RKO(货号:TCHu116)均购自中国科学院细胞库。
1.1.2 化学小分子中药小分子库(货号:HY-L02)、薯蓣皂苷(货号:HY-N0124)和蛋白酶体异肽酶Rpn11抑制剂(Capzimin)(货号:HY-110404)购自美国MCE公司;MG132(货号:S2619)和蛋白酶体去泛素化酶Usp14抑制剂(IU1)(货号:S7134)均购自美国Selleck公司;二甲基亚砜DMSO(货号:D1435)购自德国Sigma公司;PMSF蛋白酶抑制剂(货号:36978)、半胱氨酸蛋白酶抑制剂N-乙基马来酰亚胺(NEM)(可有效抑制细胞内去泛素化酶活性,货号:23030)及嘌呤霉素(货号:A1113803)均购自美国Thermo Fisher公司。
1.1.3 试剂RPMI 1640培养液、DMEM培养液及胎牛血清购自美国Gibco公司;双抗Penicilin-Streptomycin(货号:15070063)、M-PER蛋白抽提试剂(货号:78501)及Lipofectamine 3000转染试剂(货号:L3000075)均购自美国Thermo Fisher公司;CCK-8细胞增殖-毒性检测试剂盒(货号:K1018)购自美国APExBIO公司;RIPA裂解液(货号:P0013B)、PVDF膜(货号:FFP28)和结晶紫染色液(货号:C0121)均购自上海碧云天生物科技公司;Recombinant Human Ubiquitin AMC Protein(Ub-AMC,货号:U550)、Suc-Leu-Leu-Val-Tyr-AMC(Suc-LLVY-AMC,货号:S280)、Boc-Leu-Arg-Arg-AMC(Boc-LRR-AMC,货号:S300)和Z-Leu-Leu-Glu-AMC(Z-LLE-AMC,货号:S230)均购自美国R&D Systems公司。
1.1.4 基因与质粒本课题设计的UbG76V-GFP编码DNA由南京金斯瑞生物科技有限公司合成,表达UbG76V-GFP的载体质粒(编号#73320)购自美国Addgene公司。
1.1.5 抗体GFP抗体(货号:11814460001)购自德国默克公司;Ubiquitin抗体(货号:sc-8017)购自美国圣克鲁斯生物技术公司;α-tubulin(货号:11224-1-AP)及GAPDH(货号:60004-1-Ig)抗体购自武汉三鹰生物技术公司;Rabbit IgG抗体(货号:111035003)及Mouse IgG抗体(货号:115035206)购自美国Jackson Immuno Research公司。
1.2 实验方法 1.2.1 细胞培养HCT116细胞用含10%胎牛血清和1%双抗的RPMI 1640培养液培养,HEK293T和RKO细胞用含10%胎牛血清和1%双抗的MEM培养液培养,细胞均在37℃、5%CO2条件下的培养箱中进行培养。
1.2.2 Western blot实验用含有PMSF蛋白酶抑制剂的RIPA裂解液裂解细胞,冰上裂解30 min后,离心,定量,变性,制备样品。每个样品以20 μg蛋白量进行电泳,并转移到PVDF膜上,用5%脱脂奶粉进行封闭,再用一抗和二抗依次孵育,化学发光法检测条带。
1.2.3 建立UbG76V-GFP稳转细胞系HEK293T细胞转染UbG76V-GFP表达质粒,约24 h后加入3 μg/ml的嘌呤霉素进行首次筛选,及时调整嘌呤霉素用量(1~3 μg/ml)确保转染后14~16天有(10±5)个细胞克隆存活并长至肉眼可见。此时将所有细胞克隆一起消化后制成细胞悬液,接种于96孔板中(密度为1个细胞/孔),并用2 μg/ml嘌呤霉素维持培养,一周后收取细胞克隆检测目的基因的表达。
1.2.4 蛋白酶体酶活实验使用黑色透明底96孔细胞培养板(Corning, 3904),每孔接种约10 000个细胞,待细胞贴壁后加入待测药物培养6 h后弃去培养液,PBS清洗两遍,每孔加入100 μl M-PER细胞裂解液,随后加入25 μmol/L荧光底物(Suc-LLVY-AMC、Z-LLE-AMC、Boc-LRR-AMC和Ub-AMC),于37℃避光孵育1 h,荧光酶标仪读取荧光值(Ex: 345, Em: 445)。
1.2.5 CCK-8实验将HCT116、RKO细胞以5 000个/孔的密度接种于96孔板中,待细胞贴壁后进行给药处理。给药72 h后,每孔按培养液:CCK-8为10:1的比例加入CCK-8溶液,37℃孵育约1 h,用酶标仪在波长450 nm参数下测定OD值,抑制率=OD小分子/ODDMSO。
1.2.6 克隆形成实验取对数生长期的HCT116、RKO细胞,按每毫升培养液中约1 000个细胞的密度接种至12孔板中,培养细胞过夜至细胞完全贴壁。次日更换新鲜培养液并加薯蓣皂苷处理,每隔3天更换培养液并给药。药物处理2周,待细胞克隆长至合适大小(肉眼可见大小,至少每个克隆100个细胞)终止培养。弃去培养液,用PBS润洗细胞,加入4%多聚甲醛固定15 min。随后加入结晶紫溶液室温孵育10 min,弃去结晶紫溶液,在流水下轻柔冲洗结晶紫,室温干燥后,拍照记录。
1.3 统计学方法应用GraphPad Prism 8软件对数据进行统计分析,所有实验均重复3次。P < 0.05为差异有统计学意义。
2 结果 2.1 蛋白酶体抑制剂显著增强UbG76V-GFP稳转细胞的绿色荧光为发现抑制泛素-蛋白酶体系统的潜在药物,根据蛋白质降解的N端法则[10],将泛素的第76位甘氨酸突变为缬氨酸与GFP融合表达序列构建到带有嘌呤霉素选择抗性的真核慢病毒表达载体Artichoke(Addgene, 73320)上。突变后的泛素不会被细胞内游离的去泛素化酶识别、去除,UbG76V-GFP底物就会产生多聚泛素化,进入蛋白酶体降解[11], 见图 1A。在HEK293T细胞中转染UbG76V-GFP表达质粒,经两轮嘌呤霉素筛选后得到稳定表达UbG76V-GFP融合蛋白的细胞系。为验证UbG76V-GFP稳转细胞系是否成功建立,我们加入不同蛋白酶体抑制剂观察绿色荧光积累情况。结果表明与DMSO对照组相比,20S蛋白酶体抑制剂MG132显著增强稳转细胞的绿色荧光,19S蛋白酶体抑制剂Capzimin和IU1同样增强绿色荧光,见图 1B。同时,通过Western blot检测发现MG132处理后出现UbG76V-GFP和GFP两个条带,见图 1C,表明MG132能够显著稳定UbG76V-GFP蛋白。以上结果表明靶向UPS报告系统UbG76V-GFP稳转细胞系成功建立,并且蛋白酶体抑制剂能够显著增强UbG76V-GFP稳转细胞的绿色荧光。
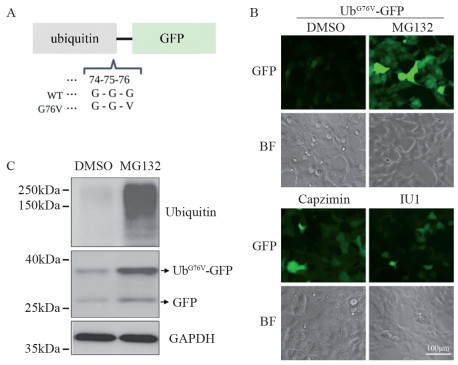
|
| A: Schematic of UbG76V-GFP reporter; B: fluorescence expression of UbG76V-GFP stably transfected cell lines treated with MG132 (5 μmol/L), capzimin (10 μmol/L) and IU1 (5 μmol/L) for 12 h; BF is bright field; C: Western blot result of the levels of total ubiquitination proteins, UbG76V-GFP, and GFP in stably transfected cells lines treated with MG132 (5 μmol/L) for 12 h. 图 1 蛋白酶体抑制剂对UbG76V-GFP稳转细胞绿色荧光的影响 Figure 1 Effect of proteasome inhibitors on fluorescence intensity of UbG76V-GFP stably transfected cells |
基于表达UbG76V-GFP稳转细胞系,以MG132作为阳性对照,利用高内涵成像系统对中药活性小分子库(共603个)进行高通量筛选。用5 μmol/L中药小分子处理稳转细胞系12 h,筛选得到6个候选小分子能够使细胞绿色荧光增强(图请扫描本文OSID码),其中薯蓣皂苷对UbG76V-GFP稳转细胞系的荧光累积作用最显著,见图 2A,薯蓣皂苷的化学结构式见图 2B。Western blot检测表明5.0 μmol/L的薯蓣皂苷与MG132作用相近,能够显著增加UbG76V-GFP和细胞内总泛素化蛋白表达,见图 2C。
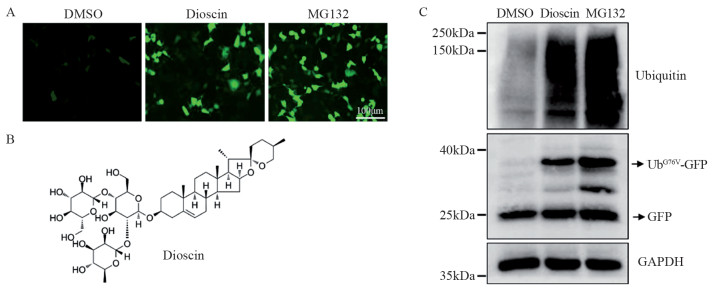
|
| A: fluorescence expression of UbG76V-GFP stably transfected cell lines treated with DMSO, dioscin (5 μmol/L), and MG132 (5 μmol/L) for 12 h; B: chemical structure of dioscin; C: Western blot result of the levels of total ubiquitination proteins, UbG76V-GFP and GFP in stably transfected cell lines treated with dioscin (5 μmol/L) and MG132 (5 μmol/L), respectively for 12 h, with DMSO as negative control. 图 2 薯蓣皂苷对UbG76V-GFP和细胞内总泛素化蛋白的影响 Figure 2 Effect of dioscin on levels of UbG76V-GFP and total ubiquitination proteins |
26S蛋白酶体是泛素-蛋白酶体系统中执行蛋白质降解的分子机器。26S蛋白酶体的20S亚基主要包含三种蛋白水解酶活性,包括糜蛋白酶样(chymotrypsin-like, CT-L)、肽基谷氨酰肽样(peptidyl-glutamyl peptide-hydrolyzing-like, PGPH-L)和胰蛋白酶样(trypsin-like, T-L)水解酶活性[12]。荧光底物水解酶活性实验表明,相较于MG132,薯蓣皂苷不能抑制20S蛋白酶体水解酶活性,见图 3A。接着利用Ub-AMC底物,NEM作为阳性对照小分子,检测薯蓣皂苷对细胞内去泛素化酶的影响。结果表明薯蓣皂苷可以显著降低Ub-AMC底物荧光强度,表明其能够抑制细胞内去泛素化酶活性,见图 3B。随后Western Blot方法检测结果表明薯蓣皂苷浓度依赖性增多HCT116细胞内多聚泛素化水平,见图 3C。
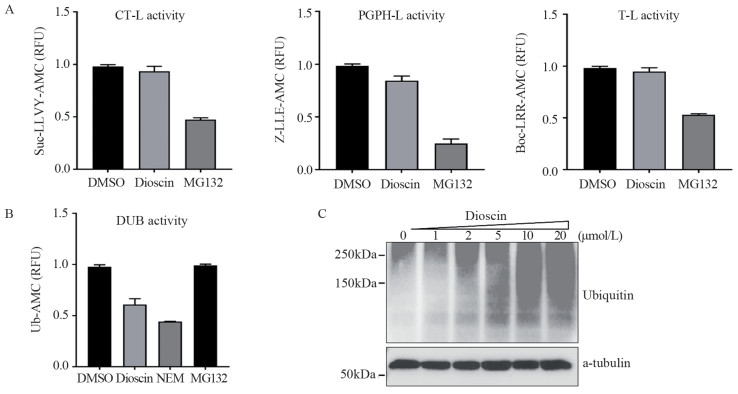
|
| A: effect of dioscin (5 μmol/L) and MG132 (5 μmol/L) on fluorescent substrates of Suc-LLVY-AMC, Z-LLE-AMC, and Boc-LRR-AMC in cells; B: effect of dioscin (5 μmol/L), NEM (5 μmol/L), and MG132 (5 μmol/L) on fluorescent substrates of Ub-AMC in cells; C: Western blot result of the effect of dioscin (0, 1, 2, 5, 10, and 20 μmol/L) on the protein expression levels of ubiquitin in HCT116 cells for 12 h. CT-L: chymotrypsin-like; PGPH-L: peptidyl-glutamyl peptide-hydrolyzing-like; T-L: trypsin-like; RFU: relative fluorescence unit; DUB: deubiquitinase; NEM: N-ethylmaleimide. 图 3 薯蓣皂苷对细胞内蛋白酶体水解酶活性和去泛素化酶活性的影响 Figure 3 Effect of dioscin on proteasome hydrolase activity and de-ubiquitin enzyme activity in cells |
为了进一步评估本研究中薯蓣皂苷的抗肿瘤活性,我们利用CCK-8实验进行验证。结果表明薯蓣皂苷显著抑制结直肠癌细胞HCT116和RKO细胞的增殖,IC50值分别为5.8 μmol/L和15.8 μmol/L,见图 4A。克隆形成实验同样表明5 μmol/L薯蓣皂苷可显著减少HCT116和RKO细胞克隆形成,见图 4B。以上结果表明薯蓣皂苷显著抑制肿瘤细胞增殖,是潜在的抗肿瘤中药小分子。

|
| A: in-vitro cell viability of HCT116 and RKO cells treated with dioscin at various concentrations for 48 h (n=3); B: colony formation of HCT116 and RKO cells treated with various concentrations of dioscin for 14 days. 图 4 薯蓣皂苷对HCT116和RKO细胞增殖的影响 Figure 4 Effect of dioscin on proliferation of HCT116 and RKO cells |
泛素-蛋白酶体系统是真核细胞主要的蛋白质降解途径。该系统作用底物繁多,包含肿瘤抑制因子、细胞周期调节因子等,当泛素-蛋白酶体系统的酶或识别特异性底物的基序发生功能性突变时,其对靶蛋白的调控能力丧失,引起肿瘤生长关键蛋白异常聚集、抑癌蛋白异常降解、突变细胞凋亡受阻和增殖加速,从而导致肿瘤的发生、发展[13]。因此,靶向UPS开发抗肿瘤药物是肿瘤治疗的新方向。其中,针对20S蛋白酶体核心亚基的抑制剂硼替佐米[14]、卡非佐米[15]和艾沙佐米[16]目前已被FDA批准用于多发性骨髓瘤和套细胞淋巴瘤的治疗。但泛素-蛋白酶体系统参与生命活动的调控机制复杂且涉及多个层次,而20S抑制剂针对泛素-蛋白酶体系统的下游,其特异性较差、不良反应多[17]。临床研究表明多种肿瘤细胞对已有蛋白酶体抑制剂产生了耐药性,亟需开发靶向UPS的新型抑制剂,以期获得更佳的肿瘤治疗效果。
中药来源广泛、结构复杂、种类繁多,是我国创新药物研究的宝贵资源[18]。我国对中药的研究源远流长,记载在案的天然药用植物超万余种,中医与民族医学关于天然药物的理论体系非常系统、完整,为我国基于中药的新药研发提供了优良条件。因此,从中药中寻找抗肿瘤活性分子具有独特的优势和广阔的应用前景。薯蓣皂苷在百合科、石竹科、薯蓣科和蔷薇科等植物中广泛存在,是一种天然甾体皂苷类化合物,其在薯蓣科植物的根茎中含量最高[19]。近来研究表明薯蓣皂苷具有显著抗肿瘤活性[20]。在对肝癌细胞的研究中发现,薯蓣皂苷能够有效抑制肝癌细胞HepG2的增殖,用半数抑制浓度处理细胞后表明细胞周期被阻滞在G2/M期[21]。在对肺癌的研究中发现,薯蓣皂苷处理肺癌细胞A549、NCI-H446和NCI-H460后,细胞增殖明显受抑制,细胞凋亡显著增加。并且低剂量薯蓣皂苷就能显著抑制肺癌细胞A549小鼠移植瘤的生长,然而其作用机制尚不明确[22]。本研究基于UbG76V-GFP报告系统筛选发现薯蓣皂苷是新型的UPS抑制剂,能抑制细胞内去泛素化酶活性,增强蛋白泛素化水平,并抑制肿瘤细胞增殖。本研究初步揭示了薯蓣皂苷在肿瘤细胞中的生物学功能和机制,为深入研究薯蓣皂苷抗肿瘤的分子机制提供了方向。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
李欣茹:实验操作、数据整理及论文撰写
王嘉琦:实验操作
柯细松:基金支持及论文修改
周香莲:实验指导及论文修改
| [1] |
Nandi D, Tahiliani P, Kumar A, et al. The ubiquitin-proteasome system[J]. J Biosci, 2006, 31(1): 137-155. DOI:10.1007/BF02705243 |
| [2] |
Swatek KN, Komander D. Ubiquitin modifications[J]. Cell Res, 2016, 26(4): 399-422. DOI:10.1038/cr.2016.39 |
| [3] |
Komander D, Rape M. The ubiquitin code[J]. Annu Rev Biochem, 2012, 81: 203-229. DOI:10.1146/annurev-biochem-060310-170328 |
| [4] |
Aliabadi F, Sohrabi B, Mostafavi E, et al. Ubiquitin-proteasome system and the role of its inhibitors in cancer therapy[J]. Open Biol, 2021, 11(4): 200390. DOI:10.1098/rsob.200390 |
| [5] |
Khalesi N, Korani S, Korani M, et al. Bortezomib: a proteasome inhibitor for the treatment of autoimmune diseases[J]. Inflammopharmacology, 2021, 29(5): 1291-1306. DOI:10.1007/s10787-021-00863-2 |
| [6] |
Fricker LD. Proteasome Inhibitor Drugs[J]. Annu Rev Pharmacol Toxicol, 2020, 60: 457-476. DOI:10.1146/annurev-pharmtox-010919-023603 |
| [7] |
Bandopadhyay S, Anand U, Gadekar VS, et al. Dioscin: A review on pharmacological properties and therapeutic values[J]. Biofactors, 2022, 48(1): 22-55. DOI:10.1002/biof.1815 |
| [8] |
Li X, Liu S, Qu L, et al. Dioscin and diosgenin: Insights into their potential protective effects in cardiac diseases[J]. J Ethnopharmacol, 2021, 274: 114018. DOI:10.1016/j.jep.2021.114018 |
| [9] |
Tao X, Yin L, Xu L, et al. Dioscin: A diverse acting natural compound with therapeutic potential in metabolic diseases, cancer, inflammation and infections[J]. Pharmacol Res, 2018, 137: 259-269. DOI:10.1016/j.phrs.2018.09.022 |
| [10] |
Dantuma NP, Lindsten K, Glas R, et al. Short-lived green fluorescent proteins for quantifying ubiquitin/proteasome-dependent proteolysis in living cells[J]. Nat Biotechnol, 2000, 18(5): 538-543. DOI:10.1038/75406 |
| [11] |
Gierisch ME, Giovannucci TA, Dantuma NP. Reporter-Based Screens for the Ubiquitin/Proteasome System[J]. Front Chem, 2020, 8(64). |
| [12] |
Budenholzer L, Cheng CL, Li Y, et al. Proteasome Structure and Assembly[J]. J Mol Biol, 2017, 429(22): 3500-3524. DOI:10.1016/j.jmb.2017.05.027 |
| [13] |
Nakamura N. Ubiquitin System[J]. Int J Mol Sci, 2018, 19(4): 1080. DOI:10.3390/ijms19041080 |
| [14] |
Scott K, Hayden PJ, Will A, et al. Bortezomib for the treatment of multiple myeloma[J]. Cochrane Database Syst Rev, 2016, 4: CD010816. |
| [15] |
Yee AJ. The role of carfilzomib in relapsed/refractory multiple myeloma[J]. Ther Adv Hematol, 2021, 12: 1543937372. |
| [16] |
Xie J, Wan N, Liang Z, et al. Ixazomib-the first oral proteasome inhibitor[J]. Leuk Lymphoma, 2019, 60(3): 610-618. DOI:10.1080/10428194.2018.1523398 |
| [17] |
Walhelm T, Gunnarsson I, Heijke R, et al. Clinical Experience of Proteasome Inhibitor Bortezomib Regarding Efficacy and Safety in Severe Systemic Lupus Erythematosus: A Nationwide Study[J]. Front Immunol, 2021, 12: 756941. DOI:10.3389/fimmu.2021.756941 |
| [18] |
Yao CL, Zhang JQ, Li JY, et al. Traditional Chinese medicine (TCM) as a source of new anticancer drugs[J]. Nat Prod Rep, 2021, 38(9): 1618-1633. DOI:10.1039/D0NP00057D |
| [19] |
Yang L, Ren S, Xu F, et al. Recent Advances in the Pharmacological Activities of Dioscin[J]. Biomed Res Int, 2019, 2019: 5763602. |
| [20] |
Xi P, Niu Y, Zhang Y, et al. The mechanism of dioscin preventing lung cancer based on network pharmacology and experimental validation[J]. J Ethnopharmacol, 2022, 292: 115138. DOI:10.1016/j.jep.2022.115138 |
| [21] |
Ding Q, Zhang W, Cheng C, et al. Dioscin inhibits the growth of human osteosarcoma by inducing G2/M-phase arrest, apoptosis, and GSDME-dependent cell death in vitro and in vivo[J]. J Cell Physiol, 2020, 235(3): 2911-2924. DOI:10.1002/jcp.29197 |
| [22] |
Li X, Liu S, Qu L, et al. Dioscin and diosgenin: Insights into their potential protective effects in cardiac diseases[J]. J Ethnopharmacol, 2021, 274: 114018. |
 2023, Vol. 50
2023, Vol. 50


