文章信息
- 伊马替尼通过PDGF/PDGFR通路对A549非小细胞肺癌裸鼠移植瘤的抑制作用及机制研究
- Inhibition and Mechanism of Imatinib on A549 Xenograft Tumor in Nude Mice via PDGF/PDGFR Pathway
- 肿瘤防治研究, 2023, 50(9): 854-859
- Cancer Research on Prevention and Treatment, 2023, 50(9): 854-859
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0228
- 收稿日期: 2023-03-10
- 修回日期: 2023-05-25
2. 310030 杭州, 浙江大学医学院
2. School of Medicine, Zhejiang University, Hangzhou 310030, China
非小细胞肺癌(non-small cell lung cancer, NSCLC)是目前最致命的恶性肿瘤之一[1],而且难以在早期诊断,约2/3的NSCLC患者确诊时即为Ⅲ或Ⅳ期,5年生存期不足15%。血小板作为最早被关注的NSCLC预后指标之一,近年来越来越引起重视。血小板衍生生长因子(platelet-derived growth factor, PDGF)及其受体(platelet-derived growth factor receptor, PDGFR)作为血小板的重要调控因子,被证实与NSCLC患者的预后有关,PDGF、PDGFR水平的升高往往提示NSCLC患者预后不良[2-4]。笔者前期研究同样发现,在临床晚期(Ⅲ或Ⅳ期)NSCLC患者中,PDGF、PDGFR水平较早期(Ⅰ或Ⅱ期)患者明显升高[5]。因此,PDGF/PDGFR通路对NSCLC的发生、发展可能具有重要作用。伊马替尼作为经典的PDGFR抑制剂,对NSCLC的抗肿瘤作用近年来受到关注,其机制被认为可能与通过调节肿瘤基质有关。前期研究[6-7]表明肿瘤基质细胞,如成纤维细胞、血管内皮细胞和炎性反应细胞,通过释放各种细胞因子,促进了肿瘤的生长、血管生成和转移。因此,本研究通过建立NSCLC裸鼠模型,观察伊马替尼在体内对NSCLC细胞及基质的影响,并探讨PDGF/PDGFR通路在此过程中的作用机制。
1 材料与方法 1.1 材料 1.1.1 细胞系和动物人A549非小细胞肺癌细胞购自武汉普诺赛生命科技有限公司。16只4~6周龄、体质量14~18 g的雄性BALB/c裸鼠购自斯贝福(北京)生物技术有限公司。动物实验经杭州赫贝科技有限公司实验动物伦理委员会批准(编号:HB2201004),符合实验室动物管理与使用准则。
1.1.2 药物与试剂伊马替尼购自美国Sigma公司;胎牛血清、PRMI 1640培养基、0.25%胰蛋白酶和青链霉素购自美国Gibco公司;兔源磷酸化AKT(p-AKT)和磷酸化ERK1/2(p-ERK1/2)多克隆抗体(批号:28731-1-AP、28733-1-AP)购自美国Proteintech Group公司;兔源PDGFB、PDGFRβ、磷酸化PDGF-β(p-PDGFRβ)多克隆抗体、鼠源α-SMA、CD34和Podoplanin(PNPN)单克隆抗体(批号:YT3631、YT3639、YP0742、YM3365、YM6152、YM6994)购自美国ImmunoWay公司;兔源β-actin一抗、辣根过氧化物酶标记的山羊抗兔二抗(批号:ab8227、ab6721)购自美国Abcam公司。Alexa Fluor 555标记的驴抗鼠二抗、Alexa Fluor 488标记山羊抗兔二抗(批号:A0460、A0423)购自上海碧云天公司。
1.1.3 仪器超净操作台(上海树立,SW-CJ-2D)、CO2细胞恒温培养箱(日本SANYO,MCO-15AC)、旋转石蜡切片机(Thermo,Finesse 325)、电泳仪(Biorad,1645050)、WB曝光仪(广州博鹭腾生物科技有限公司,GelView 6000Plus)、倒置荧光显微镜(德国蔡司,Axio Vert.A1)。
1.2 方法 1.2.1 细胞培养将A549细胞加入适量新鲜完全培养基(含有10%胎牛血清+1%青链霉素)中,置于37℃、5%CO2培养箱中孵育。
1.2.2 造模将处于对数生长期的A549细胞悬液(5×107个/毫升)以每只0.2 ml的剂量接种于裸鼠背部皮下。裸鼠移植瘤体积平均达100 mm3即提示造模成功[8-9]。
1.2.3 分组给药及处理造模成功后,将裸鼠随机分为四组:对照组、低、中、高剂量伊马替尼组(50、100、200 mg/(kg·d)),每组4只。低、中、高剂量伊马替尼组均灌胃给药,而对照组则接受相同体积的0.9%氯化钠溶液,每日1次,持续28天。期间观察裸鼠每日活动状态和进食饮水情况,每2日用游标卡尺测量肿瘤体积(V),计算公式为V=ab2/2,其中a为肿瘤最长径,b为肿瘤最短径。末次给药后24 h,处死裸鼠,剥离肿瘤组织,记录肿瘤重量。收集肿瘤组织,一部分储存于液氮中,另一部分用4%甲醛固定保存。
1.2.4 HE染色取各组裸鼠肿瘤组织,对其进行切片后捞片,并置于60℃下烘烤2 h;二甲苯脱蜡30 min,100%—95%—80%—75%—50%—30%乙醇梯度洗脱,最后用纯水浸泡;苏木精染色4 min后,自来水冲洗;1%盐酸乙醇脱去多余的苏木精,自来水冲洗10 min;伊红染色1 min,自来水冲洗;95%—95%—100%—100%乙醇梯度洗脱染料;二甲苯透明3次;中性树胶封片,风干后于显微镜下观察肿瘤组织。
1.2.5 Westernblot法检测PDGF/PDGFR通路相关蛋白及AKT、ERK1/2蛋白磷酸化水平适量称取各组肿瘤组织,用无菌剪刀剪碎,于4℃裂解30 min;超声破碎后离心(4℃,13 000 r/min)10 min,取上清液。测定蛋白浓度,根据目的蛋白分子量制备SDS-聚丙酰胺凝胶。将凝胶固定到电泳槽上,倒入电泳液。将蛋白样品和MARKER加入上样孔,各样品总蛋白量为40 μg。加样后先恒压80 V电泳,直到溴酚蓝指示剂在浓缩胶与分离胶交界处成线状,改为恒压100 V直到溴酚蓝到凝胶底部。电泳后进行转膜,浸入含有5%脱脂奶粉的PBST,于室温下封闭30 min,分别加入PDGFB(1:1 000)、PDGFRβ(1:1 000)、p-PDGFRβ(1:1 000)、p-AKT(1:2 000)、p-ERK1/2(1:2 000)、β-actin(1:2 000)一抗,4℃孵育过夜。TBST充分洗涤PVDF膜5~6次,5分钟/次。将相应的HRP标记二抗稀释为1:5 000,PVDF膜浸于二抗孵育液中,37℃摇床中孵育2 h。TBST充分洗涤PVDF膜5~6次,5分钟/次。将ECL试剂中增强液与稳定的过氧化物酶溶液按1:1比例混匀,滴于PVDF膜上。反应数分钟直到出现明显的荧光条带,用滤纸吸去多余的底物液,覆上保鲜膜,X光胶片压片后依次放入显影液显影、定影液定影,冲洗胶片。
1.2.6 双重免疫荧光染色检测肿瘤基质PDGFB、PDGFRβ蛋白的表达按照上述HE染色的方法制作切片。常规脱蜡和水化后,用dH2O清洗2次,每次5 min;将切片浸入1×柠檬酸盐修复液中,微波炉加热至沸腾后,继续保持亚沸腾温度(95℃~98℃)10 min;冷却切片后用dH2O清洗切片3次,每次5 min;在封闭缓冲液中封闭60 min;吸去封闭缓冲液,按照产品说明书中推荐的稀释比例,在抗体稀释缓冲液中配制一抗,加入稀释后的一抗,4℃孵育过夜;用1×PBS漂洗3次,每次5 min;用抗体稀释缓冲液将Alexa Fluor 555标记的二抗稀释后,室温下避光孵育1~2 h;用1×PBS漂洗3次,每次5 min;二步双染另外的抗体,加入Alexa Fluor 488标记的二抗;盖玻片和封片剂封片。
1.3 统计学方法计量资料以(x±s)表示,采用SPSS19.0统计软件分析。两两比较采用LSD-t检验,多组间数据采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 各组裸鼠肿瘤体积和肿瘤重量比较在治疗期间每隔一天测量裸鼠肿瘤体积。随着治疗天数的增加,组间差异逐渐增大,于末次给药后24 h处死,见图 1A、B。与对照组相比,低、中、高剂量伊马替尼组肿瘤重量均显著下降,且呈剂量依赖性,见图 1C。
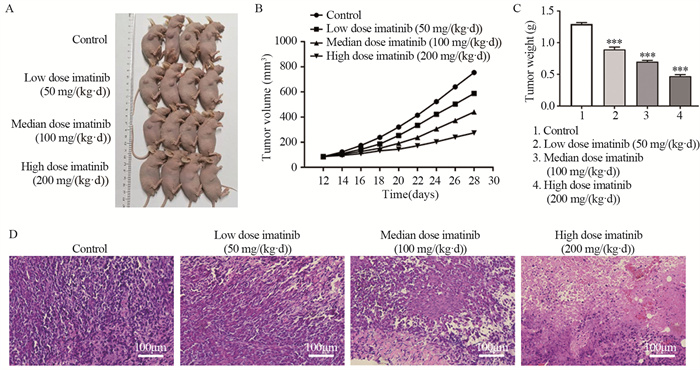
|
| ***: P < 0.001, compared with the control group. A: tumorigenesis in nude mice; B: growth curve of transplanted tumors in nude mice; C: effect of imatinib on tumor weight in nude mice; D: histopathological changes in the tumors of nude mice (HE ×200) 图 1 伊马替尼对裸鼠移植瘤生长的抑制作用 Figure 1 Inhibitory effect of imatinib on growth of transplanted tumors in nude mice |
对照组的肿瘤细胞排列紧密,形态各异、大小不一,部分细胞核大深染;低剂量伊马替尼组细胞排列呈片状且疏松,着色浅,周围可见小灶状细胞坏死;中剂量伊马替尼组肿瘤细胞变小,凋亡细胞核固缩、破碎,形成凋亡小体;高剂量伊马替尼组肿瘤细胞边界不清晰,可见多处大片状坏死和凋亡细胞,肿瘤细胞之间排列疏松,体积明显缩小,见图 1D。
2.3 各组裸鼠移植瘤组织中PDGF/PDGFR通路相关蛋白表达及AKT、ERK1/2蛋白磷酸化水平比较与对照组相比,低、中、高剂量伊马替尼组中的PDGFB表达和AKT、ERK1/2蛋白的磷酸化水平呈剂量依赖性降低(P < 0.01, P < 0.001),PDGFRβ的磷酸化也被显著抑制(P < 0.05, P < 0.01, P < 0.001),见图 2。
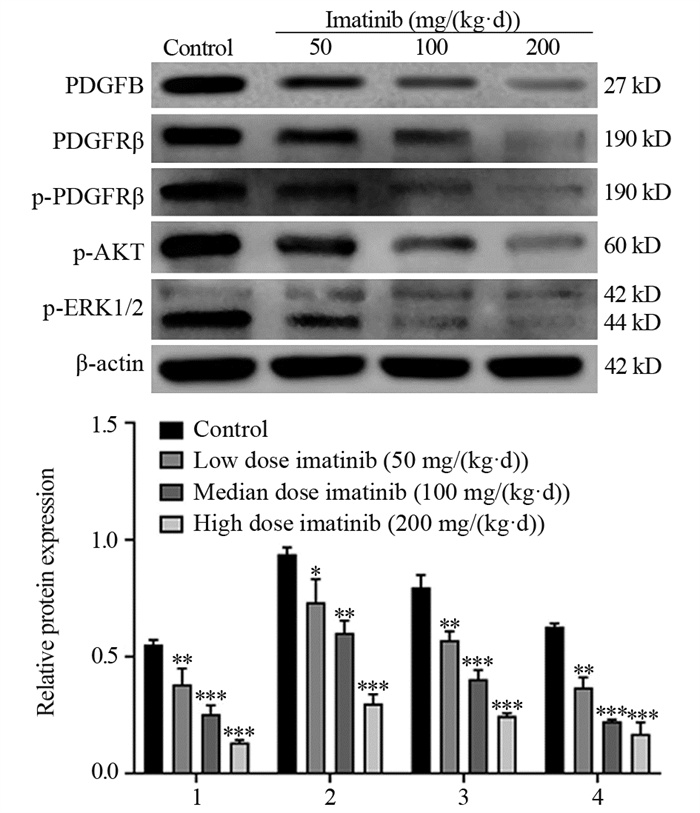
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with the control group; 1: PDGFB/β-actin; 2: PDGFRβ/p-PDGFRβ; 3: p-AKT/β-actin; 4: p-ERK1/2/β-actin. 图 2 肿瘤组织PDGFB、PDGFRβ、p-PDGFRβ、p-AKT及p-ERK1/2蛋白的表达情况 Figure 2 Expression of PDGFB, PDGFRβ, p-PDGFRβ, p-AKT, and p-ERK1/2 proteins in tumor tissues |
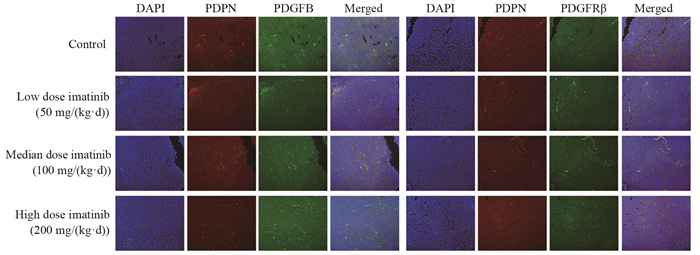
免疫荧光标记后于激光共聚焦显微镜下观察伊马替尼对肿瘤基质成纤维细胞、血管内皮细胞和淋巴内皮细胞PDGFB/PDGFRβ表达的影响,镜下可见对照组肿瘤基质成纤维细胞出现较强的PDGFB/PDGFRβ表达,且随着给药浓度的增加,伊马替尼低、中、高剂量组的肿瘤基质成纤维细胞荧光依次减弱。肿瘤基质血管内皮细胞和淋巴内皮细胞各组荧光有一定变化,但没有显著差异,见图 3~5。
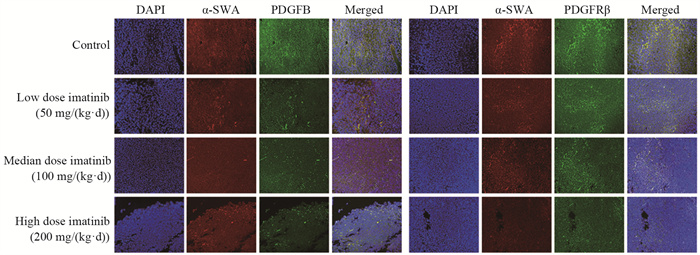
|
| 图 3 PDGFB、PDGFRβ在肿瘤基质成纤维细胞中的表达情况(双重免疫荧光染色×200) Figure 3 Expression of PDGFB and PDGFRβ in tumor stromal fibroblasts (double immunofluorescence staining ×200) |
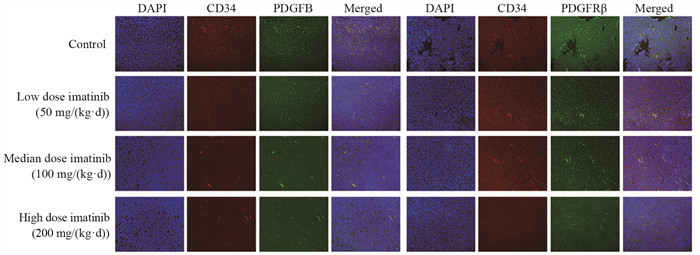
|
| 图 4 PDGFB、PDGFRβ在肿瘤基质血管内皮细胞中的表达情况(双重免疫荧光染色×200) Figure 4 Expression of PDGFB and PDGFRβ in tumor stromal vascular endothelial cells (double immunofluorescence staining ×200) |
|
| 图 5 PDGFB、PDGFRβ在肿瘤基质淋巴内皮细胞中的表达情况(双重免疫荧光染色×200) Figure 5 Expression of PDGFB and PDGFRβ in tumor stromal lymphatic endothelial cells (double immunofluorescence staining ×200) |
肺癌是一种常见的临床恶性肿瘤,约85%的肺癌为NSCLC[10],大多数患者初次诊断时即发现转移[11-12],严重影响患者的生存,深入探究NSCLC的发病机制具有重要意义。伊马替尼是一种多靶点抑制剂,具有良好的口服生物利用度,在治疗慢性粒细胞白血病和胃肠道间质瘤中取得了较好的临床疗效。本研究旨在建立裸鼠移植瘤模型模拟人NSCLC A549细胞在体内的生长环境,研究伊马替尼的体内抑瘤机制。本研究结果显示,伊马替尼在给药28天后对裸鼠NSCLC移植瘤的生长具有剂量依赖性的抑制作用;病理学观察发现,与对照组相比,给药组的肿瘤细胞均呈现不同程度的体积缩小,出现明显的细胞凋亡。Vlahovic等[13]研究了伊马替尼作为NSCLC化疗辅助手段在体内的疗效,发现伊马替尼对NSCLC裸鼠移植瘤起抑制作用。此外,Testoni等同样发现接受100 mg/kg的伊马替尼治疗后,NSCLC模型小鼠肿瘤体积显著减小[14],这与本研究结果一致。综上所述,伊马替尼对NSCLC的生长有良好的抑制作用。
PDGF是一种有丝分裂原和化学趋化剂,广泛分布于人体各种器官,包括PDGFA、PDGFB、PDGFC和PDGFD四个家族成员。其中,PDGFB的表达水平被证明与NSCLC患者的淋巴结转移相关,可能对NSCLC的发展起关键作用[5]。PDGF通过与其受体PDGFR的特异性结合启动酪氨酸激酶的磷酸化,并激活下游特定的PI3K/AKT、ERK1/2信号通路[15],促进内皮细胞的增殖和血管生成,同时促进肿瘤生长[16]。另有研究表明,PI3K/Akt信号转导通路的激活可诱导肿瘤生长,促进上皮间质转化和转移[17-18],以及通过激活ERK磷酸化促进肿瘤生长和迁移[19]。
然而,目前少有研究探讨伊马替尼对NSCLC的抗肿瘤作用机制。本研究结果显示在肿瘤组织和肿瘤基质成纤维细胞中伊马替尼几乎完全抑制了PDGFRβ的磷酸化,也抑制了PDGFB的表达,提示伊马替尼抑制NSCLC A549细胞生长可能与抑制PDGF/PDGFR信号通路相关。这一结果进一步证实了伊马替尼可通过阻断成纤维细胞中PDGFR的表达,从而起到抗NSCLC的作用。
综上所述,伊马替尼对NSCLC裸鼠A549皮下移植瘤有显著抑制作用,是一种有效抑制NSCLC A549细胞生长的药物;在肿瘤基质成纤维细胞中,伊马替尼几乎完全抑制了PDGFR的磷酸化,降低AKT、ERK1/2磷酸化,通过调节肿瘤微环境发挥抗肿瘤效应,这为临床中伊马替尼治疗NSCLC提供了前期实验基础。然而,需要注意的是,本研究仅为一项动物实验,与临床实践的实际用药途径和剂量存在一定差异,且样本量不足。因此,仍需加大样本量,进一步研究和完善以验证这些结果,并促进其在临床实践中的应用。此外,还需要进行更多的体内和体外实验,以深入了解伊马替尼对肿瘤微环境的调节机制,并评估其对肿瘤的长期效应和潜在的不良反应。
利益冲突声明:
本文作者声明不存在利益冲突。
作者贡献:
夏冰天:选题与实验设计、论文撰写
何芳:文献调研、数据分析
宋冰欣、王丽莉、朱亭郡、贾永清:实验操作、收集和整理数据
胡慧仙:实验指导、文稿审校及基金支持
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer Statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
Huang Q, Diao P, Li CL, et al. Preoperative platelet-lymphocyte ratio is a superior prognostic biomarker to other systemic inflammatory response markers in non-small cell lung cancer[J]. Medicine (Baltimore), 2020, 99(4): e18607. DOI:10.1097/MD.0000000000018607 |
| [3] |
胡慧仙, 何芳, 王丽莉, 等. 非小细胞肺癌分期分型与血小板计数及参数的相关性分析[J]. 全科医学临床与教育, 2013, 11(6): 612-614. [Hu HX, He F, Wang LL, et al. NSCLC staging and pathologic classification are correlated with platelet counts and parameters[J]. Quan Ke Yi Xue Lin Chuang Yu Jiao Yu, 2013, 11(6): 612-614. DOI:10.13558/j.cnki.issn1672-3686.2013.06.036] |
| [4] |
胡慧仙, 丁明星, 郭方明, 等. 非小细胞肺癌患者PDGF-BB水平与血小板计数的关系[J]. 现代实用医学, 2016, 28(3): 391-392. [Hu HX, Ding MX, Guo FM, et al. Relationship between PDGF-BB levels and platelet counts in patients with non-small cell lung cancer[J]. Xian Dai Shi Yong Yi Xue, 2016, 28(3): 391-392. DOI:10.3969/j.issn.1671-0800.2016.03.058] |
| [5] |
Zhang N, Hu H, Fu Y, et al. The overexpression of PDGF-BB and its receptor is correlated with lymphatic metastasis in patients with non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2018, 11(12): 6010-6017. |
| [6] |
Zhang X, Zhang Y, Qiu X, et al. Extracellular Vesicles Derived from Lung Cancer Cells Induce Transformation of Normal Fibroblasts into Lung Cancer-Associated Fibroblasts and Promote Metastasis of Lung Cancer by Delivering lncRNA HOTAIR[J]. Stem Cells Int, 2022, 2022: 3805013. |
| [7] |
Chen Y, McAndrews KM, Kalluri R. Clinical and therapeutic relevance of cancer-associated fibroblasts[J]. Nat Rev Clin Oncol, 2021, 18(12): 792-804. DOI:10.1038/s41571-021-00546-5 |
| [8] |
唐治蓉, 龙琼先, 刘欣雅, 等. 当归多糖通过调节p38通路抑制宫颈癌HeLa细胞生长、迁移和侵袭[J]. 中国免疫学杂志, 2020, 36(3): 332-337. [Tang ZR, Long QX, Liu XY, et al. Angelica sinensis polysaccharide inhibits growth, migration and invasion of cervical cancer HeLa cells by regulating p38 pathway[J]. Zhongguo Mian Yi Xue Za Zhi, 2020, 36(3): 332-337. DOI:10.3969/j.issn.1000-484X.2020.03.014] |
| [9] |
冯晓玲, 孙佳宁, 赵小萱. 红景天苷联合顺铂对人卵巢癌SKOV-3裸鼠移植瘤生长影响及其机制研究[J]. 中华中医药杂志, 2021, 36(7): 3851-3855. [Feng XL, Sun JN, Zhao XX. Effects of salidroside combined with cisplatin on growth of ovarian cancer cell SKOV-3 in nude mice and its mechanism[J]. Zhonghua Zhong Yi Yao Za Zhi, 2021, 36(7): 3851-3855.] |
| [10] |
Bade BC, Dela Cruz CS. Lung Cancer 2020: Epidemiology, Etiology, and Prevention[J]. Clin Chest Med, 2020, 41(1): 1-24. DOI:10.1016/j.ccm.2019.10.001 |
| [11] |
Chen S, Huang W, Liu Z, et al. Identification of nine mutant genes and establishment of three prediction models of organ tropism metastases of non-small cell lung cancer[J]. Cancer Med, 2023, 12(3): 3089-3100. DOI:10.1002/cam4.5233 |
| [12] |
Koch A, Sponholz S, Trainer S, et al. Pulmonary Resection after Radiosurgery and Neoadjuvant Immunochemotherapy for NSCLC Patients with Synchronous Brain Metastasis-A Case Series of Three Patients[J]. Curr Oncol, 2022, 29(4): 2225-2239. DOI:10.3390/curroncol29040181 |
| [13] |
Vlahovic G, Ponce AM, Rabbani Z, et al. Treatment with imatinib improves drug delivery and efficacy in NSCLC xenografts[J]. Br J Cancer, 2007, 97(6): 735-740. DOI:10.1038/sj.bjc.6603941 |
| [14] |
Testoni E, Stephenson NL, Torres-Ayuso P, et al. Somatically mutated ABL1 is an actionable and essential NSCLC survival gene[J]. EMBO Mol Med, 2016, 8(2): 105-116. DOI:10.15252/emmm.201505456 |
| [15] |
Pan S, Hu Y, Hu M, et al. Platelet-derived PDGF promotes the invasion and metastasis of cholangiocarcinoma by upregulating MMP2/MMP9 expression and inducing EMT via the p38/MAPK signalling pathway[J]. Am J Transl Res, 2020, 12(7): 3577-3595. |
| [16] |
Song CY, Chang SL, Lin CY, et al. Visfatin-Induced Inhibition of miR-1264 Facilitates PDGF-C Synthesis in Chondrosarcoma Cells and Enhances Endothelial Progenitor Cell Angiogenesis[J]. Cells, 2022, 11(21): 3470. DOI:10.3390/cells11213470 |
| [17] |
Liu X, Sun L, Zhang S, et al. GINS2 facilitates epithelial-to-mesenchymal transition in non-small-cell lung cancer through modulating PI3K/Akt and MEK/ERK signaling[J]. J Cell Physiol, 2020, 235(11): 7747-7756. DOI:10.1002/jcp.29381 |
| [18] |
Zhang D, Liu H, Wang W, et al. STEAP2 promotes osteosarcoma progression by inducing epithelial-mesenchymal transition via the PI3K/AKT/mTOR signaling pathway and is regulated by EFEMP2[J]. Cancer Biol Ther, 2022, 23(1): 1-16. |
| [19] |
Xie SJ, Diao LT, Cai N, et al. mascRNA and its parent lncRNA MALAT1 promote proliferation and metastasis of hepatocellular carcinoma cells by activating ERK/MAPK signaling pathway[J]. Cell Death Discov, 2021, 7(1): 110. DOI:10.1038/s41420-021-00497-x |
 2023, Vol. 50
2023, Vol. 50


