文章信息
- 食管癌微创术后治疗失败模式及辅助治疗价值评估
- Patterns of Failure After Minimally Invasive Esophagectomy and Evaluation of Value of Adjuvant Therapy for Esophageal Cancer
- 肿瘤防治研究, 2023, 50(9): 895-901
- Cancer Research on Prevention and Treatment, 2023, 50(9): 895-901
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0195
- 收稿日期: 2023-03-24
- 修回日期: 2023-06-08
2. 050041 石家庄, 河北省胸科医院医务科
2. Medical Department, Hebei Chest Hospital, Shijiazhuang 050041, China
左胸入路不完全胸腹两野清扫是十余年前我国食管癌外科治疗的主要手术入路。相较于右胸入路手术,其优点是创伤小、手术时间短、术后死亡率以及并发症发生率较低,缺点在于不能彻底清扫上纵隔淋巴结。因主动脉弓和左锁骨下动脉的遮挡及弓上三角区域狭小,手术不能完全清扫到左右两侧气管(主要是食管沟和喉返神经旁淋巴结),同时左胸入路也不能清扫颈部淋巴结,并且相对于经腹手术,其对术后肺功能也有影响。已有大量研究显示其下颈和上纵隔淋巴结复发率高达30%~40%[1-2]。在过去三十余年,行左胸入路手术患者的5年生存率一直徘徊在30%~40%[1, 3],术后放疗对于降低区域复发、改善生存具有重要价值。近些年食管癌外科术式发生了重要变化,尤其是近十余年,食管癌经右胸径路手术在国内逐渐得到开展,同时随微创设备和技术的进步,已有大宗病例报道证实食管癌微创手术的安全性和临床效果不亚于传统开放手术。2009年NCCN指南修订将微创食管癌切除术列为标准食管癌术式之一,2019年中国临床肿瘤学会(CSCO)食管癌诊疗指南亦将胸腹腔镜微创手术推荐为可选手术方式,目前微创食管癌手术在分期较早患者中已广泛应用,在局部晚期食管癌中的安全性和有效性尚有待高级别临床试验验证。在当前食管癌外科手术格局中,传统左胸路径开放手术所占比例已不足50%,手术方式逐步由左开胸向右开胸过渡,由开放手术向微创手术(minimally invasive esophagectomy, MIE)过渡。本文就当前阶段食管癌微创手术的安全性、生存状况及其术后治疗失败模式进行了归纳和总结,以期评估在食管癌微创手术条件下术后辅助治疗的价值。
1 食管癌微创手术的长期生存情况1992年Cuschieri等发表了关于胸腔镜食管切除术的报告,开启了食管癌微创手术的新时代。微创手术大致分为经食管裂孔微创食管切除术、胸腹腔镜联合食管癌切除(胃食管颈部吻合,McKeown MIE)、胸腹腔镜联合食管癌切除(胃食管胸内吻合,Ivor-Lewis MIE)、机器人辅助微创食管切除术等术式。食管癌微创手术因具有创伤小、术后并发症少、能够系统清扫淋巴结等优势,近十余年来逐渐成为食管癌切除术的发展方向。相较于左开胸,微创手术的优势能否转化为长期生存情况的改善、微创术后肿瘤复发模式是否会发生明显变化、术后辅助治疗策略是否需要调整,都是亟待解答的问题。
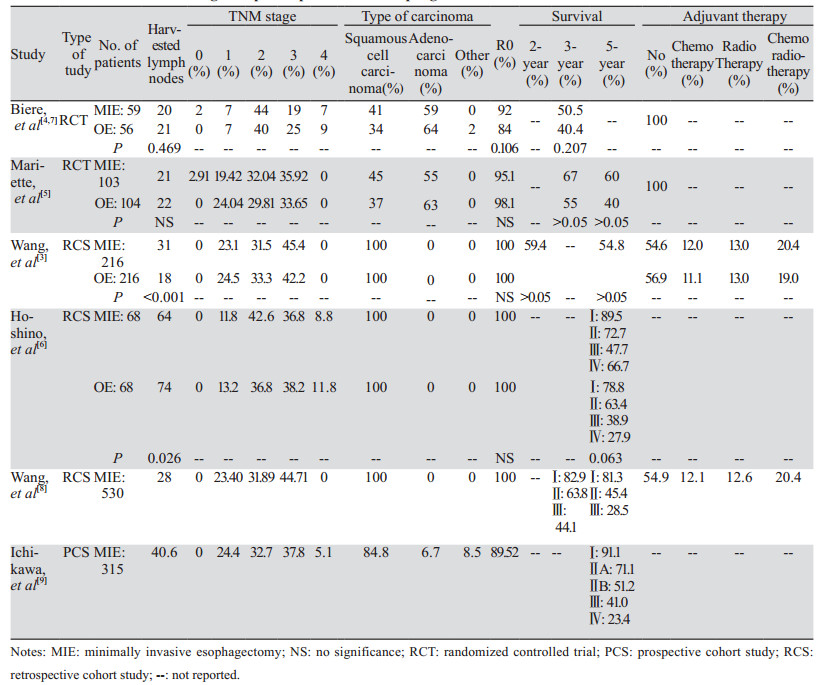
食管癌手术治疗中关注度比较高的问题是微创技术在术后生存方面是否优于或非劣效于开放手术。尽管MIE已被证明是安全可行的,但MIE相对于传统的开放食管癌切除术(open esophagectomy, OE)治疗食管癌的生存优势尚未得到证实。越来越多的大型队列研究表明,MIE的肿瘤学结果似乎与OE相当。表 1为关于MIE的研究报道,其中几项对比MIE与OE的研究[3-7]均显示MIE患者术后长期生存率非劣效于OE。TIME试验[4]将MIE与OE的短期结果进行了比较,Straatman等[7]做了TIME试验的后续研究,结果显示MIE与OE在淋巴结清扫数量和R0切除率方面相近,MIE组(59例)的3年总生存率为50.5%,而OE组(56例)为40.4%,但两者比较差异无统计学意义。MIRO试验进一步证明,MIE可在不损害长期肿瘤学结果的情况下降低术后发病率,MIRO试验[5]比较了通过腹腔镜/开胸手术混合方法进行的Ivor Lewis食管切除术与完全开放食管切除术,混合手术组3年总生存率(67.0%)与开放手术组(54.8%)相比有所提高,但差异无统计学意义,5年总生存率差异也无统计学意义(60%和40%)。上述两项随机对照试验均表明MIE在淋巴结切除数量、R0切除率和长期生存率方面非劣效于OE,甚至有进一步改善3或5年总生存率趋势。MIE是否有助于提高生存率这一问题的最终答案实际比较复杂,临床很难对这两种手术方法进行随机对照试验,因为决定选择何种术式必须考虑肿瘤的大小、位置、转移和患者一般情况,所以比较MIE与OE的研究大多为非随机研究,这又会受到选择偏倚的影响。同时,也不应忽略外科医生在OE和MIE方面的经验和手术技能,一些证据[10]表明,外科医生的技能可能比手术方法更重要。因此,由于受到多种因素的影响,MIE相较于OE在长期生存结果上的潜在优势可能尚未发挥出来,还需大规模、多中心的随机对照试验来进一步探索。
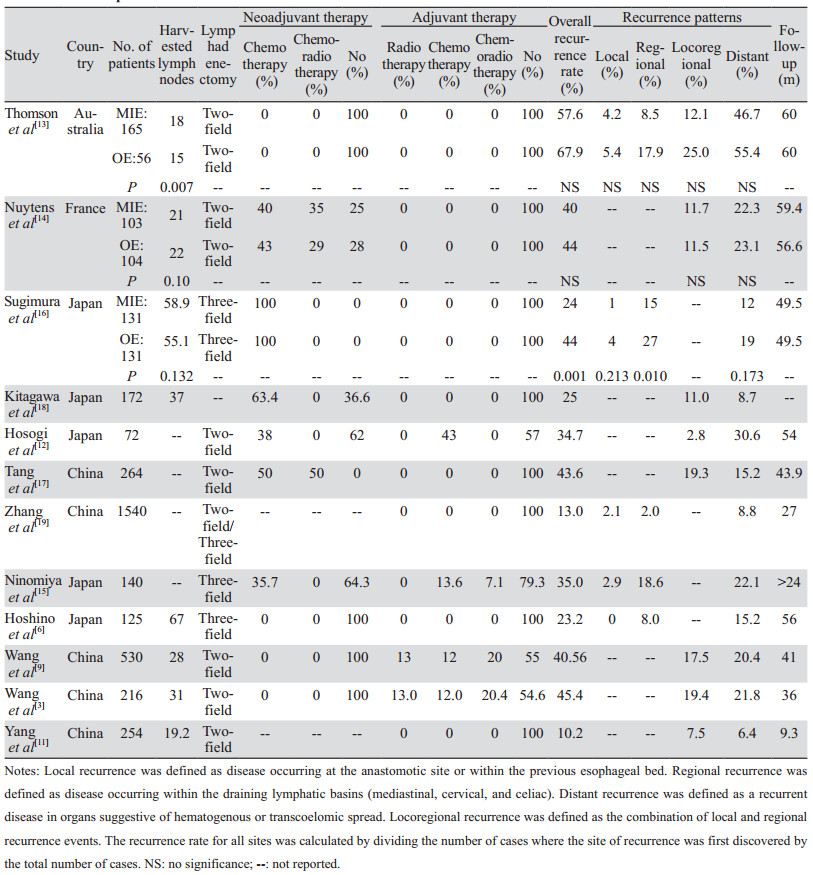
尽管大量证据支持MIE可以在有经验的中心安全地进行,但关于MIE后的复发率及复发模式研究数据相对较少,很难指导术后辅助治疗的选择。表 2为MIE治疗失败模式的相关文献[3, 6, 9, 11-19],结果显示食管癌微创术后最常见的治疗失败模式是远处转移,发生率为6.4%~46.7%不等,多数研究的术后远转率达到20%以上,也提示全身治疗是这部分患者综合治疗策略优化的重要方面。除远处转移外,MIE后次要常见治疗失败模式为局部区域性复发,发生率为2.8%~19.4%,其中Yang等[11]和Hosogi等[12]报道局部区域复发率在10%以下,其他研究得到的数据均在11%以上。
在病理类型以腺癌为主的两项研究中,Thomson等[13]进行了不同术式治疗失败模式的比较,研究中有165例和56例患者分别接受了胸腔镜辅助食管切除术(TAE)和开放式经胸食管切除术(TTE),在其5年复发模式中,TAE组的5年总体复发率为58%,与TTE组68%的复发率相当,TAE组的5年局部、区域和远处转移的首次复发率分别为4%、9%和47%,TTE组为5%、18%和55%,与开放式经胸食管切除术相比,胸腔镜辅助食管切除术有显著更好的“区域”无复发率,在局部控制方面似乎具有优势。Nuytens等[14]比较了混合微创食管切除术(HMIE)与开放食管切除术的疾病复发模式,在HMIE组(n=103)中,41例(40%)出现复发,其中12例为局部区域复发,23例为远处转移,6例为混合复发。在OE组(n=104)中,46例患者(44%)出现复发,其中12例为局部区域复发,24例为远处转移,10例为混合复发。两组之间复发率及复发区域比较差异无统计学意义。在病理类型以鳞癌为主的几项研究中,Ninomiya等[15]研究中区域性复发率较高,观察了140例接受视频辅助胸腔镜(VATS)根治性食管切除术的胸段食管鳞癌的复发模式,有49例(35.0%)患者复发,初始复发模式包括24例(17.1%)血行转移、26例(18.6%)淋巴结转移、5例(3.6%)胸膜转移、2例(1.4%)腹膜转移和局部复发4例(2.9%),但其实在26例淋转患者中,仅8例(5.7%)发生于纵隔区域。其肿瘤局部区域控制的良好疗效可能归因于腔镜技术在肿瘤组织切除方面的优势,如放大且精细的手术视野使纵隔淋巴结清扫更容易、肿瘤得到更好暴露从而更充分地切除,且腔镜技术可以发现并去除更多未被识别的肿瘤细胞或寡转移的组织及潜在的阳性淋巴结,从而更准确地分期和指导术后辅助治疗。
随着新辅助治疗的普及,一些研究重点关注了新辅助治疗后接受MIE患者的术后复发模式。Sugimura等[16]首次比较了接受新辅助化疗的局部晚期食管癌患者在OE和MIE条件下的复发模式,结果表明MIE组区域复发率明显低于OE组(15% vs. 27%,P=0.010),尤其值得注意的是,MIE组的纵隔淋巴结复发率明显低于OE组(6% vs. 16%,P=0.017),特别是MIE组的上纵隔淋巴结复发率低于OE组(12% vs. 5%,P=0.043)。两组在远处转移、局部复发等方面差异无统计学意义,MIE组总复发率低于OE组(24% vs. 44%,P=0.001)。这与Thomson等[13]和Hsu等[20]的研究结果大致相同,均显示MIE组患者比OE组患者局部区域复发率低,尤其在纵隔淋巴结复发率方面。这提示由于腔镜技术的放大效应,MIE可能会实现更精确的区域淋巴结切除,尤其在上纵隔区域,从而有助于降低MIE组的纵隔复发率。Tang等[17]在一项前瞻性多中心随机临床试验中比较了新辅助放化疗与新辅助化疗后接受MIE的局部晚期食管鳞癌患者的复发模式,结果显示,相较于新辅助化疗组,新辅助放化疗组有总复发率较低的趋势(37.9% vs. 49.2%,P=0.063),两组总体复发模式相似(P=0.802),均以局部区域复发为最高(17.4% vs. 21.2%,P=0.436),其次是远处转移(13.6% vs. 16.7%,P=0.492)。以上两项研究均为针对局部晚期食管鳞癌患者新辅助治疗后MIE的复发模式的探索,均显示局部区域复发为主要复发模式,但复发率相较于开放术式偏低,提示新辅助治疗联合MIE的治疗模式能为患者提供良好的局部控制。
总体来讲,食管癌MIE后治疗失败模式数据并不充分,从有限的研究结果来看,食管癌微创术后无论远处转移率还是局部区域复发率与开放手术历史数据[14, 21-22]比较,均呈相对较低水平,这可能与MIE选择的患者早期居多有关。在治疗失败模式中,较多研究提示远处转移是最常见的肿瘤进展模式,而对于局部区域性复发,多数研究报道的数据为10%~20%,似乎术后放疗在MIE患者的综合治疗选择中并非完全必要,而我们需要进一步探讨的是微创术后区域性复发的常见部位,如复发是否以两侧喉返神经旁或颈部锁骨上区域居多,以及对于合并高危因素的患者,如胸上段癌、pT3~4期,pN+期等,其术后局部区域复发率是否处于较高水平并需要术后放疗的介入。
3 食管癌微创手术术后辅助治疗的探讨目前对于微创食管癌切除术后的辅助放疗推荐尚无明确证据,存在的问题有两点:一是关于治疗失败模式数据目前并不充分,复发的高危区域、高风险因素均有待临床进一步探索;二是不同于开放式手术的左/右侧胸腔胃设置,管状胃在微创手术的临床应用中处于主导地位,管状胃位于后纵隔中央区域食管床处,与传统术式的术后照射范围大部重叠,因此对于食管癌微创手术术后放疗问题的探讨更为复杂,需要考量的因素更多,相关数据也更少。
Gao等[23]将118例行胸腹腔镜手术的食管癌患者随机分为术后放疗组和术后化疗组,发现术后放疗组总缓解率显著高于术后化疗组,且术后放疗组1、3、5年生存率分别为93.22%、79.66%、66.10%,显著高于术后化疗组,结果表明食管癌胸腹腔镜术后进行放疗对延长患者的生存时间和改善预后有显著效果。除此外,尚未检索到其他研究中心对行MIE的食管癌术后放疗价值的研究和评估。近年来关于食管癌术后放疗的一些前瞻性随机对照研究及回顾性研究肯定了术后放疗的价值。Yang等[24]对678例开放式手术切除后联合与不联合适形放疗的pT3N0M0期胸段食管鳞癌患者进行了分析,发现术后适形放疗能够改善pT3N0M0期胸段食管鳞癌患者的总生存率和无病生存率,且行术后放疗组患者的术后总复发率及局部区域复发率显著低于未行放疗组。Ni等[25]将172例ⅡB~Ⅲ期的食管鳞状细胞癌患者随机分配为单纯手术组、术后放疗组和术后同步放化疗组,分析发现术后放疗组/术后同步放化疗组患者的3年DFS明显优于单纯手术组患者(53.8% vs. 36.7%,P=0.020),术后放疗组/术后同步放化疗组患者的3年OS也更好(63.9% vs. 48.0%,P=0.025),结果表明术后放疗/术后同步放化疗(尤其是术后同步放化疗)可显著改善ⅡB~Ⅲ期食管鳞状细胞癌的DFS和OS。一项对比食管鳞癌患者术后放疗与单纯手术利弊的Meta分析[26]显示,与单纯手术相比,术后放疗改善了患者的OS和DFS,并显著降低了局部复发率,且显示出对特定亚组的生存获益,例如术后病理淋巴结阳性、R0切缘和T3分期的患者。相较于开放式手术而言,微创手术能够更广泛地切除纵隔淋巴结,其对术后生存及复发可能有潜在的影响,因此微创术后放疗的价值可能不同于开放手术。目前针对食管癌微创术后放疗价值的研究数据极少,对于食管癌微创术后复发模式的数据也有限。少量关于微创术后复发模式的研究提示似乎远处转移是最常见的失败模式,局部区域复发率并不高。由此推测,似乎术后放疗在MIE患者的综合治疗选择中并非完全必要。未来还需要更大样本量的研究来探讨微创术后放疗的价值及其获益人群。
另外,设计合理的临床靶区对于优化术后放疗十分重要,但目前对于食管癌术后放疗临床靶区的设计尚未达成共识。一些回顾性研究[27-29]表明,锁骨上和上纵隔区域在任何部位的胸段食管癌中复发率都很高,腹部区域在胸下段食管癌中复发率很高,因此建议将锁骨上和上纵隔区域纳入胸段食管癌术后放疗的临床靶区中,对于腹部区域,一些研究则建议胸下段食管癌的照射野应包括腹主动脉旁淋巴结,而上腹部淋巴结不一定必须包括在内[28-29]。有限的关于微创手术长期结果的研究提示似乎微创术后复发模式及各区域复发率并不同于传统开放手术。因此,对于食管癌微创术后放疗临床靶区的设计需要建立在大量对于微创术后复发模式研究的基础之上。同时,管状胃在微创手术的临床应用中处于主导地位,设计术后靶区时也应考虑管状胃的相关问题。对于管状胃的耐受性,Liu等[30]曾对105例患者进行过耐受性及毒性相关因素的分析,结果发现在较高处方剂量水平下(60~63 Gy),2级急性和晚期胃不良反应发生率仅为15.2%和13.3%,3级急性反应发生率为2.9%,无4级不良反应发生,管胃接受50 Gy照射的体积百分比(V50)与不良反应的程度呈显著相关性,因此认为在食管癌的术后放疗中,管状胃对于较高剂量的照射具有良好的耐受性。
术后化疗对食管癌患者带来的获益也未达成共识,尤其对于鳞癌,证据并不充分,对于R0切除术后高危因素者,仅作2B-3类证据Ⅲ级推荐[31-33],腺癌则证据更为充分(1A),对于新辅助治疗后未达病理完全缓解以及未做新辅助治疗,术后病理T3-4a以及N+者,均建议行化疗(Ⅰ级推荐)。化疗方案方面,氟尿嘧啶和顺铂方案已逐渐减少,对于鳞癌,更建议行顺铂+紫杉醇方案,Lyu等[32]研究表明术后以紫杉烷类药物为基础的辅助化疗可以提高淋巴结阳性患者生存率。Zhang等[34]研究表明紫杉醇联合顺铂的双周辅助化疗可能改善淋巴结阳性食管鳞癌患者的3年DFS和OS。病理类型以腺癌为主的MIE研究提示,复发模式以远处转移多见,均达20%以上[13-14, 35],治疗方案上更推荐奥沙利铂+卡培他滨[36],对于接受过新辅助同步放化疗的患者,未达病理完全缓解者,纳武利尤单抗巩固治疗已经成为标准方案[37]。在CheckMate 577[37]研究中,食管癌或胃食管结合部癌新辅助放化疗后分期为ypT+/ypN+的患者随机接受纳武利尤单抗辅助免疫治疗或安慰剂治疗,结果表明,辅助免疫治疗可以改善中位DFS。2022年NCCN和CSCO指南均推荐纳武利尤单抗用于食管癌术后辅助治疗。
对于术后辅助放化疗与辅助放疗孰优孰劣的探讨,Wang等[8]对接受MIE的530例食管鳞癌患者的研究提示,对于病理分期超过T3或N1的患者,接受辅助治疗与单独手术相比具有显著的生存获益和较好的DFS,且只有术后放化疗在改善生存率方面具有显著意义,因此建议局部晚期食管鳞癌患者在MIE后接受辅助放化疗。Ni等[25]对172例ⅡB~Ⅲ期食管鳞癌患者的随机对照研究表明,相较于术后放疗而言,术后同步放化疗尤其能够改善患者的DFS和OS,同时降低远处转移发生率,而不增加野外和腹腔淋巴结复发。由此推测,接受MIE的病期偏晚患者可能会从术后辅助放化疗中获益,未来需要更大样本量的针对接受MIE患者的亚组分析来验证此假设。
总之,食管癌微创术后的辅助治疗适应证尚不明确,未来非常重要的研究方向是探索其术后失败模式、筛选高危复发风险亚组以及高危复发区域,以确定术后放疗、术后化疗、术后放化疗及术后免疫治疗的获益人群,尤其是确定术后放疗的适应证人群及重点照射区域,而对于管胃毒性的限制,则应进一步探讨寻找优效的剂量体积参数及阈值,在最大程度上减少放疗相关损伤的发生。
4 小结与展望在当前技术背景下,MIE已成为食管癌推荐术式之一并在分期较早患者中广泛应用,已有较充分数据显示MIE相较于开放手术在减少手术创伤、减少术后恢复时间、减少术后并发症尤其是呼吸系统并发症方面具有确切优势,并且具有非劣效于开放手术的长期生存结果。尽管关于MIE后的复发率及复发模式研究数据相对较少,但基于现有研究,食管癌微创术后远处转移率仍达20%以上,局部区域性复发率多数研究报道在10%~20%之间,筛选高危复发风险人群及高危复发区域,探索术后放疗的可能获益人群,优化照射区域及剂量体积参数将是未来的研究方向之一。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
程如田:文献收集、分析及撰写论文
梁健、王琪、陈晓希、刘树堂:文献收集、分析并提供指导性支持
王澜、韩春:文章构思、论文修改并提供指导性支持
| [1] |
Kang J, Chang JY, Sun X, et al. Role of Postoperative Concurrent Chemoradiotherapy for Esophageal Carcinoma: A meta-analysis of 2165 Patients[J]. J Cancer, 2018, 9(3): 584-593. DOI:10.7150/jca.20940 |
| [2] |
Yu S, Zhang W, Ni W, et al. A propensity-score matching analysis comparing long-term survival of surgery alone and postoperative treatment for patients in node positive or stage Ⅲ esophageal squamous cell carcinoma after R0 esophagectomy[J]. Radiother Oncol, 2019, 140: 159-166. DOI:10.1016/j.radonc.2019.06.020 |
| [3] |
Wang Q, Wu Z, Zhan T, et al. Comparison of minimally invasive Ivor Lewis esophagectomy and left transthoracic esophagectomy in esophageal squamous cell carcinoma patients: a propensity score-matched analysis[J]. BMC Cancer, 2019, 19(1): 500. DOI:10.1186/s12885-019-5656-7 |
| [4] |
Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial[J]. Lancet, 2012, 379(9829): 1887-1892. DOI:10.1016/S0140-6736(12)60516-9 |
| [5] |
Mariette C, Markar SR, Dabakuyo-Yonli TS, et al. Hybrid Minimally Invasive Esophagectomy for Esophageal Cancer[J]. N Engl J Med, 2019, 380(2): 152-162. DOI:10.1056/NEJMoa1805101 |
| [6] |
Hoshino A, Nakajima Y, Kawada K, et al. The Impact of Hybrid Minimally Invasive Esophagectomy with Neck-Abdominal First Approach on the Short- and Long-Term Outcomes for Esophageal Squamous Cell Carcinoma[J]. World J Surg, 2020, 44(11): 3829-3836. DOI:10.1007/s00268-020-05655-3 |
| [7] |
Straatman J, van der Wielen N, Cuesta MA, et al. Minimally Invasive Versus Open Esophageal Resection: Three-year Follow-up of the Previously Reported Randomized Controlled Trial: the TIME Trial[J]. Ann Surg, 2017, 266(2): 232-236. DOI:10.1097/SLA.0000000000002171 |
| [8] |
Wang Q, Wu ZX, Zhan TW, et al. Long-term outcomes of 530 esophageal squamous cell carcinoma patients with minimally invasive Ivor Lewis esophagectomy[J]. J Surg Oncol, 2018, 117(5): 957-969. DOI:10.1002/jso.24997 |
| [9] |
Ichikawa H, Miyata G, Miyazaki S, et al. Esophagectomy using a thoracoscopic approach with an open laparotomic or hand-assisted laparoscopic abdominal stage for esophageal cancer: analysis of survival and prognostic factors in 315 patients[J]. Ann Surg, 2013, 257(5): 873-885. DOI:10.1097/SLA.0b013e31826c87cd |
| [10] |
Markar SR, Lagergren J. Surgical and Surgeon-Related Factors Related to Long-Term Survival in Esophageal Cancer: A Review[J]. Ann Surg Oncol, 2020, 27(3): 718-723. DOI:10.1245/s10434-019-07966-9 |
| [11] |
Yang Y, Zhang X, Li B, et al. Short- and mid-term outcomes of robotic versus thoraco-laparoscopic McKeown esophagectomy for squamous cell esophageal cancer: a propensity score-matched study[J]. Dis Esophagus, 2020, 33(6): doz080. DOI:10.1093/dote/doz080 |
| [12] |
Hosogi H, Yagi D, Sakaguchi M, et al. Upper mediastinal lymph node dissection based on mesenteric excision in esophageal cancer surgery: confirmation by near-infrared image-guided lymphatic mapping and the impact on locoregional control[J]. Esophagus, 2021, 18(2): 219-227. DOI:10.1007/s10388-020-00789-8 |
| [13] |
Thomson IG, Smithers BM, Gotley DC, et al. Thoracoscopic-assisted esophagectomy for esophageal cancer: analysis of patterns and prognostic factors for recurrence[J]. Ann Surg, 2010, 252(2): 281-291. DOI:10.1097/SLA.0b013e3181e909a2 |
| [14] |
Nuytens F, Dabakuyo-Yonli TS, Meunier B, et al. Five-Year Survival Outcomes of Hybrid Minimally Invasive Esophagectomy in Esophageal Cancer: Results of the MIRO Randomized Clinical Trial[J]. JAMA Surg, 2021, 156(4): 323-332. DOI:10.1001/jamasurg.2020.7081 |
| [15] |
Ninomiya I, Okamoto K, Tsukada T, et al. Recurrence patterns and risk factors following thoracoscopic esophagectomy with radical lymph node dissection for thoracic esophageal squamous cell carcinoma[J]. Mol Clin Oncol, 2016, 4(2): 278-284. DOI:10.3892/mco.2015.688 |
| [16] |
Sugimura K, Miyata H, Kanemura T, et al. Patterns of Recurrence and Long-Term Survival of Minimally Invasive Esophagectomy Versus Open Esophagectomy for Locally Advanced Esophageal Cancer Treated with Neoadjuvant Chemotherapy: a Propensity Score-Matched Analysis[J]. J Gastrointest Surg, 2023, 27(6): 1055-1065. DOI:10.1007/s11605-023-05615-x |
| [17] |
Tang H, Wang H, Fang Y, et al. Neoadjuvant chemoradiotherapy versus neoadjuvant chemotherapy followed by minimally invasive esophagectomy for locally advanced esophageal squamous cell carcinoma: a prospective multicenter randomized clinical trial[J]. Ann Oncol, 2023, 34(2): 163-172. DOI:10.1016/j.annonc.2022.10.508 |
| [18] |
Kitagawa H, Yokota K, Utsunomiya M, et al. A descriptive comparison of postoperative outcomes between hybrid mediastino-thoracoscopic approach and conventional thoracoscopic esophagectomy for esophageal cancer[J]. Surg Endosc, 2023, 37(4): 2949-2957. DOI:10.1007/s00464-022-09818-2 |
| [19] |
Zhang T, Hou X, Li Y, et al. Effectiveness and safety of minimally invasive Ivor Lewis and McKeown oesophagectomy in Chinese patients with stage ⅠA-ⅢB oesophageal squamous cell cancer: a multicentre, non-interventional and observational study[J]. Interact Cardiovas Thorac Surg, 2020, 30(6): 812-819. DOI:10.1093/icvts/ivaa038 |
| [20] |
Hsu PK, Huang CS, Wu YC, et al. Open versus thoracoscopic esophagectomy in patients with esophageal squamous cell carcinoma[J]. World J Surg, 2014, 38(2): 402-409. DOI:10.1007/s00268-013-2265-5 |
| [21] |
Yamashita K, Watanabe M, Mine S, et al. Minimally invasive esophagectomy attenuates the postoperative inflammatory response and improves survival compared with open esophagectomy in patients with esophageal cancer: a propensity score matched analysis[J]. Surg Endosc, 2018, 32(11): 4443-4450. DOI:10.1007/s00464-018-6187-z |
| [22] |
Coelho FDS, Barros DE, Santos FA, et al. Minimally invasive esophagectomy versus open esophagectomy: A systematic review and meta-analysis[J]. Eur J Surg Oncol, 2021, 47(11): 2742-2748. DOI:10.1016/j.ejso.2021.06.012 |
| [23] |
Gao Y, Kang M, Niu L, et al. The effects of radiotherapy after thoracic and laparoscopic surgery on patients with esophageal cancer and on their prognoses[J]. Am J Transl Res, 2021, 13(6): 6446-6456. |
| [24] |
Yang J, Zhang W, Xiao Z, et al. The Impact of Postoperative Conformal Radiotherapy after Radical Surgery on Survival and Recurrence in Pathologic T3N0M0 Esophageal Carcinoma: A Propensity Score-Matched Analysis[J]. J Thorac Oncol, 2017, 12(7): 1143-1151. DOI:10.1016/j.jtho.2017.03.024 |
| [25] |
Ni W, Yu S, Xiao Z, et al. Postoperative Adjuvant Therapy Versus Surgery Alone for Stage ⅡB-Ⅲ Esophageal Squamous Cell Carcinoma: A Phase Ⅲ Randomized Controlled Trial[J]. Oncologist, 2021, 26(12): e2151-e2160. DOI:10.1002/onco.13914 |
| [26] |
Lin HN, Chen LQ, Shang QX, et al. A meta-analysis on surgery with or without postoperative radiotherapy to treat squamous cell esophageal carcinoma[J]. Int J Surg, 2020, 80: 184-191. DOI:10.1016/j.ijsu.2020.06.046 |
| [27] |
Wang Y, Wang F. Postoperative Radiotherapy for Thoracic Esophageal Carcinoma with Upfront R0 Esophagectomy[J]. Cancer Manag Res, 2020, 12: 13023-13032. DOI:10.2147/CMAR.S286074 |
| [28] |
Zhang X, Yang X, Ni J, et al. Recommendation for the definition of postoperative radiotherapy target volume based on a pooled analysis of patterns of failure after radical surgery among patients with thoracic esophageal squamous cell carcinoma[J]. Radiat Oncol, 2018, 13(1): 255. DOI:10.1186/s13014-018-1199-3 |
| [29] |
Wang Y, Ye D, Kang M, et al. Risk Factors and Patterns of Abdominal Lymph Node Recurrence After Radical Surgery for Locally Advanced Thoracic Esophageal Squamous Cell Cancer[J]. Cancer Manag Res, 2020, 12: 3959-3969. DOI:10.2147/CMAR.S249810 |
| [30] |
Liu Q, Cai XW, Fu XL, et al. Tolerance and dose-volume relationship of intrathoracic stomach irradiation after esophagectomy for patients with thoracic esophageal squamous cell carcinoma[J]. Oncotarget, 2015, 6(31): 32220-32227. DOI:10.18632/oncotarget.4730 |
| [31] |
Feng SK, Liu XB, Xing WQ, et al. Adjuvant Chemotherapy for Node-positive Esophageal Squamous Cell Carcinoma Improves Survival[J]. Ann Thorac Surg, 2022, 114(4): 1205-1213. DOI:10.1016/j.athoracsur.2021.08.068 |
| [32] |
Lyu X, Huang J, Mao Y, et al. Adjuvant chemotherapy after esophagectomy: is there a role in the treatment of the lymph node positive thoracic esophageal squamous cell carcinoma?[J]. J Surg Oncol, 2014, 110(7): 864-868. DOI:10.1002/jso.23716 |
| [33] |
Lin JW, Li C, Yeh HL, et al. Adjuvant Chemotherapy for Pathological Node-Positive Disease in Squamous Cell Carcinoma of the Esophagus after Neoadjuvant Chemoradiotherapy Plus Surgery[J]. J Pers Med, 2022, 12(8): 1252. DOI:10.3390/jpm12081252 |
| [34] |
Zhang L, Li W, Lyu X, et al. Adjuvant chemotherapy with paclitaxel and cisplatin in lymph node-positive thoracic esophageal squamous cell carcinoma[J]. Chin J Cancer Res, 2017, 29(2): 149-155. DOI:10.21147/j.issn.1000-9604.2017.02.08 |
| [35] |
Zahoor H, Luketich JD, Levy RM, et al. A propensity-matched analysis comparing survival after primary minimally invasive esophagectomy followed by adjuvant therapy to neoadjuvant therapy for esophagogastric adenocarcinoma[J]. J Thorac Cardiovasc Surg, 2015, 149(2): 538-547. DOI:10.1016/j.jtcvs.2014.10.044 |
| [36] |
Noh SH, Park SR, Yang HK, et al. Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(12): 1389-1396. DOI:10.1016/S1470-2045(14)70473-5 |
| [37] |
Kelly RJ, Ajani JA, Kuzdzal J, et al. Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer[J]. N Engl J Med, 2021, 384(13): 1191-1203. DOI:10.1056/NEJMoa2032125 |
 2023, Vol. 50
2023, Vol. 50