文章信息
- CircPVT1在肿瘤中的调控作用研究进展
- Research Progress on Regulatory Role of CircPVT1 in Tumors
- 肿瘤防治研究, 2023, 50(9): 913-918
- Cancer Research on Prevention and Treatment, 2023, 50(9): 913-918
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0161
- 收稿日期: 2023-02-22
- 修回日期: 2023-05-09
2. 999077 香港, 香港大学李嘉诚医学院临床医学院病理学系;
3. 361000 厦门, 厦门医学院机能与临床转化福建省高校重点实验室;
4. 224007 盐城, 盐城师范学院江苏省肿瘤靶向纳米诊疗材料工程研究中心;
5. 150086 哈尔滨, 哈尔滨医科大学心肌缺血教育部重点实验室
2. Department of Pathology, School of Clinical Medicine, Li Ka Shing Faculty of Medicine, The University of Hong Kong, Hong Kong 999077, China;
3. Key Laboratory of Functional and Clinical Translational Medicine, Fujian Province University, Xiamen Medical College, Xiamen 361000, China;
4. Jiangsu Province Engineering Research Center of Tumor Targeted Nano Diagnostic and Therapeutic Materials, Yancheng Teachers University, Yancheng 224007, China;
5. Key Laboratory of Myocardial Ischemia, Ministry of Education, Harbin Medical University, Harbin 150086, China
环状RNA(circular RNA, circRNA)是一类在真核生物中广泛存在的具有共价封闭环结构的非编码RNA(non-coding RNA, ncRNA)分子,近年来在RNA研究领域广受关注;现有研究表明circRNA是通过共转录的方式产生的,并且可通过与线性剪接竞争来调控基因表达[1-2]。此外,circRNA没有5’帽子结构和3’多聚腺苷酸尾,其固有的闭环结构使其变得尤为稳定,从而能耐受RNA核酸外切酶的降解[3]。既往研究证实,circRNA可通过作为竞争性内源RNA(competing endogenous RNA, ceRNA)沉默相关miRNA、调控转录本可变剪接、调控亲本基因的表达、与RNA结合蛋白相互作用及翻译产生多肽等多种方式发挥其生物学功能[4-6]。另外,circRNA被发现于多种恶性肿瘤细胞中明显异常表达,并参与介导了肿瘤的发生发展过程[7-10]。
环状RNA浆细胞瘤变体易位1(circRNA plasmacytoma variant translocation 1, circPVT1)基因是circRNA家族中的一员,现有研究发现其在多种恶性肿瘤中表达异常上调,并能发挥促癌作用。因此,本文就circPVT1在肿瘤中的调控作用研究作一综述。
1 circPVT1概述circPVT1基因定位于人体8号染色体长臂2区4带(8q24),该区域含有癌症易感基因位点,circPVT1是由PVT1基因的3号外显子环化而成,该外显子拥有两个包含诸多Alu重复序列的长内含子侧翼(35 269 bp和41 466 bp),circPVT1(hsa_circ_0001821)长410 nt[11-12]。曾经circPVT1被认为是一种与衰老有关的环状RNA,可通过与miR-let-7家族靶向结合而参与调控成纤维细胞的增殖与衰老[12]。现有研究证实,circPVT1在食管癌、肺癌、肝癌、乳腺癌等多种恶性肿瘤中异常高表达,且表达上调的circPVT1能促进肿瘤细胞的增殖、侵袭及转移等多种恶性生物学行为,而沉默circPVT1则能抑制相关肿瘤的发生发展。因此,circPVT1未来有望成为肿瘤潜在的治疗靶点及早期诊断、预后评估的生物标志物。
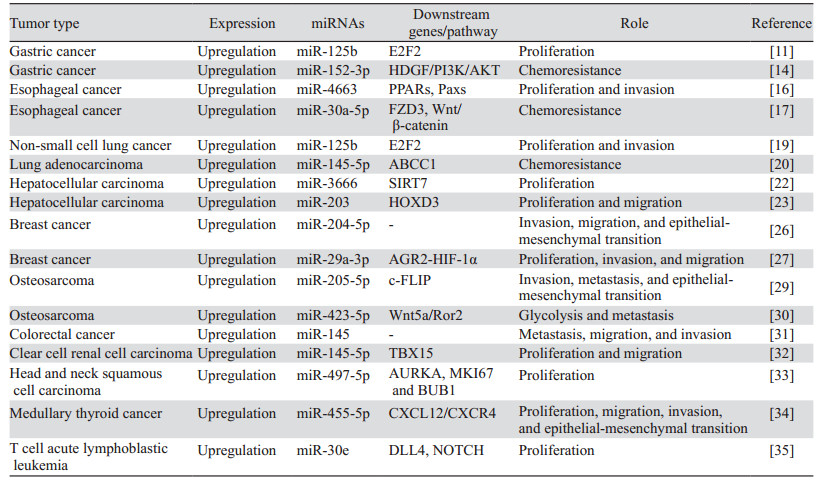
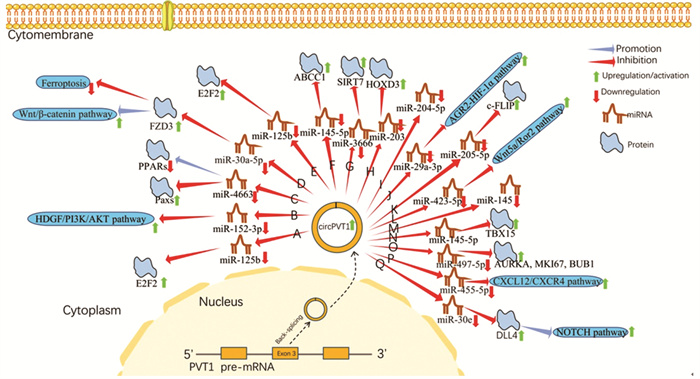
2 circPVT1与肿瘤 2.1 circPVT1与胃癌胃癌是全世界最常见的恶性肿瘤之一,同时也是癌症相关死亡的第四大原因[13]。Chen等[11]首次在胃癌组织中发现并命名了circPVT1,该研究团队对187例胃癌组织和相应癌旁组织进行实时定量聚合酶链式反应(qRT-PCR)分析,结果显示,胃癌组织中circPVT1的表达水平明显高于癌旁组织,且表达上调的circPVT1能与miR-125b靶向结合而促进后者下游靶点E2F2的表达,见图 1A,进而促进胃癌细胞增殖。利用siRNA沉默AGS和MGC-803细胞中circPVT1表达后,E2F2的表达明显下调,肿瘤细胞的增殖能力也受到抑制。此外,在对AGS和MGC-803细胞的细胞核及细胞质RNA进行分析后,该研究团队发现circPVT1优先定位于细胞质。进一步研究发现circPVT1在胃癌组织中经常表达上调的原因之一是DNA扩增。值得深入思考的是,该团队经研究发现胃癌细胞中circPVT1的表达量与神经浸润水平呈负相关。以上结果表明circPVT1有助于胃癌的发生发展,将来有可能在胃癌的治疗中起到重要作用。
|
| 图 1 circPVT1调控肿瘤发生发展的机制 Figure 1 Regulatory mechanisms of circPVT1 in tumorigenesis and progression |
Wang等[14]研究证实,对顺铂耐药的胃癌组织和细胞系(AGS/DDP和HGC-27/DDP)中circPVT1表达异常上调,且高表达的circPVT1能与HDGF/PI3K/AKT通路的调节因子miR-152-3p结合并抑制其活性,进而激活HDGF/PI3K/AKT通路并上调通路相关蛋白的表达,见图 1B,调控肿瘤细胞的顺铂耐药性。后续研究发现顺铂治疗效果与淋巴结转移和TNM分期有关。体内及体外细胞实验结果表明,使用shRNA外源性下调顺铂耐药的胃癌细胞中circPVT1和HDGF的表达均可提高肿瘤细胞对顺铂的敏感度,肿瘤细胞的活力及增殖能力亦受到抑制,并且流式细胞仪检测显示发生凋亡的肿瘤细胞明显增多。以上研究结果提示circPVT1未来有望成为胃癌治疗的潜在靶点。
2.2 circPVT1与食管癌食管癌是具有高度侵袭性的恶性肿瘤,其预后不良且死亡率较高,在食管癌中,鳞癌和腺癌占比达95%以上[15]。Zhong等[16]对20例食管癌组织及相应癌旁组织采用qRT-PCR定量分析结果显示,食管癌组织中的circPVT1表达显著上调,并且异常高表达的circPVT1与患者预后不良有关。利用特异性siRNA外源性沉默食管癌TE-10细胞中circPVT1的表达后,TE-10细胞的增殖及侵袭能力明显下降,并且Hoechst染色法检测发现更多的肿瘤细胞发生凋亡。机制上,miR-4663是circPVT1在食管癌细胞中的一个作用靶点,过表达的circ-PVT1通过靶向吸附miR-4663并抑制其功能,进而促使PPARs表达下调,并促使Paxs表达上调,见图 1C,从而影响肿瘤的恶性生物学行为。综上所述,circPVT1在食管癌中发挥着重要作用,有可能成为食管癌诊断的生物标志物,并为寻求新的干预治疗靶点提供思路。
Yao等[17]研究发现,对5-氟尿嘧啶(5-Fu)耐药的食管鳞状细胞癌细胞(EC9706/5-Fu和KYSE70/5-Fu)内表达显著上调的circPVT1通过竞争性结合MiR-30a-5p并促进后者下游靶点FZD3的表达,进而调节铁死亡并激活Wnt/β-catenin通路,见图 1D,从而抑制肿瘤细胞对5-Fu的化疗敏感度。通过转染shRNA特异性下调肿瘤细胞中circPVT1的表达能进一步下调p-β-catenin、SLC7A11、GPX4和FZD3的表达,诱导铁死亡,并提高肿瘤细胞对5-Fu的化疗敏感度。上述研究结果表明circPVT1有潜力成为食管鳞状细胞癌治疗新靶点。
2.3 circPVT1与肺癌肺癌居人类癌症死因之首,确诊晚、治疗方法有限、耐药等原因使其难以根治,成为临床上亟待攻克的科学难题[18]。Li等[19]利用qRT-PCR方法对68例非小细胞肺癌组织及相应癌旁组织的定量检测结果显示,相较于癌旁组织,非小细胞肺癌组织中circPVT1表达异常上调。转染siRNA下调非小细胞肺癌细胞(A549和H292)中circPVT1表达后,肿瘤细胞的增殖及侵袭能力受到明显抑制,细胞周期也停滞于G0/G1期。该研究团队还通过生物信息学分析、RNA免疫沉淀及荧光素酶报告基因检测法证实了转录因子c-Fos与circPVT1启动子区域结合并可能促进circPVT1在非小细胞肺癌组织中的表达。进一步研究发现过表达的circPVT1可作为ceRNA吸附miR-125b进而促进后者下游靶基因E2F2的表达而发挥促癌作用,见图 1E。另外,对68例原发肺癌组织进行的临床病理因素相关性分析结果提示,circPVT1的表达水平与远处转移呈正相关,而与年龄、性别、TNM分期、肿瘤大小、组织学分级等因素却没有明显关系。综上所述,circPVT1有潜能成为非小细胞肺癌诊断的生物标志物及治疗的靶点,并可能对制订新的治疗策略具有指导意义。
Zheng等[20]研究发现,对顺铂和培美曲塞耐药的肺腺癌组织和细胞系(A549/DR)中circPVT1的表达明显上调,而且表达异常上调的circPVT1能通过海绵效应吸附miR-145-5p进而阻断后者与其下游靶点ABCC1的结合,进一步正向调控ABCC1的表达,见图 1F,最终促使A549/DR细胞对顺铂和培美曲塞的耐药性增强。外源性沉默A549/DR细胞中circPVT1的表达后,A549/DR细胞对顺铂和培美曲塞的敏感性明显提高。该研究还指出,circPVT1的表达水平与肺腺癌患者的N分期及化疗(顺铂和培美曲塞)耐药密切相关,而且高表达circPVT1的肺腺癌患者的5年生存率明显低于低表达组。因此,circPVT1可作为肺腺癌患者预后的独立判断因素。
2.4 circPVT1与肝癌肝癌是全球最常见的致命性恶性肿瘤之一,其在确诊时通常已处于晚期,导致其预后不佳[21]。Li等[22]研究发现circPVT1在肝癌肿瘤组织中表达显著上调。转染shRNA外源性下调肝癌细胞中circPVT1表达后,肝癌细胞的生长和集落形成能力明显减弱,并且发生凋亡的肿瘤细胞占比显著增高。机制研究结果表明,表达上调的circPVT1能作为ceRNA靶向结合miR-3666,进而促进后者下游靶基因SIRT7的表达,从而发挥促癌作用,见图 1G。此外,敲低circPVT1的表达对肝癌细胞恶性生物学行为的抑制作用可被SIRT7过表达或下调miR-3666表达部分逆转。综上,circPVT1作为一种新近发现的环状RNA,很有可能成为肝癌治疗的潜在靶点。
Zhu等[23]采用qRT-PCR定量检测证实肝癌组织中circPVT1异常高表达,而表达上调的circPVT1与患者总体生存率、淋巴结转移及TNM分期显著相关。此外,细胞周期分析结果显示,高表达的circPVT1能提高S期细胞的比例。进一步研究表明,高表达的circPVT1可以直接与miR-203结合并抑制其功能,进而减弱miR-203对其下游促癌基因HOXD3的抑制效应,从而促进HOXD3的表达,最终增强肝癌细胞的增殖和迁移能力,见图 1H。以上研究结果提示,circPVT1在肝癌的发生发展过程中扮演着重要角色,并且有希望成为肝癌潜在的治疗干预靶点及未来诊断肝癌的标志性分子。
2.5 circPVT1与乳腺癌乳腺癌居女性癌症相关死因第二位,近年来其发病率和死亡率呈上升趋势,早期诊断对乳腺癌的治疗尤为重要[24-25]。Bian等[26]对99例乳腺癌肿瘤组织及相应癌旁组织采用qRT-PCR定量检测结果显示,相较于癌旁组织,乳腺癌组织中circPVT1表达显著上调。机制研究发现circPVT1能作为竞争性内源RNA与miR-204-5p结合而诱导乳腺癌肿瘤细胞的上皮-间充质转化(epithelial-mesenchymal transition,EMT)并促进肿瘤细胞侵袭及迁移,见图 1I。外源性沉默乳腺癌细胞中circPVT1的表达后,肿瘤细胞的增殖和集落形成能力明显受到抑制,细胞凋亡显著加速。此外,该团队经进一步研究发现乳腺癌组织中circPVT1高表达与TNM分期较高密切相关,并且Kaplan-Meier生存曲线分析结果显示过表达circPVT1的乳腺癌患者的总生存期明显低于低表达组。综上,circPVT1有希望成为乳腺癌诊断和预后判断的生物标志物及治疗新靶点。
Wang等[27]通过qRT-PCR检测方法对40例乳腺癌组织及相应癌旁组织进行定量分析证实,乳腺癌组织中circPVT1的表达明显高于癌旁组织。该团队通过进一步分析发现,circPVT1的表达水平与肿瘤大小及淋巴结转移显著相关,而且高表达circPVT1的乳腺癌患者的总生存时间更短。其可能的机制是,表达上调的circPVT1通过靶向吸附miR-29a-3p进而激活后者介导的AGR2-HIF-1α信号转导通路并促进通路相关蛋白AGR2与HIF-1α的表达,见图 1J,最终提高乳腺癌细胞的增殖、迁移及侵袭能力。值得注意的是,AGR2是miR-29a-3p的作用靶点,并且表达上调的AGR2可进一步促进HIF-1α表达。此外,利用shRNA外源性下调circPVT1表达后,乳腺癌细胞的恶性生物学行为明显受到抑制。综上所述,circPVT1将来有可能为乳腺癌治疗提供新的靶点并作为评估预后的分子标志物。
2.6 circPVT1与骨肉瘤骨肉瘤是一种好发于青少年及儿童的原发性骨肿瘤,具有高度侵袭性、易转移、异质性强等特点,尽管采用手术和化疗相结合的治疗方案,其预后仍较差[28]。Liu[29]等对25例骨肉瘤组织和细胞系(MG63、U2OS、Saos-2和SW1353)进行qRT-PCR定量检测发现,骨肉瘤组织及细胞系中circPVT1的表达较正常骨组织显著上调。转染特异siRNA沉默MG63和U2OS细胞内circPVT1表达后,MG63和U2OS细胞的侵袭转移能力明显减弱。对其机制进一步研究发现,高表达的circPVT1能竞争性结合miR-205-5p而间接上调后者的下游靶点c-FLIP表达,进而促进骨肉瘤肿瘤细胞EMT并诱导肿瘤细胞侵袭及转移,见图 1K。此外,该研究指出上调c-FLIP表达或者下调miR-205-5p表达可以消除沉默circPVT1对骨肉瘤肿瘤细胞恶性生物学行为的影响。这提示我们circPVT1有望为骨肉瘤临床治疗提供新的干预治疗靶点。
Wan等[30]对36例骨肉瘤患者临床样本进行的qRT-PCR定量检测结果显示,circPVT1在骨肉瘤肿瘤组织中表达异常上调。裸鼠异种移植瘤实验结果表明circPVT1的表达水平与肿瘤肺转移密切相关,而且Kaplan-Meier生存率分析显示高表达circPVT1的骨肉瘤患者的生存率显著低于低表达者。下调HOS和U2OS细胞中circPVT1的表达后,HOS和U2OS细胞内Wnt5a和Ror2的表达水平均明显下调,并且肿瘤细胞的糖酵解及转移能力明显受到抑制。进一步研究发现circPVT1可作为ceRNA吸附miR-423-5p进而激活下游Wnt5a/Ror2信号转导通路并上调包括Wnt5a和Ror2在内的通路相关蛋白的表达,见图 1L,从而促进骨肉瘤细胞的糖酵解及转移能力。值得注意的是,该研究团队通过双荧光素酶报告测定证实了Wnt5a和Ror2 mRNA的3′非编码区(3‘-UTR)是miR-423-5p发挥作用的重要靶点。以上研究结果表明circPVT1促进了骨肉瘤的发生发展并与预后有关,有潜力成为骨肉瘤治疗的新靶点及预后判断的生物标志物。
2.7 circPVT1与其他肿瘤Wang等[31]研究发现在结直肠癌肿瘤组织中circPVT1表达异常上调。并且该团队经研究证实circPVT1的表达水平与临床分期、淋巴结转移和肝转移显著相关,而且高表达circPVT1的结直肠癌患者生存率更低。此外,该团队通过在线预测及机制研究进一步证实了circPVT1可通过MRE这一应答元件靶向结合miR-145并抑制其功能,见图 1M,进而促进结直肠癌肿瘤细胞迁移、侵袭及转移。Zheng等[32]经研究证实,在肾透明细胞癌组织中明显表达上调的circPVT1能竞争性结合miR-145-5p并促进后者的下游靶基因TBX15的表达,进而促进肾透明细胞癌细胞增殖及转移,见图 1N。值得注意的是,该团队经深入研究发现circPVT1的表达水平与肾透明细胞癌的TNM分期呈明显正相关,却与年龄性别无相关性。Verduci等[33]发现mut-p53/YAP/TEAD复合体可以在转录水平上促进头颈鳞状细胞癌组织中circPVT1的表达,而表达上调的circPVT1能通过靶向结合miR-497-5p进而促进下游细胞增殖相关蛋白(AURKA, MKI67和BUB1)的表达,从而促进肿瘤细胞增殖,见图 1O。此外,该团队经多变量分析证实circPVT1过表达与总体存活率降低有关,而且此相关性依赖于TP53突变。另外,细胞周期分析结果表明下调CAL-27细胞中mut-p53表达会促使细胞周期停滞在G1期而抑制细胞生长。Zheng等[34]研究发现circPVT1在甲状腺髓样癌组织中异常高表达,而且circPVT1的表达水平与肿瘤肺转移关系密切。进一步研究其机制发现,表达上调的circPVT1能通过海绵效应吸附miR-455-5p而减弱后者对CXCL12/CXCR4信号通路的抑制作用,进而激活CXCL12/CXCR4信号通路并促进通路相关蛋白的表达,从而提高甲状腺髓样癌肿瘤细胞的EMT、增殖、迁移及侵袭能力,见图 1P。Jia等[35]研究发现T细胞急性淋巴细胞白血病患者的骨髓和细胞系(Jurkat、Molt4和CCRF-CEM)中过表达的circPVT1通过内源性竞争吸附miR-30e而促进后者下游靶基因DLL4的表达,进而诱导激活NOTCH信号通路,最终促进细胞增殖并抑制凋亡,见图 1Q。此外,该团队还发现circPVT1过表达常预示预后不良,与患者累积复发率较高和5年生存率较低显著相关。circPVT1在肿瘤中的功能特点见表 1。
随着研究的不断深入,circPVT1在不同肿瘤中发挥作用的机制逐渐被揭示。circPVT1在多数肿瘤中异常高表达,并且在肿瘤的发生发展中扮演着重要角色,例如其在食管癌、肺癌、肝癌、乳腺癌、胃癌等多种肿瘤中均能发挥促癌作用。circPVT1已经成为分子生物学研究的热点,其在肿瘤中的表达情况及更复杂更具体的调控机制仍有待进一步探究。相信,随着研究技术的不断进步,circPVT1作为潜在的干预治疗靶点有望应用于临床并为肿瘤的诊治带来突破性进展。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
鲍浩霖:查阅文献及撰写论文
黄子越、李杰瀚、梁子鑫、林宁、倪春节、崔云甫:指导论文撰写
余良:论文修改
徐艺:论文选题及思路设计
| [1] |
Mo D, Li X, Raabe CA, et al. A universal approach to investigate circRNA protein coding function[J]. Sci Rep, 2019, 9(1): 11684. DOI:10.1038/s41598-019-48224-y |
| [2] |
Ashwal-Fluss R, Meyer M, Pamudurti NR, et al. circRNA biogenesis competes with pre-mRNA splicing[J]. Mol Cell, 2014, 56(1): 55-66. DOI:10.1016/j.molcel.2014.08.019 |
| [3] |
Barrett SP, Salzman J. Circular RNAs: analysis, expression and potential functions[J]. Development, 2016, 143(11): 1838-1847. DOI:10.1242/dev.128074 |
| [4] |
Li X, Yang L, Chen LL. The Biogenesis, Functions, and Challenges of Circular RNAs[J]. Mol Cell, 2018, 71(3): 428-442. DOI:10.1016/j.molcel.2018.06.034 |
| [5] |
Wilusz JE. A 360° view of circular RNAs: From biogenesis to functions[J]. Wiley Interdiscip Rev RNA, 2018, 9(4): e1478. DOI:10.1002/wrna.1478 |
| [6] |
Shi Y, Jia X, Xu J. The new function of circRNA: translation[J]. Clin Transl Oncol, 2020, 22(12): 2162-2169. DOI:10.1007/s12094-020-02371-1 |
| [7] |
Kristensen LS, Jakobsen T, Hager H, et al. The emerging roles of circRNAs in cancer and oncology[J]. Nat Rev Clin Oncol, 2022, 19(3): 188-206. DOI:10.1038/s41571-021-00585-y |
| [8] |
Xue C, Li G, Zheng Q, et al. The functional roles of the circRNA/Wnt axis in cancer[J]. Mol Cancer, 2022, 21(1): 108. DOI:10.1186/s12943-022-01582-0 |
| [9] |
Yang F, Liu Y, Xiao J, et al. Circ-CTNNB1 drives aerobic glycolysis and osteosarcoma progression via m6A modification through interacting with RBM15[J]. Cell Prolif, 2023, 56(1): e13344. DOI:10.1111/cpr.13344 |
| [10] |
Chen Q, Wang H, Li Z, et al. Circular RNA ACTN4 promotes intrahepatic cholangiocarcinoma progression by recruiting YBX1 to initiate FZD7 transcription[J]. J Hepatol, 2022, 76(1): 135-147. DOI:10.1016/j.jhep.2021.08.027 |
| [11] |
Chen J, Li Y, Zheng Q, et al. Circular RNA profile identifies circPVT1 as a proliferative factor and prognostic marker in gastric cancer[J]. Cancer Lett, 2017, 388: 208-219. DOI:10.1016/j.canlet.2016.12.006 |
| [12] |
Panda AC, Grammatikakis I, Kim KM, et al. Identification of senescence-associated circular RNAs (SAC-RNAs) reveals senescence suppressor CircPVT1[J]. Nucleic Acids Res, 2017, 45(7): 4021-4035. DOI:10.1093/nar/gkw1201 |
| [13] |
Machlowska J, Baj J, Sitarz M, et al. Gastric Cancer: Epidemiology, Risk Factors, Classification, Genomic Characteristics and Treatment Strategies[J]. Int J Mol Sci, 2020, 21(11): 4012. DOI:10.3390/ijms21114012 |
| [14] |
Wang X, Zhang Y, Li W, et al. Knockdown of circRNA PVT1 Elevates Gastric Cancer Cisplatin Sensitivity via Sponging miR-152-3p[J]. J Surg Res, 2021, 261: 185-195. DOI:10.1016/j.jss.2020.12.013 |
| [15] |
Short MW, Burgers KG, Fry VT. Esophageal Cancer[J]. Am Fam Physician, 2017, 95(1): 22-28. |
| [16] |
Zhong R, Chen Z, Mo T, et al. Potential Role of circPVT1 as a proliferative factor and treatment target in esophageal carcinoma[J]. Cancer Cell Int, 2019, 19: 267. DOI:10.1186/s12935-019-0985-9 |
| [17] |
Yao W, Wang J, Meng F, et al. Circular RNA CircPVT1 Inhibits 5-Fluorouracil Chemosensitivity by Regulating Ferroptosis Through MiR-30a-5p/FZD3 Axis in Esophageal Cancer Cells[J]. Front Oncol, 2021, 11: 780938. DOI:10.3389/fonc.2021.780938 |
| [18] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [19] |
Li X, Zhang Z, Jiang H, et al. Circular RNA circPVT1 Promotes Proliferation and Invasion Through Sponging miR-125b and Activating E2F2 Signaling in Non-Small Cell Lung Cancer[J]. Cell Physiol Biochem, 2018, 51(5): 2324-2340. DOI:10.1159/000495876 |
| [20] |
Zheng F, Xu R. CircPVT1 contributes to chemotherapy resistance of lung adenocarcinoma through miR-145-5p/ABCC1 axis[J]. Biomed Pharmacother, 2020, 124: 109828. DOI:10.1016/j.biopha.2020.109828 |
| [21] |
Anwanwan D, Singh SK, Singh S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochim Biophys Acta Rev Cancer, 2020, 1873(1): 188314. DOI:10.1016/j.bbcan.2019.188314 |
| [22] |
Li Y, Shi H, Yuan J, et al. Downregulation of circular RNA circPVT1 restricts cell growth of hepatocellular carcinoma through downregulation of Sirtuin 7 via microRNA-3666[J]. Clin Exp Pharmacol Physiol, 2020, 47(7): 1291-1300. DOI:10.1111/1440-1681.13273 |
| [23] |
Zhu Y, Liu Y, Xiao B, et al. The circular RNA PVT1/miR-203/HOXD3 pathway promotes the progression of human hepatocellular carcinoma[J]. Biol Open, 2019, 8(9): bio043687. |
| [24] |
Jafari SH, Saadatpour Z, Salmaninejad A, et al. Breast cancer diagnosis: Imaging techniques and biochemical markers[J]. J Cell Physiol, 2018, 233(7): 5200-5213. DOI:10.1002/jcp.26379 |
| [25] |
Britt KL, Cuzick J, Phillips KA. Key steps for effective breast cancer prevention[J]. Nat Rev Cancer, 2020, 20(8): 417-436. DOI:10.1038/s41568-020-0266-x |
| [26] |
Bian Q. Circular RNA PVT1 promotes the invasion and epithelial-mesenchymal transition of breast cancer cells through serving as a competing endogenous RNA for miR-204-5p[J]. Onco Targets Ther, 2019, 12: 11817-11826. |
| [27] |
Wang J, Huang K, Shi L, et al. CircPVT1 Promoted the Progression of Breast Cancer by Regulating MiR-29a-3p-Mediated AGR2-HIF-1α Pathway[J]. Cancer Manag Res, 2020, 12: 11477-11490. DOI:10.2147/CMAR.S265579 |
| [28] |
Corre I, Verrecchia F, Crenn V, et al. The Osteosarcoma Microenvironment: A Complex But Targetable Ecosystem[J]. Cells, 2020, 9(4): 976. DOI:10.3390/cells9040976 |
| [29] |
Liu YP, Wan J, Long F, et al. circPVT1 Facilitates Invasion and Metastasis by Regulating miR-205-5p/c-FLIP Axis in Osteosarcoma[J]. Cancer Manag Res, 2020, 12: 1229-1240. DOI:10.2147/CMAR.S231872 |
| [30] |
Wan J, Liu Y, Long F, et al. circPVT1 promotes osteosarcoma glycolysis and metastasis by sponging miR-423-5p to activate Wnt5a/Ror2 signaling[J]. Cancer Sci, 2021, 112(5): 1707-1722. DOI:10.1111/cas.14787 |
| [31] |
Wang Z, Su M, Xiang B, et al. Circular RNA PVT1 promotes metastasis via miR-145 sponging in CRC[J]. Biochem Biophys Res Commun, 2019, 512(4): 716-722. DOI:10.1016/j.bbrc.2019.03.121 |
| [32] |
Zheng Z, Chen Z, Zhong Q, et al. CircPVT1 promotes progression in clear cell renal cell carcinoma by sponging miR-145-5p and regulating TBX15 expression[J]. Cancer Sci, 2021, 112(4): 1443-1456. DOI:10.1111/cas.14814 |
| [33] |
Verduci L, Ferraiuolo M, Sacconi A, et al. The oncogenic role of circPVT1 in head and neck squamous cell carcinoma is mediated through the mutant p53/YAP/TEAD transcription-competent complex[J]. Genome Biol, 2017, 18(1): 237. DOI:10.1186/s13059-017-1368-y |
| [34] |
Zheng X, Rui S, Wang XF, et al. circPVT1 regulates medullary thyroid cancer growth and metastasis by targeting miR-455-5p to activate CXCL12/CXCR4 signaling[J]. J Exp Clin Cancer Res, 2021, 40(1): 157. DOI:10.1186/s13046-021-01964-0 |
| [35] |
Jia Y, Gu W. Up-regulation of circPVT1 in T cell acute lymphoblastic leukemia promoted cell proliferation via miR-30e/DLL4 induced activating NOTCH signaling[J]. Pathol Res Pract, 2021, 224: 153536. DOI:10.1016/j.prp.2021.153536 |
 2023, Vol. 50
2023, Vol. 50