文章信息
- 巨噬细胞在放射相关性肺炎和肺纤维化中的研究进展
- Research Progress of Macrophages in Development of Radiation Pneumonitis and Pulmonary Fibrosis
- 肿瘤防治研究, 2023, 50(7): 647-651
- Cancer Research on Prevention and Treatment, 2023, 50(7): 647-651
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.23.0003
- 收稿日期: 2023-01-05
- 修回日期: 2023-03-30
放射相关性肺炎及肺纤维化是胸部肿瘤患者放疗后的常见不良反应,影响患者预后和生活质量。正常肺组织受照后机体免疫系统被激活,免疫细胞被招募到损伤部位,其中巨噬细胞的过度活化在肺炎性反应及纤维化中发挥关键作用。根据激活方式和行使功能的不同,巨噬细胞主要分为M1和M2型。细胞毒性M1型巨噬细胞主要参与放射相关性肺炎的发生,促炎M1型巨噬细胞向抗炎M2表型转变,参与晚期肺纤维化的进展,最终的病理表现取决于M1/M2巨噬细胞的相对平衡[1]。因此,本文就近年来巨噬细胞在放射相关性肺炎和肺纤维化中的研究进行综述,深入了解巨噬细胞的表型转化及其在肺损伤改变中的调控机制,有助于开发潜在的巨噬细胞靶向药物用于预防和控制疾病。
1 巨噬细胞参与放射性肺损伤病理过程巨噬细胞是气道和肺泡防御的第一道防线,胸部肿瘤患者放疗后,肺损伤病理过程主要包括急性渗出期、放射相关性炎性反应和放射相关性纤维化三个阶段,肺泡巨噬细胞(AMs)和肺间质巨噬细胞(IMs)的动态变化参与肺损伤微环境中细胞间复杂的信号传递,在调节肺内免疫应答和维持稳态中发挥关键作用。急性反应发生于受照射后数小时至数天,肺泡内蛋白渗出合并间质水肿,其中IMs数量于放疗后先逐渐增加然后再下降,1周左右达到峰值,而AMs数量在受照后先逐渐减少,至2周左右耗竭,随后逐渐增多并恢复,此阶段组织炎性反应与伤口愈合并存。经过数周的潜伏期,临床表现为长短不一的无症状窗口期,AMs和IMs数量急剧上升并参与肺组织炎性反应及纤维化进展[2]。研究表明,放射相关性炎性反应主要表现为肺间质增厚伴有大量炎性细胞浸润,浸润的巨噬细胞以促炎M1型为主,通过释放大量促炎因子和活性氧(ROS)等加重肺部炎性反应。在放射相关性纤维化阶段,巨噬细胞主要表现为M2型极化,通过分泌转化生长因子-β(TGF-β)和白细胞介素10(IL-10)等抗炎因子参与细胞外基质和胶原沉积、纤维组织增生和组织重塑[3]。巨噬细胞的表型和功能具有高度可塑性,它们接受刺激后被极化为M1或M2型,当微环境变化后可再去极化为M0巨噬细胞,M1/M2失衡是许多疾病的致病因素,如果平衡向M1巨噬细胞倾斜,则会导致促炎介质的过度产生而诱发炎性反应;如果平衡向M2巨噬细胞倾斜,则会导致组织修复过度而纤维化。
2 巨噬细胞在早期放射相关性肺炎中的作用放疗后的早期阶段,高能射线导致肺组织产生大量ROS,造成细胞DNA损伤及脂质过氧化,受损伤的肺泡上皮细胞及血管内皮细胞能够释放多种细胞因子和趋化因子,其中趋化因子配体2(CCL2)是一种高效的单核细胞趋化因子,能招募骨髓来源的巨噬细胞进入受损肺。研究表明,肺组织受照后肺泡表面活性蛋白D(SP-D)缺失导致巨噬细胞诱导型一氧化氮合酶(iNOS)表达上调,产生大量一氧化氮及活性氮(RNS)介导氧化应激反应。在微环境ROS、干扰素γ及活化的Th1细胞刺激下,大量巨噬细胞被极化为M1型并分泌多种炎性因子,进一步招募更多的免疫细胞浸润[4]。其中,肿瘤坏死因子-α(TNF-α)、TGF-β、血小板源性生长因子(PDGF)、类胰岛素生长因子-1(IGF-1)等炎性因子释放可以持续促进ROS产生,同时,活化的巨噬细胞耗氧量增加导致组织缺氧,组织缺氧和灌注减少反过来进一步刺激巨噬细胞迁移,受照后第4至10周巨噬细胞的积聚达到高峰,巨噬细胞氧化爆发,ROS产生的正反馈效应破坏了氧化还原平衡,严重超过体内抗氧化能力,导致肺部炎性反应持续存在[5]。
巨噬细胞不仅在活性氧级联反应中发挥重要作用,也是细胞因子风暴反应中的关键成分。放射相关性肺炎发生阶段,损伤部位M1型巨噬细胞增加,细胞内丝裂原活化蛋白激酶(MAPK)、核因子-κB(NF-κB)、JAK/STAT1和Notch等通路被激活,促进细胞因子类(TNF-α)、白介素类(IL-1β、IL-6、IL-8、IL-12、IL-23)、集落刺激因子(CSFs)、趋化因子和基质金属蛋白酶(MMPs)等的大量生成,这些介质的不可控释放能够放大致病效应,招募和激活中性粒细胞、单核细胞及淋巴细胞等免疫细胞释放更多的炎性反应因子[6]。细胞因子正反馈循环会诱导炎性反应风暴发生,加重患者肺泡实质细胞受损或凋亡,肺泡壁微血管屏障遭到破坏,炎性渗出引起肺组织血气交换障碍,患者出现严重缺氧、急性呼吸窘迫综合征(ARDS)甚至呼吸衰竭。其中IL-6是目前公认的发生早、敏感度高的炎性指标,TNF-α、IL-1β及IL-6等大量炎性因子介导的急性免疫反应可能是肺癌合并肺部基础疾病患者放疗后重症肺炎发生的重要机制之一[7]。
肺组织内不同空间位置巨噬细胞在炎性反应发展中的作用不同,应用单次高剂量胸部照射的动物模型研究发现,AMs是急性期炎性反应的主要响应细胞,比IMs的数量下降更为显著,小鼠受照射6周后,可观察到组织驻留巨噬细胞(TRMs)逐渐被耗竭,CD11b+髓系来源巨噬细胞流入增加,逐渐补充了AMs的消耗[8-9]。研究表明,AMs参与控制过度炎性反应及继发性组织损伤,AMs缺陷小鼠肺急性反应期细胞因子和趋化因子表达显著上调,包括TNF-α、IL-1β、趋化因子配体1(CXCL1)和单核细胞趋化蛋白-1(MCP-1)等,伴随中性粒细胞趋化增加,然而损伤的中性粒细胞无法被AMs正常清除,导致组织继发性坏死引起肺部炎性反应,小鼠死亡率增加[10]。事实上,早期浸润的巨噬细胞以恢复组织稳态为目的,然而,如果损伤刺激持续存在、大量免疫细胞的过度聚集、促炎因子诱导炎性反应风暴、氧化应激持续加剧,会促进放射相关性肺炎的发展。
3 巨噬细胞在晚期放射相关性肺纤维化中的作用肺纤维化是放疗晚期的主要不良事件,在纤维化反应的高峰期可观察到M2巨噬细胞高表达,并簇样分布于纤维化明显部位。不同于炎性反应中AMs的重要作用,应用中和抗体耗竭IMs能够更好地控制肺纤维化,提示IMs在促进肺纤维化中更为重要[11]。研究表明,M2巨噬细胞通过诸多分子机制参与肺纤维化的调控,损伤刺激的持续存在通过激活经典的JAK-STAT6通路,促进M2巨噬细胞极化并产生多种介质,如TGF-β1、结缔组织生长因子(CTGF)、IL-10、PDGF、血管内皮生长因子(VEGF)、IGF-1和半乳糖凝集素-3等。其中,TGF-β是目前公认的纤维化关键驱动因素之一,TGF-β通过与丝氨酸/苏氨酸激酶的跨膜蛋白结合,激活包括ERK/GSK3β/Snail、Smad/Snail和PI3K/AKT/mTOR等信号通路,通过级联放大反应发挥促纤维化作用[12]。
肌成纤维细胞可产生大量ECM成分,包括胶原蛋白、糖蛋白和蛋白聚糖等,在纤维化的发病中发挥核心作用。M2巨噬细胞表达的精氨酸酶可将L-精氨酸代谢为L-鸟氨酸、L-脯氨酸和多胺,直接参与促进成纤维细胞增殖。此外,M2巨噬细胞通过诱导肺泡上皮-间质转化(EMT)间接导致肌成纤维细胞数量增加。小鼠胸部受照后,上皮细胞经历从圆形鹅卵石样细胞到成纤维细胞样细胞的形态学变化,从而分化为表达ECM标记物的肌成纤维细胞,并且这一转化过程受到TGF-β的调控作用[13]。TGF-β能够增强胰岛素样生长因子结合蛋白(IGFBP7)的表达,通过激活ERK信号通路促进EMT发生,受照射的肺成纤维细胞本身也可以通过分泌CSF等因子刺激巨噬细胞极化,这一正反馈调节通路在维持IMs和成纤维细胞的活化、促进纤维化进展中占有重要地位[14]。
衰老是一种可调节应激反应,应用p16INK4a荧光素酶转基因小鼠模型的研究发现,立体定向放疗能够诱导受照射肺组织周围浸润大量衰老细胞群,包括Ⅱ型肺上皮细胞(AECⅡ)、巨噬细胞和内皮细胞[15]。纤维化敏感小鼠受照后,衰老的AECⅡ可促进IL-13等因子的释放,进而诱导TRMs极化为M2巨噬细胞,抑制衰老和衰老相关分泌表型(SASP)可以减弱M2巨噬细胞在损伤部位积聚[16-17]。同时,M2巨噬细胞也可以通过NOX2衍生的超氧化物诱导AECⅡ衰老,M2巨噬细胞与AECⅡ之间的这一正反馈回路参与驱动放疗后慢性纤维化进展[18]。体内体外研究均证实,放疗能够促进巨噬细胞衰老相关基因、促纤维化因子、SASP趋化因子、SASP基质金属蛋白酶的表达[19]。scRNA-seq显示衰老巨噬细胞酪氨酸激酶Fgr表达上调,并在放疗后第50天显著增加,衰老巨噬细胞的聚集参与促进肺组织基质重塑,刺激肺成纤维细胞的纤维化表型,从而加重肺纤维化[20]。
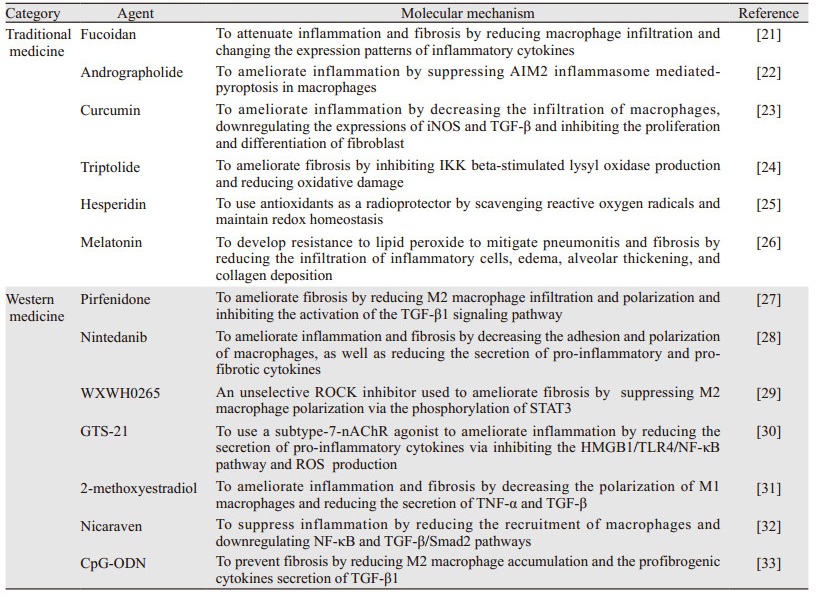
4 靶向巨噬细胞的放射相关性肺炎和肺纤维化治疗策略巨噬细胞在放射相关性肺炎肺纤维化中发挥重要作用,所以靶向巨噬细胞的相关调控通路,探索预防和治疗肺损伤改变的新策略也是近年的研究热点,包括传统中药和合成提取的西药正在如火如荼的开展,本文将近年来很有潜力的药物进行汇总,见表 1。研究发现,岩藻多糖可以通过减少中性粒细胞和巨噬细胞浸润,降低受照小鼠肺组织TIMP-1、CXCL1、MCP-1、MIP-2和IL-1等炎性因子的表达来减轻放射相关性肺炎[21]。穿心莲内酯能够显著抑制放疗后AIM2炎性小体的激活,通过减轻巨噬细胞的焦亡来缓解TNF-α、IL-1β及IL-6等炎性因子级联释放,控制肺炎及肺纤维化[22]。姜黄素一方面可通过抑制巨噬细胞浸润降低氧化应激反应,减少iNOS和TGF-β表达来减轻炎性反应,另一方面还能通过抑制成纤维细胞增殖和分化,抑制其介导的EMT及ECM沉积来缓解肺纤维化[23]。雷公藤内酯可以有效降低成纤维细胞内赖氨酸氧化酶(LOX)合成,通过抑制胶原交联控制肺纤维化进展[24]。此外,抗氧化剂橙皮苷[25]、褪黑素及二甲双胍[26]也被发现能够减轻放疗后肺炎和纤维化,其机制与清除氧自由基、抵抗脂质过氧化、减少巨噬细胞等炎性反应细胞浸润、减轻肺泡间质胶原沉积有关。
一些针对不同靶点的西药目前也取得了可喜的成果,细胞因子抑制剂比菲尼酮能减少M2巨噬细胞浸润,抑制IL-4和IL-13诱导的M2巨噬细胞极化,阻断TGF-β1/Smad3信号的激活来改善放疗诱发的肺纤维化[27]。小分子酪氨酸激酶抑制剂尼达尼布可通过抑制人重组集落刺激因子1受体(CSF1R)的激活,降低巨噬细胞的黏附及趋化,抑制巨噬细胞极化及其随后的促炎促纤维化因子生成,从而减轻肺部炎性反应及纤维化改变[28]。类似的,WXWH0265是一种有效的非选择性ROCK抑制剂,能够抑制ROCK致STAT3磷酸化,从而抑制M2巨噬细胞极化并降低放疗诱导的纤维化[29]。此外,α7胆碱能受体(α7-nAChR)激动剂GTS-21[30]、雌二醇的天然代谢产物2-甲氧基雌二醇(2ME2)[31]、羟自由基清除剂尼卡芬[32]、非甲基化的CpG二核苷酸(CpG ODN)[33]均可不同程度地通过减少巨噬细胞在损伤部位的浸润数量,下调NF-κB和TGF-β通路的激活,从而降低炎性反应因子及促纤维化因子释放,可能成为预防和治疗放射相关肺炎及肺纤维化的潜在药物。
5 总结巨噬细胞是放疗后机体免疫应答的主要效应细胞之一,在促炎和抗炎等不同表型间维持动态平衡。尽管巨噬细胞的早期激活旨在调控微环境,清除凋亡和坏死的炎性反应细胞,促进损伤的愈合和再生,当调控失衡,其持续激活会诱导炎性细胞浸润、大量炎性因子和促纤维化因子释放、促进成纤维细胞增殖分化、细胞外基质沉积及肺结构重塑等病理过程,最终导致放射相关性肺炎和肺纤维化。然而,仍有许多关键问题尚未解决,包括巨噬细胞过度激活的启动机制、维持M1/M2巨噬细胞平衡的调控因素、众多炎性因子中参与疾病发生的上游分子、巨噬细胞介导肺纤维化进展的基因分子通路等等,这些问题的深入研究有助于临床用药时机的选择、预防和治疗肺损伤靶向药物的开发、推动放疗后不良反应的管理和控制,使得肿瘤患者能够从放射治疗中获益更多。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
许亚萍:论文撰写及审校
付佳美:论文撰写
闫玉洁:文献调研
| [1] |
Yan Y, Fu J, Kowalchuk RO, et al. Exploration of radiation-induced lung injury, from mechanism to treatment: a narrative review[J]. Transl Lung Cancer Res, 2022, 11(2): 307-322. DOI:10.21037/tlcr-22-108 |
| [2] |
Meziani L, Deutsch E, Mondini M. Macrophages in radiation injury: a new therapeutic target[J]. Oncoimmunology, 2018, 7(10): e1494488. DOI:10.1080/2162402X.2018.1494488 |
| [3] |
Cheng P, Li S, Chen H. Macrophages in Lung Injury, Repair, and Fibrosis[J]. Cells, 2021, 10(2): 436-453. DOI:10.3390/cells10020436 |
| [4] |
李梦瑶, 刘盼, 柯越海, 等. 放射性肺损伤中巨噬细胞作用机制的研究进展[J]. 浙江大学学报(医学版), 2020, 49(5): 623-628. [Li MY, Liu P, Ke YH, et al. Research progress on macrophage in radiation induced lunginjury[J]. Zhejiang Da Xue Xue Bao (Yi Xue Ban), 2020, 49(5): 623-628.] |
| [5] |
李成城, 张秋宁, 王小虎. 活性氧与放射性肺损伤的相关研究进展[J]. 辐射研究与辐射工艺学报, 2019, 37(6): 1-7. [Li CC, Zhang QN, Wang XH. A review of the relationship of reactive oxygen species with radiation-induced lung injuries[J]. Fu She Yan Jiu Yu Fu She Gong Yi Xue Bao, 2019, 37(6): 1-7.] |
| [6] |
Lierova A, Jelicova M, Nemcova M, et al. Cytokines and radiation-induced pulmonary injuries[J]. J Radiat Res, 2018, 59(6): 709-753. |
| [7] |
Onishi H, Marino K, Yamashita H, et al. Case Series of 23 Patients Who Developed Fatal Radiation Pneumonitis After Stereotactic Body Radiotherapy for Lung Cancer[J]. Technol Cancer Res Treat, 2018, 17: 1533033818801323. |
| [8] |
Groves AM, Johnston CJ, Misra RS, et al. Whole-Lung Irradiation Results in Pulmonary Macrophage Alterations that are Subpopulation and Strain Specific[J]. Radiat Res, 2015, 184(6): 639-649. DOI:10.1667/RR14178.1 |
| [9] |
张妮, 杨揆, 白健, 等. 巨噬细胞起源、活化和功能异质性在放射性肺损伤中的作用研究进展[J]. 中国免疫学杂志, 2021, 37(15): 1890-1894. [Zhang N, Yang K, Bai J, et al. Advances in role of macrophage origin, activation and functional heterogeneityin radiation-induced lung injury[J]. Zhongguo Mian Yi Xue Za Zhi, 2021, 37(15): 1890-1894. DOI:10.3969/j.issn.1000-484X.2021.15.019] |
| [10] |
Meziani L, Mondini M, Petit B, et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages[J]. Eur Respir J, 2018, 51(3): 1702120. DOI:10.1183/13993003.02120-2017 |
| [11] |
Groves AM, Johnston CJ, Williams JP, et al. Role of Infiltrating Monocytes in the Development of Radiation-Induced Pulmonary Fibrosis[J]. Radiat Res, 2018, 189(3): 300-311. DOI:10.1667/RR14874.1 |
| [12] |
Liu X, Shao C, Fu J. Promising Biomarkers of Radiation-Induced Lung Injury: A Review[J]. Biomedicines, 2021, 9(9): 1181-1201. DOI:10.3390/biomedicines9091181 |
| [13] |
Park HR, Jo SK, Jung U. Ionizing Radiation Promotes Epithelial-to-Mesenchymal Transition in Lung Epithelial Cells by TGF-beta-producing M2 Macrophages[J]. In Vivo, 2019, 33(6): 1773-1784. DOI:10.21873/invivo.11668 |
| [14] |
Zhong Y, Lin Z, Lin X, et al. IGFBP7 contributes to epithelial-mesenchymal transition of HPAEpiC cells in response to radiation[J]. J Cell Biochem, 2019, 120(8): 12500-12507. DOI:10.1002/jcb.28516 |
| [15] |
Soysouvanh F, Benadjaoud MA, Santos MD, et al. Stereotactic Lung Irradiation in Mice Promotes Long-Term Senescence and Lung Injury[J]. Int J Radiat Oncol Biol Phys, 2020, 106(5): 1017-1027. DOI:10.1016/j.ijrobp.2019.12.039 |
| [16] |
Chung EJ, Kwon S, Reedy JL, et al. IGF-1 Receptor Signaling Regulates Type Ⅱ Pneumocyte Senescence and Resulting Macrophage Polarization in Lung Fibrosis[J]. Int J Radiat Oncol Biol Phys, 2021, 110(2): 526-538. DOI:10.1016/j.ijrobp.2020.12.035 |
| [17] |
Chung EJ, Kwon S, Shankavaram U, et al. Natural variation in macrophage polarization and function impact pneumocyte senescence and susceptibility to fibrosis[J]. Aging (Albany NY), 2022, 14(19): 7692-7717. |
| [18] |
Pan J, Li D, Xu Y, et al. Inhibition of Bcl-2/xl with ABT-263Selectively Kills Senescent Type Ⅱ Pneumocytes and Reverses Persistent Pulmonary Fibrosis Induced by Ionizing Radiation in Mice[J]. Int J Radiat Oncol Biol Phys, 2017, 99(2): 353-361. DOI:10.1016/j.ijrobp.2017.02.216 |
| [19] |
Su L, Dong Y, Wang Y, et al. Potential role of senescent macrophages in radiation-induced pulmonary fibrosis[J]. Cell Death Dis, 2021, 12(6): 527-539. DOI:10.1038/s41419-021-03811-8 |
| [20] |
Adams TS, Schupp JC, Poli S, et al. Single-cell RNA-seq reveals ectopic and aberrant lung-resident cell populations in idiopathic pulmonary fibrosis[J]. Sci Adv, 2020, 6(28): eaba1983. DOI:10.1126/sciadv.aba1983 |
| [21] |
Yu HH, Chengchuan Ko E, Chang CL, et al. Fucoidan Inhibits Radiation-Induced Pneumonitis and Lung Fibrosis by Reducing Inflammatory Cytokine Expression in Lung Tissues[J]. Mar Drugs, 2018, 16(10): 392-406. DOI:10.3390/md16100392 |
| [22] |
Gao J, Peng S, Shan X, et al. Inhibition of AIM2 inflammasome-mediated pyroptosis by Andrographolide contributes to amelioration of radiation-induced lung inflammation and fibrosis[J]. Cell Death Dis, 2019, 10(12): 957-972. DOI:10.1038/s41419-019-2195-8 |
| [23] |
Amini P, Saffar H, Nourani MR, et al. Curcumin Mitigates Radiation-induced Lung Pneumonitis and Fibrosis in Rats[J]. Int J Mol Cell Med, 2018, 7(4): 212-219. |
| [24] |
Guo K, Chen J, Chen Z, et al. Triptolide alleviates radiation-induced pulmonary fibrosis via inhibiting IKKbeta stimulated LOX production[J]. Biochem Biophys Res Commun, 2020, 527(1): 283-288. DOI:10.1016/j.bbrc.2020.04.023 |
| [25] |
Haddadi GH, Rezaeyan A, Mosleh-Shirazi MA, et al. Hesperidin as Radioprotector against Radiation-induced Lung Damage in Rat: A Histopathological Study[J]. J Med Phys, 2017, 42(1): 25-32. DOI:10.4103/jmp.JMP_119_16 |
| [26] |
Farhood B, Aliasgharzadeh A, Amini P, et al. Mitigation of Radiation-Induced Lung Pneumonitis and Fibrosis Using Metformin and Melatonin: A Histopathological Study[J]. Medicina (Kaunas), 2019, 55(8): 417. DOI:10.3390/medicina55080417 |
| [27] |
Ying H, Fang M, Hang QQ, et al. Pirfenidone modulates macrophage polarization and ameliorates radiation-induced lung fibrosis by inhibiting the TGF-beta1/Smad3pathway[J]. J Cell Mol Med, 2021, 25(18): 8662-8675. DOI:10.1111/jcmm.16821 |
| [28] |
Bellamri N, Morzadec C, Joannes A, et al. Alteration of human macrophage phenotypes by the anti-fibrotic drug nintedanib[J]. Int Immunopharmacol, 2019, 72: 112-123. DOI:10.1016/j.intimp.2019.03.061 |
| [29] |
Li Q, Cheng Y, Zhang Z, et al. Inhibition of ROCK ameliorates pulmonary fibrosis by suppressing M2 macrophage polarisation through phosphorylation of STAT3[J]. Clin Transl Med, 2022, 12(10): e1036. |
| [30] |
Mei Z, Tian X, Chen J, et al. alpha7-nAchR agonist GTS-21 reduces radiation-induced lung injury[J]. Oncol Rep, 2018, 40(4): 2287-2297. |
| [31] |
Elzayat MA, Bayoumi A, Abdel-Bakky MS, et al. Ameliorative effect of 2-methoxyestradiol on radiation-inducedlung injury[J]. Life Sci, 2020, 255: 117743. DOI:10.1016/j.lfs.2020.117743 |
| [32] |
Xu Y, Zhai D, Goto S, et al. Nicaraven mitigates radiation-induced lung injury by downregulating the NF-kappaB and TGF-beta/Smad pathways to suppress the inflammatory response[J]. J Radiat Res, 2022, 63(2): 158-165. DOI:10.1093/jrr/rrab112 |
| [33] |
Zhang C, Zhao H, Li B, et al. CpG-oligodeoxynucleotides may be effective for preventing ionizing radiation induced pulmonary fibrosis[J]. Toxicol Lett, 2018, 292: 181-189. DOI:10.1016/j.toxlet.2018.04.009 |
 2023, Vol. 50
2023, Vol. 50