文章信息
- KRASG12C抑制剂在KRASG12C突变晚期实体瘤中的疗效和安全性的单臂Meta分析
- Efficacy and Safety of KRASG12C Inhibitors in Advanced Solid Tumors with KRASG12C-mutated: A Single-arm Meta-analysis
- 肿瘤防治研究, 2023, 50(7): 688-693
- Cancer Research on Prevention and Treatment, 2023, 50(7): 688-693
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1524
- 收稿日期: 2022-12-29
- 修回日期: 2023-02-06
2. 710032 西安,空军军医大学实验动物中心
2. Laboratory Animal Center, Fourth Military Medical University, Xi'an 710032, China
近年来,随着靶向肿瘤驱动基因的药物研发[1-2]和免疫治疗[3]的革命性发展,无论是单一药物治疗还是与化疗联合使用,均使肿瘤患者病情得到好转。然而,晚期肿瘤患者或者肿瘤耐药患者病情进展较快,临床预后较差。
KRAS(kirsten rat sarcoma viral oncogene)是RAS家族中的3种亚型之一[4],编码一种鸟苷三磷酸酶(GTP酶),该酶在活性三磷酸鸟苷(GTP)结合和非活性二磷酸鸟苷(GDP)结合状态之间循环,以调节信号转导[5-7]。KRASG12C是一种特定的KRAS亚突变,其第12个密码子的甘氨酸被半胱氨酸取代[8-9],导致KRAS持续活化,进而促使细胞增殖癌变[10]。基于KRASG12C突变设计合成的共价抑制剂在临床前研究表现出肿瘤抑制活性[11-12]。有报道KRASG12C突变广泛存在于多种实体肿瘤中,其中约41%的非小细胞肺癌(non-small-cell lung cancer, NSCLC)发生了KRASG12C突变[13],1%~3%的结直肠癌(colorectal carcinoma, CRC)和其他实体瘤中发生了KRASG12C突变[14]。近年来,KRASG12C抑制剂研发取得了突破性进展[15]。针对KRASG12C突变的实体瘤,临床上已经完成了KRASG12C抑制剂Sotorasib[16-17]和Adagrasib[18-19]Ⅰ、Ⅱ期临床试验,但是其临床疗效和安全性缺乏足够的证据。因此,本研究对KRASG12C抑制剂Sotorasib和Adagrasib的有效性和安全性进行系统评价并按PRISMA规范进行报告,以期为KRASG12C抑制剂的临床合理用药提供依据。
1 资料与方法 1.1 方案和注册本研究在PROSPERO平台注册(Https://www.crd.york.ac.uk/PROSPERO/),注册ID为CRD42022341757。
1.2 文献检索策略计算机检索PubMed、The Cochrane Library、Web of Science、Embase、CNKI和CBM数据库,收集关于KRASG12C抑制剂在KRASG12C突变晚期实体瘤的临床研究,检索时限为建库至2022年10月12日。采用主题词和自由词联合方式进行检索,英文检索词包括Neoplasms、Tumor、Cancer、KRASG12C、Sotorasib、Adagrasib、AMG510、MRTX849、Lumakras;中文检索词包括癌、瘤、索托拉西布、阿达格拉西布。以PubMed为例,其具体检索策略见图 1。

|
| 图 1 PubMed检索策略 Figure 1 Search strategy in PubMed |
由两名研究者独立筛选文献、提取资料并交叉核对。如产生分歧则通过讨论或与第三方协商判断。资料提取内容包括:(1)纳入研究的基本信息:研究题目、第一作者、发表杂志、发表年份等;(2)研究对象的基线特征和干预措施;(3)偏倚风险评价的关键要素;(4)所关注的结局指标和结果测量数据。文章中若缺少相关资料,尽量与该文作者联系补充。
1.4 偏倚风险评价由两位研究者独立对纳入的研究进行偏倚风险评价,并交叉核对结果。偏倚风险评价采用JBI证据综合手册中Appendix 7.3 Critical appraisal checklists for case series进行评价。
1.5 纳入与排除标准纳入标准:(1)纳入所有类型的临床研究;(2)干预措施为口服Sotorasib或Adagrasib;(3)研究对象为临床组织学确诊为不可切除或转移性晚期恶性实体瘤,并经过PCR或基因测序确定携带KRASG12C突变的患者;(4)参与疗效评价的患者为Sotorasib每日口服960 mg,Adagrasib每日口服1 200 mg;所有纳入研究的人群均参与安全性评价。
主要结局指标:患者临床治疗效果和严重不良事件发生率,包括客观缓解率(ORR)和严重不良事件(5级)发生率。临床不良反应主要为腹泻、疲劳、恶心、呕吐、腹痛等。不良事件等级按照(CTCAE)5.0版本进行评价。次要结局指标:疾病控制率(DCR)和疾病稳定率(SDR)。不良事件发生率包括一般不良事件发生率(3级和4级)和所有不良事件发生率(所有等级)。排除标准:(1)非中、英文文献;(2)纳入研究对象少于10例的研究;(3)非晚期肿瘤患者;(4)重复检出或重复发表的文献;(5)未报道结局指标,联系作者无果且无法计算的研究。
1.6 统计学方法采用RevMan 5.4软件进行统计分析,主要结局指标和次要结局指标及其95%CI进行合并。纳入研究均为单臂研究,因此基于事件的发生率(P)转换为发生率的标准误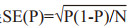
初检共获得903篇文献,经过逐层筛选后,最终纳入4篇单臂临床研究文献[16-19],筛选过程见图 2,共包括388例患者参与疗效评价,394例患者参与安全性评价。

|
| 图 2 文献筛选流程 Figure 2 Literature screening process |
最终纳入4篇文献,均为KRASG12C突变、晚期并经过至少一种全身治疗的实体瘤患者。纳入研究的基本特征见表 1。
4篇文献均为单臂研究,均未报告是否连续纳入患者,同时未报告该疾病的地理区域特征等。偏倚风险评价结果见表 2。
疾病客观缓解率Meta分析结果见图 3,异质性检验结果显示,各研究间有统计学异质性(I2=84%, P<0.05),采用随机效应模型进行Meta分析。结果显示,患者疾病客观缓解率为35%(95%CI: 0.23~0.47)。疾病客观缓解率中,完全缓解率为0。

|
| 图 3 疾病客观缓解率Meta分析 Figure 3 Meta-analysis of objective response rate |
疾病总体控制率Meta分析结果见图 4,异质性检验结果显示,各研究间有统计学异质性(I2=64%, P<0.05),采用随机效应模型进行Meta分析。结果显示,患者总体疾病控制率为82%(95%CI: 0.76~0.89)。

|
| 图 4 疾病总体控制率Meta分析 Figure 4 Meta-analysis of disease control rate |
疾病稳定率Meta分析结果见图 5,各研究间有统计学异质性(I2=82%, P<0.05),采用随机效应模型进行Meta分析。结果显示,患者疾病稳定率为45%(95%CI: 0.32~0.57)。

|
| 图 5 疾病稳定率Meta分析 Figure 5 Meta-analysis of stable disease rate |
严重不良事件(5级)发生率Meta分析结果见图 6,异质性检验结果显示,各研究间无统计学异质性(I2=0, P>0.05),采用固定效应模型进行Meta分析。结果显示,患者严重不良事件发生率为2%(95%CI: 0~0.03)。

|
| 图 6 临床严重不良事件发生率Meta分析 Figure 6 Meta-analysis of the incidence of serious adverse events |
临床一般不良事件(3级和4级)发生率Meta分析结果见图 7,异质性检验结果显示,各研究间有统计学异质性(I2=93%, P<0.05),采用随机效应模型进行Meta分析。结果显示,患者一般不良事件发生率为28%(95%CI: 0.12~0.43)。

|
| 图 7 临床一般不良事件发生率Meta分析 Figure 7 Meta-analysis of the incidence of general adverse events |
临床所有不良事件发生率Meta分析结果见图 8,异质性检验结果显示,各研究间有统计学异质性(I2=97%, P<0.05),采用随机效应模型进行Meta分析。结果显示,患者所有不良事件发生率为79%(95%CI: 0.59~1.00)。

|
| 图 8 临床所有不良事件发生率Meta分析 Figure 8 Meta-analysis of the incidence of all clinical adverse events |
考虑疾病总体控制率分析结果异质性较高,纳入研究中晚期NSCLC患者最多(80.9%),其他各种肿瘤患者数量相对较少,因此我们对晚期NSCLC患者进行亚组分析。疾病部分缓解率亚组Meta分析结果见图 9,异质性检验结果显示,各研究间无统计学异质性(I2=0, P>0.05),采用固定效应模型进行Meta分析。结果显示,NSCLC患者疾病部分缓解率为38%(95%CI: 0.33~0.44)。

|
| 图 9 NSCLC患者疾病部分缓解率Meta分析 Figure 9 Meta-analysis of partial remission rate of disease in NSCLC patients |
本研究合并分析了4篇关于KRASG12C抑制剂Sotorasib和Adagrasib对于晚期实体瘤疗效和安全性的单臂研究。4篇文献中3篇来自New England Journal of Medicine杂志,1篇来自Journal of Clinical Oncology杂志。KRASG12C抑制剂Sotorasib和Adagrasib对患者疾病客观缓解率为35%(95%CI: 0.23~0.47),同时患者严重不良事件发生率仅为2%(95%CI: 0~0.03),考虑纳入的患者均为至少经过一种全身性治疗的晚期实体瘤患者,其临床35%的疾病部分缓解率仍然让人振奋。
此Meta分析纳入研究分析结果异质性较高。单个率的Meta分析异质性主要受纳入研究样本量的影响,在纳入研究有限的情况下无法将异质性控制在一定范围,但是对比单个研究来说,本研究结果更具客观性。对于主要结局指标PR,我们针对NSCLC进行了亚组分析,减小了结果异质性,表明Sotorasib和Adagrasib在治疗晚期KRASG12C突变的NSCLC疗效差别较小。主要结局指标PR异质性的另一个原因可能是KRASG12C突变的其他晚期肿瘤对于治疗的反应差异较大。严重不良事件(5级)发生率异质性较小,表明Sotorasib和Adagrasib在安全性上基本一致。
纳入的研究均为晚期肿瘤患者尚能取得令人满意的治疗效果,KRASG12C抑制剂对于早期肿瘤患者的治疗效果可能会更佳。同时有临床前研究表明,KRASG12C抑制剂联合靶向治疗[20]和免疫治疗[21]会产生明显的协同治疗效果,因此,KRASG12C抑制剂联合其他药物治疗可能是今后临床KRASG12C突变患者的一个有效的治疗策略。
KRASG12C抑制剂是针对KRASG12C突变肿瘤的靶向药物,尚没有研究指出KRASG12C抑制剂对于KRAS的其他突变如KRASG12D、KRASG12A和KRASG12V等显示出肿瘤抑制活性。在NSCLC中,KRASG12C突变比例较高[22],将会有较多患者受益,但是针对其他类型肿瘤,如结直肠癌[23-24]、胰腺癌[24]等,KRASG12D或者其他类型的突变较多,因此需要对这些突变研发针对性的靶向药,才能使更多肿瘤患者获益。
本研究存在一定局限性:(1)纳入的研究数较少,且都是Ⅰ~Ⅱ期研究,没有Ⅲ期研究;(2)部分研究报告病例较少,且报告病例和纳入病例数有一定的出入,可能存在发表偏倚;(3)不同研究间存在明显的异质性,部分未知的异质性来源可能造成一定偏倚;(4)为了研究KRASG12C抑制剂的临床效果,我们将两种抑制剂Sotorasib和Adagrasib进行合并研究,可能因此造成偏倚。
综上所述,KRASG12C抑制剂Sotorasib和Adagrasib针对晚期突变的实体瘤患者产生了显著的肿瘤抑制效果,并且具有较好的安全性,能使晚期KRASG12C突变实体瘤患者受益。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
谭邓旭:数据分析、文章撰写
刘可、马一凡:文献检索、数据提取
汪永锋:核对数据
张延英、师长宏:课题指导、文章撰写指导
| [1] |
Blechacz B, Komuta M, Roskams T, et al. Clinical diagnosis and staging of cholangiocarcinoma[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(9): 512-522. DOI:10.1038/nrgastro.2011.131 |
| [2] |
Parameswaran S, Kundapur D, Vizeacoumar FS, et al. A Road Map to Personalizing Targeted Cancer Therapies Using Synthetic Lethality[J]. Trends Cancer, 2019, 5(1): 11-29. DOI:10.1016/j.trecan.2018.11.001 |
| [3] |
Galon J, Bruni D. Approaches to treat immune hot, altered and cold tumours with combination immunotherapies[J]. Nat Rev Drug Discov, 2019, 18(3): 197-218. DOI:10.1038/s41573-018-0007-y |
| [4] |
Xu K, Park D, Magis AT, et al. Small Molecule KRAS Agonist for Mutant KRAS Cancer Therapy[J]. Mol Cancer, 2019, 18(1): 85. DOI:10.1186/s12943-019-1012-4 |
| [5] |
Hofmann MH, Gerlach D, Misale S, et al. Expanding the Reach of Precision Oncology by Drugging All KRAS Mutants[J]. Cancer Discov, 2022, 12(4): 924-937. DOI:10.1158/2159-8290.CD-21-1331 |
| [6] |
Liu P, Wang Y, Li X. Targeting the untargetable KRAS in cancer therapy[J]. Acta Pharm Sin B, 2019, 9(5): 871-879. DOI:10.1016/j.apsb.2019.03.002 |
| [7] |
Ostrem JM, Peters U, Sos ML, et al. K-Ras(G12C) inhibitors allosterically control GTP affinity and effector interactions[J]. Nature, 2013, 503(7477): 548-551. DOI:10.1038/nature12796 |
| [8] |
Hallin J, Engstrom LD, Hargis L, et al. The KRAS(G12C) Inhibitor MRTX849 Provides Insight toward Therapeutic Susceptibility of KRAS-Mutant Cancers in Mouse Models and Patients[J]. Cancer Discov, 2020, 10(1): 54-71. DOI:10.1158/2159-8290.CD-19-1167 |
| [9] |
Papke B, Der CJ. Drugging RAS: Know the enemy[J]. Science, 2017, 355(6330): 1158-1163. DOI:10.1126/science.aam7622 |
| [10] |
Pylayeva-Gupta Y, Grabocka E, Bar-Sagi D. RAS oncogenes: weaving a tumorigenic web[J]. Nat Rev Cancer, 2011, 11(11): 761-774. DOI:10.1038/nrc3106 |
| [11] |
Janes MR, Zhang J, Li LS, et al. Targeting KRAS Mutant Cancers with a Covalent G12C-Specific Inhibitor[J]. Cell, 2018, 172(3): 578-589. e17. DOI:10.1016/j.cell.2018.01.006 |
| [12] |
Lito P, Solomon M, Li LS, et al. Allele-specific inhibitors inactivate mutant KRAS G12C by a trapping mechanism[J]. Science, 2016, 351(6273): 604-608. DOI:10.1126/science.aad6204 |
| [13] |
Biernacka A, Tsongalis PD, Peterson JD, et al. The potential utility of re-mining results of somatic mutation testing: KRAS status in lung adenocarcinoma[J]. Cancer Genet, 2016, 209(5): 195-198. DOI:10.1016/j.cancergen.2016.03.001 |
| [14] |
Neumann J, Zeindl-Eberhart E, Kirchner T, et al. Frequency and type of KRAS mutations in routine diagnostic analysis of metastatic colorectal cancer[J]. Pathol Res Pract, 2009, 205(12): 858-862. DOI:10.1016/j.prp.2009.07.010 |
| [15] |
Kim D, Xue JY, Lito P. Targeting KRAS(G12C): From Inhibitory Mechanism to Modulation of Antitumor Effects in Patients[J]. Cell, 2020, 183(4): 850-859. DOI:10.1016/j.cell.2020.09.044 |
| [16] |
Hong DS, Fakih MG, Strickler JH, et al. KRAS(G12C) Inhibition with Sotorasib in Advanced Solid Tumors[J]. N Engl J Med, 2020, 383(13): 1207-1217. DOI:10.1056/NEJMoa1917239 |
| [17] |
Skoulidis F, Li BT, Dy GK, et al. Sotorasib for Lung Cancers with KRAS p.G12C Mutation[J]. N Engl J Med, 2021, 384(25): 2371-2381. DOI:10.1056/NEJMoa2103695 |
| [18] |
Jänne PA, Riely GJ, Gadgeel SM, et al. Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRAS(G12C) Mutation[J]. N Engl J Med, 2022, 387(2): 120-131. DOI:10.1056/NEJMoa2204619 |
| [19] |
Ou SI, Jänne PA, Leal TA, et al. First-in-Human Phase I/IB Dose-Finding Study of Adagrasib (MRTX849) in Patients With Advanced KRAS(G12C) Solid Tumors (KRYSTAL-1)[J]. J Clin Oncol, 2022, 40(23): 2530-2538. DOI:10.1200/JCO.21.02752 |
| [20] |
Molina-Arcas M, Moore C, Rana S, et al. Development of combination therapies to maximize the impact of KRAS-G12C inhibitors in lung cancer[J]. Sci Transl Med, 2019, 11(510): eaaw7999. DOI:10.1126/scitranslmed.aaw7999 |
| [21] |
Canon J, Rex K, Saiki AY, et al. The clinical KRAS(G12C) inhibitor AMG 510 drives anti-tumour immunity[J]. Nature, 2019, 575(7781): 217-223. DOI:10.1038/s41586-019-1694-1 |
| [22] |
Dunnett-Kane V, Nicola P, Blackhall F, et al. Mechanisms of Resistance to KRAS(G12C) Inhibitors[J]. Cancers (Basel), 2021, 13(1): 151. DOI:10.3390/cancers13010151 |
| [23] |
Kemp SB, Cheng N, Markosyan N, et al. Efficacy of a Small-Molecule Inhibitor of KrasG12D in Immunocompetent Models of Pancreatic Cancer[J]. Cancer Discov, 2023, 13(2): 298-311. DOI:10.1158/2159-8290.CD-22-1066 |
| [24] |
Hofmann MH, Gerlach D, Misale S, et al. Expanding the Reach of Precision Oncology by Drugging All KRAS Mutants[J]. Cancer Discov, 2022, 12(4): 924-937. DOI:10.1158/2159-8290.CD-21-1331 |
 2023, Vol. 50
2023, Vol. 50




