文章信息
- 淋巴细胞变化对非小细胞肺癌患者免疫检查点抑制剂相关肺炎的预测价值
- Predictive Value of Lymphocyte Count Changes on Checkpoint-inhibitor-related Pneumonitis in Patients with Non-small Cell Lung Cancer
- 肿瘤防治研究, 2023, 50(8): 772-776
- Cancer Research on Prevention and Treatment, 2023, 50(8): 772-776
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1508
- 收稿日期: 2022-12-22
- 修回日期: 2023-01-17
目前,肺癌是世界范围内死亡率最高的肿瘤,其最常见病理学分型为非小细胞肺癌(non-small cell lung cancer, NSCLC),约占85%。近70%肺癌患者确诊时已是晚期,5年生存率更是不足3%[1-2]。近年来免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的临床应用极大地提高了NSCLC患者生存获益[3]。ICIs治疗为NSCLC患者带来长期生存获益的同时,也会导致一系列免疫相关不良反应(immune-related adverse events, irAEs)的发生[4]。最常见致命性的irAE是免疫检查点抑制剂相关肺炎(checkpoint inhibitor-related pneumonitis, CIP),占所有因irAEs导致死亡的患者中的35%[5]。CIP的临床症状具有相对非特异性,最常见临床表现为呼吸困难和咳嗽,这些临床症状可能会导致患者缺氧并迅速进展为呼吸衰竭,导致患者死亡,严重影响了NSCLC患者ICIs治疗的获益[6]。ICI治疗会恢复并激活人体T细胞的抗肿瘤作用,但过度激活T细胞可能参与了irAEs的发生和发展[7]。有研究发现CIP患者支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中以CD4+ T、CD8+ T细胞为主的淋巴细胞大量增加和一些抗炎表型的调节性T细胞(regulatory cell, Tregs)表达减弱,造成了肺部组织免疫微环境的改变,从而可能导致了CIP的发生[8-9]。然而外周血中淋巴细胞、T细胞、Th细胞和Ts细胞计数变化与CIP发生的相关性仍不明确。随着ICIs用药方案的多样化和适应证的不断增加,未来CIP的发生率也会进一步上升。目前CIP作为一种机制不明确的、潜在致命性的irAE,很大程度上影响了肿瘤患者从ICIs治疗中获益。因此,本研究回顾性选取淋巴细胞、T细胞、Th细胞和Ts细胞计数进行分析,旨在探讨这些细胞计数变化与CIP发生的相关性。
1 资料与方法 1.1 研究对象选择2019年1月—2022年6月收治入院739例接受ICIs治疗的NSCLC患者纳入回顾性数据收集对象,在排除不符合研究纳入标准后共有85例晚期患者被纳入研究,其中有13例患者发生CIP,从其余未发生CIP的患者中随机匹配26例患者作为对照组。
纳入标准:(1)至少使用过一剂ICIs治疗的ⅢB~Ⅳ期的NSCLC患者;(2)基线时、CIP发生时或者最后一剂ICI治疗时这三个时间点都检测过外周血淋巴细胞免疫功能的患者;(3)CIP患者符合国家综合癌症网络,美国临床肿瘤学会和欧洲肿瘤内科学会指南的诊断标准[10-12]。排除标准:(1)临床资料不完整;(2)双原发肿瘤的患者;(3)淋巴细胞功能检测前使用过免疫调节剂、免疫抑制剂的患者。我们将CIP定义为ICIs治疗过程中突发咳嗽、呼吸困难或喘息的临床症状和胸部影像学检查新发的不可解释的间质或者炎性改变,并排除了其他病因。对于考虑诊断CIP的患者,进行痰培养、BALF培养和实验室检查(常规血液检查,降钙素原,C-反应蛋白、肿瘤标志物,动脉气体分析,D-二聚体和脑利钠肽等),排除其他肺部疾病(例如肺部感染和肿瘤进展)。对于既往进行过放疗的患者,通过影像学评估排除放射性肺炎可能。本研究获得昆明医科大学第三附属医院伦理学委员会的批准(伦理批号:KYLX2022205)。
1.2 临床资料和分组以1:2的比例纳入发生CIP(CIP组)的患者和随机选择的未发生CIP(对照组)的相应患者。从每例患者的病例记录中获得以下信息:性别、年龄、东部合作肿瘤学组体能状态(ECOG)、吸烟情况、预先存在的肺部基础疾病、组织学类型、放射治疗管理、病理分期、治疗数据和驱动基因状态。CIP的严重程度根据不良事件的共同毒性标准(CTCAE版本4.03)进行分级,轻度CIP被定义为1~2级肺炎,重度CIP定义为3~4级肺炎。收集CIP患者ICI治疗前的基线和CIP诊断时外周血数据。收集对照组ICI治疗前的基线和最后一剂ICI前外周血数据。外周血数据包括淋巴细胞、T细胞、Th细胞和Ts细胞计数。
1.3 统计学方法使用SPSS26软件处理数据。基线处连续变量的差异使用独立样本t检验进行评估。两组之间基线和组内的变化使用配对t检验评估。χ2检验用于组间比较;费舍尔的精确检验用于分析分类变量。使用受试者特征工作曲线(ROC)评估各指标对CIP发生的预测价值。使用Spearman相关系数检验来评估两变量之间的线性关系。P < 0.05为差异有统计学意义。
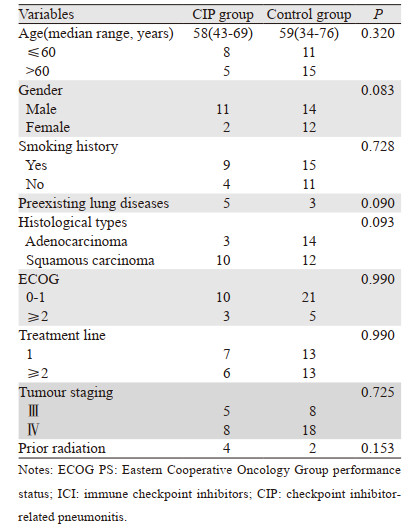
2 结果 2.1 两组患者基线资料对比两组患者的年龄、性别、吸烟状态、肺部基础疾病、组织学类型、ECOG评分、治疗线数、分期、先前接受放疗间差异无统计学意义(P > 0.05),见表 1。
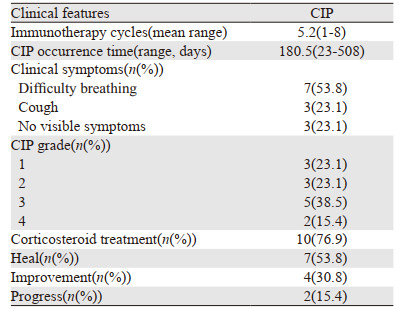
在发生CIP的患者中,肺炎发生在中位免疫治疗5.2个周期后。初始ICIs治疗与CIP发生之间的中位时间为180.5天;7例患者最初表现为呼吸困难,3例患者出现咳嗽,3例患者无症状。有7例患者发生了重度CIP,10例CIP患者接受全身性类固醇治疗。13例发生CIP的患者中,7例完全康复,4例好转,2例死于肺炎进展,见表 2。
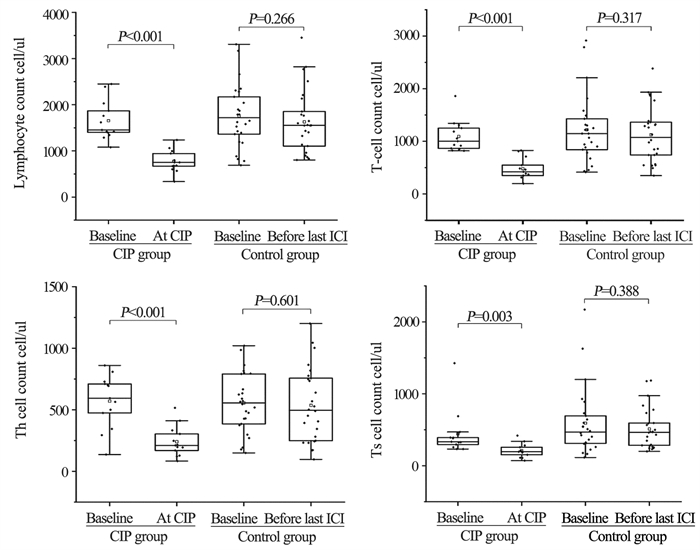
经独立样本t检验,CIP组和对照组患者基线淋巴细胞、T细胞、Th细胞和Ts细胞的绝对值计数差异无统计学意义(P=0.631, P=0.520, P=0.861, P=0.305)。经配对样本t检验,发现CIP组在CIP发生时的淋巴细胞、T细胞、Th细胞和Ts细胞的绝对值计数较基线时明显下降(P < 0.001, P < 0.001, P=0.03, P < 0.001),在对照组未发现这种变化,见图 1。
|
| 图 1 不同标志物在基线、CIP发生和最后一剂ICI前后变化 Figure 1 Changes in different markers at baseline, at the onset of CIP and before and after the last dose of ICI |
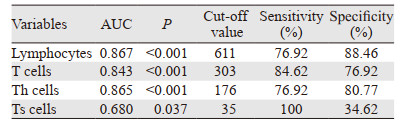
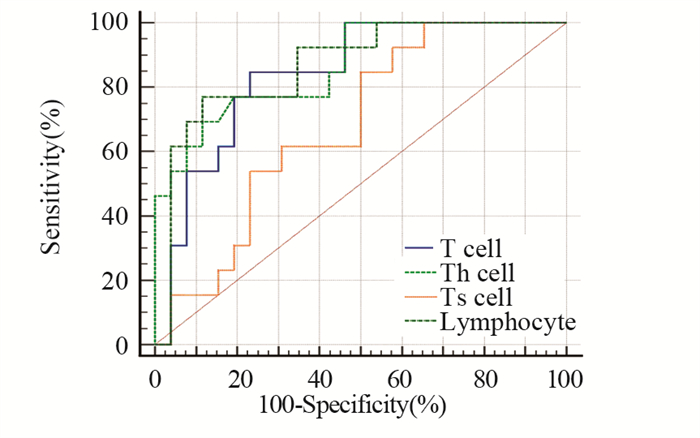
根据淋巴细胞、T细胞、Th细胞和Ts细胞的绝对值计数绘制ROC,淋巴细胞绝对值计数线下面积最大是0.867,截断值是611个/微升,敏感度及特异性分别是76.92%和88.46%,见图 2。其他指标的预测效能从大到小依次为Th、T细胞和Ts细胞,见表 3。
|
| 图 2 不同指标对CIP发生预测的ROC曲线 Figure 2 ROC curves for prediction of CIP occurrence by different indicators |
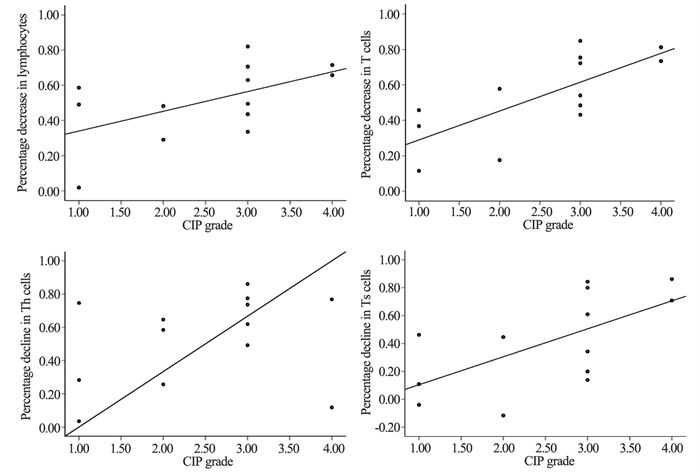
淋巴细胞、T细胞、Ts细胞较基线下降的百分比与CIP的严重程度呈正相关(rs=0.577, P=0.039; rs=0.735, P=0.04; rs=0.632, P=0.023);Th细胞下降的百分比与CIP的严重程度存在相关性,但无统计学意义(rs=0.324, P=0.285),见图 3。
|
| 图 3 不同指标较基线下降百分比与CIP等级的相关性 Figure 3 Correlation between the percentage decrease of different markers from baseline and CIP grade |
由于回顾性研究的局限性,大部分患者未在CIP治愈或好转后进行T细胞、Th细胞、Ts细胞、淋巴细胞检测。我们在两例CIP患者中观察到,当CIP患者临床症状及影像学改变恢复后,淋巴细胞、T细胞、Th细胞和Ts细胞的绝对值计数恢复到基线水平,其中包括1例重度CIP患者和1例轻度CIP患者。
3 讨论ICIs的临床应用极大地改善了NSCLC患者的预后。随着ICIs用药方案的多样化和适应证的不断增加,未来CIP的发生率也可能会进一步上升。目前对于CIP的研究多集中在肺部病灶免疫微环境淋巴细胞的变化,但这对临床CIP的诊断帮助甚少,临床工作中对CIP患者进行肺组织活检并不现实[13-14]。外周血作为一种方便获取的标本,且操作简单易于实时评估,其淋巴细胞的变化有着潜在的临床价值。因此,探索外周血淋巴细胞变化与免疫检查点抑制剂相关肺炎的相关性很有必要。
研究表明,CIP发生时,大量的淋巴细胞可能会从血液中转运并浸润到肺炎病灶,导致循环池中淋巴细胞降低,从而表现为外周血淋巴细胞计数下降[15]。有回顾性研究发现,较高的基线外周血淋巴细胞水平(> 2000个/毫升)是irAEs的危险因素[16]。Lin等研究结果显示外周血淋巴细胞较基线下降与肺癌患者CIP的发生相关,淋巴细胞的绝对计数(< 1 150个/毫升)是重度CIP的独立危险因素[17]。T细胞是淋巴细胞的主要成分,外周血中T细胞变化与淋巴细胞变化密切相关[18],这与本研究结果基本一致。本研究发现外周血淋巴细胞和T细胞计数下降与CIP的发生有相关性,其下降百分比与CIP的严重程度相关,两者下降幅度相似。Ts细胞是抑制性T细胞,能抑制辅助性Th细胞活性,从而间接抑制B细胞的分化和细胞毒性T细胞杀伤功能, 对体液免疫、细胞免疫起负向调节作用的T细胞亚群。当Ts细胞功能异常时,体内免疫反应过强,可能会引起自身免疫性疾病[19]。Ts细胞活性还与一种特发的间质性肺炎——淋巴细胞间质性肺炎的发生相关[20]。上述研究表明,Ts细胞可能参与了CIP的发生。本研究进一步发现Ts细胞计数下降与CIP发生相关,其较基线下降百分比与CIP的严重程度相关。Wang等发现CIP患者外周血和BLAF中Th1细胞和Th17细胞的激活导致了Th1细胞与Th2细胞、Th17细胞与Treg细胞的比例失衡与CIP的发生密切相关[21]。这可能解释了本研究中外周血Th细胞的减少虽然与CIP发生相关,但是和CIP的等级之间差异无统计学意义这一结果。
本研究发现,淋巴细胞、T细胞、Th细胞和Ts细胞计数下降可以在一定程度上预测CIP的发生,其中淋巴细胞变化对发生CIP的预测价值最大。淋巴细胞、T细胞和Ts细胞计数较基线下降的百分比与CIP的严重程度密切相关。本研究也存在以下两方面的局限性:首先,这是一项单中心、小样本、回顾性研究;其次,患者发生CIP时未能进行BLAF的淋巴细胞、T细胞、Th细胞和Ts细胞计数检测,没有证实外周血淋巴细胞变化和BLAF淋巴细胞变化的同步性,未来需要大样本、前瞻性、随机性研究来进一步验证。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
王志勇:设计研究方案、收集统计数据、撰写和修改论文
张莹松、李悦文:研究方案设计和收集数据
付菱:收集数据
庄莉:指导研究方案设计和修改论文
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Bodor JN, Boumber Y, Borghaei H. Biomarkers for immune checkpoint inhibition in non-small cell lung cancer (NSCLC)[J]. Cancer, 2020, 126(2): 260-270. DOI:10.1002/cncr.32468 |
| [3] |
Brahmer JR, Govindan R, Anders RA, et al. The Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of non-small cell lung cancer (NSCLC)[J]. J Immunother Cancer, 2018, 6(1): 75. DOI:10.1186/s40425-018-0382-2 |
| [4] |
Ramos-Casals M, Brahmer JR, Callahan MK, et al. Immune-related adverse events of checkpoint inhibitors[J]. Nat Rev Dis Primers, 2020, 6(1): 38. DOI:10.1038/s41572-020-0160-6 |
| [5] |
Wang DY, Salem JE, Cohen JV, et al. Fatal Toxic Effects Associated With Immune Checkpoint Inhibitors: A Systematic Review and Meta-analysis[J]. JAMA Oncol, 2018, 4(12): 1721-1728. DOI:10.1001/jamaoncol.2018.3923 |
| [6] |
Sun Y, Shao C, Li S, et al. Programmed cell death 1 (PD-1)/PD-ligand 1(PD-L1) inhibitors-related pneumonitis in patients with advanced non-small cell lung cancer[J]. Asia Pac J Clin Oncol, 2020, 16(6): 299-304. DOI:10.1111/ajco.13380 |
| [7] |
Zhai X, Zhang J, Tian Y, et al. The mechanism and risk factors for immune checkpoint inhibitor pneumonitis in non-small cell lung cancer patients[J]. Cancer Biol Med, 2020, 17(3): 599-611. DOI:10.20892/j.issn.2095-3941.2020.0102 |
| [8] |
Suzuki K, Yanagihara T, Matsumoto K, et al. Immune-checkpoint profiles for T cells in bronchoalveolar lavage fluid of patients with immune-checkpoint inhibitor-related interstitial lung disease[J]. Int Immunol, 2020, 32(8): 547-557. DOI:10.1093/intimm/dxaa022 |
| [9] |
Suresh K, Naidoo J, Zhong Q, et al. The alveolar immune cell landscape is dysregulated in checkpoint inhibitor pneumonitis[J]. J Clin Invest, 2019, 129(10): 4305-4315. DOI:10.1172/JCI128654 |
| [10] |
Puzanov I, Diab A, Abdallah K, et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group[J]. J Immunother Cancer, 2017, 5(1): 95. DOI:10.1186/s40425-017-0300-z |
| [11] |
Brahmer JR, Lacchetti C, Schneider BJ, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 2018, 36(17): 1714-1768. DOI:10.1200/JCO.2017.77.6385 |
| [12] |
Haanen J, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2017, 28(suppl_4): iv119-iv142. |
| [13] |
Sears CR, Peikert T, Possick JD, et al. Knowledge Gaps and Research Priorities in Immune Checkpoint Inhibitor-related Pneumonitis. An Official American Thoracic Society Research Statement[J]. Am J Respir Crit Care Med, 2019, 200(6): e31-e43. DOI:10.1164/rccm.201906-1202ST |
| [14] |
Naidoo J, Cottrell TR, Lipson EJ, et al. Chronic immune checkpoint inhibitor pneumonitis[J]. J Immunother Cancer, 2020, 8(1): e000840. DOI:10.1136/jitc-2020-000840 |
| [15] |
Farmer JR. Testing Immune-Related Adverse Events in Cancer Immunotherapy[J]. Clin Lab Med, 2019, 39(4): 669-683. DOI:10.1016/j.cll.2019.07.012 |
| [16] |
Diehl A, Yarchoan M, Hopkins A, et al. Relationships between lymphocyte counts and treatment-related toxicities and clinical responses in patients with solid tumors treated with PD-1 checkpoint inhibitors[J]. Oncotarget, 2017, 8(69): 114268-114280. DOI:10.18632/oncotarget.23217 |
| [17] |
Lin X, Deng H, Yang Y, et al. Peripheral Blood Biomarkers for Early Diagnosis, Severity, and Prognosis of Checkpoint Inhibitor-Related Pneumonitis in Patients With Lung Cancer[J]. Front Oncol, 2021, 11: 698832. DOI:10.3389/fonc.2021.698832 |
| [18] |
Kishton RJ, Sukumar M, Restifo NP. Metabolic Regulation of T Cell Longevity and Function in Tumor Immunotherapy[J]. Cell Metab, 2017, 26(1): 94-109. DOI:10.1016/j.cmet.2017.06.016 |
| [19] |
Germain RN. Special regulatory T-cell review: A rose by any other name: from suppressor T cells to Tregs, approbation to unbridled enthusiasm[J]. Immunology, 2008, 123(1): 20-27. DOI:10.1111/j.1365-2567.2007.02779.x |
| [20] |
Majeski JA, Stinnett JD, Cameron DJ. Suppressor T cell activity in lymphoid interstitial pneumonia[J]. J Surg Oncol, 1987, 34(1): 61-63. DOI:10.1002/jso.2930340115 |
| [21] |
Wang YN, Lou DF, Li DY, et al. Elevated levels of IL-17A and IL-35 in plasma and bronchoalveolar lavage fluid are associated with checkpoint inhibitor pneumonitis in patients with non-small cell lung cancer[J]. Oncol Lett, 2020, 20(1): 611-622. DOI:10.3892/ol.2020.11618 |
 2023, Vol. 50
2023, Vol. 50