文章信息
- TCbHP与AC-THP方案新辅助治疗HER2阳性乳腺癌真实世界疗效和安全性比较
- Real-world Efficacy and Safety Comparison of Neoadjuvant Treatment of HER2-positive Breast Cancer with TCbHP Versus AC-THP
- 肿瘤防治研究, 2023, 50(8): 782-787
- Cancer Research on Prevention and Treatment, 2023, 50(8): 782-787
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1507
- 收稿日期: 2022-12-22
- 修回日期: 2023-02-13
2. 071000 保定,河北大学附属医院乳腺外科;
3. 053000 衡水,衡水市人民医院腺体外科;
4. 065000 廊坊,河北中石油中心医院乳腺外科;
5. 066000 秦皇岛,秦皇岛市第一医院乳腺外科;
6. 054000 邢台,邢台市人民医院乳腺外科;
7. 075000 张家口,河北北方学院附属第一医院乳腺外科;
8. 061000 沧州,沧州市中心医院甲乳外科;
9. 073000 定州市,定州市人民医院甲乳外科;
10. 056000 邯郸,河北工程大学附属医院乳腺外科;
11. 056000 邯郸市,邯郸市中心医院乳腺外科
2. Department of Breast Surgery, The Affiliated Hospital of Hebei University, Baoding 071000, China;
3. Department of Gland Surgery, Hengshui People's Hospital, Hengshui 053000, China;
4. Department of Breast Surgery, CNPC Central Hospital, Langfang 065000, China;
5. Department of Breast Surgery, The First Hospital of Qinhuangdao, Qinhuangdao 066000, China;
6. Department of Breast Surgery, People Hospital of Xingtai, Xingtai 054000, China;
7. Department of Breast Surgery, The First Affiliated Hospital of Hebei North University, Zhangjiakou 075000, China;
8. Department of Breast and Thyroid Surgery, Cangzhou Central Hospital, Cangzhou 061000, China;
9. Department of Breast and Thyroid Surgery, Dingzhou City People's Hospital, Dingzhou 073000, China;
10. Department of Breast Surgery, Affiliated Hospital of Hebei Engineering University, Handan 056000, China;
11. Department of Breast Surgery, Handan Central Hospital, Handan 056000, China
2020年全球最新癌症数据显示女性恶性肿瘤中新发病例数排名第一位是乳腺癌,约为226万,也是导致女性因恶性肿瘤死亡的主要病种[1]。人类表皮生长因子2(HER2)阳性乳腺癌大约占乳腺癌的15%~20%,侵袭性强,预后较差[2-3]。对于淋巴结阳性、肿瘤负荷偏大的HER2阳性乳腺癌患者,指南推荐优选新辅助治疗。新辅助治疗不仅可以实现降期手术、降期保乳、降期保腋窝的目的,还可以通过术后病理缓解情况了解肿瘤的药物敏感性,从而制定后续治疗决策[4-5]。Neosphere、PEONY等研究奠定了曲妥珠单抗联合帕妥珠单抗(trastuzumab plus pertuzumab, HP)在HER2阳性乳腺癌患者新辅助靶向治疗中的基石地位[6-7],但与何种化疗方案联合尚无定论。多个权威指南规范一致推荐TCbHP方案(紫杉类+铂类+HP)为HER2阳性乳腺癌新辅助治疗的首选/优选方案,将AC-THP方案(蒽环类序贯紫杉类+HP)作为备选/可选方案[5, 8-11]。目前并无证据表明TCbHP方案的疗效优于AC-THP方案。国内外临床实践中,在药物选择、药物剂量、用药顺序、疗程等方面存在一定差异,可能对治疗效果有一定影响。目前缺乏直接对比TCbHP与AC-THP方案间疗效、安全性及耐受性的高水平循证医学证据。真实世界的临床实践与设计严谨的临床试验之间存在一定差异。真实世界研究可以和随机对照研究互为补充,为临床诊疗提供更全面的证据[8]。本研究旨在通过对比TCbHP与AC-THP方案新辅助治疗HER2阳性乳腺癌在真实世界临床实践中的疗效、安全性、耐受性,为临床决策提供依据。
1 资料与方法 1.1 研究对象选取2019年6月1日—2021年12月31日在河北省各地市共计11家三甲医院接受TCbHP或AC-THP方案新辅助治疗并完成后续手术的HER2阳性乳腺癌患者为研究对象。纳入标准:(1)病理证实为HER2阳性浸润性乳腺癌;(2)无远处转移;(3)接受TCbHP或AC-THP方案新辅助治疗(至少4周期)并完成后续手术治疗;(4)可获得完整临床病理资料。排除标准:(1)非浸润性乳腺癌或HER2阴性浸润性乳腺癌;(2)存在远处转移;(3)接受其他新辅助治疗方案;(4)不能获得完整临床病理资料。
1.2 研究方法回顾性收集符合本研究纳入标准患者的病例资料,对接受两种方案患者的疗效、安全性、耐受性进行比较、分析。
主要研究终点:(1)总体病理完全缓解率(total pathological complete response, tpCR):即乳腺原发灶无浸润性癌(可允许存在导管原位癌)且区域淋巴结阴性(ypT0/isypN0);(2)≥3级不良事件发生率:≥3级不良事件发生人数/总人数×100%(参照CTCAE5.0版标准);(3)既定治疗方案完成率:完成既定方案例数/总例数×100%。次要研究终点:(1)乳腺病理完全缓解率(breast pathological complete response, bpCR):即乳腺原发灶无浸润性癌(可允许存在导管原位癌)(ypT0/is);(2)腋窝病理完全缓解率(axillary pathological complete response, apCR):即区域淋巴结阴性(ypN0)。分层因素:年龄、肿瘤大小、淋巴结状态、临床分期、HER2状态、激素受体(hormone-receptor, HR)状态、Ki-67增殖指数。
1.3 统计学方法应用SPSS27.0软件完成统计学分析。运用χ2检验或Fisher’s精确检验进行组间样本率的比较,检验水准α=0.05(双侧)。
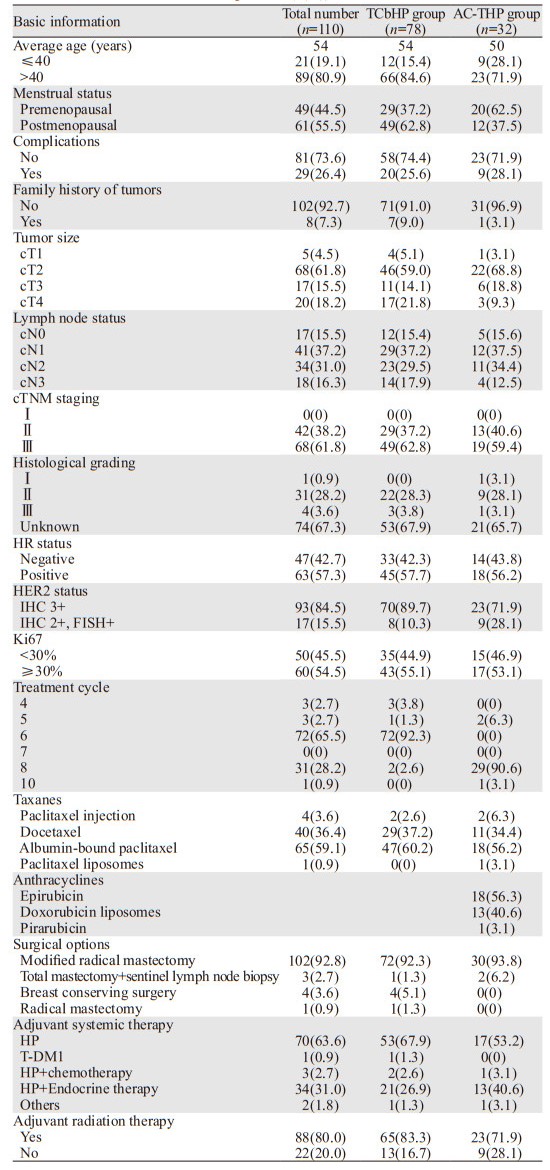
2 结果 2.1 一般资料研究最终纳入110例患者,TCbHP组78例,AC-THP组32例。患者均为女性,中位年龄54岁(30~71岁)。方案中所涉及铂类药物均为卡铂,紫杉类和蒽环类药物的具体选择见表 1。本研究所涉及治疗方案的药物剂量均按照指南规范计算,其中卡铂中位剂量为600 mg(400~900 mg),普遍低于指南规定依据AUC=5/6计算的标准剂量。治疗方案均为21天。TCbHP组92.3%患者接受6周期治疗,AC-THP组90.60%患者接受8周期治疗。患者末次化疗至手术的中位时间为25天(13~64天)。
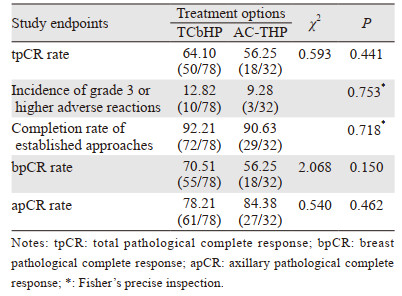
TCbHP组的tpCR率略高于AC-THP组(64.10% vs. 56.25%),但差异无统计学意义(P=0.441)。TCbHP组的bpCR率较AC-THP组稍高,但差异无统计学意义(70.51% vs. 56.25%, P=0.150)。AC-THP组的apCR率较TCbHP组稍高,但差异无统计学意义(84.38% vs. 78.21%, P=0.462),见表 2。
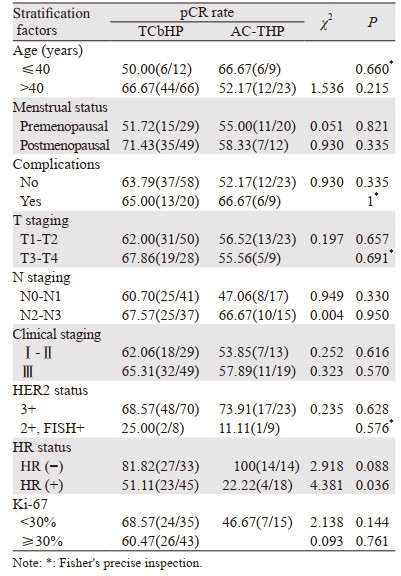
探索性分析发现,HR阳性患者中,TCbHP组的tpCR率显著高于AC-THP组(51.11% vs. 22.22%, P=0.036)。HR阴性患者中,AC-THP组的tpCR率有高于TCbHP组的趋势,但差异无统计学意义(100% vs. 81.82%, P=0.088)。年龄、月经状态、是否有并发症、肿瘤大小、淋巴结状况、cTNM分期、HER2状况、Ki-67增殖指数均与两组间tpCR率无关(P > 0.05)。见表 3。
|
数据显示:TCbHP组3级以上不良事件发生率略高于AC-THP组,但差异无统计学意义(12.82% vs. 9.38%, P=0.753),均为中性粒细胞减少。无死亡病例。见表 2。
2.4 既定方案完成率两组既定方案完成率差异无统计学意义(92.21% vs. 90.63%, P=0.718),见表 2。TCbHP组6例、AC-THP组1例患者因不能耐受化疗提前接受手术治疗,AC-THP组有2例患者因早期疗效欠佳更换为TCbHP方案,按照初始入组一并纳入分析。
3 讨论乳腺癌的新辅助治疗疗效目前仍以tpCR率作为评估标准,尽管存在一定的局限性,但由于早期缩瘤效果明显,疗程相对较短,多个指南一致推荐TCbHP方案为HER2阳性乳腺癌新辅助治疗的首选/优选方案。AC-THP方案早期缩瘤效果较慢,疗程较TCbHP方案长,多数指南将其作为备选/可选方案。TRAIN-2研究结果表明,9周期TCbHP方案与3周期FEC+HP序贯6周期TCbHP方案比较,两者的tpCR率无显著差别(68.00% vs. 67.00%, P=0.95)[12]。TRYPHAENA研究结果表明,非蒽环组TCbHP×6与蒽环组FEC+THP×3→THP×3、FEC×3→THP×3的pCR率(66.20% vs. 61.6% vs. 57.30%)相似[13]。NEOPETRA研究为真实世界研究,共纳入243例患者,治疗方案为:HP+蒽环类+紫杉类组(74.10%)、HP+单药紫杉类组(11.10%)、HP+含铂类化疗组(14.40%),三组tpCR率分别为71.00%、59.30%、48.60%,蒽环联合紫杉类药物组的tpCR率最高,差异有统计学意义(P=0.028)[14]。上述研究表明,目前并无直接证据证明TCbHP方案的疗效优于AC-THP方案。
我国与国外的临床实践在药物选择(如是否应用5-氟尿嘧啶)、药物剂量、用药顺序、疗程等方面存在一定差异,可能会对治疗效果产生一定的影响。目前缺乏在我国临床实践中直接比较TCbHP方案和AC-THP方案疗效、安全性、耐受性的高水平循证医学证据。真实世界研究是生成、收集、利用真实世界数据来提供真实世界依据的研究,可以和随机对照研究互相补充,为临床诊疗提供更全面的依据。
本研究是当前国内比较TCbHP方案与AC-THP方案疗效及安全性样本例数最多的多中心真实世界回顾性研究。本研究中TCbHP组患者绝大多数(92.3%)采用6周期方案,tpCR率为64.10%,与采用9周期TCbHP方案的TRAIN-2研究的tpCR率(68.00%)和TRYPHAENA研究中6周期TCbHP方案组的tpCR率(66.20%)类似,略高于采用6周期TCbHP方案的KRISTINE研究(55.70%)[15]。此外,本研究中卡铂剂量普遍低于根据AUC=5/6计算的标准剂量,可能对治疗效果有一定影响。
本研究AC-THP组的tpCR率为56.25%,略低于BERENICE研究中AC-THP组pCR率61.8%[16],可能与BERENICE研究中采用剂量密集型方案(ddAC×4→THP×4)有关。在蒽环类药物序贯紫杉类药物方案中,国外多同时应用5-氟尿嘧啶,而我国的临床实践中较少同时应用5-氟尿嘧啶。
本研究中,TCbHP组pCR率高于AC-THP组,但差异无统计学意义,与TRAIN-2研究、TRYPHAENA研究结果一致。TCbHP组与AC-THP组的bpCR率、apCR率同样差异无统计学意义。进一步的探索性分析发现,HR阳性患者中TCbHP组的tpCR率显著高于AC-THP组,但在HR阴性患者中,AC-THP组的tpCR率有高于TCbHP组的趋势,差异无统计学意义。造成这种现象的原因一方面可能与样本选择偏倚、总体样本例数偏少有关,另一方面可能存在不同激素受体状态的肿瘤对不同化疗药物的敏感度存在差异。此现象值得进一步深入研究。
本研究两组人群中3级以上不良事件发生率均比较低,主要为中性粒细胞减少,无死亡病例。TCbHP组的3级以上不良事件发生率略高于AC-THP组,但差异无统计学意义。本研究中TCbHP组的严重不良事件发生率低于TRAIN-2研究(22%),可能与本组患者的卡铂用量普遍偏低有关。此外,由于收集的病例资料中血液学毒性记录较详细,其他呕吐等不良反应记录不够明确,同时,真实世界临床实践中,粒细胞集落刺激因子的预防性使用和强力止吐药物的应用也较为普遍,可能也是不良事件发生率及程度低于临床试验的原因之一。
本研究两组方案的既定方案完成率均较高,TCbHP组中6例、AC-THP组中1例患者因不能耐受化疗而终止治疗。两组的既定方案完成率无显著差别。
综上所述,在我国真实世界的临床实践中,TCbHP方案与AC-THP方案新辅助治疗HER2阳性乳腺癌的疗效确切,安全性及耐受性良好。两种方案tpCR率无显著差别,AC-THP方案也可考虑作为HER2阳性乳腺癌新辅助治疗的优选方案之一。由于本研究为真实世界回顾性研究,病例选择可能存在一定偏倚,且样本例数总体偏少,可能对研究结果有一定影响。此外,本研究随访期短,患者的远期疗效有待进一步观察。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
耿丹:收集病例,统计分析,论文撰写与修改
胡崇珠:指导临床试验的设计,审核数据及统计分析结果,论文审阅与修改
郝鑫、宋瑞、王久洁、代颖、蒲朋朋、高建朝、张亮、刘娜、张豪云、冯志龙:收集与提供病例
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene[J]. Science, 1987, 235: 177-182. DOI:10.1126/science.3798106 |
| [3] |
Loibl S, Gianni L. HER2-positive breast cancer[J]. Lancet, 2017, 389(10087): 2415-2429. DOI:10.1016/S0140-6736(16)32417-5 |
| [4] |
Derks MGM, van de Velde CJH. Neoadjuvant chemotherapy in breast cancer: more than just downsizing[J]. Lancet Oncol, 2018, 19(1): 2-3. DOI:10.1016/S1470-2045(17)30914-2 |
| [5] |
中国乳腺癌新辅助治疗专家共识(2022年版)专家组. 中国乳腺癌新辅助治疗专家共识(2022年版)[J]. 中国癌症杂志, 2022, 32(1): 80-88. [Expert group of expert consensus on neoadjuvant treatment of breast cancer in China (2022 edition). Expert consensus on neoadjuvant treatment of breast cancer in China (2022 edition)[J]. Zhongguo Ai Zheng Za Zhi, 2022, 32(1): 80-88.] |
| [6] |
Gianni L, Pienkowski T, Im YH, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2012, 13(1): 25-32. DOI:10.1016/S1470-2045(11)70336-9 |
| [7] |
Shao Z, Pang D, Yang H, et al. Efficacy, Safety, and Tolerability of Pertuzumab, Trastuzumab, and Docet-axel for Patients With Early or Locally Advanced ERBB2-Positive Breast Cancer in Asia: The PEONY Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2020, 6(3): e193692. DOI:10.1001/jamaoncol.2019.3692 |
| [8] |
中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2022[M]. 北京: 人民卫生出版社, 2022: 1-210. [Guidelines Working Committee of the Chinese Clinical Oncology Society. Chinese Society of Clinical Oncology (CSCO) breast cancer Diagnosis and Treatment Guidelines 2022[M]. Beijing: People's Health Publishing House, 2022: 1-210.]
|
| [9] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10): 954-1040. [The Society of Breast Cancer China Anti-Cancer Association. Guidelines for breast cancer diagnosis and treatment by China Anti-Cancer Association (2021 edition)[J]. Zhongguo Ai Zheng Za Zhi, 2021, 31(10): 954-1040.] |
| [10] |
NCCN Clinical Practice Guidelines in Oncology: Breast Cancer(Version 8. 2021)[M]. 2021.
|
| [11] |
Tamirisa N, Hunt KK. Neoadjuvant Chemotherapy, Endocrine Therapy, and Targeted Therapy for Breast Cancer: ASCO Guideline[J]. Ann Surg Oncol, 2022, 29(3): 1489-1492. DOI:10.1245/s10434-021-11223-3 |
| [12] |
Mette SR, Anna Vt, Erik DW, et al. Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2): a multicentre, open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2018, 19: 1630-1640. DOI:10.1016/S1470-2045(18)30570-9 |
| [13] |
Schneeweiss A, Chia S, Hickish T, et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase Ⅱ cardiac safety study (TRYPHAENA))[J]. Ann Oncol, 2013, 24(9): 2278-2284. DOI:10.1093/annonc/mdt182 |
| [14] |
González-Santiago S, Saura C, Ciruelos E, et al. Real-world effectiveness of dual HER2 blockade with per-tuzumab and trastuzumab f or neoadjuvant treatment of HER2-positive early breast cancer (The NEOPETRA Study)[J]. Breast Cancer Res Treat, 2020, 184(2): 469-479. DOI:10.1007/s10549-020-05866-1 |
| [15] |
Hurvitz SA, Martin M, Symmans WF, et al. Neoadjuvant trastuzumab, pertuzumab, and chemotherapy versus trastuzumab emtansine plus pertuzumab in patients with HER2-positive breast cancer (KRISTINE): a random-ised, open-label, multicentre, phase 3 trial[J]. Lancet Oncol, 2018, 19(1): 115-126. DOI:10.1016/S1470-2045(17)30716-7 |
| [16] |
Swain SM, Ewer MS, Viale G, et al. Pertuzumab, trastuzumab, and standard anthracycline- and taxane-based chemotherapy for the neoadjuvant treatment of patients with HER2-positive localized breast cancer (BERENICE): a phase Ⅱ, open-label, multicenter, multinational cardiac safety study[J]. Ann Oncol, 2018, 29(3): 646-653. DOI:10.1093/annonc/mdx773 |
 2023, Vol. 50
2023, Vol. 50