文章信息
- PD-1/PD-L1抑制剂单药或联合铂类双药化疗对PD-L1高表达的一线非鳞状非小细胞肺癌有效性的真实世界研究
- Effectiveness of PD-(L)1 Inhibitors Alone or in Combination with Platinum-doublet Chemotherapy in First-line (1L) Non-squamous Non-small-cell Lung Cancer (Nsq-NSCLC) with PD-L1-high Expression Using Real-world Data
- 肿瘤防治研究, 2023, 50(8): 820-829
- Cancer Research on Prevention and Treatment, 2023, 50(8): 820-829
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1473
- 收稿日期: 2022-12-13
- 修回日期: 2023-04-17
2. Valld'Hebron University Hospital, Valld'Hebron Institute of Oncology, Barcelona 08035, Spain;
3. National and Kapodistrian University of Athens, Athens 15527, Greece;
4. Frontier Science Foundation Hellas, Athens 15773, Greece;
5. Product Development Data Sciences, F. Hoffmann-La Roche Ltd, Basel 4070, Switzerland;
6. Product Development Data Sciences, Genentech, Inc., South San Francisco 94080, USA;
7. Product Development Medical Affairs, F. Hoffmann-La Roche Ltd, Basel 4070, Switzerland;
8. European Thoracic Oncology Platform (ETOP), Coordinating Office, Bern 3008, Switzerland;
9. Centre Hospitalier Universitaire Vaudois (CHUV) and University of Lausanne, Lausanne 1011, Switzerland
通过检查点抑制剂(主要是抗PD-1/PD-L1)来恢复或增强抗肿瘤免疫反应的治疗策略,已成为无癌基因成瘾的晚期非小细胞肺癌(non-small-cell lung cancer, NSCLC)治疗的一场革命。目前抗PD-1/PD-L1单药或联合铂类化疗已成为晚期NSCLC一线标准治疗方案[1]。然而,比较抗PD-1/PD-L1和多西他赛二线治疗的研究显示,仅少数患者可获益于抗PD-1/PD-L1治疗,表明仍需寻找可靠的生物标志物来识别有疗效反应的患者[2-5]。
在比较抗PD-L1单药治疗和细胞毒性化疗的多项研究中,尽管评估肿瘤细胞PD-L1表达水平的免疫组织化学方法存在一些差异,但PD-L1表达水平被证实可预测患者的疗效反应[6]以及无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)[2-5]。因此,在抗PD-1/PD-L1单药[7-12]或与抗CTLA-4联用[12-14]对比铂类双药化疗的一线治疗研究中,PD-L1表达水平也已被用于筛选患者。上述研究表明,PD-1/PD-L1抑制剂仅能使PD-L1高表达(定义为在≥50%的肿瘤细胞中检测出PD-L1阳性)患者的OS显著获益,从而定义了帕博利珠单抗[7]、阿替利珠单抗[10]和西米普利单抗[11]一线治疗的新标准。
与此同时,化疗联合抗PD-1/PD-L1±抗CTLA-4在晚期NSCLC一线治疗方面也取得了新进展,其药理基础是化疗可引发免疫原性细胞死亡,使肿瘤微环境更有利于抗肿瘤免疫反应。细胞毒性化疗联合抗PD-1/PD-L1(±抗CTLA-4)的Ⅲ期临床研究显示[15-18],无论PD-L1表达水平如何,患者的OS均可延长。因此,现有证据支持使用PD-1/PD-L1抑制剂单药或联合铂类双药治疗PD-L1高表达(PD-L1≥50%)的晚期NSCLC患者。然而,目前尚无比较单药和联合治疗的头对头研究。不过,现有临床研究中使用抗PD-1/PD-L1单药治疗出现早期疾病进展的患者比例似乎高于联合化疗。因此,临床医生往往需要根据临床实际情况选择治疗方案,对于侵袭性高或致命性肿瘤仍倾向联合化疗,而对于侵袭性低或由于合并症导致化疗耐受性差的患者倾向单药治疗。目前尚无证据表明免疫治疗联合化疗能显著增加长期获益的患者比例[19]。
由于临床试验中患者的筛选标准越来越严格,其结果很难适用于临床实践中的患者群体。而真实世界数据(real-world data, RWD)囊括了临床试验中被排除或人数占比较少的患者亚组,可作为科学性证据对随机试验进行补充。特别是在缺乏随机证据的情况下,来自RWD的证据有助于指导PD-L1高表达且无癌基因成瘾的晚期NSCLC患者的一线治疗方案选择[20]。
本研究中,欧洲胸部肿瘤协作平台(European Thoracic Oncology Platform, ETOP)与罗氏公司合作,拟使用RWD模拟假设的临床试验。本研究回顾性使用了大型多中心真实世界癌症数据库的数据,旨在比较使用抗PD-1/PD-L1单药(肿瘤免疫单药治疗(cancer immunotherapy-mono, CIT-mono))或联合化疗(CIT-chemotherapy,CIT-chemo)治疗PD-L1高表达的晚期NSCLC患者的临床结局。
1 方法 1.1 研究设计与数据获取回顾性观察队列分析使用美国Flatiron Health电子健康记录(electronic health record, EHR)衍生的去识别信息数据库的数据。该数据库是一个通过技术支持的图表抽象管理的纵向数据库,由去识别信息的患者结构化数据(例如人口统计学数据)和非结构化数据组成。在研究期间,去识别信息数据来源于美国约280个癌症诊所(约800个护理站点)。
从EHR系统中选择了:在2011年1月1日或之后在Flatiron Health网络就诊至少两次,病理符合NSCLC,并在2011年1月1日或之后诊断为ⅢB期、ⅢC期、ⅣA期或ⅣB期NSCLC;或诊断为早期或分期不详的NSCLC,但随后出现复发或进展的肺癌患者(ICD-9:162.x或ICD-10:C34x/C39.9)。本研究队列的基础是141 013例患者的概率样本,包括2016年10月24日之后确诊为晚期肺癌的患者。
在研究开始前,机构审查委员会已批准研究方案,并免除了知情同意。
转移诊断日期、转移部位及停止治疗的确认日期,这些与研究相关的特定数据通过人工提取确认。最终的队列包含了约1 000名患者,这些患者的信息经过提取确认,损耗图见图 1。

|
|
a: CIT-chemo包括不联合贝伐珠单抗的铂类双药治疗;排除参与临床试验的患者。b: 绝对中性粒细胞计数≥1500/mcl,血小板≥100 000/mcl,血红蛋白≥9 g/dl,血肌酐≤1.5×ULN,总胆红素≤1.5×ULN,AST和ALT≤2.5×ULN。c: 生命体征、服药、未取消的用药医嘱或实验室检测结果的记录。d: 为了限制密集的抽取过程,Flatiron为处理患者的随机样本提供了去识别数据(项目开始前的限制设置为大约1000名患者)。 ALT:丙氨酸转氨酶;AST:天冬氨酸转氨酶;chemo:化疗;CIT:肿瘤免疫治疗;ECOG:东部肿瘤协作组;EHR:电子健康记录;FH:Flatiron健康;NSCLC:非小细胞肺癌;TPS:肿瘤比例评分;ULN:实验室检测正常范围上限。 图 1 患者损耗图 |
最初纳入队列的患者必须符合以下纳入标准:≥18岁,ECOG体力状况评分0或1分,诊断为Ⅳ期NSCLC或早期NSCLC且随后发生肿瘤转移,PD-L1肿瘤比例评分(tumor proportion score, TPS)或表达PD-L1的肿瘤细胞(tumor cell, TC)≥1%,从2016年10月24日(CIT首次获批用于一线治疗)至2019年2月28日(最短随访时间≥12个月)期间,起始治疗采用PD-1/PD-L1抑制剂单药或联用铂类双药化疗作为一线治疗。根据Flatiron商业规则,由肿瘤医师基于治疗规范流程来定义肿瘤治疗线数(暴露)。研究设计时考虑了国家综合癌症网络指南中包括的治疗方案,但排除了联用贝伐珠单抗的患者。
此外,排除了参与临床试验,有证据表明伴EGFR、ROS1、BRAF或ALK易位驱动基因突变,存在器官和血液系统功能不全,以及ECOG体力状况评分缺失的患者。
在最初确定的955例患者队列中,有258例患者PD-L1表达 < 50%,CIT-mono非其标准治疗。在PD-L1≥50%的患者中,仅142例患者组织学为鳞癌,其中只有13例患者接受了联合治疗。为了使患者群体的同质性更好、疗效结局的比较更有意义,分析队列仅限于PD-L1表达≥50%的非鳞状NSCLC(non-squamous NSCLC, Nsq-NSCLC)患者。
1.3 研究终点指标主要终点为OS,定义为从起始一线治疗至全因死亡的时间。对于在研究截止时(2020年2月29日)未死亡的患者,将其最后一次确认活动日期(生命体征、用药、实验室检测结果或药物时间表中最后一次治疗事件的记录)作为删失日期。
Flatiron Health数据库中的死亡率信息来自电子病历中的结构化字段和非结构化文档。此外,电子病历数据还与外部死亡数据源关联,以填补电子病历中可能缺失的死亡日期[21]。
次要终点是真实世界的无进展生存期(real-world progression-free survival, rwPFS),使用影像学数据支持的临床锚定法进行评估[22-23]。RwPFS定义为从治疗开始至死亡或疾病进展的时间。疾病进展由医生基于影像学扫描或组织活检病理或临床评估确定。对于未发生死亡或疾病进展的患者,在研究截止前的最后一次临床记录日期删失其数据,若患者结构性活动数据间隔≥90 d,则更早删失。在rwPFS分析中,排除最后一次临床记录日期信息缺失且无疾病进展的患者。
1.4 统计分析使用标准统计学描述比较PD-1/PD-L1抑制剂单药治疗组(CIT-mono组)和PD-1/PD-L1抑制剂联合铂类双药化疗组(CIT-chemo组)的队列特征。分类变量以频率和百分比表示,连续变量以中位数及四分位间距(interquartile range, IQR)表示。采用Mann-Whitney U检验或Fisher精确检验比较治疗组间基线时的人口统计学和临床资料。
使用Kaplan-Meier方法和95%置信区间(confidence interval, CI)估计OS和rwPFS的中位数。使用Log rank检验评估两个治疗组间的差异。采用反向OS Kaplan-Meier法计算中位随访时间。
使用Cox比例风险回归模型估计风险比(hazard ratio, HR)和95%CI。使用预先设定的亚组分析评估脑转移、肝转移和吸烟史(从不吸烟:无吸烟史;目前/既往吸烟:有吸烟史)的影响。在亚组分析中,包含了一个治疗相互作用的亚组。
使用Schoenfeld残差和生存时间的相关性来检验比例风险假设。
通过倾向评分匹配法分析减少PD-1/PD-L1抑制剂单药(CIT-mono组)和联用铂类双药化疗启动剂(CIT-chemo组)间的系统性差异,并减少两组间因混杂因素不平等而产生的潜在偏倚。通过对关键预后因素(年龄、性别、种族、吸烟史、ECOG体力状况评分、转移类型、脑转移、肝转移和治疗开始时间)进行回归治疗分配(CIT-mono组vs. CIT-chemo组)并使用逆概率加权法(the inverse probability of treatment weighting methodology, IPTW)估计倾向评分。计算IPTW调整的HRs(IPTW-adjusted HRs, IPTW-aHRs)。使用标准化均数差(standardized mean difference, SMD)方法进一步评估治疗组间协变量加权后的平衡。失衡定义为SMD > 0.1。
根据Flatiron数据库,以起始治疗至因任何原因停止CIT治疗的时间计算治疗持续时间。未停止CIT治疗的患者在研究截止日期前最后一次确认活动的日期时删失。采用Kaplan-Meier法估计中位数和95%CI。
使用R软件进行所有统计分析,统计检验均为双侧检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 队列分析本研究共纳入520例PD-L1高表达(≥50%)Nsq-NSCLC患者,其中351例在一线转移治疗中使用CIT-mono,169例使用CIT-chemo。
患者及肿瘤的基线特征见表 1。CIT-mono组患者的年龄显著高于CIT-chemo组(CIT-mono组:31% < 65岁;37%≥75岁vs. CIT-chemo组:46% < 65岁;20%≥75岁,P < 0.001)。CIT-mono组52%的患者和CIT-chemo组44%的患者为女性(两组间无统计学差异,P=0.11)。CIT-mono和CIT-chemo组的大多数患者为白种人(分别70%;69%),来自美国南部(分别45%;54%)或东北部(分别21%;17%)地区。
两组中大多数患者有吸烟史(CIT-mono组为90%;CIT-chemo组为91%),ECOG PS评分1分(CIT-mono组为61%;CIT-chemo组为54%)。
两组患者肿瘤转移类型有显著差异,CIT-mono组患者中有77%为新发Ⅳ期,而CIT-chemo组中有93%(P < 0.001)。
CIT-mono组和CIT-chemo组分别有26%和30%的患者诊断时合并脑转移,分别有12%和17%的患者合并肝转移(P均无统计学意义)。关于其他转移部位的信息详见原著补充表S1。
CIT-mono组患者从疾病晚期诊断到开始一线治疗的中位时间为1.10个月(IQR:0.76~1.60),CIT-chemo组为0.92个月(IQR:0.69~1.40),均在1个月左右。
患者异质性见原著补充表S1,两个治疗组基线时原始数据和调整数据的SMD,均在倾向性评分加权后进行了说明。结果显示,初始异质性,特别是年龄和转移类型方面,在研究中很明显(SMD > 0.4),但经过调整后,所有变量都达到了同质性(所有SMD < 0.1)。
值得注意的是,在大多数病例中,PD-L1表达的检测方法为22C3(CIT-mono组和CIT-chemo组中分别为86%和85%)。已知伴EGFR、ALK、ROS-1或BRAF突变的NSCLC患者被系统性排除,而在大多数病例中,数据库中记录的局部EGFR、ALK、ROS-1突变阴性及BRAF阴性的比例分别为85%、81%、73%和48%(详见原著补充表S2A)。针对无吸烟史患者的类似生物标志物检测信息详见原著补充表S2B,其中90%为EGFR阴性。
2.2 治疗情况在CIT-mono组中,几乎所有患者都使用了帕博利珠单抗治疗,而CIT-chemo组的患者主要使用帕博利珠单抗联合卡铂和培美曲塞化疗(详见原著补充表S3)。两组治疗持续时间相似,CIT-mono组治疗中位时间为8.5个月(95%CI: 6.9~11.0个月),CIT-chemo组为7.3个月(95%CI: 5.5~11.2个月)(Log rank检验P=0.97)。在数据库截断时,CIT-mono组99例(28%)患者和CIT-chemo组51例(30%)患者仍在治疗。
值得注意的是,因任何原因中止治疗的患者(252例CIT-mono患者,118例CIT-chemo患者)中,有将近一半(CIT-mono组44%;CIT-chemo组47%)的患者接受了后续治疗。对于接受后续治疗的患者,CIT-mono组和CIT-chemo组分别有46%和23%的患者使用了含CIT的二线治疗。
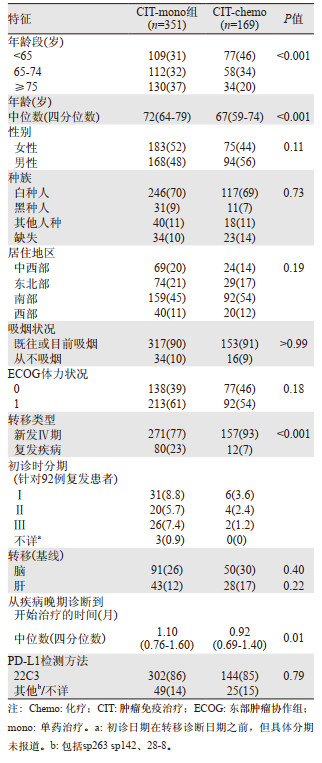
2.3 OSCIT-mono组中位随访时间为23.5个月(IQR:15.7~28.7个月),CIT-chemo组为19.9个月(IQR:14.9~26.3个月),两组分别观察到168例(48%)和78例(46%)患者死亡。记录的中位OS分别为22.1个月(95%CI: 18.3~30.3个月)和21.0个月(95%CI: 15.3个月~无法估计)(未调整数据:图 2A;IPTW调整后数据:原著补充图S2)。两组患者未调整的OS(HRcombo_versus_mon=0.98,95%CI: 0.75~1.28,P=0.87)和IPTW调整的OS(IPTW-aHRcombo_versus_mono=1.03,95%CI: 0.77~1.39,P=0.83)差异均无统计学意义。
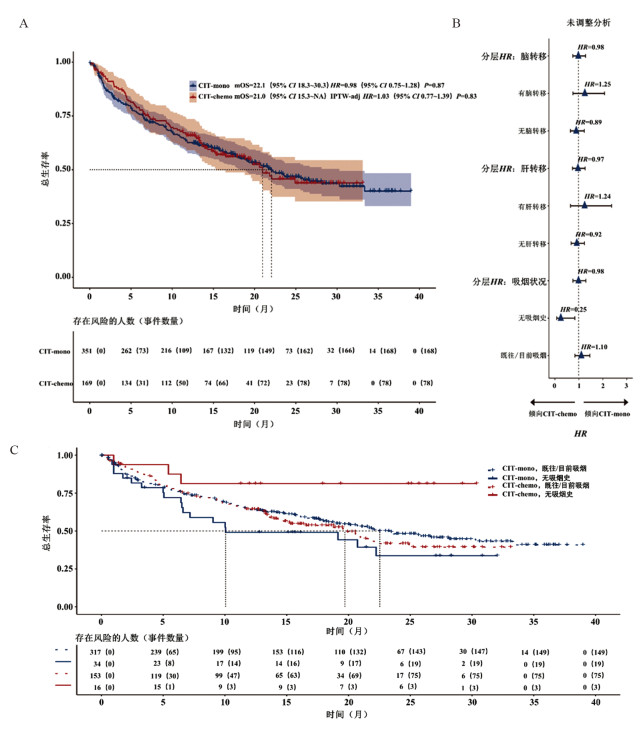
|
| IPTW-adj:调整的逆概率加权法。A:两治疗组总生存期的Kaplan-Meier图。B:基于感兴趣的临床变量分层的治疗效果探索性分析。C:按治疗和吸烟状况分组的总生存期的Kaplan-Meier图。 图 2 总生存期 |
此外,预先设定的脑/肝转移和吸烟状况的亚组分析中(图 2B),吸烟状况显著影响OS的疗效差异(交互P=0.02),表明无吸烟史的患者亚组中(n=50),CIT-chemo较CIT-mono显著获益(HR=0.25;95%CI: 0.07~0.83)(图 2C)。脑/肝转移组治疗效果差异无统计学意义(详见原著补充图S3A和B)。
2.4 RwPFS在CIT-mono组中,170例(50%)患者出现疾病进展或死亡,中位rwPFS为11.5个月(95%CI: 8.1~15.0个月),而在CIT-chemo组,87例(53%)患者出现进展或死亡,中位rwPFS为10.8个月(95%CI: 9.0~15.3个月)(未调整数据:图 3A;IPTW调整数据:原著补充图S4)。
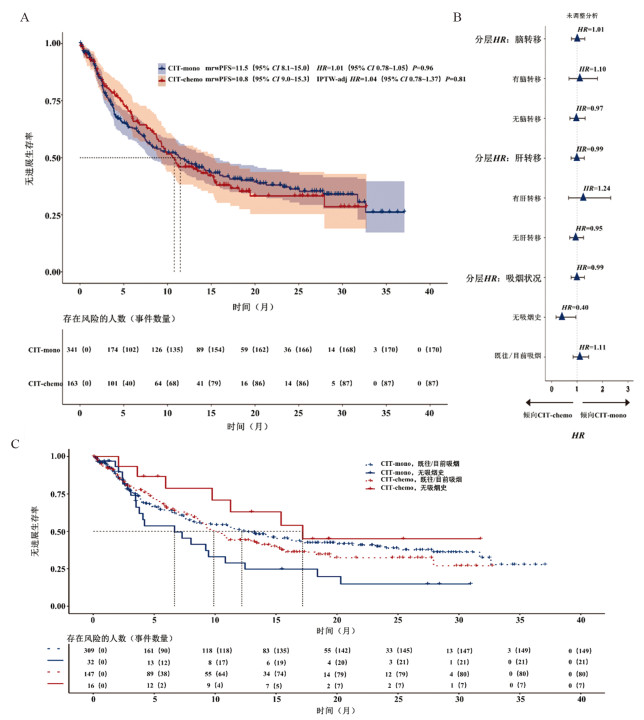
|
| mrw:真实世界中位数据;rw:真实世界数据。A:按治疗分组的rwPFS的Kaplan-Meier图。由于缺少最后一次临床记录日期的信息,520例患者中有16例被排除在rwPFS分析之外。未调整的Cox模型(Schoenfeld残差检验)违背了比例风险假设,而调整后的模型则满足比例风险假设。B:基于感兴趣的临床变量分层的治疗效果探索性分析。C:按治疗和吸烟状态分组的rwPFS的Kaplan-Meier图。 图 3 RwPFS |
与OS的结果一样,CIT-chemo组和CIT-mono组间的rwPFS差异无统计学意义(HRcombo_versus_ mono=1.01,95%CI: 0.78~1.05,P=0.96;IPTW-aHRcombo_versus_mono=1.04,95%CI: 0.78~1.37,P=0.81)。
类似地,在对rwPFS的亚组分析中(图 3B),对于无吸烟史的患者(n=50),CIT-chemo组较CIT-mono组患者的rwPFS显著获益(与OS类似)(HR=0.40;95%CI: 0.17~0.95,交互P=0.04)。图 3C显示了根据不同治疗和吸烟状态分组的Kaplan-Meier曲线,原著补充图显示了根据脑/肝转移状态分组的Kaplan-Meier曲线(原著补充图S5A和B)。
值得注意的是,两个治疗组间早期进展(3个月时间点之前的PFS事件)患者的百分比相似(CIT-chemo组20%,CIT-mono组17%,P=0.48),其基线特征未观察到显著差异(原著补充表S4)。
3 讨论在PD-L1高表达(定义为PD-L1在≥50%的TC上表达)的晚期NSCLC中,抗PD-L1一线单药治疗以及抗PD-1/PD-L1±抗CTLA-4联合化疗在各组织学亚型中均为可用的治疗选择,然而抗PD-L1+贝伐珠单抗联合化疗仅作为Nsq-NSCLC的一种治疗选择[8, 10, 11, 16-18, 24-28]。检查点抑制剂单药治疗(CIT-mono)具有避免化疗固有毒性的优势,但若患者对免疫治疗无反应,则可能增加患者早期进展的风险。
到目前为止,除了PD-L1之外,尚无其他生物标志物可在该治疗环境中指导临床决策[29]。大多数临床医生倾向于根据患者的实际情况(如患者是否虚弱或存在快速进展的风险)来选择CIT-mono或CIT-chemo治疗方案。实际上,几项NSCLC研究已经证实,与联合化疗组相比,不联合化疗的免疫治疗策略使部分亚组患者发生早期疾病进展,随后报道了在治疗前3~6个月出现了过多早期死亡[8-10, 25, 28]。
然而,目前仍然没有公认的与较差的免疫治疗结果相关的临床特异性指标、生物学指标或病理指标,用来指导合理的治疗选择。在部分随机研究[11, 27, 30]中,严格筛选PD-L1高表达患者确实明显降低了免疫治疗组患者早期疾病进展的发生率,但早期疾病进展仍无法完全避免。
由于目前尚无比较PD-L1高表达NSCLC患者使用CIT-mono或CIT-combo的随机研究数据,本研究使用Flatiron数据库的数据特别评估了真实世界中这部分患者的预后。本研究中大于75岁的患者比例很高,清晰反映了仅纳入严格筛选的患者的临床研究结果很难适用于日常临床实践。接受CIT-mono治疗的Nsq-NSCLC患者比接受CIT-combo治疗的患者年龄更大,患者的体质较弱可能是选择CIT-mono治疗的临床因素之一。此外,接受CIT-mono的患者出现疾病复发的频率更高,提示既往化疗和(或)放疗暴露可能是另一个临床因素。
尽管存在某些不平衡,在使用IPTW法调整了已知的预后因素后,PD-L1高表达的Nsq-NSCLC患者使用CIT-mono或CIT-combo的总中位OS和rwPFS无显著差异。对于合并与预后不良相关肿瘤转移的患者同样如此,尤其是合并脑或肝转移的患者,通常认为其出现症状性早期进展的风险更大,理论上免疫单药治疗的风险更高,但使用单药或联合治疗的患者并无显著疗效差异。因此,上述结果可能不支持将这部分患者排除在CIT单药治疗之外。
本研究中设定的亚组分析发现了基于吸烟状态分组的结果差异,尽管样本量小,但表明CIT-chemo较CIT-mono使既往无吸烟史的患者显著获益。在大多数CIT-mono[8-10, 25, 28]或CIT双药[12-14]临床研究中,以及仅使用短疗程化疗的CheckMate 9LA研究[18]中,尽管排除了已知EGFR或ALK基因突变的患者,但对于无吸烟史人群,CIT-mono的表现一直较差。但是在使用高PD-L1表达作为筛选标准的CIT-mono研究中[12, 27, 30],无吸烟史患者接受CIT-mono后观察到的结局较差的情况相对减轻。尽管无吸烟史,PD-L1高表达可能反映预先存在免疫激活。值得注意的是,最近一项研究纳入了PD-L1高表达(≥50%)的NSCLC患者,随机给予抗PD-1西米普利单抗或铂类药物化疗,与既往类似研究结果不同,该研究发现CIT-mono组患者的HR更优[11],可能由于该研究排除了无吸烟史以及癌基因成瘾的NSCLC患者。在CIT-combo研究中未观察到无吸烟史对包含免疫治疗研究臂患者的不利影响[17, 19, 24, 26, 31]。免疫治疗联合化疗能否改善OS,特别是对于无吸烟史,及EGFR、ALK、ROS和RET癌基因成瘾的患者群体,仍有待前瞻性研究进一步证实,目前仍在评估中。
根据交叉研究的比较,PD-L1高表达肿瘤患者的现有数据表明,与CIT-combo相比,CIT-mono的客观缓解率较低[32]。本研究提供了rwPFS和OS的数据,但由于分析中使用的数据性质,无法采用盲法独立中心评审,进而无法收集疗效反应信息。值得注意的是,一项对PD-1治疗后NSCLC反应强度相关性的分析显示,所有程度的肿瘤退缩均与PFS或OS显著延长相关[33]。本研究纳入了Nsq-NSCLC患者,无论有无吸烟史,发现CIT-mono组较CIT-combo组患者的rwPFS在治疗的前几个月出现了更大幅度的下降,这一结果也印证了比较CIT-mono和化疗的随机研究中观察到的早期疾病进展过多的情况。然而,这种早期PFS动力学并没有减少CIT-mono患者的OS或rwPFS获益。该结果也与评估在化疗基础上联合抗PD-L1治疗的研究[16, 19]的长期分析数据一致,表明与CIT-mono相比,CIT-combo的患者长期生存并无显著改善[30],这似乎主要依赖于PD-L1的表达水平。因此,本研究提示,对于PD-L1高表达的患者,CIT联合化疗可以预防早期进展,但不能增加长期获益于CIT的患者比例。
本研究无法避免真实世界研究的一些固有局限性。首先,由于两组患者初始治疗时间相近,可以合理排除永恒时间偏倚(immortal time bias)。而因患者失访导致的偏倚无法避免,虽然在两组队列中这种情况可能相当。其次,rwPFS不能与临床研究中根据RECIST标准评估的PFS进行比较,但在两组中反映了现实生活中如何做出治疗决策。再次,本研究中评估的临床亚组未使用倾向性评分加权。对于临床定义的亚组结果,如无吸烟史的亚组,由于多重检验、样本量较小和未经IPTW调整,须谨慎解读。
对于整个队列的分析,本研究通过对关键预后因素(年龄、性别、种族、吸烟史、ECOG体力状态评分、转移类型、脑转移、肝转移和开始治疗的时间)进行回归治疗分配(CIT-mono vs CIT-combo)来估计倾向性评分。重要的是,对于全队列分析,通过对上述患者特征进行倾向性评分加权调整后,获得了良好的平衡,所有结果都低于SMD的切点值(0.1)。
RWD分析的最终结论表明,除了无吸烟史的患者,一线CIT治疗中联合化疗对生存结局没有显著影响。抗PD-1/PD-L1一线单药治疗仍然是有吸烟史和PD-L1高表达(> 50%)患者的标准治疗方案。正在进行的比较抗PD-1/PD-L1单药治疗和抗PD-1/PD-L1联合化疗(NCT03793179、NCT04547504)的随机临床研究应该能够更好地区分从上述两种治疗策略中获益的患者。
致谢:
感谢默沙东(中国)投资有限公司郑尧杰和李华为本文翻译提供学术支持,感谢上海北翱医药科技有限公司为本文提供辅助编辑工作,感谢默沙东(中国)投资有限公司的支持。
版权声明:
本文原文“Effectiveness of PD-(L)1 inhibitors alone or in combination with platinum-doublet chemotherapy in first-line (1L) non-squamous non-small-cell lung cancer (Nsq-NSCLC) with PD-L1-high expression using real-world data”,首次发表在Annals of Oncology, 2022, 33(5): 511-521. 本次二次发表已取得版权所有者©2022 Elsevier出版社的同意,对原文进行翻译,不涉及一稿多投及侵犯版权等问题。
专家点评孙浩,吴一龙
近年来,以ICIs为代表的免疫治疗为EGFR、ALK等特定驱动基因阴性的非小细胞肺癌患者带来新的一线治疗选择。目前在我国获批了两种免疫治疗模式:一种是ICIs联合化疗,多项临床研究显示[1-2],无论PD-L1表达水平,对比单纯化疗,ICIs联合化疗均能为患者带来显著的临床获益。而另外一种ICIs单药治疗为患者提供了去化疗治疗方案的可能性,其疗效获益与PD-L1表达水平具有相关性。KN-042研究已经表明,尽管在所有PD-L1阳性表达分层群体,帕博利珠单抗单药治疗相较于化疗均能显著延长OS,而整体获益最显著的还是其中PD-L1 TPS≥50%的患者群体[3]。随着ICIs在晚期NSCLC的广泛应用,尽管去化疗模式为诸多追求生存质量的患者带来了福音。但对于更优方案、更长临床获益的追求,让我们始终无法回避一个问题:对于PD-L1≥50%的晚期NSCLC患者,在免疫单药的基础上,增加化疗联合治疗方案,能否为该群体带来更显著的临床获益呢?或者哪些PD-L1高表达的群体,可能更适合联合治疗方案?
Pérol等在Annals of Oncology发表的一项基于真实世界数据的研究或许能为回答该问题提供了一些参考[4]。这项回顾性研究纳入了来自美国Flatiron HealthEHR数据库中520例PD-L1 TPS≥50%的Nsq-NSCLC患者,其中351例患者使用ICIs单药治疗,169例使用ICIs联合化疗,评估使用两种免疫治疗方案的患者OS以及rwPFS,旨在比较PD-L1高表达群体中两种不同治疗模式的优劣性。最终,整体研究结果显示,无论是OS还是rwPFS,两种治疗方案差异均无统计学意义。也就是说,在该研究中,对于高表达整体人群来讲,增加联合化疗方案并未能带来更优的临床获益。
那是否有更多的亚组分析数据来进一步细分人群?在该研究的探索性分析中发现,无吸烟史的患者,相较于ICIs单药治疗,接受ICIs联合化疗的OS和rwPFS表现更优[4]。同样地,在既往免疫单药临床研究的亚组分析中,也看到了同样的趋势[5-7]。但是需要注意的是,在以PD-L1高表达为入组标准的回顾性分析中,这种差异性并不明显,这就表明,PD-L1高表达可能本身与免疫激活状态相关,且独立于吸烟状态[8-9]。同时,由于吸烟状态往往还会决定驱动基因的分布情况,所以对于吸烟状态与高表达群体疗效相关性的数据,尚需警惕过度解读。此外,该研究表明,对于合并特定转移占位的患者,包括合并脑转移和肝转移的亚组,增加联合化疗方案并无显著提高OS和rwPFS。
相对真实世界研究的研究结果而言,临床研究的汇总分析可以为我们提供更有力的证据。FDA在今年针对PD-L1 TPS≥50%的晚期NSCLC公布了另外一项研究的分析结果[10],这项研究对经FDA批准上市的ICIs所对应的12项随机对照试验进行了汇总分析,结果显示,对于PD-L1 TPS≥50%的患者采用免疫联合化疗方案,可以延长PFS、提高ORR,增加免疫治疗的短期疗效,然而,相较于免疫治疗单药来说,OS有数值优势但并无显著统计学差异。在随后的亚组分析中发现≥75岁的患者选用免疫单药治疗可能会有更好的临床获益。
值得注意的是,上述两项研究的基线特征是不同的,尤其是≥75岁的患者比例,在FDA汇总分析[10]中为11%(免疫单药组)vs. 10%(免疫联合化疗组),在Pérol等[4]研究中为37%(免疫单药组)vs. 20%(免疫联合化疗组)。这表明,在临床实践中,高龄是为患者选择单药治疗的重要特征。这些结果提示相较于接受免疫联合化疗,真实世界中接受免疫单药的≥75岁的患者更多。此外,对于PD-L1高表达的老年患者,在免疫治疗基础上增加化疗并没有带来更好的疗效,反而有增加不良反应的风险。
同样,该研究不可避免地存在一定局限性:首先,该真实世界研究组间基线特征并不平衡,同时,对于临床定义的亚组结果,如无吸烟史的亚组,由于多重检验、样本量较小和未经IPTW调整,须谨慎解读。但这些局限性并不影响这项真实世界研究为临床实践提供宝贵的参考依据:在临床实践中,对于高龄、不愿接受化疗的PD-L1高表达晚期NSCLC患者,免疫单药治疗更倾向于能为这些患者带来更理想的生存获益。当然,后续需要当前正在进行的比较抗PD-1/PD-L1单药治疗和抗PD-1/PD-L1联合化疗(NCT03793179、NCT04547504)的随机对照临床研究数据,来进一步更严谨地论证该问题。
利益冲突声明:
所有作者均声明不存在利益冲突。
| [1] |
Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated Analysis From KEYNOTE-189: Pembrolizumab or Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2020, 38(14): 1505-1517. DOI:10.1200/JCO.19.03136 |
| [2] |
Paz-Ares L, Vicente D, Tafreshi A, et al. A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407[J]. J Thorac Oncol, 2020, 15(10): 1657-1669. DOI:10.1016/j.jtho.2020.06.015 |
| [3] |
Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus Chemotherapy for Previously Untreated, PD-L1-Expressing, Locally Advanced or Metastatic Non-Small-Cell Lung Cancer (KEYNOTE-042): A Randomised, Open-Label, Controlled, Phase 3 Trial[J]. The Lancet, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [4] |
Pérol M, Felip E, Dafni U, et al. Effectiveness of PD-(L)1 Inhibitors Alone or in Combination with Platinum-Doublet Chemotherapy in First-Line (1L) Non-Squamous Non-Small-Cell Lung Cancer (Nsq-NSCLC) with PD-L1-High Expression Using Real-World Data[J]. Ann Oncol, 2022, 33(5): 511-521. DOI:10.1016/j.annonc.2022.02.008 |
| [5] |
Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus Chemotherapy for Previously Untreated, PD-L1-Expressing, Locally Advanced or Metastatic Non-Small-Cell Lung Cancer (KEYNOTE-042): A Randomised, Open-Label, Controlled, Phase 3 Trial[J]. Lancet, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [6] |
Reck M, Ciuleanu TE, Lee JS, et al. First-Line Nivolumab Plus Ipilimumab Versus Chemotherapy in Advanced NSCLC With 1% or Greater Tumor PD-L1 Expression: Patient-Reported Outcomes From CheckMate 227 Part 1[J]. J Thorac Oncol, 2021, 16(4): 665-676. DOI:10.1016/j.jtho.2020.12.019 |
| [7] |
Jassem J, de Marinis F, Giaccone G, et al. Updated Overall Survival Analysis From IMpower110: Atezolizumab Versus Platinum-Based Chemotherapy in Treatment-Naive Programmed Death-Ligand 1-Selected NSCLC[J]. J Thorac Oncol, 2021, 16(11): 1872-1882. DOI:10.1016/j.jtho.2021.06.019 |
| [8] |
Reck M, Rodríguez-Abreu D, Robinson AG, et al. Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater[J]. J Clin Oncol, 2019, 37(7): 537-546. DOI:10.1200/JCO.18.00149 |
| [9] |
Reck M, Rodríguez-Abreu D, Robinson AG, et al. Five-Year Outcomes With Pembrolizumab Versus Chemotherapy for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score ≥50%[J]. J Clin Oncol, 2021, 39(21): 2339-2349. DOI:10.1200/JCO.21.00174 |
| [10] |
Akinboro O, Vallejo JJ, Nakajima EC, et al. Outcomes of Anti–PD-(L)1 Therapy with or without Chemotherapy (Chemo) for First-Line (1L) Treatment of Advanced Non-Small Cell Lung Cancer (NSCLC) with PD-L1 Score ≥50%: FDA Pooled Analysis[J]. J Clin Oncol, 2022, 40(16_suppl): 9000-9000. DOI:10.1200/JCO.2022.40.16_suppl.9000 |
 2023, Vol. 50
2023, Vol. 50