文章信息
- 带前导肽的人锰超氧化物歧化酶抗顺铂诱导的肾损伤效应
- Anti-cisplatin-induced Renal-injury Effect of Human Manganese Superoxide Dismutase with Leader Peptide
- 肿瘤防治研究, 2023, 50(7): 675-680
- Cancer Research on Prevention and Treatment, 2023, 50(7): 675-680
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1465
- 收稿日期: 2022-12-12
- 修回日期: 2023-05-05
2. 350014 福州, 福建医科大学肿瘤临床医学院/福建省肿瘤医院放射生物学研究室
2. Laboratory of Radiation Biology, Clinical Oncology School of Fujian Medical University & Fujian Cancer Hospital, Fuzhou 350014, China
活性氧(reactive oxygen species, ROS)是包括超氧阴离子(O2·-)、过氧化氢(H2O2)、羟自由基(·OH)等在内氧的还原产物的统称。细胞内产生的过量ROS会损伤胞内重要的生物大分子(如蛋白质和DNA等),称为氧化损伤。超氧化物歧化酶(superoxide dismutase, SOD)是机体中唯一可以清除O2·-的抗氧化酶,在所有生物中都不可或缺。人体细胞中定位于线粒体的MnSOD(SOD2)在细胞中以N端前导肽线粒体靶向序列(mitochondrion targeting sequence, MTS)加成熟SOD2组成的前体蛋白形式合成,MTS将前体蛋白引导进线粒体基质后被降解,从而生成具有酶活性的成熟SOD2[1]。因此现有的人源SOD2重组蛋白都以成熟SOD2的方式进行生产,已知的SOD2结构也均源于成熟SOD2。然而,人们在人脂肪肉瘤细胞LSA中发现了一种30 kDa的人源SOD2异构体(LSA-type-Mn-SOD),该类型SOD2以携带MTS前导肽的形式存在,并且MTS前导肽具有介导蛋白进入细胞的能力[2]。
虽然成熟SOD2早已被证明是一种强大的保护和治疗剂,可用于抗氧化应激相关的疾病,如肾损伤[3]以及电离辐射所引起的辐射损伤[4]等,但失去MTS前导肽的SOD2受其分子量限制也失去了跨膜进入细胞的能力,无法清除细胞内的多余自由基。然而,氧化损伤的根源来自细胞内积累的多余自由基。例如化疗药顺铂(DDP),临床上常用于治疗卵巢癌、肝癌和肺癌等恶性肿瘤[5-7],其会在胞内产生大量的O2·-和·OH,这些ROS在杀死肿瘤细胞的同时也会引起机体正常细胞的氧化损伤,进而导致化疗不良反应,如化疗性肾损伤[8-9]。
因此,为充分发挥SOD2的抗氧化性能,本研究前期合成了源于人肝细胞的SOD2全长基因,得到25 kDa带有MTS前导肽的全长SOD2重组蛋白(MTS-SOD2),证实其也具有跨膜活性,且在生理条件下具有良好的SOD活力[10]。鉴于MTS前导肽的分子量约2 kDa,其与SOD2的融合是否会影响SOD2的结构与功能呢?为此,本研究拟进一步探究前导肽MTS对SOD2结构以及抗DDP诱导的肾损伤能力的影响,并对比MTS-SOD2与临床使用化疗防护剂阿米福汀(AMFT)的作用效果,为MTS-SOD2的临床应用奠定基础。
1 材料与方法 1.1 菌株及实验动物GST-SOD2及GST-MTS-SOD2重组菌株均为本实验室构建并保存。昆明(KM)小鼠(雄性,6周龄,体质量约18±1 g)购自福建吴氏实验动物公司,动物实验遵守相关实验动物福利规定,动物实验方案经福州大学生物科学与工程学院实验动物伦理委员会批准,批准号为科审2019-SG-165。
1.2 主要试剂牛凝血酶购自北京博尔西科技有限公司;注射用阿米福汀(天地达)购自南京绿叶制药有限公司;DDP购自江苏豪森药业集团有限公司;BCA蛋白含量测定试剂盒购自美国Thermo公司;SOD、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)、尿素氮(BUN)和肌酐(Cr)测定试剂盒均购自南京建成生物工程研究所。
1.3 MTS-SOD2结构预测以PDB数据库中人源成熟SOD2晶体结构5vf9为模板,利用同源建模软件Modeller 10.1构建MTS-SOD2三级结构,通过loop区优化得到最终模型后用SAVES评估预测结构的质量(http://services.mbi.ucla.edu/SAVES/)。以PyMOL绘制并比较SOD2和MTS-SOD2三维结构。
1.4 SOD2和MTS-SOD2重组蛋白的制备参照文献[10]分别制备得到SOD2(简称S)与MTS-SOD2(简称MS)重组蛋白。以试剂盒分别测定重组蛋白的蛋白含量和SOD活力。最终纯化得到SOD2与MTS-SOD2重组蛋白的SOD比活力分别为(1740±60)U/mg和(1980±70)U/mg。
1.5 MTS-SOD2重组蛋白抗DDP诱导的肾损伤效应 1.5.1 实验分组将KM小鼠随机分为7组,每组8只。正常组(Untred)仅注射PBS;另外6组分别为单纯DDP损伤组(Ctrl)、SOD2+DDP组(S)、MTS-SOD2(低、中和高剂量)+DDP组(MS-L、MS-M和MS-H)、阳性对照AMFT+DDP组(AMFT)。实验分组、给药剂量及流程,见图 1。
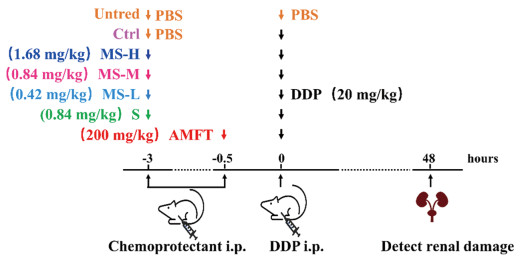
|
| i.p: intraperitoneal injection. 图 1 小鼠实验设计图 Figure 1 Schematic of the mice experiment |
小鼠经眼框取血后收集血清,按试剂盒说明书方法检测血清BUN和Cr水平。
1.5.3 小鼠肾脏指数分析小鼠处死后,切除肾脏组织并拍照、称重,小鼠肾脏指数(renal index)按以下公式计算:Renal index(%)=(肾脏质量/小鼠处死前体质量)×100%。
1.5.4 小鼠肾脏抗氧化指标测定取适量肾脏组织按照9倍质量比加入0.9%氯化钠溶液,匀浆,离心取上清液,试剂盒法分别检测肾脏MDA水平、GSH-Px活力、CAT活力、SOD活力及T-AOC。
1.5.5 小鼠肾脏组织病理分析取肾脏组织制成石蜡切片,并用苏木精和曙红(HE)染色,然后使用正置显微镜(×200)进行组织病理学检查。
1.6 统计学方法所有数据均表示为x±s,数据统计分析利用Microsoft Excel 365与GraphPad Prism 8.0软件进行,One-way ANOVA进行统计学分析,P < 0.05为差异有统计学意义。
2 结果 2.1 前导肽MTS对SOD2结构的影响MTS-SOD2单体的预测结构见图 2A,包含两个结构域,N端结构域由2个长的反平行螺旋所占据,C端结构域是一个α+β桶结构,其中还包含有一个三链折叠,前导肽MTS以无规卷曲的方式位于N末端。SAVES软件分析结果显示该预测模型的结构较为合理。由图 2B可知,预测所得的MTS-SOD2整体结构与成熟SOD2的结构十分相似,二者的C端结构域基本重合,但N端结构域中的两个α-螺旋则产生了较大的偏移。在成熟SOD2单体的活性部位,Mn原子都具有4个配位残基,其中3个His和1个Asp,MTS-SOD2活性中心的4个配位残基与成熟SOD2相比都发生了一定程度的偏转,见图 2C。
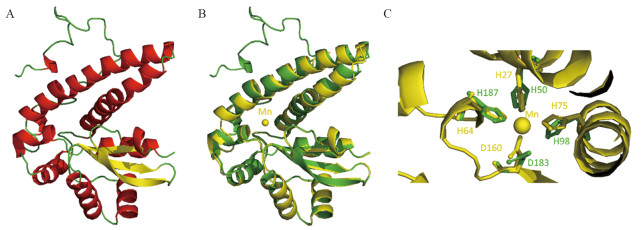
|
| A: simulated 3D structure of MTS-SOD2 monomer; B: 3D structure alignment of MTS-SOD2 monomer (green) and mature SOD2 monomer (a chain of 5vf9, yellow); C: alignment of active sites of MTS-SOD2 monomer (green) and mature SOD2 monomer (a chain of 5vf9, yellow). 图 2 MTS-SOD2单体三级结构模拟图 Figure 2 Simulated 3D structure of MTS-SOD2 monomer |
BUN和Cr是肾功能的重要指标,可直接体现肾脏中肾小球的滤过功能。由图 3可知,DDP损伤使小鼠BUN和Cr水平分别提高了2.1倍和1.1倍(P < 0.0001)。与Ctrl组相比,AMFT组损伤鼠的BUN和Cr水平均显著降低(P < 0.0001),预给予SOD2(S组)对损伤鼠的Cr和BUN水平均无保护作用,三种剂量的MTS-SOD2均可显著降低损伤鼠BUN水平(P < 0.001),但仅MS-M组可同时显著下降损伤鼠的Cr水平(P < 0.01)。
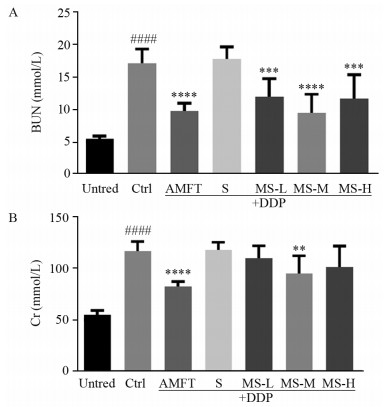
|
| Error bars are the x±s (n=8). ####: P < 0.0001, compared with the Untred group; **: P < 0.01, ***: P < 0.001, ****: P < 0.0001, compared with the Ctrl group. 图 3 MTS-SOD2对DDP损伤鼠BUN(A)及Cr水平(B)的影响 Figure 3 Effect of MTS-SOD2 on BUN(A) and Cr level(B) in DDP-injured mice |
结果表明,DDP不会对各组小鼠的肾脏大小产生显著影响,见图 4A,但肾脏的表观色泽和组织结构有改变。DDP使损伤鼠(Ctrl组)肾脏颜色由红转白,组织结构受损严重,出现明显的肾间质炎性反应细胞浸润(图中白色箭头标示),肾间质水肿,以及肾小管上皮细胞脱落。与Ctrl组相比,S组小鼠肾脏表观及组织结构均无改善,AMFT组和MS蛋白组损伤鼠的肾脏颜色和组织结构均有不同程度的恢复,其中以MS-M组效果最佳,该组损伤鼠肾脏色泽基本恢复至正常鼠水平,见图 4B。
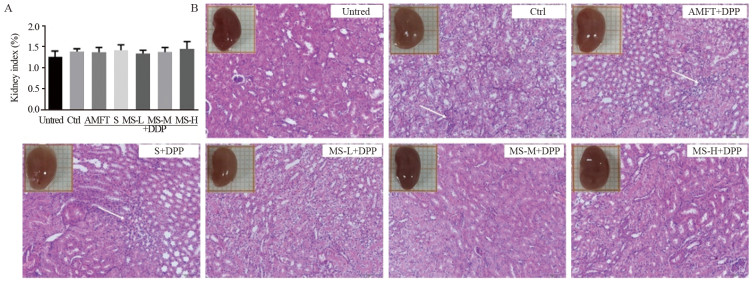
|
| A: error bars are x±s (n=8); B: hematoxylin-eosin staining. Images were taken under a light microscope (200×). Scale bar=50 μm. White arrow: inflammatory cells. 图 4 MTS-SOD2对DDP损伤小鼠的肾脏指数(A)和肾脏表观及病理(B)的影响 Figure 4 Effect of MTS-SOD2 recombinant protein on kidney index(A), appearance, and pathology changes(B) in DDP-injured mice |
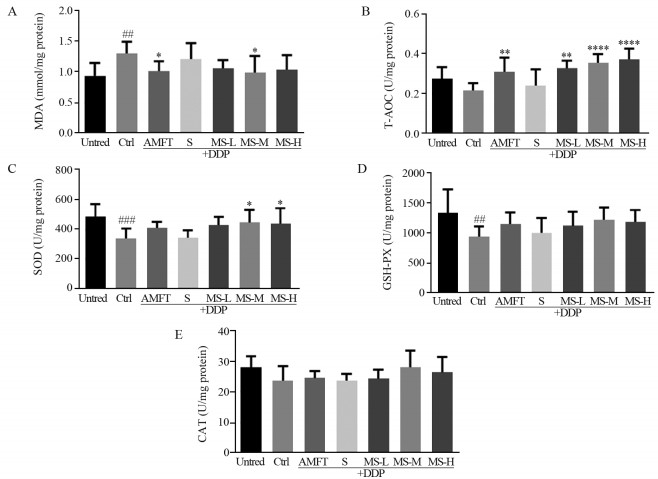
脏器组织抗氧化体系平衡的变化可反映该脏器组织因氧化应激而导致的氧化损伤程度。其中MDA水平反映了机体组织细胞受自由基攻击的严重程度,是组织细胞内ROS水平的间接指标,T-AOC活力则可反映组织细胞整体的抗氧化能力。由图 5可知,与Untred组相比,DDP损伤使Ctrl组小鼠肾脏MDA水平显著上升(P < 0.01),T-AOC、SOD和GSH-Px水平显著下降(P < 0.01),而CAT水平则无显著变化(P > 0.05)。与Ctrl组相比,S组损伤鼠肾脏的各个抗氧化指标均无改善,AMFT组和MS组损伤鼠肾脏的抗氧化指标则有不同程度的改善。MS组中MS-M组的作用效果最好,该组别与AMFT组的损伤鼠肾脏MDA水平较Ctrl组均显著降低(P < 0.05),T-AOC水平均显著提高(P < 0.0001,P < 0.01),GSH-PX活力均有所增加,但都无显著性。但与Ctrl组相比,则仅有MS-M组和MS-H组损伤鼠肾脏的SOD活力显著升高(P < 0.05)。
|
| Error bars are x±s (n=8). ##:P<0.01, ###:P<0.001, compared with the Untred group; *: P<0.05, **: P<0.01, ****: P<0.0001, compared with the Ctrl group. 图 5 MTS-SOD2对DDP损伤小鼠肾脏MDA水平(A)、T-AOC(B)、SOD活力(C)、GSH-PX活力(D)和CAT活力(E)的影响 Figure 5 Effect of MTS-SOD2 pretreatment on MDA level (A), T-AOC(B), SOD activity(C), GSH-PX activity(D), and CAT activity(E) of kidney in DDP-injured mice |
DDP是使用最广泛和最有效的化疗药物之一,但其同时还会导致ROS依赖性肾小管损伤和肾凋亡[11],而O2·-是导致损伤的关键ROS[9]。
既然DDP所致肾损伤根源于ROS所致的氧化损伤,那可清除ROS的物质就可预防DDP所致氧化损伤。小分子抗氧化剂是通过中和ROS来产生抗氧化效应,小分子抗氧化剂如维生素C和维生素E已被证明可以改善由DDP诱导的健康大鼠和小鼠的肾毒性和氧化损伤,但研究同时表明使用维生素降低DDP损伤的作用是剂量依赖性的[12-13]。大剂量使用维生素C会引起人体消化系统、泌尿系统、心血管系统及血液系统的不良反应[14]。而大量服用维生素E可能导致生殖功能障碍、肌酸尿、胃肠道不适、疲倦乏力、下肢水肿等不良反应[15]。
AMFT是FDA唯一批准用于预防DDP诱导的非小细胞肺癌和晚期卵巢癌患者肾毒性的药物[16-17]。它是一种有机硫化磷化合物,是小分子抗氧化剂的代表,可直接与烷化剂、铂类化疗药物等的活化代谢产物结合,从而降低化疗药物毒性的作用,但是多年的临床研究发现AMFT会引起患者的口干、头晕、恶心和呕吐等不良反应,使其在临床的使用受限[18]。
与小分子抗氧化剂相比,抗氧化酶则是作为生物催化剂清除ROS,自身不参与反应,因此其清除ROS的能力具有高效性,使用剂量远小于小分子抗氧化剂,这也使其具有更好的使用安全性。然而,与小分子抗氧化剂相比,天然抗氧化酶无法进入细胞,清除胞内多余的ROS致使其在抗机体氧化损伤中的应用受限。
在众多的抗氧化酶中,SOD是唯一一类可以清除O2·-的天然酶,由于线粒体是O2·-的发源地,因此位处线粒体的SOD2最为重要。在前期研究中,我们通过基因重组得到具有SOD2活力的可跨膜MTS-SOD2重组蛋白[10]。本研究首先通过蛋白质结构预测发现MTS-SOD2的整体三级结构与成熟SOD2的十分相似,但MTS会对SOD2的部分二级结构造成影响,进而使SOD2活性中心与Mn原子配位的关键残基发生偏转。由于MTS-SOD2具有高于成熟SOD2的比活力,可推测MTS前导肽所带来的结构变化对SOD2的活性具有积极的促进作用。未来将进一步测定MTS-SOD2晶体结构,深入分析MTS前导肽提高SOD2蛋白SOD活性的原因。
此外,本研究结果证实了能进入细胞是抗氧化酶可充分发挥其抗DDP诱导的氧化损伤作用的关键。在使用DDP之前预给予中剂量(0.84 mg/kg)可跨膜的MTS-SOD2可以显著降低损伤鼠肾脏组织MDA水平,显著提高损伤鼠肾脏组织SOD的活力,从而显著提高T-AOC活力,进而改善肾脏组织病理变化,恢复损伤鼠肾功能。预给予0.84 mg/kg MTS-SOD2的整体保护效果与200 mg/kg的AMFT相当甚至优于后者。然而,预给予同样剂量无MTS前导肽的SOD2却基本无效。由于酶的活性都具有高度的专一性,本研究结果也证实了DDP诱导产生的ROS中最为重要的是O2·-。
由于多数化疗药以及放射治疗都是通过诱导生成ROS导致正常细胞的氧化损伤而形成放化疗不良反应,相较于需要大剂量使用的小分子抗氧化剂,具有高度专一性和高效的MTS-SOD2无疑更具有成为新型放化疗防护剂的潜力。未来将进一步探究MTS-SOD2蛋白抗DDP损伤的分子机制及使用安全性。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
潘剑茹:实验设计与实施、数据分析及文章撰写
韩亚南、何夏琪、叶小强:部分实验实施及数据处理
何火聪:方法指导及文章审校
| [1] |
Frye KA, Sendra KM, Waldron KJ, et al. Old dogs, new tricks: New insights into the iron/manganese superoxide dismutase family[J]. J Inorg Biochem, 2022, 230: 111748. DOI:10.1016/j.jinorgbio.2022.111748 |
| [2] |
Bonetta Valentino R. The structurefunction relationships and physiological roles of MnSOD mutants[J]. Biosci Rep, 2022, 42(6): BSR20220202. DOI:10.1042/BSR20220202 |
| [3] |
Kitada M, Xu J, Ogura Y, et al. Manganese Superoxide Dismutase Dysfunction and the Pathogenesis of Kidney Disease[J]. Front Physiol, 2020, 11: 755. DOI:10.3389/fphys.2020.00755 |
| [4] |
Chen D, Ai X, Li Y, et al. Protective effects of Cu/Zn-SOD and Mn-SOD on UVC radiation-induced damage in NIH/3T3 cells and murine skin[J]. Acta Histochem, 2023, 125(4): 152030. DOI:10.1016/j.acthis.2023.152030 |
| [5] |
Kryczka J, Kryczka J, Czarnecka-Chrebelska KH, et al. Molecular Mechanisms of Chemoresistance Induced by Cisplatin in NSCLC Cancer Therapy[J]. Int J Mol Sci, 2021, 22(16): 8885. DOI:10.3390/ijms22168885 |
| [6] |
Song M, Cui M, Liu K. Therapeutic strategies to overcome cisplatin resistance in ovarian cancer[J]. Eur J Med Chem, 2022, 232: 114205. DOI:10.1016/j.ejmech.2022.114205 |
| [7] |
Xu XF, Yang XK, Song Y, et al. Dysregulation of non-coding RNAs mediates cisplatin resistance in hepatocellular carcinoma and therapeutic strategies[J]. Pharmacol Res, 2022, 176: 105906. DOI:10.1016/j.phrs.2021.105906 |
| [8] |
Mirzaei S, Hushmandi K, Zabolian A, et al. Elucidating Role of Reactive Oxygen Species (ROS) in Cisplatin Chemotherapy: A Focus on Molecular Pathways and Possible Therapeutic Strategies[J]. Molecules, 2021, 26(8): 2382. DOI:10.3390/molecules26082382 |
| [9] |
Mapuskar KA, Wen H, Holanda DG, et al. Persistent increase in mitochondrial superoxide mediates cisplatin-induced chronic kidney disease[J]. Redox Biol, 2019, 20: 98-106. DOI:10.1016/j.redox.2018.09.020 |
| [10] |
潘剑茹, 陈莉娟, 何火聪, 等. 全长SOD2重组蛋白的可溶表达、纯化、稳定性与跨膜效应[J]. 生物工程学报, 2017, 33(7): 1168-1177. [Pan JR, Chen LJ, He HC, et al. Expression, purification, stability and transduction efficiency of full-length SOD2 recombinant proteins[J]. Sheng Wu Gong Cheng Xue Bao, 2017, 33(7): 1168-1177. DOI:10.13345/j.cjb.170007] |
| [11] |
Soni H, Kaminski D, Gangaraju R, et al. Cisplatin-induced oxidative stress stimulates renal Fas ligand shedding[J]. Ren Fail, 2018, 40(1): 314-322. DOI:10.1080/0886022X.2018.1456938 |
| [12] |
Chen MF, Yang CM, Su CM, et al. Vitamin C protects against cisplatin-induced nephrotoxicity and damage without reducing its effectiveness in C57BL/6 mice xenografted with Lewis lung carcinoma[J]. Nutr Cancer, 2014, 66(7): 1085-1091. DOI:10.1080/01635581.2014.948211 |
| [13] |
Hakiminia B, Goudarzi A, Moghaddas A. Has vitamin E any shreds of evidence in cisplatin-induced toxicity[J]. J Biochem Mol Toxicol, 2019, 33(8): e22349. |
| [14] |
Ngo B, Van Riper JM, Cantley LC, et al. Targeting cancer vulnerabilities with high-dose vitamin C[J]. Nat rev Cancer, 2019, 19(5): 271-282. DOI:10.1038/s41568-019-0135-7 |
| [15] |
Peh HY, Tan WS, Liao W, et al. Vitamin E therapy beyond cancer: Tocopherol versus tocotrienol[J]. Pharmacol Ther, 2016, 162: 152-169. DOI:10.1016/j.pharmthera.2015.12.003 |
| [16] |
Fouladi M, Chintagumpala M, Ashley D, et al. Amifostine protects against cisplatin-induced ototoxicity in children with average-risk medulloblastoma[J]. J Clin Oncol, 2008, 26(22): 3749-3755. DOI:10.1200/JCO.2007.14.3974 |
| [17] |
Stankovic JSK, Selakovic D, Mihailovic V, et al. Antioxidant Supplementation in the Treatment of Neurotoxicity Induced by Platinum-Based Chemotherapeutics-A Review[J]. Int J Mol Sci, 2020, 21(20): 7753. DOI:10.3390/ijms21207753 |
| [18] |
King M, Joseph S, Albert A, et al. Use of Amifostine for Cytoprotection during Radiation Therapy: A Review[J]. Oncology, 2020, 98(2): 61-80. DOI:10.1159/000502979 |
 2023, Vol. 50
2023, Vol. 50


