文章信息
- 小分子抑制剂CIL56介导食管鳞状细胞癌细胞死亡
- Effect of Small-molecule Inhibitor CIL56 on Death of Esophageal Squamous Cell Carcinoma Cells
- 肿瘤防治研究, 2023, 50(7): 658-665
- Cancer Research on Prevention and Treatment, 2023, 50(7): 658-665
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1447
- 收稿日期: 2022-12-06
- 修回日期: 2023-04-13
2. 450000 郑州,郑州大学附属郑州中心医院药学部
2. Department of Pharmacy of Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou 450000, China
食管癌(esophageal cancer, EC)是常见的恶性消化道肿瘤,据2020年统计,其发病率和死亡率分别位于全球肿瘤病例的第7位和第6位[1]。在我国,食管癌的主要病理分型是食管鳞状细胞癌,目前临床上治疗食管癌的主要手段是手术切除。对于早期食管鳞状细胞癌,主要通过内镜黏膜切除术(endoscopic mucosal resection, EMR)或内镜下黏膜下剥离术(endoscopic submucosal dissection, ESD)进行治疗[2]。传统化疗也是临床上治疗食管鳞状细胞癌常用方法,常用的化疗药物有顺铂、5-Fu、多西他赛、奈达铂等[3-5]。此外,新辅助化疗、放疗以及基于PD-1/PD-L1的免疫疗法也被用于食管鳞状细胞癌(ESCC)的治疗[6],但对于晚期食管鳞状细胞癌患者,原发肿瘤复发或转移的频率约为60%[7],且患者的5年生存率 < 30%[8]。因此,探索低浓度且具有高抑癌作用、高特异性的化合物对食管鳞状细胞癌的治疗有着重要意义。
小分子抑制剂CIL56又称CA3,结构见图 1A。Song等研究报道小分子抑制剂CA3在体外和体内实验中均能显著抑制食管腺癌细胞的增殖,促进食管腺癌细胞凋亡[9]。本课题组通过前期筛选发现小分子抑制剂CIL56能够显著抑制食管鳞状细胞的增殖(该研究目前还未发表)。基于此,本研究以食管鳞状细胞癌TE-1、KYSE-140、KYSE-150细胞为研究对象,探讨CIL56对食管鳞状细胞癌的增殖抑制作用及相关作用机制,为CIL56在食管鳞状细胞癌中的应用提供一定的理论基础。
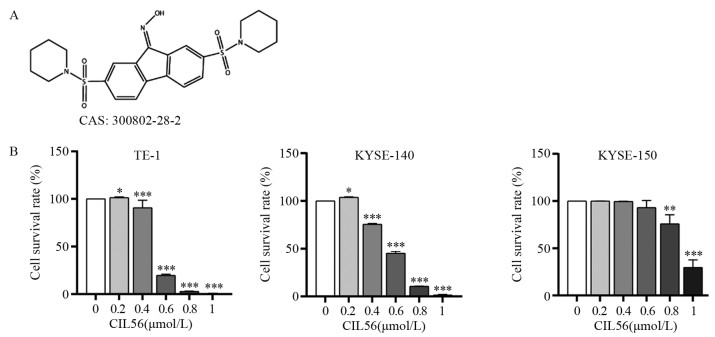
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with 0 μmol/L CIL56. 图 1 CIL56分子式(A)及CIL56作用72h对食管鳞状细胞癌增殖(B)的影响 Figure 1 Molecular formula(A) of CIL56 and Effect of CIL56 treatment for 72h on proliferation(B) of esophageal squamous cell carcinoma |
小分子抑制剂CIL56购自陶术生物公司(货号T4309)。人食管鳞状癌细胞株TE-1、KYSE-140、KYSE-150购自中国科学院上海细胞库。总谷胱甘肽检测试剂盒(Total Glutathione Assay Kit)购自上海碧云天生物技术有限公司(货号S0052)。胎牛血清购自赛文创新(北京)生物科技有限公司(货号FSP500-12J269)、RPMI 1640基础培养基购自北京索莱宝科技有限公司(货号31800-500 ml)、铁离子比色法检测试剂盒购自北京普利莱基因技术有限公司(货号E1042)。xCT抗体购自艾博抗(上海)贸易有限公司(货号ab175186)、GPX4抗体购自艾比玛特医药科技(上海)有限公司(货号T56959M)、YAP1抗体购自武汉三鹰生物技术有限公司(货号13584-1-AP)。
1.2 方法 1.2.1 细胞培养人食管鳞状癌细胞株TE-1、KYSE-140、KYSE-150均使用含10%胎牛血清、1%双抗(青霉素-链霉素)的RPMI 1640培养基,在多功能生物培养箱(37℃、5%CO2、饱和湿度)中进行培养。
1.2.2 磺酰罗丹明B比色法(SRB)取对数生长期细胞,计数后平均每孔铺3 500个细胞过夜培养(96孔板)。待细胞培养板取出后,将孔中培养基一并倒掉,每孔加入60~70 μl的10%(w/v)三氯乙酸溶液(4℃预冷),在4℃冰箱中过夜固定。用去离子水冲洗5~7次,注意不要冲到细胞,于37℃恒温烘干箱中烘干。待完全烘干后,每孔加入50 μl磺酰罗丹明B染液,室温染色30分钟。使用1%(v/v)乙酸溶液冲洗,当细胞培养板倒扣在吸水纸上无色时即可放置37℃恒温烘干箱中烘干。每孔加入100 μl的0.01 mmol/L Tris-base溶液,于全波长酶标仪中振荡10分钟,在540 nm处测定吸光度。
1.2.3 平板克隆形成实验取对数生长期细胞,计数后平均每孔铺3 000/6 000个细胞过夜培养(6孔板)。每孔各加入2 ml含药培养基,每隔3~4天换一次液,置于细胞培养箱中培养1周左右。取出后使用1×PBS(4℃预冷)清洗细胞2次,每孔加入1 ml 10%福尔马林溶液,室温固定1 h;用1×PBS(4℃预冷)清洗后,每孔加入1 ml 0.1%结晶紫溶液,室温染色30分钟后用1×PBS(4℃预冷)清洗,室温晾干后拍照记录。
1.2.4 划痕愈合实验取对数生长期细胞,计数后平均每孔铺适量细胞过夜培养(24孔板)。利用直尺作参考,使用200 μl无菌枪头沿直尺划痕,使用1×PBS(4℃预冷)清洗细胞2次,随后加入1 ml含药培养基(2%胎牛血清),于细胞培养箱中培养,在显微镜(10×物镜)下标记出划痕范围并拍照。于0、12、24、48 h拍照记录。
1.2.5 铁离子浓度检测使用0.2、0.4、0.6、0.8 μmol/L的CIL56处理细胞24 h后(24孔板),用1×PBS(4℃预冷)清洗细胞2遍,弃去洗液。每孔加入200 μl细胞裂解液,室温振荡裂解2 h。按照说明书配好标准品与混液A,每个1.5 ml离心管中加入100 μl混液A、100 μl的标准品/样品,混匀后于60℃水浴中加热1 h,冷却至室温后瞬离;每孔加入30 μl的铁离子检测试剂,混匀后室温孵育30分钟;取200 μl用高通量超微量分光光度计在550 nm处测定吸光度;余下细胞液做BCA蛋白浓度测定,绘制标准曲线并计算铁离子浓度。
1.2.6 总谷胱甘肽含量检测根据试剂盒说明书配制试剂和标准品。称量空管重量,胰酶消化后收集细胞,1 000 r/min、离心5分钟。使用1×PBS(4℃预冷)清洗细胞沉淀1次,待吸净PBS后称重,扣除空管重量并记录;加入细胞沉淀三倍体积的蛋白去除剂s溶液(10 mg细胞沉淀相当于10 μl),于液氮和37℃水浴中对样品进行两次快速冻融;冰上放置5分钟,4℃微量离心机、10 000 g离心10分钟,取上清并按试剂盒操作说明测定细胞总谷胱甘肽(Glutathione, GSH)含量。样品5倍稀释,室温孵育25分钟后在412 nm处测定样品吸光度。
1.2.7 Western blot检测细胞总蛋白提取:使用0.2、0.4、0.6、0.8 μmol/L的CIL56处理细胞24 h,弃去细胞培养液,用1×PBS(4℃预冷)清洗细胞2次,弃去洗液。加入适量的2.5×缓冲液于冰上裂解10分钟,收集到1.5 ml离心管中瞬离,100℃金属浴5~10分钟。室温冷却后,瞬离,保存在-80℃低温冰箱。
使用12%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶进行电泳分离;恒流转印;0.5%脱脂牛奶(1×TBST配制)室温封闭2 h;目的蛋白一抗稀释液(0.5%脱脂牛奶配制)4℃孵育过夜,1×TBST(4℃预冷)清洗3次、10分钟/次;室温孵育相应二抗1 h(0.5%脱脂牛奶配制),使用1 ×TBST(4℃预冷)清洗3次、10分钟/次;使用ECL超敏发光液于多功能成像仪中显影。
1.3 统计学方法图像分析使用Image J软件;实验数据分析用SPSS20.0和GraphPad Prism 8软件;采用单因素方差分析或独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 CIL56显著抑制食管鳞状细胞癌的细胞增殖SRB检测、光学显微镜观察和平板克隆方法检测结果显示,CIL56能显著抑制食管鳞状细胞癌的细胞增殖(均P < 0.05),且呈浓度依赖性,见图 1B, 2~3。CIL56对TE-1、KYSE-140、KYSE-150三株细胞的IC50值分别为0.502、0.534、0.908 μmol/L。
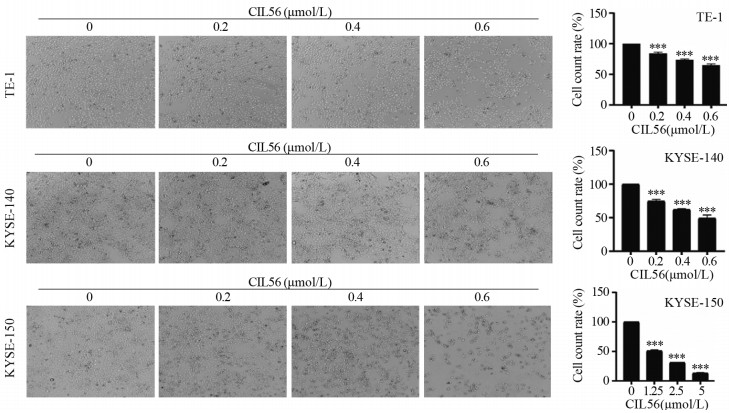
|
| ***: P < 0.001, compared with 0 μmol/L CIL56. 图 2 光学显微镜下CIL56作用24h对食管鳞状细胞癌增殖作用的影响 Figure 2 Effect of CIL56 treatment for 24h on proliferation of esophageal squamous cell carcinoma under an optical microscope |
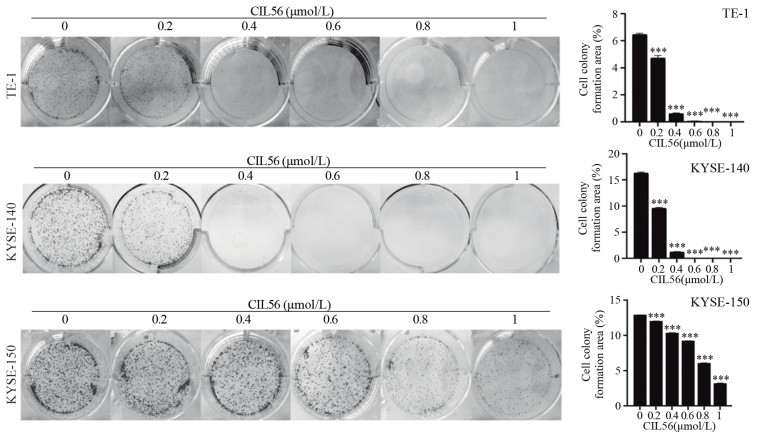
|
| ***: P < 0.001, compared with 0 μmol/L CIL56. 图 3 平板克隆实验显示CIL56对食管鳞状细胞癌增殖作用的影响 Figure 3 Effect of CIL56 on proliferation of esophageal squamous cell carcinoma detected by plate-cloning method |
结合2.1三株细胞增殖实验数据,选择杀伤作用最小的浓度进行划痕愈合实验。结果显示0.2 μmol/L的CIL56能够显著抑制TE-1、KYSE-150、KYSE-140细胞的迁移,差异有统计学意义(P < 0.001)且在该浓度作用下对这三株细胞的增殖无显著影响,见图 4。
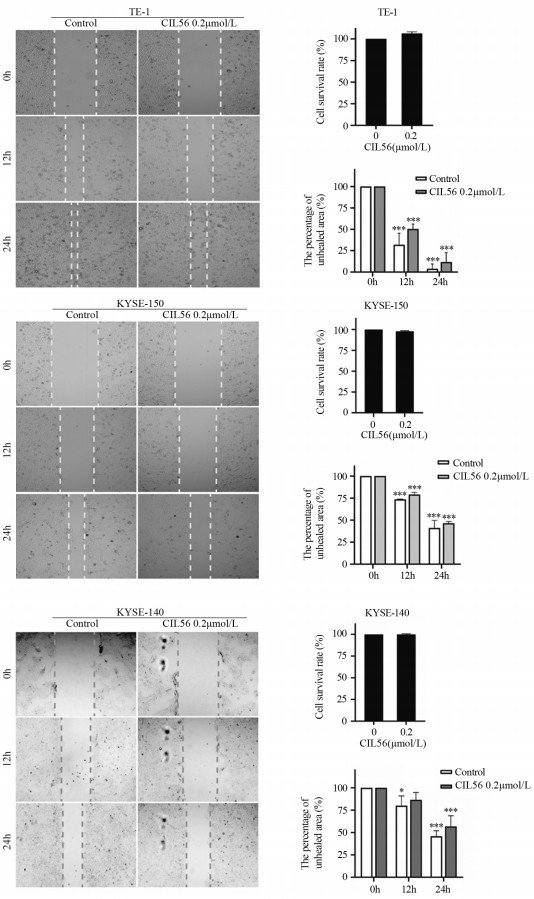
|
| *: P < 0.05, ***: P < 0.001, compared with 0μmol/L CIL56. 图 4 0.2μmol/L CIL56对食管鳞状细胞癌迁移作用的影响 Figure 4 Effect of 0.2μmol/L CIL56 on migration of esophageal squamous cell carcinoma |
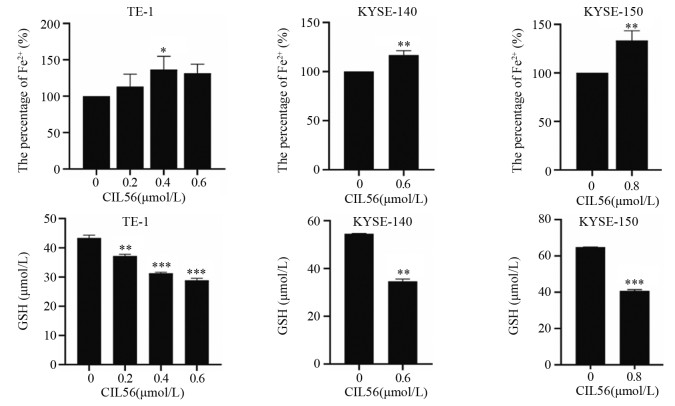
给予不同浓度的CIL56作用24 h,结果显示,与对照组相比,在TE-1细胞中铁离子的含量在0.4 μmol/L上升了13.29%(P < 0.05),KYSE-140在0.6 μmol/L上升了16.79%(P < 0.01),KYSE-150在0.8 μmol/L上升了33.40%(P < 0.01)。给予不同浓度CIL56作用这三株细胞12 h,结果显示,在TE-1细胞中随着CIL56浓度的增加,GSH浓度随之明显降低,而在另两株细胞中也能降低细胞内GSH浓度(均P < 0.01),见图 5。
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with 0 μmol/L. 图 5 CIL56对食管鳞状细胞癌中铁离子及GSH浓度的影响 Figure 5 Effect of CIL56 on iron concentration and GSH concentration in esophageal squamous cell carcinoma |
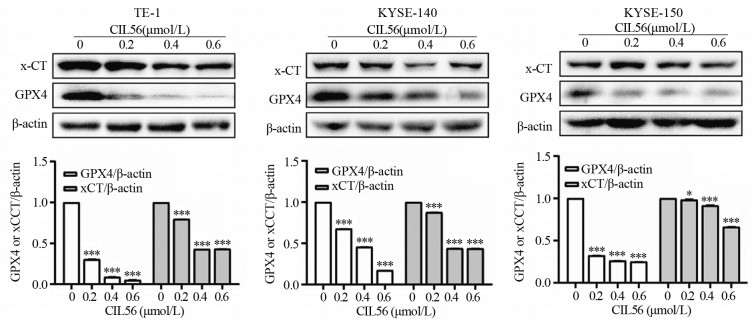
梯度浓度的CIL56作用24 h后,TE-1、KYSE-150、KYSE-140细胞中xCT及GPX4蛋白的表达显著降低(均P < 0.05),见图 6。
|
| *: P < 0.05, ***: P < 0.001, compared with 0 μmol/L CIL56. 图 6 CIL56对食管鳞状细胞癌xCT和GPX4蛋白表达的影响 Figure 6 Effect of CIL56 on xCT and GPX4 protein expression in esophageal squamous cell carcinoma |
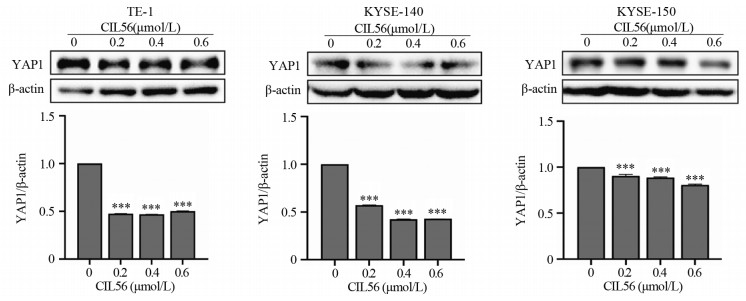
浓度梯度的CIL56作用24 h,结果显示,CIL56明显抑制TE-1、KYSE-150、KYSE-140细胞中YAP1蛋白的表达,差异有统计学意义(均P < 0.001),见图 7。
|
| ***: P < 0.001, compared with 0 μmol/L CIL56. 图 7 CIL56对食管鳞状细胞癌YAP1蛋白表达的影响 Figure 7 Effect of CIL56 on YAP1 protein expression in esophageal squamous cell carcinoma |
目前临床上食管鳞状细胞癌治疗方法主要为手术切除、放疗、化疗等。虽然这些治疗措施在不断发展和完善,但是晚期ESCC的患者预后仍不理想,总体5年生存率低。因此,探索高效、高特异性的小分子化合物对食管癌的治疗有着重要意义。我们通过前期筛选发现小分子化合物CIL56能够显著抑制ESCC细胞的增殖,促进ESCC细胞死亡。且本研究发现ESCC细胞中,给予CIL56能够下调GPX4和xCT蛋白的表达,增加细胞内Fe2+浓度、降低GSH的水平,这提示CIL56可能诱导ESCC细胞发生铁死亡。
铁死亡是一种铁离子依赖的非细胞凋亡的细胞死亡方式,伴随着膜脂质过氧化(lipid peroxidation, LPO)、活性氧(reactive oxygen species, ROS)产生而引起的特定形式的细胞死亡[10]。铁死亡被诱导之后,会引起细胞形态学的改变,比如细胞体积缩小、线粒体形态发生变化,以及GSH耗竭、GPX4表达降低、ROS产生等[11]。大量研究表明,铁死亡与多种疾病的发生发展过程相关,靶向其信号通路中的关键蛋白或可成为病情缓解的关键。已有研究报道在多种肿瘤的发生与发展中,如肝癌[12]、肺癌[13]、乳腺癌[14]、胰腺癌[15]、胃癌[16]等肿瘤中铁死亡被抑制。即在这些肿瘤细胞中,胱氨酸/谷氨酸反转运蛋白系统xCT被激活,GSH的代谢和CPX4的活性增加,LOP和铁离子的代谢被抑制等。因此,诱导肿瘤细胞发生铁死亡是肿瘤治疗的有效策略。
研究表明,细胞GSH耗竭或GPX4失活都能诱导铁死亡发生,从而导致细胞死亡[17-19]。CIL56被报道是铁死亡诱导剂[20]。本研究发现CIL56能够显著抑制GPX4的表达、抑制细胞中GSH的浓度。在细胞发生铁死亡时,胱氨酸/谷氨酸反转运蛋白系统xCT发挥重要作用[21]。小分子化合物Erastin不可逆转地抑制xCT活性,这是其诱导铁死亡的重要机制之一。本研究中小分子化合物CIL56也能够抑制ESCC中xCT蛋白的表达,这也可能是其促进ESCC发生铁死亡的机制之一。
此外,CIL56作为一种新的YAP1蛋白抑制剂,Morice等报道,在骨肉瘤中,CIL56通过抑制YAP/Tead的转录活性,减少YAP蛋白的产生进而抑制骨肉瘤细胞增殖、促进肿瘤细胞凋亡[20]。另有研究报道发现低氧能诱导YAP蛋白表达,抑制其磷酸化,增强YAP转录活性促进低氧诱导的脉络膜内皮细胞的内皮间质转变,而CA3通过抑制YAP转录活性抑制该过程[22]。此外,Delvaux等在胃肠道间质瘤细胞中,给予YAP抑制剂verteporfin能够显著减少GSH的含量和GPX4蛋白水平促进肿瘤细胞发生铁死亡,且该作用与YAP转录活性相关。而在GIST882和GIST48细胞中,给予CA3亦能诱导细胞发生铁死亡,但CA3并不抑制YAP转录活性,这提示在该过程中YAP可能不参与CA3诱导的铁死亡[23]。本研究发现CIL56能够抑制YAP蛋白的表达,这可能是其促进ESCC发生细胞死亡的机制之一。
综上所述,本研究发现小分子化合物CIL56能够显著抑制ESCC的细胞增殖及迁移,其可能的作用机制是抑制ESCC细胞中xCT蛋白的表达和GPX4蛋白的表达,增加细胞内Fe2+浓度,抑制细胞中GSH的浓度,同时抑制YAP蛋白的表达。本研究为小分子CIL56抑制剂在食管鳞状细胞癌的治疗提供一定的理论基础。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
陈嘉兴:实验过程和实验数据的收集、分析及论文撰写
许霞青:课题思路的提出及设计研究方案
张旗:论文修订
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
di Pietro M, Canto MI, Fitzgerald RC. Endoscopic Management of Early Adenocarcinoma and Squamous Cell Carcinoma of the Esophagus: Screening, Diagnosis, and Therapy[J]. Gastroenterology, 2018, 154(2): 421-436. DOI:10.1053/j.gastro.2017.07.041 |
| [3] |
Cao C, Luo J, Gao L, et al. Definitive radiotherapy for cervical esophageal cancer[J]. Head Neck, 2015, 37(2): 151-155. DOI:10.1002/hed.23572 |
| [4] |
Zhang P, Xi M, Zhao L, et al. Clinical efficacy and failure pattern in patients with cervical esophageal cancer treated with definitive chemoradiotherapy[J]. Radiother Oncol, 2015, 116(2): 257-261. DOI:10.1016/j.radonc.2015.07.011 |
| [5] |
Li HX, Liu J, Cheng Y, et al. Concurrent chemoradiotherapy for cervical esophageal squamous cell carcinoma: treatment results from a prospective observational study[J]. Dis Esophagus, 2018, 31(5). |
| [6] |
Sohda M, Kuwano H. Current Status and Future Prospects for Esophageal Cancer Treatment[J]. Ann Thorac Cardiovasc Surg, 2017, 23(1): 1-11. DOI:10.5761/atcs.ra.16-00162 |
| [7] |
Kumagai K, Mariosa D, Tsai JA, et al. Systematic review and meta-analysis on the significance of salvage esophagectomy for persistent or recurrent esophageal squamous cell carcinoma after definitive chemoradiotherapy[J]. Dis Esophagus, 2016, 29(7): 734-739. DOI:10.1111/dote.12399 |
| [8] |
李化龙. 食管癌的治疗进展[J]. 四川生理科学杂志, 2020, 42(4): 522-526. [Li HL. Progress in the treatment of esophageal cancer[J]. Sichuan Sheng Li Ke Xue Za Zhi, 2020, 42(4): 522-526.] |
| [9] |
Song S, Xie M, Scott AW, et al. A Novel YAP1 Inhibitor Targets CSC-Enriched Radiation-Resistant Cells and Exerts Strong Antitumor Activity in Esophageal Adenocarcinoma[J]. Mol Cancer Ther, 2018, 17(2): 443-454. DOI:10.1158/1535-7163.MCT-17-0560 |
| [10] |
Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death[J]. Cell Death Differ, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 |
| [11] |
Lu B, Chen XB, Ying MD, et al. The Role of Ferroptosis in Cancer Development and Treatment Response[J]. Front Pharmacol, 2017, 8: 992. |
| [12] |
Yao F, Deng Y, Zhao Y, et al. A targetable LIFR-NF-κB-LCN2 axis controls liver tumorigenesis and vulnerability to ferroptosis[J]. Nat Commun, 2021, 12(1): 7333. DOI:10.1038/s41467-021-27452-9 |
| [13] |
Zhang W, Sun Y, Bai L, et al. RBMS1 regulates lung cancer ferroptosis through translational control of SLC7A11[J]. J Clin Invest, 2021, 131(22): e152067. DOI:10.1172/JCI152067 |
| [14] |
Yang J, Zhou Y, Xie S, et al. Metformin induces Ferroptosis by inhibiting UFMylation of SLC7A11 in breast cancer[J]. J Exp Clin Cancer Res, 2021, 40(1): 206. DOI:10.1186/s13046-021-02012-7 |
| [15] |
Badgley MA, Kremer DM, Maurer HC, et al. Cysteine depletion induces pancreatic tumor ferroptosis in mice[J]. Science, 2020, 368(6486): 85-89. DOI:10.1126/science.aaw9872 |
| [16] |
Zhang H, Deng T, Liu R, et al. CAF secreted miR-522 suppresses ferroptosis and promotes acquired chemo-resistance in gastric cancer[J]. Mol Cancer, 2020, 19(1): 43. DOI:10.1186/s12943-020-01168-8 |
| [17] |
Yang WS, Stockwell BR. Ferroptosis: Death by Lipid Peroxidation[J]. Trends Cell Biol, 2016, 26(3): 165-176. DOI:10.1016/j.tcb.2015.10.014 |
| [18] |
Yang WS, SriRamaratnam R, Welsch ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2): 317-331. DOI:10.1016/j.cell.2013.12.010 |
| [19] |
Wortmann M, Schneider M, Pircher J, et al. Combined deficiency in glutathione peroxidase 4 and vitamin E causes multiorgan thrombus formation and early death in mice[J]. Circ Res, 2013, 113(4): 408-417. DOI:10.1161/CIRCRESAHA.113.279984 |
| [20] |
Morice S, Mullard M, Brion R, et al. The YAP/TEAD Axis as a New Therapeutic Target in Osteosarcoma: Effect of Verteporfin and CA3 on Primary Tumor Growth[J]. Cancers (Basel), 2020, 12(12): 3847. DOI:10.3390/cancers12123847 |
| [21] |
Ursini F, Maiorino M. Lipid peroxidation and ferroptosis: The role of GSH and GPx4[J]. Free Radic Biol Med, 2020, 152: 175-185. DOI:10.1016/j.freeradbiomed.2020.02.027 |
| [22] |
Zou R, Feng YF, Xu YH, et al. Yes-associated protein promotes endothelial-to-mesenchymal transition of endothelial cells in choroidal neovascularization fibrosis[J]. Int J Ophthalmol, 2022, 15(5): 701-710. DOI:10.18240/ijo.2022.05.03 |
| [23] |
Delvaux M, Hagué P, Craciun L, et al. Ferroptosis Induction and YAP Inhibition as New Therapeutic Targets in Gastrointestinal Stromal Tumors (GISTs)[J]. Cancers (Basel), 2022, 14(20): 5050. DOI:10.3390/cancers14205050 |
 2023, Vol. 50
2023, Vol. 50


