文章信息
- 血液学指标在儿童及青少年鼻咽癌中的预后价值
- Prognostic Value of Hematological Indicators in Children and Adolescents with Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2023, 50(6): 581-586
- Cancer Research on Prevention and Treatment, 2023, 50(6): 581-586
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1446
- 收稿日期: 2022-12-06
- 修回日期: 2023-03-09
2. 210000 南京,南京医科大学肿瘤个体化医学协同创新中心
2. Collaborative Innovation Center for Cancer Personalized Medicine, Nanjing Medical University, Nanjing 210000, China
鼻咽癌(nasopharyngeal carcinoma, NPC)是我国南方地区头颈部常见癌种,发病年龄高峰在40~60岁[1],儿童及青少年NPC整体发病率低,在此年龄段恶性肿瘤中发病率 < 5%,但占鼻咽部恶性肿瘤的20%~50%[2-3]。儿童及青少年NPC初诊时分期较成人偏晚,但治疗效果及预后较成人好[4],目前,以铂类药物为基础诱导化疗(induction chemotherapy, IC)后行同步放化疗(concurrent chemoradiotherapy, CCRT)被认为是局部晚期儿童青少年NPC的标准治疗。在预后方面,血液学相关指标例如中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、淋巴细胞与单核细胞比值(LMR)、血红蛋白(Hb)、乳酸脱氢酶(LDH)与白蛋白(ALB)比值(LAR)等在以成人为主的NPC群体中已证实与预后有关[5-11]。本研究回顾性分析我院收治的79例儿童及青少年NPC患者病历资料,重点分析治疗前血液学相关指标在这部分特殊人群中的预后价值。
1 资料与方法 1.1 临床资料回顾性分析2006年8月—2020年11月南京医科大学附属肿瘤医院收治的初诊儿童及青少年NPC患者临床资料。研究纳入标准:(1)经病理活检和免疫组织化学确诊的初治鼻咽癌;(2)年龄≤20岁;(3)治疗前行血常规及生化(肝肾功能)检查;(4)均接受调强放射治疗;(5)临床随访资料完整;(6)无重要脏器功能不全者或合并其他肿瘤,KPS评分≥80。排除标准:(1)年龄 > 20岁;(2)治疗前相关血液学检验资料缺失;(3)存在放化疗禁忌证或合并多原发肿瘤,KPS评分 < 80。经入排标准筛选后共79例儿童及青少年NPC患者纳入本研究。按照1972年世界卫生组织贫血诊断标准[12]将治疗前6~14岁儿童及15~20岁青少年女性Hb < 120 g/L、15~20岁青少年男性Hb < 130 g/L定义为贫血。
1.2 治疗模式除3例患者采用单纯调强放射治疗以外所有患者均接受以调强放疗为基础联合化疗、靶向、免疫治疗的综合治疗模式。放化综合治疗中包括单纯CCRT、CCRT联合IC和(或)辅助化疗、放化序贯治疗(化疗+放疗、放疗+化疗、化疗+放疗+化疗)。所有患者均接受常规调强放射治疗,放疗处方剂量范围为:原发灶(GTV1)5 800~7 600 cGy;转移淋巴结(GTV2):5 488~7 000 cGy;高危亚临床病灶区(CTV1)5 264~6 710 cGy;低危亚临床病灶区(CTV2)4 500~5 394 cGy。常见的化疗方案有FP(5-Fu+顺铂)、TP(紫衫类药物+顺铂)、TFP(紫衫类药物+5-Fu+顺铂),以上方案均每3周一疗程,IC与辅助化疗在1~4个疗程之间,同步化疗在1~2个疗程之间。期间有部分患者由于无法耐受化疗不良反应而接受靶向及免疫治疗,靶向治疗药物包括尼妥珠单抗、西妥昔单抗、重组人血管内皮抑制素注射液;免疫治疗药物包括卡瑞利珠单抗及度伐利尤单抗。
1.3 随访治疗结束后2年内,每2~3个月复查一次,第3~5年每6个月复查一次,之后每年复查一次。采用门诊或住院复查、电话随访等多种随访形式。随访内容包括:病史询问、体格检查、鼻咽镜检查、头颈部MRI或CT、胸腹部CT,必要时ECT或PET-CT复查等。总生存(OS)定义为从明确诊断到(任何原因)死亡或者随访截止时间;无进展生存(PFS)定义为从明确诊断到肿瘤发生(任何方面)进展、死亡或者随访截止时间。
1.4 统计学方法应用SPSS26.0统计软件进行统计分析。采用受试者工作特征曲线(ROC)确定NLR、PLR、LMR、ALB、LDH、LAR的最佳截断值。由Kaplan-Meier法得到OS及PFS,采用卡方检验对临床资料进行分析,Log rank检验各项生存结局指标,单因素分析得出与预后相关的指标再纳入多因素分析,多因素分析则采用Cox比例风险回归模型。双侧P < 0.05被认为差异有统计学意义。
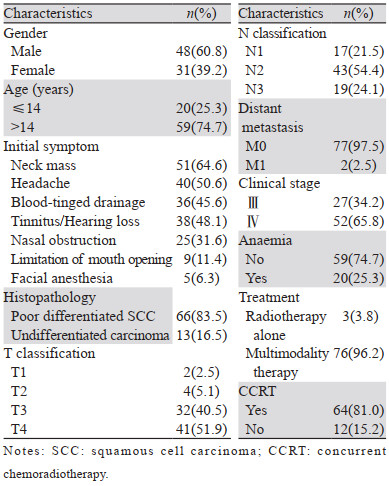
2 结果 2.1 患者的基线特征入组的79例儿童及青少年NPC患者的基线特征见表 1。男女发病比例约为1.55:1。中位发病年龄17岁(7~20岁)。初诊症状以无痛性颈部肿块最为常见,这一结论与既往文献报道相符[13],其次为头痛、耳鸣及听力下降、回吸性血涕等。病理分型按照WHO1978年分类标准[14],83.5%的患者归为低分化鳞癌,其余患者为未分化癌。所有患者按照国际抗癌联盟(UICC)/美国癌症联合委员会(AJCC)第八版分期系统进行分期,结果均为局晚期(Ⅲ~Ⅳ期),其中有2例患者初诊时分别伴随左侧股骨、右侧髂骨转移。治疗前共20例儿童及青少年NPC患者达到贫血诊断标准。
|
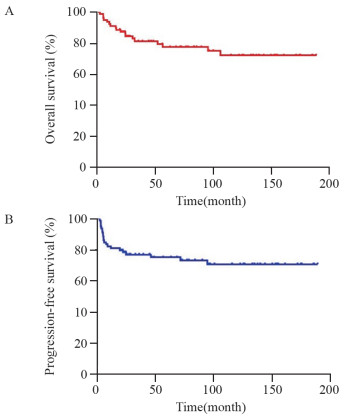
所有患者均按计划完成治疗规定的放射剂量照射,其中2例伴有远处转移(左侧股骨、右侧髂骨)的患者转移灶分别接受4 000 cGy和3 500 cGy的二维放疗照射。79例患者中,3例患者仅行单纯放疗;64例患者接受了CCRT,其中47例患者在CCRT基础上联合IC和(或)辅助化疗,17例患者仅行CCRT;12例患者行放化序贯治疗。79例患者中,有28例患者在治疗期间联合靶向药物治疗,3例患者在放疗后使用免疫药物维持治疗。中位随访68.5个月(3.2~189个月),5年OS为77.6%,5年PFS为75.2%。共有21例患者疾病发生了进展,其中20例患者远处转移(骨、肺、肝),1例患者局部复发。随访期间死亡18例,死因均为疾病进展。79例患者治疗后OS及PFS曲线见图 1。
|
| 图 1 79例儿童青少年鼻咽癌患者总生存率(A)和无进展生存率曲线(B) Figure 1 Seventy-nine children and adolescents with nasopharyngeal carcinoma overall survival curve(A) and progression-free survival curve(B) |
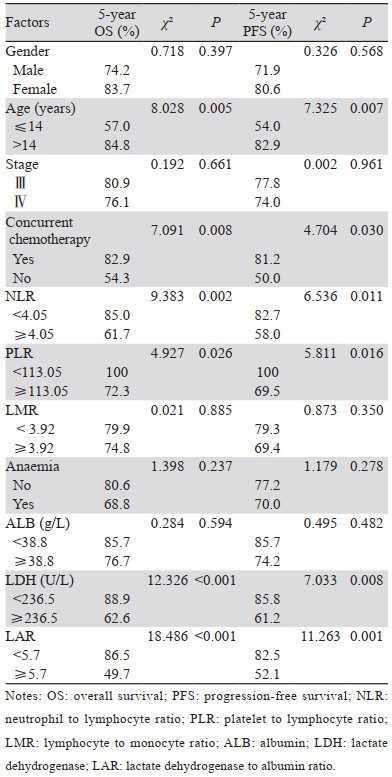
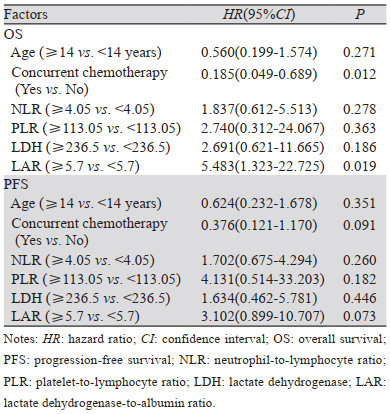
使用ROC确定治疗前各项血液学指标的最佳截断值,NLR为4.05、PLR为113.05、LMR为3.92、ALB为38.8 g/L、LDH为236.5 U/L、LAR为5.7,以最佳截断值为界将上述血液学指标均分为小于最佳截断值组和大于等于最佳截断值组。Hb则根据是否达到贫血诊断标准进行分组。并将性别(男vs. 女)、年龄(≤14岁vs. > 14岁)、分期(Ⅲ期vs. Ⅳ期)、同步化疗(有vs. 无)四项临床特征一起纳入单因素分析。结果显示,年龄≤14岁、无同步化疗、治疗前血液学指标(高NLR、PLR、LDH、LAR)与儿童及青少年NPC较差的OS、PFS均显著相关,见表 2。为了纠正可能存在的混杂因素,进一步评估血液学指标在儿童及青少年NPC患者中的预后意义,将单因素分析中P < 0.05的自变量纳入Cox多因素回归模型中,结果显示无同步化疗(P=0.012)、治疗前高LAR(P=0.019)是儿童及青少年NPC患者OS的独立不良预后因素,见表 3。
|
|
儿童及青少年NPC治疗效果较好,目前局晚期(ⅡN1~Ⅳa期)患者以铂类药物为基础的IC联合CCRT加或不加辅助治疗已在多项回顾性及前瞻性临床研究中取得令人满意的生存结局[15-18]。但远处转移(骨、肺、肝等)目前仍然是治疗失败最主要的原因[19],本研究中大部分患儿治疗失败的原因同样如此,寻找儿童及青少年NPC患者人群有效的预后因素对指导后续个体化治疗方案的制定至关重要。
全身炎性反应产生的多种炎性反应细胞及炎性反应因子通过影响肿瘤微环境已被证实与肿瘤的发生发展密切相关[20]。血小板是血液的一种成分,其功能主要是与凝血因子相互作用形成血栓,有研究证实血小板可以介导肿瘤细胞的生长、播散和血管生成,血小板数量较高与肿瘤进展有直接关联[21]。Hb是体内运输氧的载体,而氧含量的高低与以放射治疗为主的头颈部恶性肿瘤的疗效密切相关,乏氧细胞对放射线抵抗性增强,是放疗后肿瘤复发和转移的重要因素[22]。血液学指标中的中性粒细胞、淋巴细胞、单核细胞、血小板及Hb易于获取且与多种癌种(如结直肠癌、非小细胞肺癌、喉癌、口咽癌等)的预后有关[23-26]。在多项关于成人NPC研究中发现,治疗前高NLR、PLR、贫血是独立预后不良因素,而高LMR则提示预后较好[5-7, 11]。本研究单因素分析结果示NLR≥4.05(P=0.002)、PLR≥113.05(P=0.026)与儿童及青少年NPC较差的OS显著相关,高NLR(P=0.011)、PLR(P=0.016)与较差的PFS同样具有显著统计学关联,这一结论与成人NPC结果一致,但本研究未能证实高LMR在儿童及青少年NPC中的积极预后意义。治疗前是否贫血也与儿童及青少年NPC患者的OS、PFS无显著关联。一项来自中山大学肿瘤防治中心的同样应用WHO贫血诊断标准探索Hb水平与NPC预后关系的回顾性研究提示,治疗前Hb水平是NPC无远处转移生存的独立预后因素,治疗中期Hb水平则是OS的独立预后影响因素,但此研究入组的大部分患者年龄超过20岁[11]。
LDH广泛存在于人体组织中,是糖无氧酵解及糖异生的重要酶系之一,而在肿瘤发生发展过程中由于生长速度快,能量的获取以无氧糖酵解为主,因而治疗前高水平的LDH往往预示肿瘤负荷量大及乏氧程度高,导致后续放化疗效果欠佳[22],目前研究认为LDH与致癌信号通路的激活以及许多肿瘤的代谢活性、侵袭性和免疫原性有关,是多种恶性肿瘤的独立预后影响因素[27]。治疗前ALB水平可以反映患者的营养状态,而营养状况与后续肿瘤治疗方式的选择及治疗反应密切相关,对于处于生长发育中的儿童及青少年NPC患者而言,治疗前营养状况的评估更为重要。将LDH与ALB联合应用于包括NPC在内的多种恶性肿瘤的预后判断已在多项研究中得到证实[28-31],较高的LAR值代表预后不佳。本研究分别将ALB、LDH及LAR纳入单因素分析以求全面探究各个指标的预后价值,根据分析结果将达到统计学差异的因素(LDH、LAR)进一步纳入Cox比例风险回归模型中,结果发现LAR≥5.7(P=0.019)是儿童及青少年NPC患者OS的独立不良预后因素,总体死亡风险是LAR < 5.7组的5.483倍,PFS方面LAR(≥5.7 vs. < 5.7)虽然没有达到统计学差异,但低LAR组有低疾病进展风险的趋势(P=0.073)。此外,本研究发现放疗期间有无同步化疗同样是儿童及青少年NPC患者OS的独立预后因素。
鉴于儿童及青少年NPC与成人在临床特征、治疗效果方面存在差异,关于血液学指标在NPC中的预后价值已报道文献入组的研究对象大部分为成人患者,这与儿童及青少年NPC发病率低有直接关系,目前尚无相关研究探索血液学指标在儿童及青少年NPC患者群体中的预后价值。本回顾性研究发现治疗前高NLR、PLR、LDH、LAR与儿童及青少年NPC患者的不良OS、PFS存在相关性,其中,LAR是其OS的独立预后影响因素。治疗前血液学相关指标获取简便、价格不高、可操作性强,根据本研究的结论为儿童及青少年NPC患者的预后指标选择提供一个新思路,并指导后续个体化治疗方案的制定。但本研究属于小样本回顾性研究,其结论仍有待于大型随机性临床试验进一步验证。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
袁芳琴:论文撰写及统计学分析
王 藤:数据收集及统计学分析
郭文杰:研究设计
何 侠:论文撰写指导
尹 丽:研究设计、论文撰写指导及修订
| [1] |
Wu SG, Liao XL, He ZY, et al. Demographic and clinicopathological characteristics of nasopharyngeal carcinoma and survival outcomes according to age at diagnosis: A population-based analysis[J]. Oral Oncol, 2017, 73: 83-87. DOI:10.1016/j.oraloncology.2017.08.006 |
| [2] |
Laskar S, Sanghavi V, Muckaden MA, et al. Nasopharyngeal carcinoma in children: ten years' experience at the Tata Memorial Hospital, Mumbai[J]. Int J Radiat Oncol Biol Phys, 2004, 58(1): 189-195. DOI:10.1016/S0360-3016(03)00773-9 |
| [3] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [4] |
Chen BB, Lu SY, Peng H, et al. Comparison of Long-Term Outcomes and Sequelae Between Children and Adult Nasopharyngeal Carcinoma Treated With Intensity Modulated Radiation Therapy[J]. Int J Radiat Oncol Biol Phys, 2020, 106(4): 848-856. DOI:10.1016/j.ijrobp.2019.11.035 |
| [5] |
He JR, Shen GP, Ren ZF, et al. Pretreatment levels of peripheral neutrophils and lymphocytes as independent prognostic factors in patients with nasopharyngeal carcinoma[J]. Head Neck, 2012, 34(12): 1769-1776. DOI:10.1002/hed.22008 |
| [6] |
Jiang R, Zou X, Hu W, et al. The elevated pretreatment platelet-to-lymphocyte ratio predicts poor outcome in nasopharyngeal carcinoma patients[J]. Tumour Biol, 2015, 36(10): 7775-7787. DOI:10.1007/s13277-015-3505-0 |
| [7] |
Li J, Jiang R, Liu W S, et al. A large cohort study reveals the association of elevated peripheral blood lymphocyte-to-monocyte ratio with favorable prognosis in nasopharyngeal carcinoma[J]. PLoS One, 2013, 8(12): e83069. DOI:10.1371/journal.pone.0083069 |
| [8] |
Chang H, Gao J, Xu BQ, et al. Haemoglobin, neutrophil to lymphocyte ratio and platelet count improve prognosis prediction of the TNM staging system in nasopharyngeal carcinoma: development and validation in 3, 237 patients from a single institution[J]. Clin Oncol (R Coll Radiol), 2013, 25(11): 639-646. DOI:10.1016/j.clon.2013.07.004 |
| [9] |
郑隽, 徐夏, 付晓燕. 治疗前乳酸脱氢酶/白蛋白比值预测鼻咽癌预后的价值[J]. 实用医学杂志, 2018, 34(8): 1285-1288. [Zheng J, Xu X, Fu XY. The clinical applicaton of pretreatment lactate dehydrogenase/albumin ratio in predicting the prognosis of nasopharyngeal carcinoma[J]. Shi Yong Yi Xue Za Zhi, 2018, 34(8): 1285-1288. DOI:10.3969/j.issn.1006-5725.2018.08.015] |
| [10] |
魏学燕, 韩光, 李莹, 等. 全程营养支持治疗对局部晚期鼻咽癌患者营养状况的影响[J]. 肿瘤防治研究, 2020, 47(8): 617-622. [Wei XY, Han G, Li Y, et al. Effect of Whole-course Nutrition Support on Nutritional Status of Patients with Locally Advanced Nasopharyngeal Carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(8): 617-622.] |
| [11] |
Guo SS, Tang LQ, Chen QY, et al. Is Hemoglobin Level in Patients with Nasopharyngeal Carcinoma Still a Significant Prognostic Factor in the Era of Intensity-Modulated Radiotherapy Technology?[J]. PLoS One, 2015, 10(8): e0136033. DOI:10.1371/journal.pone.0136033 |
| [12] |
Wickramasinghe SN. Nutritional anaemias[J]. Clin Lab Haematol, 1988, 10(2): 117-134. DOI:10.1111/j.1365-2257.1988.tb01164.x |
| [13] |
Dourthe ME, Bolle S, Temam S, et al. Childhood Nasopharyngeal Carcinoma: State-of-the-Art, and Questions for the Future[J]. J Pediatr Hematol Oncol, 2018, 40(2): 85-92. DOI:10.1097/MPH.0000000000001054 |
| [14] |
Shanmugaratnam K. Histological typing of nasopharyngeal carcinoma[J]. IARC Sci Publ (1971), 1978(20): 3-12. |
| [15] |
Lu S, Chang H, Sun X, et al. Long-Term Outcomes of Nasopharyngeal Carcinoma in 148 Children and Adolescents[J]. Medicine (Baltimore), 2016, 95(17): e3445. DOI:10.1097/MD.0000000000003445 |
| [16] |
Ben-Ami T, Ash S, Ben-Harosh M, et al. Nasopharyngeal carcinoma in children and young adults-Beyond 5-year survival[J]. Pediatr Blood Cancer, 2020, 67(9): e28494. |
| [17] |
Buehrlen M, Zwaan CM, Granzen B, et al. Multimodal treatment, including interferon beta, of nasopharyngeal carcinoma in children and young adults: preliminary results from the prospective, multicenter study NPC-2003-GPOH/DCOG[J]. Cancer, 2012, 118(19): 4892-4900. DOI:10.1002/cncr.27395 |
| [18] |
Rodriguez-Galindo C, Krailo MD, Krasin MJ, et al. Treatment of Childhood Nasopharyngeal Carcinoma With Induction Chemotherapy and Concurrent Chemoradiotherapy: Results of the Children's Oncology Group ARAR0331 Study[J]. J Clin Oncol, 2019, 37(35): 3369-3376. DOI:10.1200/JCO.19.01276 |
| [19] |
Gioacchini FM, Tulli M, Kaleci S, et al. Prognostic aspects in the treatment of juvenile nasopharyngeal carcinoma: a systematic review[J]. Eur Arch Otorhinolaryngol, 2017, 274(3): 1205-1214. DOI:10.1007/s00405-016-4154-7 |
| [20] |
Song XD, Wang YN, Zhang AL, et al. Advances in research on the interaction between inflammation and cancer[J]. J Int Med Res, 2020, 48(4): 300060519895347. |
| [21] |
Sharma D, Brummel-Ziedins KE, Bouchard BA, et al. Platelets in tumor progression: a host factor that offers multiple potential targets in the treatment of cancer[J]. J Cell Physiol, 2014, 229(8): 1005-1015. DOI:10.1002/jcp.24539 |
| [22] |
Yang M, Yang Y, Cui H, et al. The natural compound gambogic acid radiosensitizes nasopharyngeal carcinoma cells under hypoxic conditions[J]. Tumori, 2016, 102(2): 135-143. DOI:10.5301/tj.5000411 |
| [23] |
Yamamoto T, Kawada K, Obama K. Inflammation-Related Biomarkers for the Prediction of Prognosis in Colorectal Cancer Patients[J]. Int J Mol Sci, 2021, 22(15): 8002. DOI:10.3390/ijms22158002 |
| [24] |
Li P, Li H, Ding S, et al. NLR, PLR, LMR and MWR as diagnostic and prognostic markers for laryngeal carcinoma[J]. Am J Transl Res, 2022, 14(5): 3017-3027. |
| [25] |
Mandaliya H, Jones M, Oldmeadow C, et al. Prognostic biomarkers in stage Ⅳ non-small cell lung cancer (NSCLC): neutrophil to lymphocyte ratio (NLR), lymphocyte to monocyte ratio (LMR), platelet to lymphocyte ratio (PLR) and advanced lung cancer inflammation index (ALI)[J]. Transl Lung Cancer Res, 2019, 8(6): 886-894. |
| [26] |
Semin DY, Mardynsky YS, Medvedev SV, et al. Prognostic value of hemoglobin concentration in the course of chemoradiotherapy of patients with oropharyngeal squamous cell carcinoma[J]. Vopr Onkol, 2015, 61(1): 125-129. |
| [27] |
Claps G, Faouzi S, Quidville V, et al. The multiple roles of LDH in cancer[J]. Nat Rev Clin Oncol, 2022, 19(12): 749-762. |
| [28] |
Peng RR, Liang ZG, Chen KH, et al. Nomogram Based on Lactate Dehydrogenase-to-Albumin Ratio (LAR) and Platelet-to-Lymphocyte Ratio (PLR) for Predicting Survival in Nasopharyngeal Carcinoma[J]. J Inflamm Res, 2021, 14: 4019-4033. |
| [29] |
Feng JF, Wang L, Yang X, et al. Prognostic value of lactate dehydrogenase to albumin ratio (LAR) in patients with resectable esophageal squamous cell carcinoma[J]. Cancer Manag Res, 2019, 11: 7243-7251. |
| [30] |
Aday U, Tatlı F, Akpulat FV, et al. Prognostic significance of pretreatment serum lactate dehydrogenase-to-albumin ratio in gastric cancer[J]. Contemp Oncol (Pozn), 2020, 24(3): 145-149. |
| [31] |
Aday U, Böyük A, Akkoç H. The prognostic significance of serum lactate dehydrogenase-to-albumin ratio in colorectal cancer[J]. Ann Surg Treat Res, 2020, 99(3): 161-170. |
 2023, Vol. 50
2023, Vol. 50


