文章信息
- 达芬奇机器人辅助经剑突下与经侧胸入路治疗前纵隔肿瘤的临床疗效比较
- Clinical Efficacy of Da Vinci Robot-assisted Subxiphoid Versus Lateral Thoracic Approach for Treatment of Anterior Mediastinal Tumors
- 肿瘤防治研究, 2023, 50(6): 598-602
- Cancer Research on Prevention and Treatment, 2023, 50(6): 598-602
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1388
- 收稿日期: 2022-11-22
- 修回日期: 2023-01-18
2. 730000 兰州,甘肃省人民医院胸外科
2. Department of Thoracic Surgery, Gansu Provincial Hospital, Lanzhou 730000, China
前纵隔肿瘤以良性肿瘤多见,患者早期通常无明显症状,多数患者为体检发现,当肿瘤逐渐增大时,可能会对周围的组织及器官产生压迫症状,临床上常采用手术治疗[1]。电视辅助胸腔镜手术(video-assisted thoracoscopic surgery, VATS)在前纵隔肿瘤手术中的应用已经很广泛,但VATS存在一些不足之处。自2009年罗清泉等[2]完成中国内地首例机器人辅助前纵隔肿瘤切除术以来,机器人辅助胸腔镜手术(robot-assisted thoracoscopic surgery, RATS)逐渐成为国内治疗前纵隔肿瘤的重要术式,并在近年来取得了突破性的进展[3-4],与传统胸腔镜前纵隔肿瘤切除术相比,其具有三维立体的视角,视野开阔,放大倍数高,机械臂在狭窄解剖区域比人手更灵活、稳定和精确,对胸腺静脉等血管的处理及靠近无名静脉、上腔静脉及膈神经等危险区域的操作更加精准与安全[5],特别是在胸腺瘤治疗中,实现了前纵隔脂肪骨骼化清扫,使全胸腺切除变得高效。
早期RATS下切除前纵隔肿瘤常采用侧胸入路,容易对患者肋间神经和肌肉造成损伤,造成术后急慢性疼痛,不利于术后恢复[6]。而经剑突下入路保证了胸廓的完整性,且不经过肋间操作,避免了损伤肋间神经而造成的术后疼痛,更容易识别双侧膈神经及胸腺上极,对肺功能损害更小,手术切口也更加美观,因此近年来在临床上应用广泛[7-8]。随着我中心RATS纵隔肿瘤切除技术逐渐成熟,决定在此基础上继续完善优化手术流程,采取非气管插管即喉罩麻醉以简化麻醉流程,缩短手术时间和恢复时间,提高患者术后生活质量。本研究旨在探讨喉罩麻醉下RATS中经剑突下与经侧胸入路治疗前纵隔肿瘤的围手术期疗效及安全性。
1 资料与方法 1.1 研究对象本研究为单中心回顾性队列研究,纳入并分析2017年3月—2022年7月甘肃省人民医院胸外科经同一术者连续完成的102例行喉罩麻醉下RATS治疗的前纵隔肿瘤患者。
纳入标准:(1)术前使用增强CT检查明确为纵隔肿瘤;(2)对于胸腺瘤合并重症肌无力的患者经积极内科治疗后症状控制稳定等[9];(3)既往无肺结核、胸膜炎或者手术病史且术前相关检查未提示胸膜增厚、粘连[10]。排除标准:(1)中、后纵隔肿瘤;(2)心肺功能不良或严重心律失常不能耐受手术的患者;(3)为防止出现因术者或助手不同,从而产生偏倚的问题,排除了部分不同术者手术的患者数据,所有纳入患者的手术均由同一位胸外科医生(苟云久教授)主刀完成且助手也固定。本研究经甘肃省人民医院伦理委员会审查(审批号:2023-052)。所有患者术前均签署知情同意书。
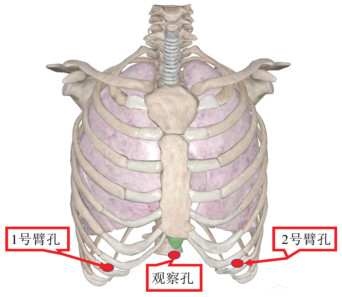
1.2 手术方法经剑突下组采用三孔三臂全孔法、CO2人工气胸。麻醉采取喉罩通气下的全身麻醉。体位:头高脚底位,双臂外展。剑突下通过术者手指来辅助完成制孔,打孔位置:剑突下长约3 cm切口为观察孔,而机械臂孔分别设置于左右侧锁骨中线、肋骨下缘[10],见图 1。手术过程中解剖纵隔胸膜,将纵隔肿物完全切除,严密止血(术中图片请扫描本文OSID码)。从观察孔处取出标本。然后清点器械及辅料无误后,放置胸腔引流管,膨肺,逐层关闭胸腔。
|
| 图 1 剑突下入路孔位布局 Figure 1 Hole layout of subxiphoid approach |
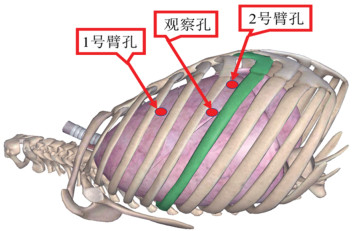
经侧胸组采用三孔三臂全孔法、CO2人工气胸。麻醉采取喉罩通气下的全身麻醉。体位:侧卧体位,略向前倾。孔位设置为“5-3-5”法,见图 2,“5”为观察孔,在患侧腋前线第五肋间;“3”为1号臂操作孔,在腋前线第三肋间;“5”为2号臂操作孔,在锁骨中线第五肋间。手术过程中解剖纵隔胸膜,将纵隔肿物完全切除,严密止血(术中图片请扫描本文OSID码)。从操作孔处取出标本。然后清点器械及辅料无误后,放置胸腔引流管,膨肺,逐层关闭胸腔。
|
| 图 2 侧胸入路孔位布局 Figure 2 Hole layout of lateral thoracic approach |
观察指标包括:性别、年龄、体重指数(body mass index, BMI)、吸烟史、合并症(包括冠心病、高血压和糖尿病)、肿瘤大小、肿瘤类型和患者就诊的一般主诉。手术和术后数据包括手术时间、装机时间、术中出血量、术后总引流量、术后引流时间、术后住院时间、术后疼痛视觉模拟(visual analogue scale, VAS)评分(术后第1、2、3天)和术后并发症。
1.4 统计学方法采用SPSS26.0软件进行统计分析,连续变量以均数±标准差(x±s)表示,正态分布数据的组间比较采用两组独立样本t检验,非正态分布数据的组间比较采用Wilcoxon检验。分类变量以频数和百分比(%)表示,组间比较采用卡方检验或Fisher检验。P < 0.05为差异有统计学意义。
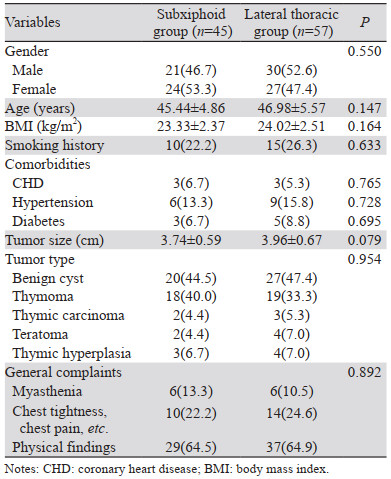
2 结果 2.1 患者一般资料两组入选患者均顺利完成手术,无围手术期死亡病例。两组在性别、年龄、BMI、肿瘤大小和肿瘤类型等基线指标方面差异无统计学意义(P > 0.05),见表 1。
|
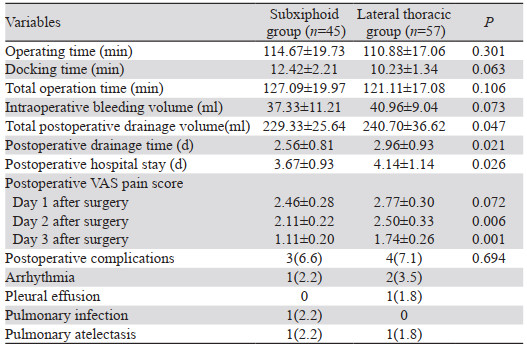
剑突下组在术后总引流量、术后引流时间、术后住院时间、术后第2和第3天VAS疼痛评分方面均优于侧胸组,差异具有统计学意义(P < 0.05);在手术时间、装机时间、总手术时间、术中出血量、术后第1天VAS疼痛评分和术后并发症方面,两组差异无统计学意义(P > 0.05),见表 2。
|
既往的研究表明,在VATS切除前纵隔肿瘤中,剑突下入路和侧胸入路均有较高的安全性[11-12]。我中心自2016年起开始使用达芬奇机器人手术系统,在RATS技术逐渐成熟后常规行喉罩麻醉下RATS侧胸入路治疗前纵隔肿瘤患者。此外,我们基于VATS中剑突下入路的经验也积极开展了喉罩麻醉下RATS剑突下入路治疗前纵隔肿瘤患者,故在本研究中,我们回顾性分析了喉罩麻醉下不同入路RATS前纵隔肿瘤切除术在我们单一医疗组中的短期疗效及安全性。
与气管插管不同,i-gel喉罩不进入声门及以下气管,操作简单,低刺激及低应力反应,较少出现气道及咽部并发症[13],本研究中仅侧胸组术后出现1例轻度咽喉痛,其余患者均未发生声音嘶哑及饮水呛咳的情况。有研究表明置入i-gel喉罩较气管插管较少产生皮质醇、白介素-6、肿瘤坏死因子-α和内咖肽等物质,可以降低全身炎性反应及氧化反应[14],对血流动力学影响也更小[15]。但i-gel喉罩气道密封性较气管插管差且不能实现单肺通气,为保证良好的手术视野,我们往往同时加用6~8 mmHg人工气胸,使肺处于半萎缩状态[16],麻醉师无需特意小潮气量高频通气,如术中术侧肺组织萎陷不良影响手术视野,在保证氧合佳的情况下可适当降低潮气量,必要时可联合使用支气管封堵器,应用保护性通气模式。这样既保证了手术的安全,又提高了患者的舒适度,减少咽喉及气道的并发症[13]。
本研究结果表明,在总手术时间方面剑突下组与侧胸组差异无统计学意义,但是剑突下组的装机时间比侧胸组略长。在术中出血量方面,两组无显著差异。根据笔者的深刻体会,RATS侧胸入路和剑突下入路比既往我们应用VATS侧胸入路和剑突下入路在减少术中出血量方面具有显著优势,主要原因可能是:第一,RATS提供了十倍放大的三维可视化图像和优越的成像质量,有助于术中识别各种结构;第二,RATS可以自由地进行机械臂的关节运动,并通过其手腕提供七个自由度的活动,使外科医生能够在稳定舒适的环境中进行手术,从而实现更精确的解剖,避免神经和动脉的损伤;第三,RATS在缝合方面具有优势,利于术者处理术中出血。
剑突下入路保持了胸廓的完整性与稳定性,剑突周围无骨性结构,便于移除标本,且不经过肋间操作,避免了损伤肋间神经,术后疼痛减轻[10]。本研究结果表明,与侧胸组相比,剑突下组在术后总引流量、术后引流时间和术后住院时间方面更具优势。剑突下入路可以减少胸膜损伤和胸壁细小淋巴管断裂渗漏,胸腔积液产生的途径减少,可以减少术后总引流量[7]。此外,笔者认为由于剑突下入路患者术后疼痛更轻,利于患者积极的咳嗽咳痰和早期下床活动,故引流量更少,患者也可以更早拔除引流管。同时,由于更早脱管,患者主观疼痛显著降低,从而不会出现因疼痛带来的呼吸减弱以及对术后机械辅助排痰的配合欠佳,进而影响术后肺复张;由于没有床边引流瓶的限制,更便于患者下床活动,减少了因长时间卧床而发生的坠积性肺炎的发生率;同时,由于引流管与外界相通,细菌有机会通过引流管逆行而上,造成胸腔感染[17],因此,减少了感染的发生率。此外,早期下床,也可以加速肠道蠕动,促进患者优质蛋白的摄入,加快术后恢复,故而缩短了术后住院时间,这也正是加速康复外科所提倡的[18]。
在术后疼痛VAS评分方面,术后第2、3天剑突下组优于侧胸组,而术后第1天两组未见明显差异。患者术后疼痛来源主要有以下两个方面;第一,术区切口肌肉、筋膜及神经的病理性疼痛;第二,术后引流管口摩擦和牵拉导致的疼痛。我中心在术后常规予以镇痛泵持续静脉给药镇痛。而侧胸组带管时间的延长会加剧引流管对胸膜及管口的持续性刺激,加重患者疼痛,影响术后咳嗽咳痰、夜间睡眠和术后下床活动,进而延长术后住院时长以及加重患者经济负担。此外,笔者认为,由于侧胸组的操作孔位于腋前线和锁骨中线的肋骨间,此处的肋间肌较厚,肋间神经及血管分布较剑突下丰富,故而相较于剑突下入路,主观疼痛更为显著。在术后并发症方面,剑突下组发生率略低于侧胸组,但两组差异无统计学意义。
本中心的侧胸入路一般采用右侧肋间入路,与左侧肋间入路相比,右侧胸腔操作空间相对较大,有更好的手术视野,重要的是能避开心脏、主动脉弓等结构,安全性更高[19]。若是胸腺肿瘤明显突出于左侧胸腔时,选择左肋间入路手术是比较适合且安全的[20]。根据我们的经验,RATS中剑突下入路的优势如下:视野好、显露好;机械臂更加灵活、震颤少、更加安全;肿瘤切除更加完整、前纵隔脂肪清扫更彻底(对于胸腺瘤,剑突下入路可以观察到胸腺双侧的视野,能够更彻底、安全的解剖胸腺及其周围的脂肪组织);便于取出标本;切口更加美观,疼痛更轻,年轻患者的接受度更高。此外,虽然本研究纳入的病例均无术中中转开胸,但是剑突下入路不需要摆放侧卧体位,若在手术中意外出现大出血情况需要紧急开胸止血时,会比侧胸入路更快。有报道[21]表明RATS切除前纵隔肿瘤中剑突下入路的学习曲线为10~20例达到平台期,根据我们的经验在有丰富VATS经验的情况下,10台手术后基本可以达到平台期。
本研究存在一定的局限性和不足:首先由于纳入研究的数据来源为单中心且为回顾性研究,样本量相对较少,故结果可能存在偏倚;其次,本研究缺乏长期生存分析,拟进一步通过随访完善数据。
综上所述,喉罩麻醉下RATS剑突下入路在切除前纵隔肿瘤方面安全、可行,与侧胸入路相比,剑突下入路在术后快速恢复和术后患者疼痛方面具有优势,患者接受度更高,值得推广。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
洪子强:数据整理与分析、论文设计及撰写
盛燕楠:论文审阅与修改
白向豆、崔百强:论文指导与统计分析
逯英杰、金大成:协助数据收集
吴旭升、成涛:论文审阅与指导
苟云久:研究选题与设计、论文审阅与修改
| [1] |
Gao L, Lu J, Shen Z, et al. A novel method of subxiphoid video-assiste thoracic surgery for thymectomy[J]. Ann Transl Med, 2021, 9(16): 1339. DOI:10.21037/atm-21-4070 |
| [2] |
黄佳, 罗清泉, 谭强. 机器人外科手术系统辅助胸腔镜胸腺瘤切除手术一例[J]. 上海医学, 2010, 33(11): 1072. [Huang J, Luo Q, Tan Q. A case of assisted thoracoscopic thymoma resection by robotic surgical system[J]. Shanghai Yi Xue, 2010, 33(11): 1072.] |
| [3] |
Asaf BB, Puri HV, Bishnoi S, et al. Subxiphoid robotic extended thymectomy–The first Indian report[J]. J Minim Access Surg, 2020, 16(4): 360-363. DOI:10.4103/jmas.JMAS_34_19 |
| [4] |
Park SY, Han KN, Hong JI, et al. Subxiphoid approach for robotic single-site-assisted thymectomy[J]. Eur J Cardiothorac Surg, 2020, 58(Suppl_1): i34-i38. |
| [5] |
Şehitogullari A, Nasır A, Anbar R, et al. Comparison of perioperative outcomes of videothoracoscopy and robotic surgical techniques in thymoma[J]. Asian J Surg, 2020, 43(1): 244-250. DOI:10.1016/j.asjsur.2019.04.005 |
| [6] |
Fok M, Bashir M, Harky A, et al. Video-assisted thoracoscopic versus robotic-assisted thoracoscopic thymectomy: systematic review and meta-analysis[J]. Innovations (Phila), 2017, 12(4): 259-264. DOI:10.1097/imi.0000000000000382 |
| [7] |
Suda T, Kaneda S, Hachimaru A, et al. Thymectomy via a subxiphoid approach: Single-port and robot-assisted[J]. J Thorac Dis, 2016, 8(Suppl 3): S265-S271. |
| [8] |
Park S. Robot-assisted thoracic surgery thymectomy[J]. J Chest Surg, 2021, 54(4): 319-324. DOI:10.5090/jcs.21.059 |
| [9] |
Call S, Obiols C, Rami-Porta R. Present indications of surgical exploration of the mediastinum[J]. J Thorac Dis, 2018, 10(Suppl 22): S2601-S2610. |
| [10] |
中国医师协会医学机器人医师分会胸外科专业委员会筹备组, 谭群友, 张太明, 等. 机器人辅助纵隔肿瘤手术中国专家共识(2019版)[J]. 中国胸心血管外科临床杂志, 2020, 27(2): 117-125. [Preparatory Group of the Thoracic Surgery Specialty Committee of the Medical Robotics Physicians Branch of the Chinese Medical Association, Tan QY, Zhang TM, et al. Chinese expert consensus on robot-assisted mediastinal tumor surgery (2019 edition)[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2020, 27(2): 117-125.] |
| [11] |
Da M, Peng W, Mo X, et al. Comparison of efficacy between video-assisted thoracoscopic surgery and thoracotomy in children with mediastinal tumors: 6-year experience[J]. Ann Transl Med, 2019, 7(22): 653-661. DOI:10.21037/atm.2019.10.81 |
| [12] |
Nagano H, Suda T, Ishizawa H, et al. Video-assisted thoracoscopic surgery for ectopic mediastinal parathyroid tumor: subxiphoid and lateral thoracic approach[J]. J Thorac Dis, 2019, 11(7): 2932-2938. DOI:10.21037/jtd.2019.07.35 |
| [13] |
孟祥瑞, 徐惟, 王述民, 等. 79例完全无管化机器人纵隔肿物切除术的回顾性分析研究[J]. 中国胸心血管外科临床杂志, 2019, 26(3): 211-216. [Meng XR, Xu W, Wang SM, et al. Retrospective analysis of mediastinum mass resection with totally no tube during da Vinci robotic surgery for 79 patients[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2019, 26(3): 211-216.] |
| [14] |
Tang C, Chai X, Kang F, et al. I-gel laryngeal mask airwaycombined with tracheal intubation attenuate systemic stress response in patients undergoing posterior fossa surgery[J]. Mediators Inflamm, 2015, 2015: 965925. |
| [15] |
Chauhan G, Nayar P, Seth A, et al. Comparison of clinical performance of the I-gel with LMA proseal[J]. J Anaesthesiol Clin Pharmacol, 2013, 29(1): 56-60. DOI:10.4103/0970-9185.105798 |
| [16] |
刘星池, 许世广, 徐惟, 等. 完全无管化达芬奇机器人纵隔肿瘤切除手术在快速康复外科中应用[J]. 临床军医杂志, 2016, 44(6): 569-570. [Liu XC, Xu SG, Xu W, et al. Application of completely tubeless Da Vinci robotic mediastinal tumor resection in fast rapid rehabilitation in surgery[J]. Lin Chuang Jun Yi Za Zhi, 2016, 44(6): 569-570.] |
| [17] |
刘文汉, 石文君. 胸腔镜纵隔良性肿瘤切除术后不留置引流管的安全性及可行性分析[J]. 现代肿瘤医学, 2020, 28(21): 3730-3733. [Liu WH, Shi WJ. Safety and feasibility analysis of non-drainage after thoracoscopic resection of benign mediastinal tumors[J]. Xian Dai Zhong Liu Yi Xue, 2020, 28(21): 3730-3733.] |
| [18] |
Dong Q, Zhang K, Cao S, et al. Fast-track surgery versus conventional perioperative management of lung cancer-associated pneumonectomy: a randomized controlled clinical trial[J]. World J Surg Oncol, 2017, 15(1): 20. |
| [19] |
Mao Y, Lan Y, Cui F, et al. Comparison of different surgical approaches for anterior mediastinal tumor[J]. J Thorac Dis, 2020, 12(10): 5430-5439. |
| [20] |
Abu-Akar F, Gonzalez-Rivas D, Yang C, et al. Subxiphoid uniportal VATS f or thymic and combined mediastinal and pulmonary resections-a two-year experience[J]. Semin Thorac Cardiovasc Surg, 2019, 31(3): 614-619. |
| [21] |
Zhang H, Chen L, Zheng Y, et al. Robot-assisted thymectomy via subxiphoid approach: technical details and early outcomes[J]. J Thorac Dis, 2018, 10(3): 1677-1682. |
 2023, Vol. 50
2023, Vol. 50


