文章信息
- 基于病证结合信息构建广泛期小细胞肺癌安罗替尼疗效预测模型
- Prediction Model of Treatment Effect of Anlotinib on Extensive-stage Small Cell Lung Cancer Based on Combination of Disease and Syndrome Information
- 肿瘤防治研究, 2023, 50(5): 483-489
- Cancer Research on Prevention and Treatment, 2023, 50(5): 483-489
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1373
- 收稿日期: 2022-11-21
- 修回日期: 2023-03-01
小细胞肺癌(SCLC)作为肺癌中的常见类型,占所有新确诊肺癌的13%左右[1]。根据肿瘤侵袭范围大小,SCLC可分为局限期和广泛期,约70%的患者在确诊时已为广泛期。其肿瘤恶性程度较高,极具侵袭性,预后相对较差,5年总生存率低于10%[2]。目前基于铂类药物的联合化疗方案仍然是SCLC治疗的标准方案,与不含铂的方案相比,虽然具有较高的应答率和显著的生存参数改善,但SCLC仍易出现复发转移与耐药率高的问题[3]。近年来,相关学者在SCLC的靶向治疗、免疫治疗方面也做出了相应探索,但其研究进展仍较缓慢,临床效果也十分有限。盐酸安罗替尼作为一种新型小分子多靶点酪氨酸激酶抑制剂,主要通过有效抑制血管内皮细胞生长因子受体(vascular endothelial growth factor receptor, VEGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor, PDGFR)、成纤维生长因子受体(fibroblast growth factor receptor, FGFR)和干细胞生长因子受体等激酶的活性,进而发挥抗肿瘤血管生成和抑制肿瘤生长的作用[4],是国内唯一获批NSCLC及SCLC的抗血管生成药[5]。有研究结果显示安罗替尼治疗ES-SCLC仍存在局限性,不同ES-SCLC患者对安罗替尼的治疗反应不尽相同,无进展生存期与总生存期之间也存在较大差异性[6-8]。目前研究学者尝试从安罗替尼疗效的预测因子方面进行了探索,一些可能性的预测因子也被挖掘,但其效果并不是很理想,仍待进一步考究[9-10]。中医药在治疗ES-SCLC方面优势明显,其中医证候分布也极具特色,具备成为预测因子的潜力,截止目前尚未发现同类研究。故本研究考虑将中医证素因素纳入,建立中医证素参与的安罗替尼治疗既往接受过多线化疗进展的广泛期SCLC患者预后的预测列线图,并对模型预测效力进行评估。
1 资料与方法 1.1 研究对象纳入2020年1月至2022年6月期间在唐山市人民医院放化疗科接受安罗替尼治疗的广泛期SCLC患者127例。本研究经唐山市人民医院伦理委员会批准,所有患者在入组前均已签署了知情同意书。诊断标准:(1)西医诊断标准:采用中华人民共和国国家卫生健康委员会发布的《原发性肺癌诊疗指南(2022年版)》[11]进行诊断;(2)中医病性证素诊断标准:依据朱文锋的《证素辨证学》[12],按照“证候辨证素计算表”,以各症状对各证素贡献度之和≥20时,即可诊断为该病性证素,同时根据权值之和辨别证素的轻重。纳入标准:(1)年龄为18~80周岁;(2)组织学或细胞学和影像学确诊为SCLC;(3)既往接受过一线含铂两药化疗失败的难治性SCLC患者,或接受过二线及以上化疗的SCLC患者;(4)肿瘤分期为广泛期;(5)至少存在一个可测量病灶。排除标准:(1)有严重的重要脏器功能不全者;(2)合并其他原发肿瘤;(3)既往使用过其他血管靶向药;(4)依从性差,未按规定用药,疗效无法判定者;(5)未使用其他抗肿瘤药物及非抗肿瘤药物者。
1.2 患者基本临床信息由肿瘤内科专业医师采集纳入研究对象的年龄、性别、PS评分、药物剂量、治疗线数、不良反应、疗效评价、无进展生存期、总生存期、是否发生脑转移、肝转移、骨转移等一般临床信息。利用X-tile软件寻找出年龄截断值并进行分组[13]。由两位副高级以上职称的中西医结合医师根据《证素辨证学》、《中药新药临床研究指导原则》[14]及相关参考文献制定包括四诊信息在内的临床观察研究表,根据患者的中医四诊信息进行中医病性证素辨别。
1.3 治疗方法早餐前,空腹服用盐酸安罗替尼胶囊(正大天晴药业;国药准字:H20180002;规格:8毫克/粒或12毫克/粒),每日1次,每次1/粒。连续服药2周,停药1周,即3周(21天)为一个疗程。服药期间,密切监测不良反应,并根据不良反应情况进行剂量调整以使患者能够耐受;出现不可耐受不良反应或疾病进展时,停止用药。
1.4 疗效评价每2个治疗周期(42天)进行一次疗效评价。客观疗效指标具体依据RECIST 1.1评价标准进行治疗效果的评估。无进展生存期(PFS)定义为开始口服安罗替尼直至肿瘤客观进展或死亡时间。总生存期(OS)定义为开始口服安罗替尼至任何原因引起的死亡时间。
1.5 统计学方法使用SPSS23.0软件和R软件(版本4.0.4)中的“glmnet”和“rms”包进行统计分析。计数资料采用频数与百分比表示,采用卡方检验或者Fisher精确概率法进行检验。计量资料采用平均数、标准差与中位数表示,符合正态分布采用t检验,不符合则采用Wilcoxon符号秩和检验。采用Kaplan-Meier法进行单因素生存分析,Log rank法进行检验,单因素分析中对生存时间影响显著的因素纳入Cox回归模型进行多因素分析,筛选出独立的预后影响因素,应用R语言构建预测安罗替尼治疗广泛期小细胞肺癌预后的列线图预测模型,通过C-index指数评估模型的预测能力,应用校准曲线判断模型预测值与真实值之间的符合度。采用双侧检验,P < 0.05为差异有统计学意义。
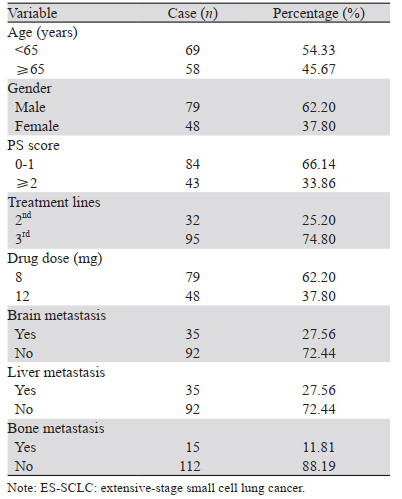
2 结果 2.1 一般临床资料127例广泛期SCLC患者中位OS为4个月,PFS为2个月。年龄、性别、PS评分、治疗线数、使用药物剂量、脑转移、肝转移、骨转移情况,见表 1。
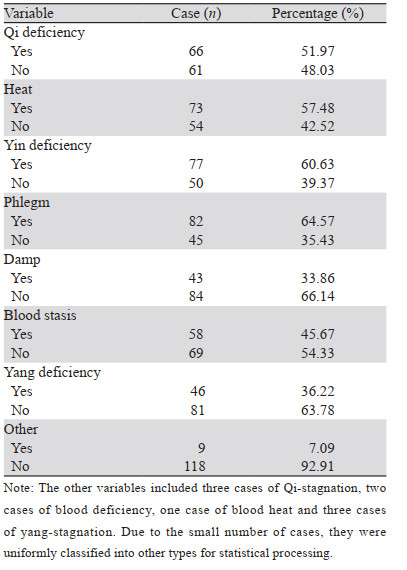
127例广泛期SCLC患者中医证素分布频率由高到低依次为痰、阴虚、热、气虚、血瘀、阳虚、湿、其他(包括气滞3例,血虚2例,血热1例,阳郁3例),见表 2。
|
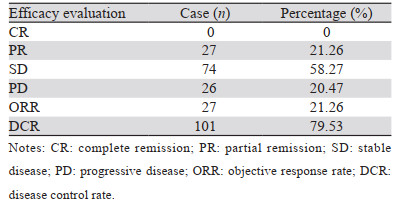
127例广泛期SCLC患者经安罗替尼治疗2个周期后,客观缓解率为21.26%,疾病控制率为79.53%,见表 3。
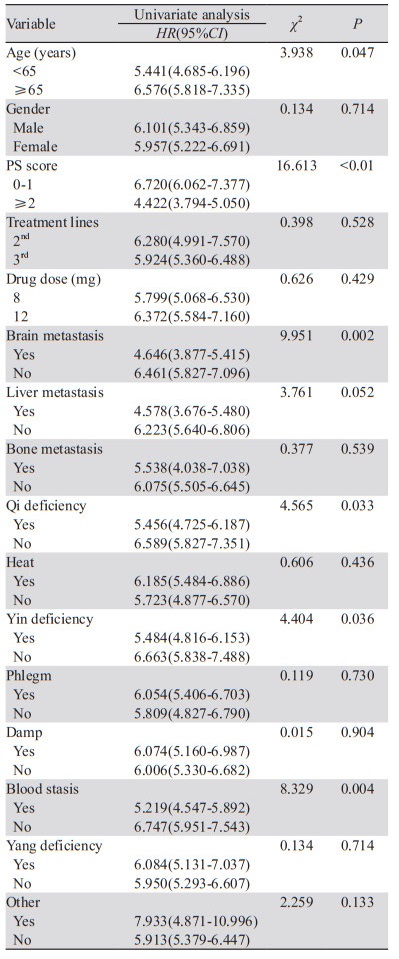
经Kaplan-Meier法单因素生存分析显示,年龄(P=0.047)、PS评分(P < 0.01)、脑转移(P=0.002)、气虚病性证素(P=0.033)、阴虚病性证素(P=0.036)、血瘀病性证素(P=0.004)是影响SCLC患者预后的相关危险因素,见表 4。
|
将单因素分析中的年龄、PS评分、脑转移、气虚病性证素、阴虚病性证素、血瘀病性证素纳入Cox回归模型行多因素分析发现,PS评分(HR=2.188, 95%CI: 1.302~3.675, P=0.003)、脑转移(HR=1.891, 95%CI: 1.128~3.171, P=0.016)、血瘀病性证素(HR=1.691, 95%CI: 1.060~2.699, P=0.028)是影响安罗替尼治疗广泛期SCLC患者预后的独立危险因素,见图 1。
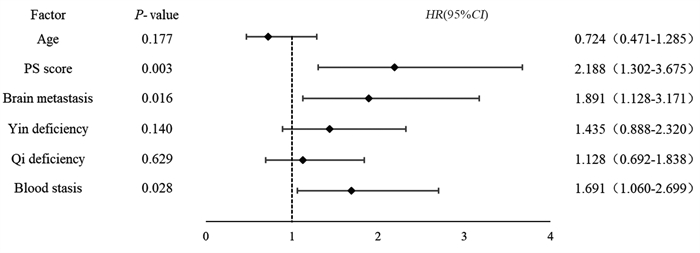
|
| 图 1 127例广泛期SCLC患者预后的多因素分析结果 Figure 1 Multivariate prognostic analysis of 127 patients with ES-SCLC |
基于多因素Cox回归分析筛选出来的PS评分、脑转移、血瘀病性证素这3个独立预测因子,建立安罗替尼治疗广泛期SCLC患者6个月、9个月生存概率的列线图预测模型,见图 2。在该列线图中,每一个独立预测因素都有其对应的分数(Points),将各项预测因素所对应的分数相加可以分别得出6个月、9个月生存概率的总分(Total Points),从而得出广泛期SCLC患者经安罗替尼治疗后6个月、9个月的生存概率。该模型预测安罗替尼治疗广泛期SCLC患者预后的C-index值为0.689。校准曲线结果显示,预测值与真实值之间符合的平均绝对误差为0.089和0.046,预测风险接近实际风险,符合度好,见图 3。
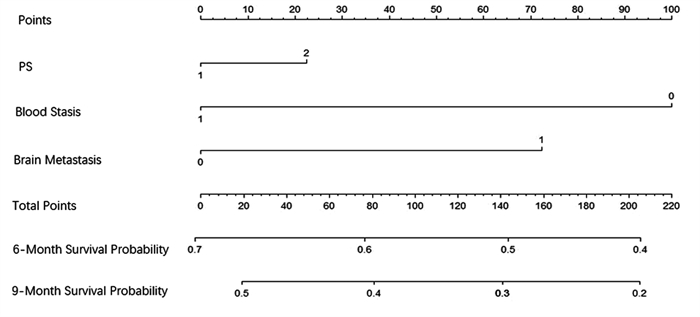
|
| 图 2 经安罗替尼治疗后广泛期SCLC患者预后的列线图预测模型 Figure 2 Prognosis prediction model of patients with ES-SCLC after anlotinib therapy |
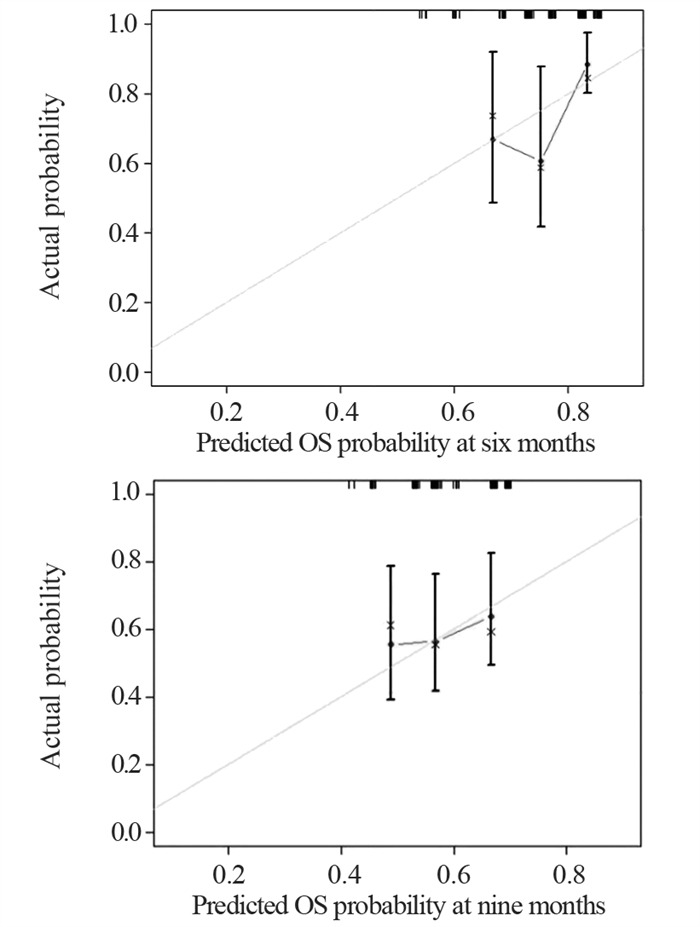
|
| 图 3 预测6个月、9个月生存概率的校准曲线图 Figure 3 Calibration curves predicting 6- and 9-month survival probabilities |
SCLC对放疗和化疗敏感,多年来,放化疗一直是SCLC的主要一线治疗手段,但治疗后易耐药,因此抗血管生成治疗的研究受到关注。目前,抗血管生成药物主要聚焦于单克隆抗体(如Bevacizumab)、内源性血管生成抑制剂(如Endostar)、抗血管生成融合蛋白(如Aflibercept)和小分子酪氨酸激酶抑制剂(如安罗替尼等)4类[15]。一项随机研究证实,Bevacizumab明显改善了SCLC患者的PFS,但未能延长OS,此外在该项研究中参与试验的57例SCLC患者有9%的患者在Bevacizumab治疗期间出现了G3~4毒性[16]。重组人血管内皮抑素(Endostar)通过抑制形成血管的内皮细胞迁移而抑制肿瘤新生血管生成,从而达到抑制恶性肿瘤生长的目的[17]。目前临床多将此应用于NSCLC的治疗,而应用于SCLC治疗的报道相对较少且滞后。Aflibercept(VEGF Trap)是一种重组的VEGF受体-抗体融合蛋白,对VEGF-A的亲和力高于Bevacizumab,其在肺癌的治疗中显示出潜在优势,但缺乏大型临床试验验证[18]。安罗替尼作为中国唯一获批NSCLC、SCLC三线治疗的靶向药,明显延长了中国广泛期SCLC患者的PFS和OS[16],其有效性及安全性也得到了相关临床研究的证实,因此被广泛应用于中国ES-SCLC患者的治疗。
安罗替尼是一种多靶点酪氨酸激酶抑制剂,可抑制肿瘤血管生成,在临床试验中表现出良好的抗癌疗效和可接受的安全性。Gao等[19]研究发现,接受安罗替尼治疗的40例ES-SCLC患者PFS为3.0个月,OS为7.8个月,并且DCR为45.0%。而本研究中,经安罗替尼治疗的127例ES-SCLC患者中位OS为4个月,PFS为2个月,DCR为79.53%,二者存在一定偏差,考虑与样本量及地域分布有关。该项研究同时显示ECOG评分 > 1可能是安罗替尼预后不良的危险因素,与本研究结果中PS评分是影响ES-SCLC患者预后的独立影响因素具有一致性,并且PS评分≥2分时,患者预后不良。王静怡等[8]在一项安罗替尼二三线治疗ES-SCLC患者预后的研究中证实,存在脑转移和血浆IL-8 > 17.7 ng/L是接受安罗替尼二三线治疗的ES-SCLC患者独立的预后不良因素。与本研究筛选出来的存在脑转移独立因素一致,表明本研究与既往研究结果相符。查阅既往资料未发现有从中医药角度切入分析影响安罗替尼治疗ES-SCLC患者预后相关因素的文献,但不乏肺癌中医证型与某些药物治疗非小细胞肺癌疗效及预后相关性的报道[20-22]。长期临床研究发现,SCLC患者的中医证型分布具有一定的规律性,而作为构成中医证型的证候要素,一定程度上完善了疾病辨证的客观性,使得以往对中医疾病经验性辨证的模糊性诊断转变为较为清晰、客观的标准化诊断,更易被临床接受。基于此,考虑将ES-SCLC患者的中医证素作为影响因素纳入考虑范围,建立中医证素参与的安罗替尼多线治疗广泛期小细胞肺癌患者预后的列线图模型,其中血瘀病性证素作为独立预测因子被筛选出来。中医理论认为血瘀日久不畅易形成瘀血,而瘀血作为病理产物被认为是包括肺癌在内的多种疾病预后不良的危险因素。既往未发现把中医证候要素结合到预测模型中的报道,建立中医证素参与的预测模型可能提升模型预测效力,而且可根据研究结果及早采取中医方法进行预防干预,比如对于存在血瘀病性证素的ES-SCLC患者可适当予活血化瘀药物干预,以提高患者预后。
既往文献研究多认为年龄为癌症的独立预后因素,而本文研究中年龄被排除在外,考虑原因包括:一方面年龄带来的预后影响可能被多种因素,特别是PS评分(随着年龄的增加,患者的体力状态往往更差)所抵消。Chen等[23]的一项随机多中心Ⅱ期试验研究也提示年龄与安罗替尼治疗SCLC的预后无明显相关性;Wu等[24]在另一项前瞻性Ⅱ期临床试验中同样发现,年龄不是影响安罗替尼治疗SCLC预后的独立影响因素,这些结果与本研究结果一致;另外,本研究选择的安罗替尼抗血管生成治疗,患者耐受性较好,与化疗相比,即使高龄患者也能够保持较好的治疗依从性和连续性,这些情况可能为高龄患者带来切实的生存获益,这也体现在年龄不再是独立的预后因素。由于本研究纳入的病例数有限,可能存在一定偏倚,未来会扩充病例,进一步探讨年龄对于预后的影响。此外,研究单因素分析发现气虚和阴虚病性证素为安罗替尼疗效的负性预测指标,而在多因素分析中,这两个指标被证实不是独立的预测因素。气虚、阴虚证的患者在中医上属于虚证,以正气不足为主要临床表现,即体力状态不佳——PS评分低。推测在多因素分析时,其对于安罗替尼疗效的预测作用被体力状态评分所抵消。安罗替尼通过竞争性结合VEGFR/PDGF/FGFR上的位点,阻断上述信号转导途径,抑制血管生成,进而使肿瘤细胞缺乏营养而凋亡。血瘀证患者,瘀血内阻,致机体气血运行不畅,其病理生理本质是氧供和代谢物清除障碍,从而造成肿瘤微环境处于乏氧状态。本研究发现血瘀证患者的抗血管生成药物治疗效果不佳,推测乏氧的微环境可能使肿瘤更能耐受以抑制血管生成为主要机制的抗肿瘤药物,如安罗替尼。而非血瘀证患者的肿瘤血管丰富,供氧充足,抗血管生成药更易发挥作用,可以通过阻断肿瘤的血管生成,发挥确切的抗肿瘤作用。这也提示临床中针对此类患者可及早采取有效手段进行干预,对提高患者预后具有指导意义。
PS评分≥2分、存在脑转移、具有血瘀病性证素被认为是ES-SCLC患者预后不良的危险因素。本研究采用这三个独立预测因素建立的中医证素参与的安罗替尼多线治疗广泛期小细胞肺癌患者预后的列线图模型,可推测ES-SCLC患者6个月、9个月的生存概率。列线图模型的一致性系数(C-index)为0.689,处于0.50和0.70之间,其准确度相对较低,提示该模型预测性能需要进一步提升,下一步研究考虑将更多的预测因素纳入其中,以期进一步提升模型的预测效力。此外预测6个月、9个月生存概率的校准曲线结果显示符合度好,说明该模型具备一定的预测性能,可应用于临床实际,为安罗替尼更好地应用于临床提供中西医结合辨证治疗依据。
既往研究多以西医学相关因素作为影响因子去构建肺癌患者预后的预测模型,事实上,在中医“治未病”理论指导下,中医证候作为对四诊信息的凝练归纳,以其不同于西医的视角,宏观反映了疾病的本质以及疾病转归,可用来预测疾病的预后。将中医证素作为影响因子参与模型构建,实现了预测因子的中西医结合及扩展,相比以往单一纳入西医相关影响因素的预测模型而言,本研究所构建的预测模型的预测效力在一定程度上得到了提高,为从中医药角度出发探寻影响安罗替尼治疗ES-SCLC患者预后的影响因素提供了新思路,但该模型的推广和应用仍需要大样本量的循证医学数据和前瞻性预后预测的研究来加以验证。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
吴 琼:实验实施及论文撰写
马军燕:分析、解释数据、撰写文章
董量、李春阳:采集、分析、解释数据及技术和材料支持
王志武:审阅和指导文章
| [1] |
Poirier JT, George J, Owonikoko TK, et al. New approaches to SCLC therapy: from the laboratory to the clinic[J]. J Thorac Oncol, 2020, 15(4): 520-540. DOI:10.1016/j.jtho.2020.01.016 |
| [2] |
Dingemans A-M C, Früh M, Ardizzoni A, et al. Small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2021, 32(7): 839-853. DOI:10.1016/j.annonc.2021.03.207 |
| [3] |
Gözel S, Sumbul A, Sedef AM, et al. Influence of Creatinine Clearance on Survival Parameters in Small Cell Lung Cancer Treated with Cisplatin-Based Chemotherapy Regimen: Topic: Drug Treatment Alone and in Combination with Radiotherapy[J]. J Thoracic Oncol, 2017, 12(1): s701-s702. DOI:10.1016/j.jtho.2016.11.921 |
| [4] |
Li D, Wei G, Li L, et al. Bronchopleural fistula in squamous cell lung cancer following anlotinib treatment: A case report[J]. Mol Clin Oncol, 2019, 11(6): 595-598. |
| [5] |
中国医师协会肿瘤医师分会, 中国临床肿瘤学会血管靶向治疗专家委员会, 中国抗癌协会肿瘤靶向治疗专业委员会. 盐酸安罗替尼治疗晚期肺癌中国专家共识(2020版)[J]. 中华肿瘤杂志, 2020, 42(10): 807-816. [Oncologist Branch of Chinese Medical Doctor Association, Expert Committee of Vascular Targeted Therapy of Chinese Society of Clinical Oncology, Professional Committee of Targeted Therapy of Cancer of Chinese Anti-Cancer Association. Chinese expert consensus on the treatment of advanced lung cancer by antirotinib hydrochloride (2020 edition)[J]. Zhonghua Zhong Liu Za Zhi, 2020, 42(10): 807-816.] |
| [6] |
Zhang Y, Jia B, Li J, et al. Anlotinib in treatment of an elderly patient with recurrent advanced SCLC[J]. Tumori, 2020, 106(6): NP36-NP40. DOI:10.1177/0300891619900673 |
| [7] |
张国伟, 程瑞瑞, 牛媛媛, 等. 安罗替尼单药治疗89例老年广泛期小细胞肺癌的疗效和安全性分析[J]. 肿瘤学杂志, 2002, 28(6): 479-484. [Zhang GW, Cheng RR, Niu YY, et al. Efficacy and Safety of antirotinib in the treatment of 89 elderly patients with extensive small cell lung cancer[J]. Zhong Liu Xue Za Zhi, 2002, 28(6): 479-484.] |
| [8] |
王静怡, 董量, 付浩宇, 等. 安罗替尼二三线治疗的广泛期小细胞肺癌患者预后分析[J]. 中国临床医生杂志, 2021, 49(1): 38-41. [Wang JY, Dong L, Fu HY, et al. Prognosis analysis of patients with extensive small cell lung cancer treated with second or third line antirotinib[J]. Zhongguo Lin Chuang Yi Sheng Za Zhi, 2021, 49(1): 38-41.] |
| [9] |
卢美君, 赵燕仪, 康马飞. 影响安罗替尼临床疗效和预后的多因素分析[J]. 现代肿瘤医学, 2022, 30(10): 1831-1835. [Lu MJ, Zhao YY, Kang MF. Analysis of the factors influencing the clinical efficacy and prognosis of androtinib[J]. Xian Dai Zhong Liu Yi Xue, 2022, 30(10): 1831-1835. DOI:10.3969/j.issn.1672-4992.2022.10.023] |
| [10] |
Li H, Liu Y, Liu X, et al. A novel multi-target tyrosine kinase inhibitor anlotinib combined with irinotecan has in-vitro anti-tumor activity against human small-cell lung cancer[J]. Anti-Cancer Drugs, 2020, 31(10): 1057-1064. DOI:10.1097/CAD.0000000000000969 |
| [11] |
中华人民共和国国家卫生健康委员会. 原发性肺癌诊疗指南(2022年版)[J]. 中国合理用药探索, 2022, 19(9): 1-28. [National Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of primary lung cancer (2022 edition)[J]. Zhongguo He Li Yong Yao Tan Suo, 2022, 19(9): 1-28.] |
| [12] |
朱文锋. 证素辨证学[M]. 第1版. 北京: 人民卫生出版社, 2008: 88-90. [Zhu WF. Syndrome element Differentiation[M]. 1st Ed. Beijing: People's Medical Publishing House, 2008: 88-90.]
|
| [13] |
王蓉, 申洹浣, 谢书阳, 等. 不同年龄组小细胞肺癌的临床特征与预后影响因素分析[J]. 中国医院统计, 2022, 29(4): 246-252, 256. [Wang R, Shen HH, Xie SY, et al. Analysis of clinical features and prognostic factors of small cell lung cancer in different age groups[J]. Zhongguo Yi Yuan Tong Ji, 2022, 29(4): 246-252, 256.] |
| [14] |
中华人民共和国卫生部. 中药新药临床研究指导原则(试行)[M]. 北京: 中国医药科技出版社, 2002: 216-224. [Ministry of Health of the People's Republic of China. Guidelines for clinical research of New Chinese Medicine (Trial)[M]. Beijing: China Medical Science and Technology Press, 2002: 216-224.]
|
| [15] |
王晶, 李凯. 小细胞肺癌治疗中的抗血管生成药物研究进展[J]. 中华肿瘤杂志, 2020, 42(8): 624-628. [Wang J, Li K. Research progress of anti-angiogenic drugs in the treatment of small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2020, 42(8): 624-628.] |
| [16] |
Montanino A, Manzo A, Carillio G, et al. Angiogenesis inhibitors in small cell lung cancer[J]. Front Oncol, 2021, 11: 655316. |
| [17] |
Xu Q, Gu J, Lv Y, et al. Angiogenesis for tumor vascular normalization of Endostar on hepatoma 22 tumor-bearing mice is involved in the immune response[J]. Oncol Lett, 2018, 15(3): 3437-3446. |
| [18] |
Rodríguez-Remírez M, del Puerto-Nevado L, Fernández-Aceñero MJ, et al. Targeting galectin-1 by aflibercept strongly enhances its antitumor effect in neuroendocrine carcinomas[J]. Neuroendocrinology, 2021, 111(1-2): 146-157. |
| [19] |
Gao X, Peng L, Zhang L, et al. Real-world efficacy and safety of anlotinib as third- or further-line treatment in refractory small cell lung cancer[J]. J Cancer Res Clin Oncol, 2022, 148(10): 2661-2671. DOI:10.1007/s00432-021-03848-4 |
| [20] |
肖琳, 王志武, 宣立功, 等. 晚期非小细胞肺癌安罗替尼治疗后中医证型与近期疗效相关性因素的分析[J]. 辽宁中医杂志, 2022, 49(9): 74-78. [Xiao L, Wang ZW, Xuan LG, et al. Analysis of correlation factors between TCM syndrome type and short-term curative effect after treatment of advanced non-small cell lung cancer with antirotinib[J]. Liaoning Zhong Yi Za Zhi, 2022, 49(9): 74-78.] |
| [21] |
周卫东, 袁庆, 艾瑛, 等. 不同中医证型肺鳞癌患者的化疗疗效及其中医干预疗效[J]. 实用医学杂志, 2020, 36(5): 677-681. [Zhou WD, Yuan Q, Ai Y, et al. Therapeutic effect of chemotherapy and TCM intervention in patients with lung squamous cell carcinoma with different TCM syndroms[J]. Shi Yong Yi Xue Za Zhi, 2020, 36(5): 677-681.] |
| [22] |
芦希艳, 姚家久, 赵宁侠. 中医辨证辅助化疗治疗非小细胞肺癌的临床疗效及对患者免疫功能和预后的影响[J]. 癌症进展, 2002, 20(8): 797-799, 804. [Lu XY, Yao JJ, Zhao NX. Clinical efficacy of TCM syndrome differentiation and adjuvant chemotherapy in the treatment of non-small cell lung cancer[J]. Ai Zheng Jin Zhan, 2002, 20(8): 797-799, 804.] |
| [23] |
Chen T, Tang M, Xu X, et al. Inflammation-based prognostic scoring system for predicting the prognosis of advanced small cell lung cancer patients receiving anlotinib monotherapy[J]. J Clin Lab Anal, 2022, 36(12): e24772. |
| [24] |
Wu D, Nie J, Hu W, et al. A phaseⅡ study of anlotinib in 45 patients with relapsed small cell lung cancer[J]. Int J Cancer, 2020, 147(12): 3453-3460. |
 2023, Vol. 50
2023, Vol. 50