文章信息
- Testin基因对鼻咽癌5-8F细胞裸鼠移植瘤放疗敏感性的影响
- Effect of Testin Gene on Radiosensitivity of Nasopharyngeal Cancer 5-8F Cells
- 肿瘤防治研究, 2023, 50(8): 767-771
- Cancer Research on Prevention and Treatment, 2023, 50(8): 767-771
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1341
- 收稿日期: 2022-11-14
- 修回日期: 2023-05-30
2. 431400 武汉,武汉市新洲区人民医院耳鼻咽喉科
2. Department of Otolaryngology, Xinzhou District People's Hospital, Wuhan 431400, China
鼻咽癌(nasopharyngeal carcinoma, NPC)细胞放疗敏感性差是影响患者复发和生存率下降的重要因素[1]。大量文献报道NPC的放疗敏感性与肿瘤细胞内的基因表达有关,研究显示,MIIP、SALL4、B7-H3、miRNA-381等基因可用于增加肿瘤的放疗效果[2-5]。Testin基因(TES)为目前研究发现的一重要抑癌基因,TES基因在鼻咽癌的发生和发展中产生何种作用、是否能调控鼻咽癌细胞的放疗敏感性等问题,一直备受关注。本课题组前期研究发现,过表达TES基因可明显抑制鼻咽癌5-8F细胞的增殖和迁移能力,并增加肿瘤细胞的放射敏感性[6-7]。因此,本次研究主要利用转染了TES的细胞,建立裸鼠移植瘤模型,从体外动物水平观察TES对鼻咽癌5-8F细胞移植瘤放疗敏感性的影响,探索TES在鼻咽癌治疗中的作用机制。
1 材料与方法 1.1 主要材料鼻咽癌5-8F细胞系、TES重组表达质粒均由武汉大学中南医院实验室提供;胎牛血清购自美国Gibco公司;直线加速器购自德国SIEMENS股份公司;BALB/c裸小鼠,SPF级,鼠龄5~8周,体质量(18~20)g,在武汉大学实验动物中心无特殊病原菌条件下分笼饲养。
1.2 方法 1.2.1 细胞培养与转染选择生长状态良好的鼻咽癌5-8F细胞用于实验,将实验细胞分为两组:未转染组:未转染的5-8F细胞组;TES组:转染了高表达TES的5-8F细胞组。按照常规程序进行转染,构建高表达TES的5-8F细胞系(5-8F-pEGFP-N1-TES),并应用Western blot实验进行评估和鉴定。
1.2.2 细胞进行射线照射将未转染组和TES组进行射线照射,照射设备为Varian2100C直线加速器,吸收剂量率400 cGy/min,放射野为10 cm×10 cm,距离100 cm,辐射剂量分别为2、4、6、8 Gy。
1.2.3 细胞克隆形成实验常规培养下,分别将未转染组和TES组细胞暴露于不同剂量下(2、4、6、8 Gy)进行照射,照射完成后进行细胞培养10 d,去上清液、固定、洗涤晾干,计算克隆数。采用GraphPrism6.0软件,Linear-quadratic模型计算拟合剂量生存曲线。
1.2.4 裸鼠移植瘤模型建立取对数生长期的未转染组和TES组细胞,经胰蛋白酶消化后,制备单细胞悬液,用1×PBS洗涤细胞3次,计数并用PBS重悬、调整细胞密度为4×107/ml。用1 ml注射器抽取两组瘤细胞悬液分别接种于裸鼠一侧背部皮下,每个接种部位0.1 ml,含活细胞数4×106个。接种一周左右开始成瘤。
1.2.5 放疗条件及实验分组取注射瘤细胞悬液的裸鼠用直线加速器进行局部照射肿瘤,每次照射剂量为6 Gy,每三天照射一次,总剂量为18 Gy。根据是否经历局部照射,将成瘤裸鼠分为四组:未转染组:注射5-8F细胞液;TES组:注射高表达TES的5-8F细胞液;照射组:注射5-8F细胞液的成瘤小鼠经过局部照射;TES照射组:注射高表达TES的5-8F细胞的成瘤小鼠经过局部照射。
1.2.6 移植瘤生长情况接种一周左右开始成瘤实验,每隔3天测量移植瘤裸鼠体质量,游标卡尺测量肿瘤最长直径(a)及最短直径(b),按照公式V=a×b2/2计算移植瘤体积并绘制生长曲线。接种一月后,处死小鼠,获取肿瘤组织,称重后计算抑瘤率=(对照组瘤质量-处理组瘤质量)/对照组瘤质量。
1.2.7 移植瘤中细胞凋亡情况胰酶消化肿瘤组织制备成单细胞悬液,高速离心机2000 r/min,离心5 min;PBS缓冲液洗涤两遍,高速离心机2000 r/min,离心5 min。去上清液;加入100 μl 1×Binding Buffer缓冲液,混匀,再加入5 μl Annexin V-异硫氰酸荧光素(FITC)和5 μl碘化丙啶(PI),室温条件下孵育15 min,最后加入400 μl 1×Binding Buffer缓冲液,1 h内行流式细胞仪检测细胞凋亡情况。
1.3 统计学方法实验结果采用SPSS22.0统计软件分析和Gpraph Pad Prism 5进行作图、分析。本研究采用完全随机设计,所有计量数据均以x±s表示。两组间数据采取t检验,多组间数据比较采取单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 Western blot实验验证转染的5-8F细胞中TES过表达TES组中TES的表达较未转染组和空载体组明显增强,见图 1。表明过表达TES转染模型成功建立。

|
| 图 1 过表达TES蛋白的表达情况 Figure 1 Overexpression of TES protein expression |
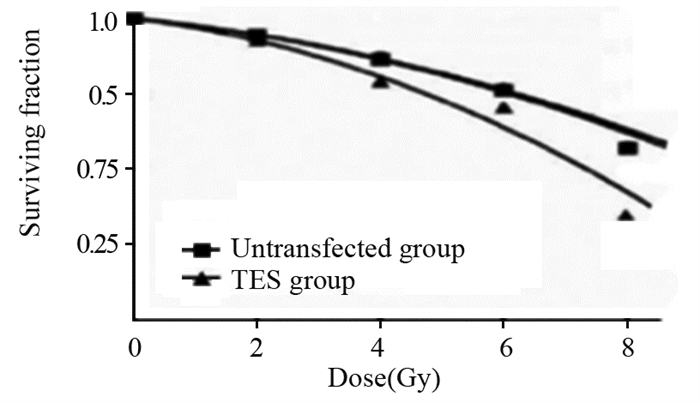
放疗前,两组间克隆形成率差异无统计学意义(F=0.600, P > 0.05),照射后,两组间克隆形成率差异具有统计学意义(均P < 0.01),见表 1、图 2。表明TES可增加鼻咽癌5-8F细胞的放疗敏感性。
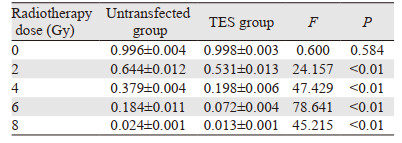
|
|
| 图 2 未转染组和TES组照射前后细胞存活曲线 Figure 2 Cell survival curves before and after irradiation in the nontransfected and TES groups |
未转染组小鼠瘤体生长速度最快;与未转染组比较,TES组、照射组、TES照射组的小鼠瘤体生长速度减慢,其中TES照射组瘤体生长速度最慢;与TES组、照射组相比较,TES照射组小鼠瘤体生长速度显著降低,且差异具有统计学意义(P < 0.01),见图 3。
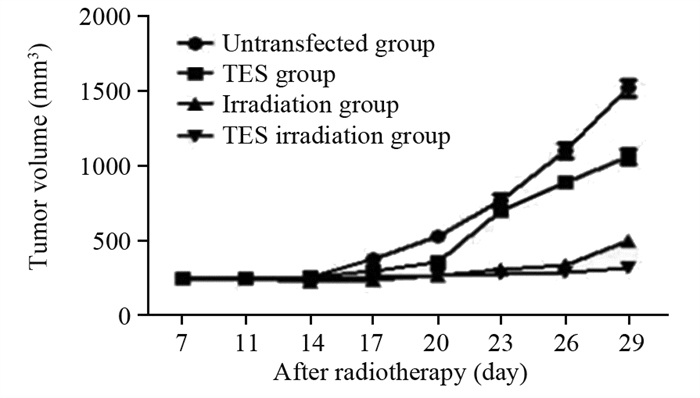
|
| Comparing the groups on days 7, 11, 14, 17, 20, 23, 26, and 29, the corresponding F-values were 0.204, 2.037*, 16.48*, 26.74*, 63.04*, 309.7*, 315.82*, and 356.02*; *: P < 0.05. 图 3 未转染组、TES组、照射组及TES照射组照射后细胞增殖情况 Figure 3 Cell proliferation after irradiation in the untransfected, TES, irradiation, and TES irradiation groups |
与未转染组比较,TES组、照射组、TES照射组的瘤体质量依次降低,抑瘤率依次升高,组间多重比较差异均有统计学意义(P < 0.01),见表 2。
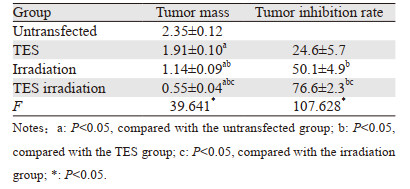
|
与未转染组比较,TES组、照射组和TES照射组的细胞凋亡率依次增加。TES照射组细胞凋亡率最高,组间多重比较差异均有统计学意义(P < 0.05),见图 4。

|
| A: Untransfected group; B: TES group; C: irradiation group; D: TES irradiation group. 图 4 流式细胞仪检测各组细胞凋亡情况 Figure 4 Flow cytometry detection of cell apoptosis in each group |
鼻咽癌复发是影响患者生存率的重要因素[8]。在这些复发的患者中,其主要原因是由于机体产生了放射抵抗,从而导致远处转移[9]。为解决这个问题,越来越多的研究者通过植入基因来改变肿瘤细胞的内在活性,诱导细胞凋亡,从而达到增加放射敏感性的效果[10]。
Testin基因(TES)为目前研究发现的一个重要的抑癌基因,它位于染色体易断裂区域7q31.1/2,在大部分恶性肿瘤中显示为杂合型缺失[11]。该基因的表达缺失与癌症密切相关,研究发现,Testin基因在多种恶性肿瘤如胃癌、肺癌、淋巴瘤、脑星形细胞瘤、结直肠癌等中表达降低,并且与肿瘤患者的不良预后密切相关,而高表达TES则明显抑制恶性肿瘤细胞的增殖、促进其凋亡[12-17]。这与本课题组前期研究结果一致,TES在鼻咽癌组织中表达下降[18],并且可明显抑制鼻咽癌5-8F细胞的增殖、促进其凋亡[5-6]。有研究发现,高表达TES可能通过作用于一种细胞骨架调节因子Mena,从而抑制胃癌细胞的增殖、迁移、侵袭和阻滞肿瘤的细胞周期,并且在体外裸鼠实验中抑制胃癌细胞的成瘤性[19]。Dong等[20]研究发现TES通过诱导肿瘤细胞凋亡,减少细胞增殖,将肿瘤细胞停滞在细胞G1期,从而增加子宫内膜癌细胞的凋亡、抑制肿瘤的转移及浸润。同样,Wang等[21]通过流式细胞术揭示了过表达TES可诱导小细胞肺癌细胞凋亡。此外,他们还发现过表达TES对裸鼠体内小细胞肺癌移植瘤形成和生长的抑制作用;相反,TES蛋白表达的减少会增加细胞运动性,减少细胞与细胞之间的接触,因此,TES被认为可能是恶性肿瘤转移的生物标志物[22]。
迄今为止,TES在头颈部肿瘤的研究报道较少,尤其在鼻咽癌细胞放疗敏感性方面的作用尚未报道。我们通过细胞克隆形成实验,分析过表达TES的鼻咽癌5-8F细胞株的放疗敏感性,研究结果显示,TES细胞经照射后,细胞的存活率明显降低(P < 0.01),说明TES可提高鼻咽癌5-8F细胞的放疗敏感性。为了深入研究TES影响鼻咽癌5-8F细胞放疗敏感性的发生机制,我们建立鼻咽癌5-8F细胞裸鼠移植瘤模型,结果显示,与未转染组比较,TES组、照射组和TES照射组瘤体生长速度依次减慢(P < 0.05),瘤体质量依次降低,细胞凋亡率依次增加。其中,TES照射组瘤体生长速度最慢、质量下降最大、细胞凋亡率最高。这些结果均提示,TES基因可有效提高鼻咽癌5-8F细胞的放疗敏感性,也提示TES可能是调控鼻咽癌放疗敏感性相关的重要因子。
综上所述,高表达Testin基因(TES)可提高鼻咽癌的放疗敏感性,下一步我们将对TES的作用分子机制进行深入研究,希望能为临床应用及鼻咽癌的靶向治疗带来新的思路。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
钟准:设计研究方案,实验操作,收集与统计数据,撰写论文
费永光:收集并整理数据,协助实验操作及数据分析,文稿修改
| [1] |
Kamran SC, Riaz N, Lee N. Nasopharyngeal Carcinoma[J]. Surg Oncol Clin N Am, 2015, 24(3): 547-561. DOI:10.1016/j.soc.2015.03.008 |
| [2] |
Zhou HP, Qian LX, Zhang N, et al. MⅡP gene expression is associated with radiosensitivity in human nasopharyngeal carcinoma cells[J]. Oncol Lett, 2018, 15(6): 9471-9479. |
| [3] |
Nie X, Guo E, Wu C, et al. SALL4 induces radioresistance in nasopharyngeal carcinoma via the ATM/Chk2/p53 pathway[J]. Cancer Med, 2019, 8(4): 1779-1792. |
| [4] |
Chen H, Duan X, Deng X, et al. EBV-upregulated B7-H3 inhibits NK cell-mediated antitumor function and contributes to nasopharyngeal carcinoma progression[J]. Cancer Immunol Res, 2023, 11(6): 830-846. DOI:10.1158/2326-6066.CIR-22-0374 |
| [5] |
周苏娜, 张明鑫, 张琰君, 等. miRNA-381表达及其与鼻咽癌放疗敏感性的关系[J]. 现代肿瘤医学, 2017, 25(19): 3042-3046. [Zhou SN, Zhang MX, Zhang YJ, et al. Expression of miRNA-381 and its correlation with radiosensitivity in nasopharyngeal carcinoma[J]. Xian Dai Zhong Liu Yi Xue, 2017, 25(19): 3042-3046. DOI:10.3969/j.issn.1672-4992.2017.19.004] |
| [6] |
Zhong Z, Zhang F, Yin SC. Effects of Testin gene expression on proliferation and migration of the 5-8F nasopharyngeal carcinoma cell line[J]. Asian Pac J Cancer Prev, 2015, 16(6): 2555-2559. DOI:10.7314/APJCP.2015.16.6.2555 |
| [7] |
钟准, 尹述成. Testin 基因对高转移鼻咽鳞癌细胞的影响[J]. 临床耳鼻咽喉头颈外科杂志, 2017, 31(21): 1676-1680. [Zhong Z, Yin SC. Role of Testin in nasopharyngeal squamous cancer with high ability of metastasis[J]. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2017, 31(21): 1676-1680.] |
| [8] |
吴巧媛. 复发型鼻咽癌的治疗进展[J]. 重庆医学, 2022, 51(9): 1585-1589. [Wu QY. Progress in treatment of recurrent nasopharyngeal carcinoma[J]. Chongqing Yi Xue, 2022, 51(9): 1585-1589. DOI:10.3969/j.issn.1671-8348.2022.09.029] |
| [9] |
中国医师协会放射肿瘤治疗医师分会, 中华医学会放射肿瘤治疗学分会. 中国鼻咽癌放射治疗指南(2022版)[J]. 中华肿瘤防治杂志, 2022, 29(9): 611-622. [Radiation oncology therapy physicians branch, Chinese medical association, Branch of radiation oncology, Chinese medical association. Chinese Guidelines for Radiotherapy of Nasopharyngeal Cancer (2022 Edition)[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2022, 29(9): 611-622.] |
| [10] |
王铭浩, 肖大江. 放射增敏在局部晚期鼻咽癌综合治疗中的研究现状[J]. 江苏医药, 2022, 48(5): 527-531. [Wang MH, Xiao DJ. The current research status of radiation sensitization in the comprehensive treatment of locally advanced nasopharyngeal carcinoma[J]. Jiangsu Yi Yao, 2022, 48(5): 527-531.] |
| [11] |
Popiel A, Kobierzycki C, Dzięgiel P. The Role of Testin in Human Cancers[J]. Pathol Oncol Res, 2019, 25(4): 1279-1284. DOI:10.1007/s12253-018-0488-3 |
| [12] |
Kokate SB, Dixit P, Poirah I, et al. Testin and filamin-C downregulation by acetylated Siah2 increases invasiveness of Helicobacter pylori-infected gastric cancer cells[J]. Int J Biochem Cell Biol, 2018, 103: 14-24. DOI:10.1016/j.biocel.2018.07.012 |
| [13] |
Weeks RJ, Ludgate JL, Le Mée G, et al. Silencing of Testin expression is a frequent event in spontaneous lymphomas from Trp53-mutant mice[J]. Sci Rep, 2020, 10(1): 16255. DOI:10.1038/s41598-020-73229-3 |
| [14] |
Wang DD, Chen YB, Zhao JJ, et al. TES functions as a Mena-dependent tumor suppressor in gastric cancer carcinogenesis and metastasis[J]. Cancer Commun (Lond), 2019, 39(1): 3. DOI:10.1186/s40880-019-0347-y |
| [15] |
Wang M, Wang Q, Peng WJ, et al. Testin is a tumor suppressor in non-small cell lung cancer[J]. Oncol Rep, 2017, 37(2): 1027-1035. DOI:10.3892/or.2016.5316 |
| [16] |
Steponaitis G, Kazlauskas A, Skiriute D, et al. Testin (TES) as a candidate tumour suppressor and prognostic marker in human astrocytoma[J]. Oncol Lett, 2016, 12(5): 3305-3311. DOI:10.3892/ol.2016.5077 |
| [17] |
Zhu Y, Qiao Q. The relationship between TESTIN expression and the prognosis of colorectal cancer[J]. Pathol Res Pract, 2022, 232: 153744. DOI:10.1016/j.prp.2021.153744 |
| [18] |
张飞, 尹述成. Testin基因在鼻咽癌组织中的表达及其临床意义[J]. 临床耳鼻咽喉头颈外科杂志, 2016, 30(12): 982-985. [Zhang F, Yin SC. Expression and clinical significance of Testin in nasopharyngeal carcinoma[J]. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2016, 30(12): 982-985.] |
| [19] |
王丹丹, 陈义兵, 赵靖靖, 等. TES通过Mena依赖的方式抑制胃癌生长和转移[J]. 癌症, 2020, 39(7): 321-334. [Wang DD, Chen YB, Zhao JJ, et al. TES inhibits the growth and metastasis of gastric cancer through a Mena dependent manner[J]. Ai Zheng, 2020, 39(7): 321-334.] |
| [20] |
Dong R, Pu H, Wang Y, et al. TESTIN was commonly hypermethylated and involved in the epithelial-mesenchymal transition of endometrial cancer[J]. APMIS, 2015, 123(5): 394-400. |
| [21] |
Wang M, Wang Q, Peng WJ, et al. Testin is a tumor suppressor in non-small cell lung cancer[J]. Oncol Rep, 2017, 37(2): 1027-1035. |
| [22] |
Popiel A, Kobierzycki C, Dzięgiel P. The Role of Testin in Human Cancers[J]. Pathol Oncol Res, 2019, 25(4): 1279-1284. |
 2023, Vol. 50
2023, Vol. 50


