文章信息
- 胃上部癌No.12a组淋巴结转移规律及生存分析
- No.12a Lymph Node Metastasis and Survival Analysis of Upper Gastric Cancer
- 肿瘤防治研究, 2023, 50(9): 887-894
- Cancer Research on Prevention and Treatment, 2023, 50(9): 887-894
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1333
- 收稿日期: 2022-11-14
- 修回日期: 2023-04-12
2. 450003 郑州, 河南省人民医院胃肠外科
2. Department of Gastrointestinal Surgery, Henan Provincial People's Hospital, Zhengzhou 450003, China
胃癌(gastric cancer, GC)是严重威胁人类健康的恶性肿瘤。2018年统计数据显示,全球胃癌新发病率位于恶性肿瘤第五位,死亡率位于恶性肿瘤第三位[1]。近年来,在胃癌总体发病率下降的背景下,胃上部癌发病率呈逐年上升趋势,特别是在亚洲国家[2]。2018年第5版《胃癌治疗指南》中将胃上1/3的癌定义为胃上部癌[3],范围包括贲门、胃底及部分胃体部,此部位的特殊解剖及淋巴引流范围复杂,使外科医生对胃上部癌淋巴结清扫的分歧更大。淋巴结转移是胃上部癌最常见的转移类型,目前,胃上部癌主流的手术方式是全胃切除术+D2淋巴结清扫[4-5],标准的D2淋巴结清扫范围包括No.1、No.2、No.3、No.4、No.5、No.6、No.7、No.8a、No.9、No.10、No.11和No.12a[6]。为了避免不必要的淋巴结清扫,随着研究证据的不断积累,D2淋巴结清扫的范围在不断修改,例如,JCOG0110试验后日本胃癌治疗指南(第5版)便建议全胃切除术+D2淋巴结清扫术中不应包括对No.10组淋巴结的清扫[3]。No.12a为肝十二指肠韧带内沿肝动脉的淋巴结,日本第5版胃癌治疗规约[7]和2021版中国临床肿瘤学会指南(CSCO)[8]认为,No.12a组淋巴结转移是区域性淋巴结转移,D2胃癌根治术中应进行清扫。但2项大型随机试验的结果未能证明No.12a组淋巴结清扫有明显的生存益处[9-10]。第七届美国癌症联合委员会(AJCC)[11]将No.12a组淋巴结转移视为远处转移,因与其他胃外淋巴结转移患者相比,No.12a组淋巴结转移率低。然而,第八届AJCC又重新将其归类为区域淋巴结转移[12]。另外,据报道No.12a的转移率为1.7%~18.2%[13-16],且其转移主要与胃窦部的肿瘤高度相关[16],那么对于肿瘤位置相对较远的胃上部癌来说No.12a组淋巴结的转移规律又是怎样的?对该部位的No.12a组淋巴结清扫是否能够带来生存获益?所以,本研究旨在评估胃上部癌No.12a组淋巴结的转移模式并探索淋巴结清扫的适应证,现报道如下。
1 资料与方法 1.1 患者选择回顾性筛选2013年7月—2017年7月在河南省人民医院接受根治性手术的胃上部癌患者。入选标准:(1)行腹腔镜辅助根治性全胃切除+标准D2/D2+淋巴结清扫术,达到R0切除;(2)手术组织病理证实为胃腺癌;(3)分组拣取各组淋巴结并送组织病理检查;(4)临床病理资料完整;(5)患者清扫No.12a组淋巴结。排除标准:(1)残胃癌患者;(2)接受新辅助化疗者;(3)腹膜转移或其他远处转移者;(4)未行根治性切除术者;(5)切除淋巴结 < 16枚者;(6)行近端胃切除的患者;(7)未分组捡取淋巴结者。数据提取过程见图 1,最终纳入377例胃上部癌患者。
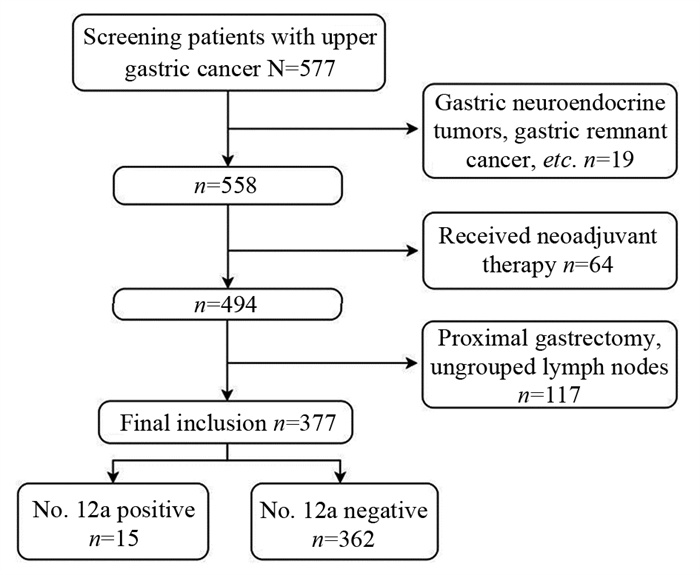
|
| 图 1 患者筛选流程图 Figure 1 Flowchart of patient screening |
所有患者外科手术切除范围与淋巴结清扫范围基于2021年版中国的CSCO胃癌治疗指南要求完成。腹腔镜辅助胃癌根治术依据2017年版《中国腹腔镜胃癌根治手术质量控制专家共识》[17]所推荐的适应证进行。No.12a组淋巴结清扫方式:沿胃十二指肠动脉及肝总动脉(common hepatic artery, CHA)充分显露胃右动脉(right gastric artery, RGA)及肝固有动脉(proper hepatic artery, PHA),于CHA、胃十二指肠动脉(gastroduodenal artery, GDA)及胰腺上缘夹角处打开门静脉(portal vein, PV)前方筋膜,显露门静脉,将肝总动脉向腹前壁挑起。沿门静脉前方分离,清扫门静脉与肝固有动脉间淋巴结。沿门静脉内缘向上分离至肝门部。将肝总动脉向右下牵拉,清扫肝固有动脉内侧及门静脉内侧淋巴脂肪组织。打开肝十二指肠韧带被膜,继续脉络化肝固有动脉前方及外侧,清扫第12a组淋巴结。标本离体30 min内分组拣取淋巴结,见图 2。
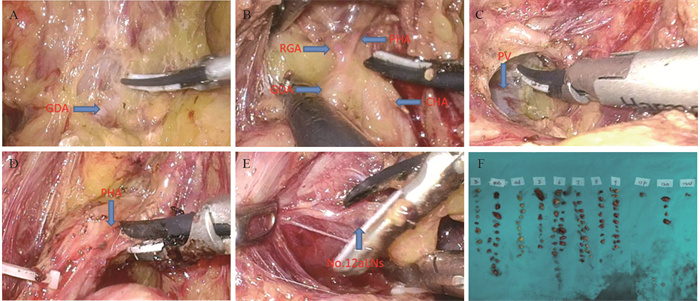
|
| GDA: the gastroduodenal artery; RGA: the right gastric artery; CHA: the common hepatic artery; PHA: the proper hepatic artery; PV: the portal vein. A: severed the right gastroomentum artery, free the gastroduodenal artery; B: bare the common hepatic artery, the right gastric artery and the proper hepatic artery; C: expose the portal vein, separate along the front of the portal vein, and clean the lymph nodes between the portal vein and the liver intrinsic artery; D: lift down the intrinsic artery of the liver to sweep away the surrounding adipose tissue; E: open the hepatoduodenal ligament and clean the 12a group lymph nodes; F: lymph nodes were picked in groups within 30 minutes after the specimen is left. 图 2 No.12a组淋巴结清扫步骤 Figure 2 Dissection of No.12a lymph node |
术后根据病理分期(Ⅱ~Ⅲ期)行辅助化疗,化疗方案为SOX(奥沙利铂+替吉奥):第1天,奥沙利铂注射液130 mg/m2静脉滴注;第1~14天服用替吉奥,剂量需根据患者体表面积确定,体表面积 > 1.50 m2者60毫克/次,体表面积1.25~1.50 m2者50毫克/次,体表面积 < 1.25 m2者40毫克/次,2次/天,早晚餐后服用;第15~21天暂停,即每21天为1个周期,最多进行8个周期。静脉滴注奥沙利铂前,给予多巴胺D2受体抑制剂、5-HT3受体拮抗剂、糖皮质激素等药物预防或减轻奥沙利铂静滴期间的不良反应。
1.3 数据搜集收集患者临床病理资料,包括性别、年龄、体质量指数(body mass index, BMI)、肿瘤大小、分化程度、Borrmann分型、pT分期、pN分期、TNM分期、神经脉管侵犯等。TNM分期参照AJCC第8版分期系统[18]。根据第5版日本胃癌分类规约[19]设定肿瘤的最大直径作为肿瘤长度,根据ROC最大曲线下面积,设定肿瘤直径以5.5 cm为界,见图 3。
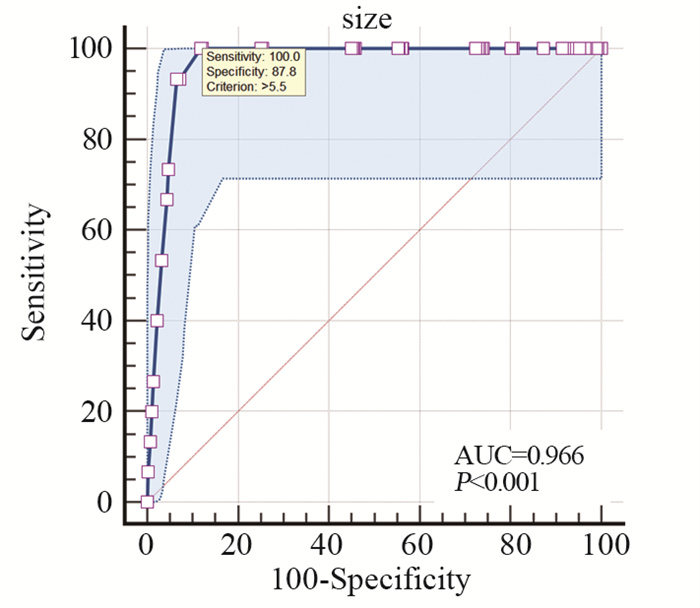
|
| 图 3 肿瘤直径ROC曲线 Figure 3 ROC curve of tumor diameter |
复发和生存状态最后更新于2022年1月。随访观察通过门诊或电话进行。具体时间:术后第1年每3个月门诊复查或随访1次,术后第2年每6个月1次,之后每年随访1次。观察终点是总体生存期(OS)。OS定义为从治疗到患者死亡或最后一次随访时间。患者数据获河南省人民医院伦理委员会批准,并按照1964年赫尔辛基宣言及其后续修正案中提出的伦理声明进行研究。
1.5 统计学方法应用SPSS21.0、R9.1软件进行统计分析,计数资料比较采用χ2检验或Fisher精确检验;运用Kaplan-meier绘制生存曲线,Cox回归检验各因素对患者预后的影响。此外,在R软件中采用“Hmisc”包分析比较其他区域淋巴结转移与No.12a站淋巴结转移的相关性,并用“corrplot”包进行可视化处理。检验水准α=0.05。
2 结果 2.1 患者临床病理特征共筛选了577例患者,最终有377例患者参加了研究。患者手术时的中位年龄为63(24~80)岁。其中,男257例(68.2%),女120例(32.8%)。TNMⅠ期患者44例(11.7%),Ⅱ期和Ⅲ期患者分别为107例(28.4%)、226例(59.9%)。No.12a组淋巴结阳性患者15例(4.0%),阴性患者362例(96.0%)。No.12a组淋巴结阳性患者均伴有淋巴结广泛转移(N3),TNM分期均为进展期(Ⅱ~Ⅲ期)。
2.2 胃上部癌No.12a组淋巴结转移与临床病理特征之间的关系对于胃上部癌,肿瘤位置(小弯侧)、肿瘤直径(≥5.5 cm)、分化程度、pT分期、pN分期、pTNM分期与No.12a组淋巴结的转移显著相关(P < 0.05),而性别、年龄、BMI、Borrmann分型、神经血管侵犯组内比较,差异无统计学意义(P > 0.05),见表 1。
采用Spearman相关检验判断区域淋巴结与No.12a组淋巴结转移的关系。通过绘制热点图,直观判断相互之间存在单调关系的区域淋巴结。结果显示,No.5淋巴结(r=0. 65, P < 0.001)、No.8a淋巴结(r=0.60, P < 0.001)与No.12a组淋巴结转移之间存在相关关系,见图 4。
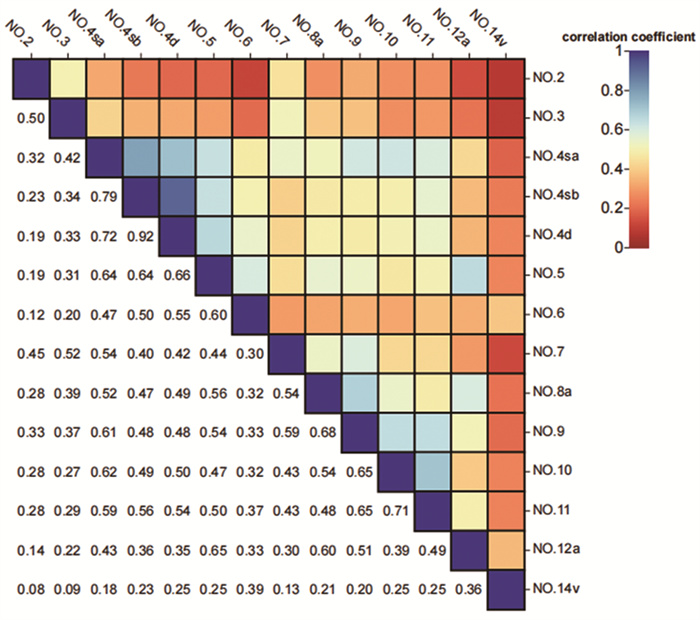
|
| 图 4 区域淋巴结与No.12a组淋巴结转移相关性 Figure 4 Correlation between regional lymph nodes and No.12a lymph node metastasis |
纳入的患者均进行了随访(电话失访者以门诊最后一次复查时间为随访时间),中位随访时间为43(5~98)个月。截至随访终点,伴有No.12a组淋巴结转移的患者,其中1例情况不明(仅门诊随访),余均死亡。生存分析显示,No.12a淋巴结阳性组5年总生存率为0,显著差于阴性组的45.9%(P < 0.01),见图 5。

|
| 图 5 胃上部癌No.12a组淋巴结阳性和阴性患者的OS曲线 Figure 5 OS curves of positive and negative No.12a lymph nodes of patients with upper gastric cancer |
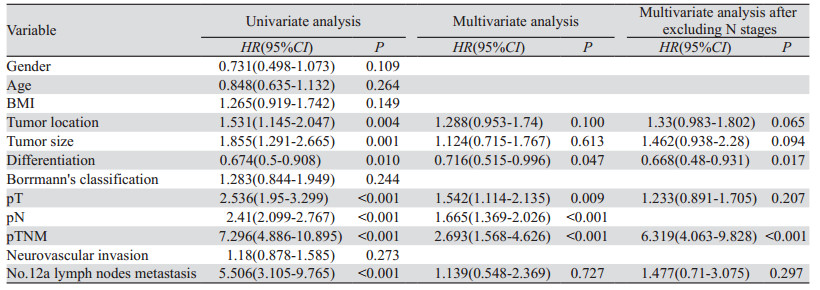
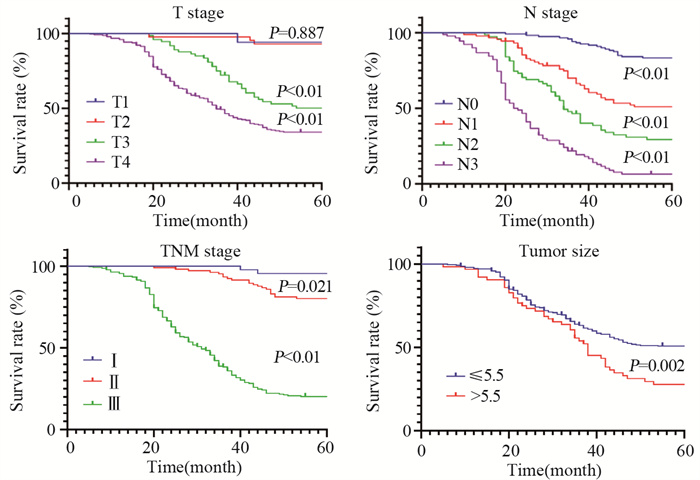
单变量Cox分析显示OS与肿瘤位置、肿瘤大小、分化程度、pT分期、pN分期、pTNM分期、No.12a组淋巴结转移相关,见表 2、图 2。进一步多变量Cox回归分析。结果显示分化程度(HR: 0.716, 95%CI: 0.515~0.996, P=0.047)、pT分期(HR: 1.542,95%CI: 1.114~2.135, P=0.009)、pN分期(HR: 1.665, 95%CI: 1.369~2.026, P < 0.001)、pTNM分期(HR: 2.693, 95%CI: 1.568~4.626, P < 0.001)是影响OS的独立因素。为排除变量间共线性,剔除N分期后Cox回归结果示:分化程度(HR: 0.668, 95%CI: 0.48~0.931, P=0.017)、pTNM分期(HR: 6.319, 95%CI: 4.063~9.828, P < 0.001)是影响胃上部癌预后生存的独立危险因素,见表 2、图 6。
|
|
| 图 6 影响胃上部癌患者OS独立危险因素的生存曲线 Figure 6 Survival curve of independent risk factors affecting prognosis and survival in patients with upper gastric cancer |
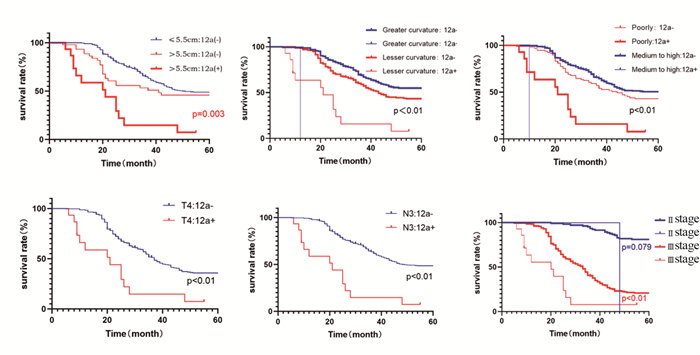
将影响No.12a组淋巴结转移的因素行亚组分析,当肿瘤直径 > 5.5 cm、肿瘤位置为小弯侧、分化程度为低分化、T分期为T4、N分期为N3、TNM分期为Ⅲ期时,No.12a组淋巴结转移者的预后显著较差(P < 0.05),见图 7。
|
| A: tumor size subgroup; B: tumor location subgroup; C: differentiation degree subgroup; D: T4 stage subgroup; E: N3 stage subgroup; F: Ⅱ-Ⅲ stage subgroup. 图 7 不同亚组预后生存分析 Figure 7 Prognosis and survival analysis of different subgroups |
根据日本第5版胃癌诊疗指南[7],对于全胃切除术,标准D2淋巴结切除术包括No.12a组淋巴结的清扫。然而,常规清扫No.12a组淋巴结的益处仍有争议。2022版NCCN胃癌治疗指南中指出[5],对远处淋巴结的广泛清扫仅仅有助于疾病的准确分期,对生存期的延长尚无定论[20-22]。对于No.12a组淋巴结转移率偏低的胃上部癌而言,常规清扫No.12a组淋巴结能否得到生存获益仍有待探讨。
近年来,随着腹腔镜技术的开展,腹腔镜辅助胃癌根治术相比于传统开腹手术安全性更高、淋巴结清扫方面无劣性[23]。所以本研究回顾性分析了377例接受腹腔镜下全胃切除术的胃上部癌患者的个体临床数据,分析No.12a组淋巴结在该部位的转移规律并评估No.12a组淋巴结转移对患者生存结果的影响。
通常根据淋巴结转移率决定是否行淋巴结清扫:转移率 > 10%则强烈推荐清扫,转移率介于5%~10%则弱推荐清扫,转移率 < 5%则不推荐清扫[24]。本研究中,胃上部癌No.12a组淋巴结转移率仅为4.0%,属于不推荐清扫组。Zheng等一项研究结果表明,26例No.12a组淋巴结切除的胃上部癌患者,没有1例阳性病例[25]。Suh等[26]研究表现了类似的结果,20例行No.12a组淋巴结切除术的胃上部癌患者,0例出现了No.12a组淋巴结阳性。Hosoda等[27]研究中也没有1例出现No.12a组淋巴结转移。Sato等[28]研究表明51例No.12a组淋巴结切除的患者中仅有1例为阳性。以上研究均表明胃上部癌患者No.12a组淋巴结转移率较低,原因可能是位于胃上部的肿瘤距离No.12a组淋巴结较远,因此,主要淋巴回流并不优先汇入幽门上部淋巴结再汇入No.12a组淋巴结。本研究通过数据分析发现,胃上部癌No.12a组淋巴结转移的高危因素:肿瘤位置为小弯侧、肿瘤直径≥5.5 cm、低分化、浸润深度较深(T4)、淋巴结广泛转移(N3)、TNM分期较晚(Ⅱ~Ⅲ)。胃小弯侧No.12a组淋巴结转移率(6.5%, 14/213)显著高于胃大弯侧(0.6%, 1/164),原因可能是,小弯侧淋巴结主要来源于胃左淋巴结区,该区域淋巴结主要沿胃左动脉干淋巴结流向胃左动脉根部淋巴结;大弯侧淋巴结则主要来源于胃网膜左淋巴结区,该区域主要经脾动脉干淋巴结流向脾动脉根部淋巴结,而沿肝动脉分布的No.12a组淋巴结最终引流汇入与胃左动脉毗邻的肝动脉根部淋巴结,这也是No.5、No.8a组淋巴结与No.12a组淋巴结转移显著相关的根本原因,但是本研究仅仅15例No.12a组淋巴结转移阳性患者,这限制了No.5、No.8a组淋巴结作为No.12a组淋巴结转移的预测因子[2]。另一方面,肿瘤直径也是影响No.12a组淋巴结转移的重要因素,这与其他研究结果相似[29-30]。同时,我们发现所有No.12a组淋巴结转移患者都处于晚期(T4, N3, Ⅱ~Ⅲ期)阶段,这也解释了为什么No.12a组淋巴结阳性患者通常预后不良[16]。
本研究通过Cox回归分析发现,No.12a组淋巴结转移好像并不是胃上部癌总体生存的独立影响因素,但No.12a组淋巴结转移阳性患者的预后比No.12a组淋巴结转移阴性的患者更差(P < 0.001),这与其他研究结果类似[15, 31]。可能是因为伴有No.12a组淋巴结转移的患者均为进展期,较晚的病理分期可能是No.12a组淋巴结转移的患者预后较差的原因。因此,我们对影响No.12a组淋巴结转移的因素进行了亚组分析,结果显示,当肿瘤直径 > 5.5 cm、肿瘤位置为小弯侧、分化程度为低分化、T分期为T4、N分期为N3、TNM分期为Ⅲ期时,No.12a组淋巴结的转移者预后显著较差,所以对于该部分患者,术中应该积极清扫No.12a组淋巴结,以利生存获益。
本研究存在以下局限性:(1)小样本量限制了其他区域淋巴结阳性的患者数量,因此,应进行大样本的研究,以期将相关区域淋巴结阳性作为No.12a组淋巴结转移的预测因子;(2)No.12a组淋巴结转移的患者数量非常少,导致Cox回归结果可能不准确;(3)考虑新辅助化疗对No.12a组淋巴结转移的影响,本研究没有纳入行新辅助化疗的患者,这可能增加了选择性偏倚;(4)本研究是单中心研究,可能导致较大的异质性,以后尚需要多中心、大样本的证据支持。
本研究分析了胃上部癌患者的No.12a组淋巴结转移模式。目前的数据表明,No.12a组淋巴结转移似乎不是胃上部癌预后的独立危险因素,但伴No.12a组淋巴结转移患者的预后比不伴No.12a组淋巴结转移的预后更差。虽然对于胃上部癌来说,No.12a组淋巴结转移的总体发病率较低,但当肿瘤处于以下几种情况时应积极清扫No.12a组淋巴结:肿瘤位于小弯侧、分化程度为低分化、肿瘤分期较晚(T4、N3或Ⅱ~Ⅲ期)。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
杜书祥:数据搜索、数据分析和论文撰写
吴刚:论文审校
| [1] |
李国新. 胃癌外科2021年研究进展及学科展望[J]. 中华胃肠外科杂志, 2022, 25(1): 15-21. [Li GX. Research progress and prospect of gastric cancer surgery in 2021[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2022, 25(1): 15-21.] |
| [2] |
张晋杰, 王杰, 胡文庆. 进展期胃上部癌淋巴结清扫的现状与研究进展[J]. 中华胃肠外科杂志, 2018, 21(2): 236-240. [Zhang JJ, Wang J, Hu WQ. Current status and research progress of lymph node dissection in advanced gastric cancer[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2018, 21(2): 236-240. DOI:10.3760/cma.j.issn.1671-0274.2018.02.024] |
| [3] |
所剑, 李伟. 第5版日本《胃癌治疗指南》解读[J]. 中国实用外科杂志, 2018, 38(4): 407-413. [Suo J, Li W. Interpretation of Japanese Gastric Cancer Association (JGCA) gastric cancer treatment guidelines 2018-the fifth Edition[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2018, 38(4): 407-413. DOI:10.19538/j.cjps.issn1005-2208.2018.04.16] |
| [4] |
邱海波, 周志伟. NCCN胃癌临床实践指南2017年第五版更新要点解读[J]. 中华胃肠外科杂志, 2018, 21(2): 160-164. [Qiu HB, Zhou ZW. Updates and interpretation on NCCN clinical practice guidelines for gastric cancer 2017 version 5[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2018, 21(2): 160-164. DOI:10.3760/cma.j.issn.1671-0274.2018.02.008] |
| [5] |
Ajani JA, D'amico TA, Bentrem DJ, et al. Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2022, 20(2): 167-192. DOI:10.6004/jnccn.2022.0008 |
| [6] |
张广坛, 张学东, 薛焕洲, 等. 进展期胃癌的手助腹腔镜全胃切除及D2淋巴结清扫[J]. 中华普通外科杂志, 2015, 30(10): 762-765. [Zhang GT, Zhang XD, Xue HZ, et al. Hand-assisted laparoscopic total gastrectomy with regional lymph node dissection for advanced gastric cancer[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2015, 30(10): 762-765. DOI:10.3760/cma.j.issn.1007-631X.2015.10.004] |
| [7] |
Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition)[J]. Gastric Cancer, 2021, 24(1): 1-21. DOI:10.1007/s10120-020-01042-y |
| [8] |
Wang FH, Zhang XT, Li YF, et al. The Chinese Society of Clinical Oncology (CSCO): Clinical guidelines for the diagnosis and treatment of gastric cancer, 2021[J]. Cancer Commun (Lond), 2021, 41(8): 747-795. DOI:10.1002/cac2.12193 |
| [9] |
Hartgrink HH, van de Velde CJ, Putter H, et al. Extended lymph node dissection for gastric cancer: who may benefit? Final results of the randomized Dutch gastric cancer group trial[J]. J Clin Oncol, 2004, 22(11): 2069-2077. DOI:10.1200/JCO.2004.08.026 |
| [10] |
Cuschieri A, Weeden S, Fielding J, et al. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial.Surgical Co-operative Group[J]. Br J Cancer, 1999, 79(9-10): 1522-1530. DOI:10.1038/sj.bjc.6690243 |
| [11] |
Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471-1474. DOI:10.1245/s10434-010-0985-4 |
| [12] |
Lu J, Zheng CH, Cao LL, et al. The effectiveness of the 8th American Joint Committee on Cancer TNM classification in the prognosis evaluation of gastric cancer patients: A comparative study between the 7th and 8th editions[J]. Eur J Surg Oncol, 2017, 43(12): 2349-2356. DOI:10.1016/j.ejso.2017.09.001 |
| [13] |
Kong SH, Yoo MW, Kim JW, et al. Validation of limited lymphadenectomy for lower-third gastric cancer based on depth of tumour invasion[J]. Br J Surg, 2011, 98(1): 65-72. |
| [14] |
Wei ZW, Xia GK, Wu Y, et al. Evaluation of skeletonization of the hepatoduodenal ligament for the lower third gastric cancer by propensity score analysis[J]. Hepatogastroenterology, 2013, 60(127): 1789-1796. |
| [15] |
Cai S, Chen J, C C, et al. Survival of proper hepatic artery lymph node metastasis in patients with gastric cancer: implications for D2 lymphadenectomy[J]. PLoS One, 2015, 10(3): e0118953. DOI:10.1371/journal.pone.0118953 |
| [16] |
Kumagai K, Hiki N, Nunobe S, et al. Metastasis to the lymph nodes along the proper hepatic artery from adenocarcinoma of the stomach[J]. Langenbeck Arch Surg, 2016, 401(5): 677-685. DOI:10.1007/s00423-016-1429-9 |
| [17] |
中国医师协会腹腔镜外科医师培训学院, 中国抗癌协会胃癌专业委员会, 中国研究型医院学会机器人与腹腔镜外科专业委员会, 中国腹腔镜胃肠外科研究组. 中国腹腔镜胃癌根治手术质量控制专家共识(2022版)[J]. 中华消化外科杂志, 2022, 21(5): 573-585. [Laparoscopic Surgeon Training College of Chinese Medical Doctor Association, Gastric Cancer Professional Committee of China Anti-Cancer Association, Robotic and Laparoscopic Surgery Professional Committee of Chinese Research Hospital Association, Chinese Laparoscopic Gastrointestinal Surgery Research Group. Chinese experts' consensus on quality control of laparoscopic radical gastrectomy (2022 edition)[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2022, 21(5): 573-585. DOI:10.3760/cma.j.cn115610-20220328-00170] |
| [18] |
In H, Solsky I, Palis B, et al. Validation of the 8th Edition of the AJCC TNM Staging System for Gastric Cancer using the National Cancer Database[J]. Ann Surg Oncol, 2017, 24(12): 3683-3691. DOI:10.1245/s10434-017-6078-x |
| [19] |
Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3rd English edition[J]. Gastric Cancer, 2011, 14(2): 101-112. DOI:10.1007/s10120-011-0041-5 |
| [20] |
Lin JX, Lin JP, Wang ZK, et al. Assessment of Laparoscopic Spleen-Preserving Hilar Lymphadenectomy for Advanced Proximal Gastric Cancer Without Invasion Into the Greater Curvature: A Randomized Clinical Trial[J]. JAMA Surg, 2023, 158(1): 10-18. DOI:10.1001/jamasurg.2022.5307 |
| [21] |
Schwarz RE, Smith DD. Clinical impact of lymphadenectomy extent in resectable gastric cancer of advanced stage[J]. Ann Surg Oncol, 2007, 14(2): 317-328. DOI:10.1245/s10434-006-9218-2 |
| [22] |
Seevaratnam R, Bocicariu A, Cardoso R, et al. How many lymph nodes should be assessed in patients with gastric cancer? A systematic review[J]. Gastric Cancer, 2012, 15(Suppl 1): S70-88. |
| [23] |
胡建昆, 张维汉. 中国腹腔镜胃癌手术20年术式变迁与发展[J]. 中华普外科手术学杂志(电子版), 2021, 15(2): 129-132. [Hu JK, Zhang WH. Changes and development of laparoscopic gastric cancer surgery in China over the past 20 years[J]. Zhonghua Pu Wai Ke Shou Shu Xue Za Zhi(Dian Zi Ban), 2021, 15(2): 129-132. DOI:10.3877/cma.j.issn.1674-3946.2021.02.003] |
| [24] |
中华医学会外科学分会腹腔镜与内镜外科学组. SiewertⅡ型食管胃结合部腺癌腔镜手术治疗中国专家共识(2019版)[J]. 中国实用外科杂志, 2019, 39(11): 1129-1135. [Laparoscopic and Endoscopic Surgery Group, Surgery Society of Chinese Medical Association. Chinese expert consensus on laparoscopic surgery for Siewert type Ⅱ esophagogastric junction adenocarcinoma (2019 edition)[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2019, 39(11): 1129-1135. DOI:10.19538/j.cjps.issn1005-2208.2019.11.02] |
| [25] |
Zheng Z, Yin J, Wu HW, et al. Explored Risk Factors for Lymph Node Metastasis with Siewert Ⅱ/Ⅲ Adenocarcinoma of the Gastroesophageal Junction[J]. Anticancer Res, 2017, 37(8): 4605-4610. |
| [26] |
Suh YS, Lee KG, Oh SY, et al. Recurrence Pattern and Lymph Node Metastasis of Adenocarcinoma at the Esophagogastric Junction[J]. Ann Surg Oncol, 2017, 24(12): 3631-3639. DOI:10.1245/s10434-017-6011-3 |
| [27] |
Hosoda K, Yamashita K, Moriya H, et al. Optimal treatment for Siewert type Ⅱ and Ⅲ adenocarcinoma of the esophagogastric junction: A retrospective cohort study with long-term follow-up[J]. World J Gastroenterol, 2017, 23(15): 2723-2730. DOI:10.3748/wjg.v23.i15.2723 |
| [28] |
Sato Y, Katai H, Ito M, et al. Can proximal Gastrectomy Be Justified for Advanced Adenocarcinoma of the Esophagogastric Junction?[J]. J Gastric Cancer, 2018, 18(4): 339-347. DOI:10.5230/jgc.2018.18.e33 |
| [29] |
Wei ZW, Xia GK, Wu Y, et al. Evaluation of skeletonization of the hepatoduodenal ligament for the lower third gastric cancer by propensity score analysis[J]. Hepatogastroenterology, 2013, 60(127): 1789-1796. |
| [30] |
Yamashita H, Katai H, Morita S, et al. Optimal extent of lymph node dissection for Siewert typeⅡesophagogastric junction carcinoma[J]. Ann Surg, 2011, 254(2): 274-280. DOI:10.1097/SLA.0b013e3182263911 |
| [31] |
Huang Y, Zhu G, Zheng W, et al. Scope definition and resection significance of No. 12a group lymph nodes in gastric cancer[J]. Mol Clin Oncol, 2016, 5(2): 257-262. DOI:10.3892/mco.2016.911 |
 2023, Vol. 50
2023, Vol. 50



