文章信息
- 胃癌术前淋巴结分期不足的危险因素及预测模型的建立
- Risk Factors and Establishment of Prediction Model for Preoperative Lymph Node Staging Deficiency in Gastric Cancer
- 肿瘤防治研究, 2023, 50(5): 498-504
- Cancer Research on Prevention and Treatment, 2023, 50(5): 498-504
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1254
- 收稿日期: 2022-10-24
- 修回日期: 2023-02-27
2. 450003 郑州,河南大学人民医院胃肠外科;
3. 450003 郑州,河南省人民医院胃肠外科
2. Department of Gastrointestinal Surgery, People's Hospital of He'nan University, Zhengzhou 450003, China;
3. Department of Gastrointestinal Surgery, He'nan Provincial People's Hospital, Zhengzhou 450003, China
胃癌是严重威胁人类健康的恶性肿瘤。2020年世界卫生组织(WHO)统计数据显示,全球胃癌发病率位于恶性肿瘤新发病第五位,死亡率位于恶性肿瘤第三位[1]。目前,外科手术仍是胃癌有效的根治性方法,对于进展期的胃癌患者来说,标准治疗策略是手术联合术后辅助治疗或者术前新辅助+手术联合术后辅助治疗[2-3]。术前的准确分期是实施合理的手术方案、决定是否需要新辅助治疗的前提[4]。无论超声内镜还是薄层CT扫描对T分期的准确性都可达到80%以上[5]。另外,PET/CT的存在几乎可以明确是否有周围脏器和远处脏器转移。然而,无论哪种影像学检查,术前N分期的判断都依据于肿大淋巴结的个数,但淋巴结的大小与肿瘤转移与否是两个不同的概念,没有肿大的淋巴结也有转移的可能,肿大的淋巴结也可能是炎性反应,因此术前以肿大淋巴结的个数作为预测N分期的指标存在一定局限性,进而影响治疗决策的制定。所以,迫切需要一种能辅助影像学检查预测术前N分期的方法。然而目前鲜有关于术前N分期不足的危险因素的研究。本研究旨在探讨薄层多期增强CT尚不能发现的淋巴结转移的危险因素,并进一步建立术前N分期不足的风险评估模型,以此为治疗方案的选择提供参考。
1 资料与方法 1.1 一般资料回顾性分析2017年7月至2021年7月河南省人民医院胃肠外科收治的268例GC患者的临床病理资料。入组的患者均行常规术前检查,包括胸部、全腹部薄层多期增强CT,必要时行PET/CT检查评估肿瘤是否存在远处转移。TNM分期参照美国癌症联合会(AJCC)第8版分期系统[6],N0指无区域淋巴结转移,N1指1~2个区域淋巴结有转移,N2指3~6个区域淋巴结有转移,N3指7个或7个以上区域淋巴结有转移。Lauren分型为肠型、弥漫型、混合型[7]。肿瘤长径的测量根据第5版日本胃癌分类规约,设定肿瘤的最大直径作为肿瘤长径[8]。
1.2 纳入和排除标准纳入标准:(1)病理学证实为胃腺癌;(2)接受了胃癌根治术+标准的D2或D2+淋巴清扫术;(3)达到R0切除;(4)分组拣取各组淋巴结并送病理检查。排除标准:(1)残胃癌;(2)接受新辅助化疗的患者;(3)未行根治性切除术的患者;(4)切除淋巴结数目 < 15的患者;(5)术前N分期过度的患者;(6)行上腹部手术的患者;(7)缺乏完善的临床资料。
1.3 方法 1.3.1 术前评估CT扫描:CT检查采用1 mm薄层多期增强CT。所有病例于术前10 d内行CT检查。CT扫描前患者禁食8~12 h,检查前饮水800~1 000 ml。扫描层厚1 mm。先行平扫,再行双期增强扫描,对比剂使用碘普胺注射液。经肘静脉注射对比剂后27 s开始动脉期扫描,60 s开始静脉期扫描。图像评价:薄层多期增强CT图像术前经两位腹部放射学高年资医师观察、测量和术前分期。淋巴结转移采用淋巴结长径≥1 cm或增强后CT值≥100 Hu为转移阳性的标准[9-10]。分化程度、Borrmann分型由术前胃镜病理检查所得。
1.3.2 术后评估收集所有患者病理资料,包括肿瘤部位、分化程度、Borrmann分型、肿瘤直径、肿瘤浸润深度(T分期)、淋巴结转移情况(N分期)。所有患者术后标本组织进行染色后,均由高年资病理科医生进行病理评估,并依据美国癌症联合会(AJCC)第8版TNM分期系统对术后病理进行分期。以术后病理分期为标准,评估术前CT预测淋巴结转移情况。分期不足即为cN0→pN1、cN0→pN2、cN0→pN3、cN1→pN2、cN1→pN3或cN2→pN3。分析薄层多期增强CT对胃癌患者术前N分期的评估价值。
1.3.3 治疗策略本中心严格按照中国CSCO胃癌诊疗指南制定治疗策略[11]。
1.3.4 随访通过门诊或电话进行随访,于术后第1年每3个月门诊复查或随访1次,术后第2年每6个月1次,之后每年随访1次。随访截止日期为2022年11月。观察终点是总体生存期(OS),定义为从治疗到患者死亡或最后一次随访日期的时间。本研究经河南省人民医院伦理委员会批准,并按照1964年赫尔辛基宣言及其后续修正案中提出的伦理声明进行研究,并取得患者知情同意。
1.4 统计学方法应用SPSS21统计软件进行分析。计量资料首先进行正态性检验,满足正态分布的连续性数值变量以(x±s)表示,两组间比较采用独立样本t检验,Mann-Whitney U检验用于非正态分布的两组数值变量比较,数据资料以M(Q1, Q3)表示;计数资料组间比较采用χ2检验或Fisher精确检验;将P < 0.05的单因素纳入Logistic回归,分析其独立危险因素;运用Kaplan-Meier绘制术前N分期准确组与不足组的生存曲线;利用R软件包绘制Nomogram图,绘制预测模型的ROC曲线,计算ROC曲线下面积(AUC)、95%CI、敏感度和特异性。P < 0.05为差异有统计学意义。
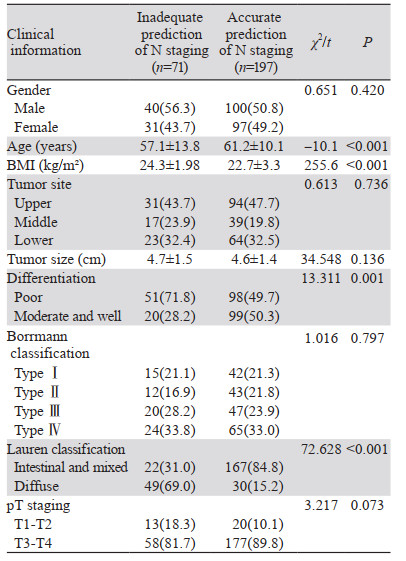
2 结果 2.1 患者临床病理资料共筛查了784例患者,最终纳入268例患者,病例筛查流程见图 1。纳入患者的临床病理特征见表 1。患者中位年龄为60岁(24~88岁)。术前N分期不足者71例(26.5%),N分期准确者197例(74.5%)。
|
| 图 1 病例筛选流程图 Figure 1 Flow chart of patient screening |
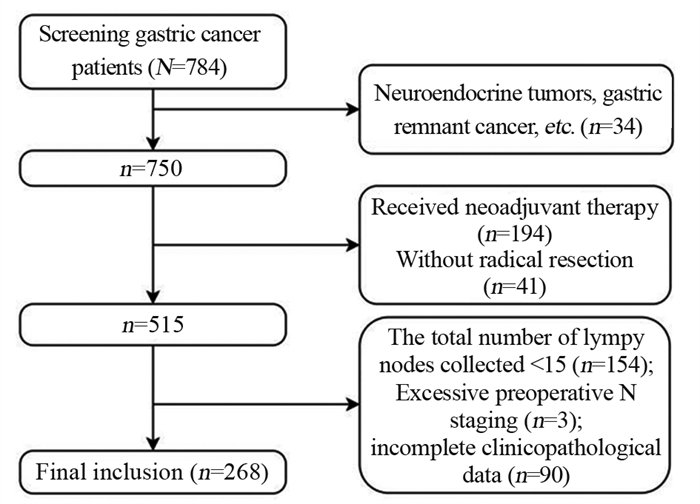
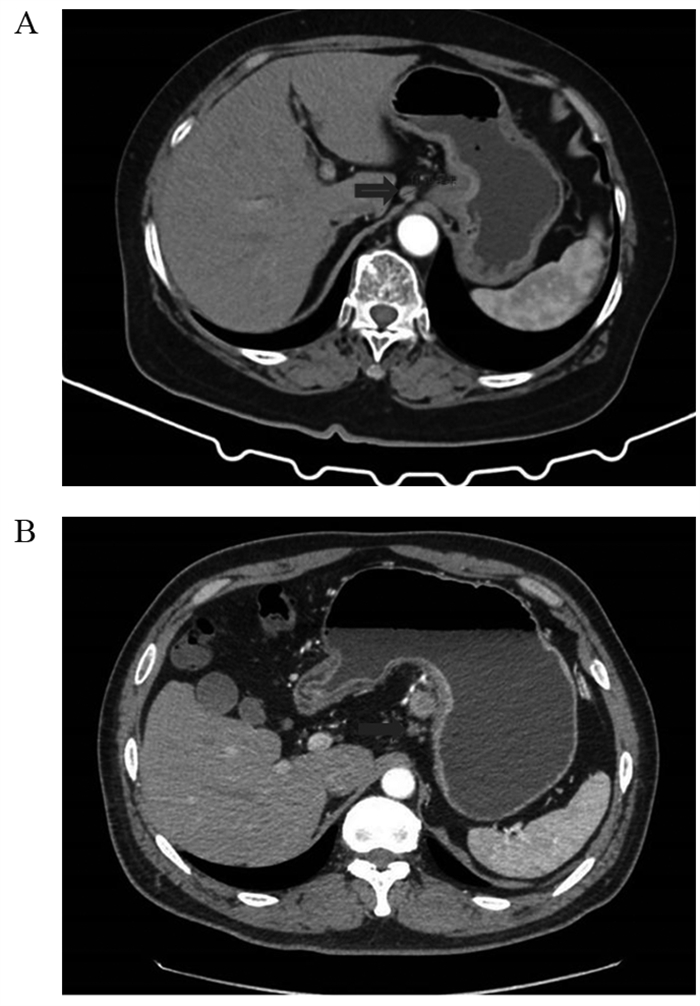
淋巴结可疑阳性CT显影评估:No.3组淋巴结长径≥1 cm,见图 2A;动脉期,增强CT值≥100 Hu,见图 2B。Lauren分型CT显影评估:肠型,胃壁均质不规则增厚,强化后扫描病灶呈均质轻中度强化,见图 3A;弥漫型,胃壁局限性增厚,其中动脉期呈不均质强化,见图 3B;混合型,胃壁均质不规则或局部增厚,强化期呈轻度强化,见图 3C。
|
| A: No. 3 positive lymph nodes (arrow); B: positive lymph nodes (pathologically confirmed), with marked enhancement around the arterial phase. 图 2 胃癌淋巴结转移的薄层CT表现 Figure 2 Thin-slice CT findings of lymph node metastasis in gastric cancer |
|
| A: intestinal type: the gastric wall was homogeneous and irregularly thickened, and the lesions showed homogeneous mild-to-moderate enhancement; B: diffuse type: localized thickening of the gastric wall, with heterogeneous enhancement in the arterial phase; C: mixed type: the gastric wall was homogeneous and irregular or localized thickening, with mild enhancement in the enhancement phase. 图 3 Lauren分型薄层CT表现 Figure 3 Thin-slice CT manifestations for Lauren classification |
结果显示,CT对胃癌分期评估不足与年龄、BMI、分化程度和Lauren分型有关(P < 0.05),而与性别、pT分期、肿瘤部位、肿瘤大小、Borrmann分型无关(P > 0.05),见表 1。
2.4 多因素分析将单因素分析中有统计学差异的因素纳入Logistic回归模型中进行分析,结果显示,年龄越小、BMI越高、低分化和Lauren分型为弥漫型可能是术前N分期不足的独立危险因素(P < 0.05),见表 2。
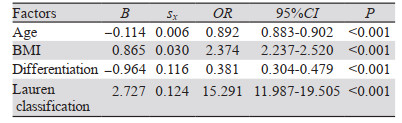
|
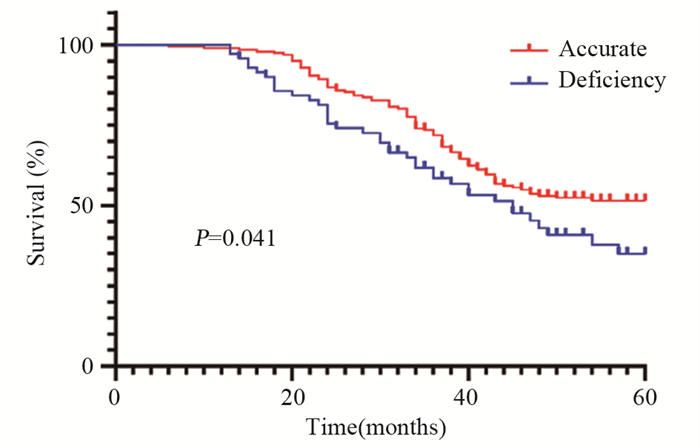
本次随访率100%(电话失访者以门诊最后一次复查时间为随访截止日期),中位随访时间为37(5~64)个月。截至随访终点,术前N分期不足组与准确组的患者中位生存时间估计值分别为44.50和50.71个月。两组的生存曲线不同(Log rank P=0.041),术前N分期准确组优于术前N分期不足组,见图 4。
|
| 图 4 术前N分期不足和准确的预后生存曲线 Figure 4 Prognosis survival curves of deficiency or accurate prediction of N staging |
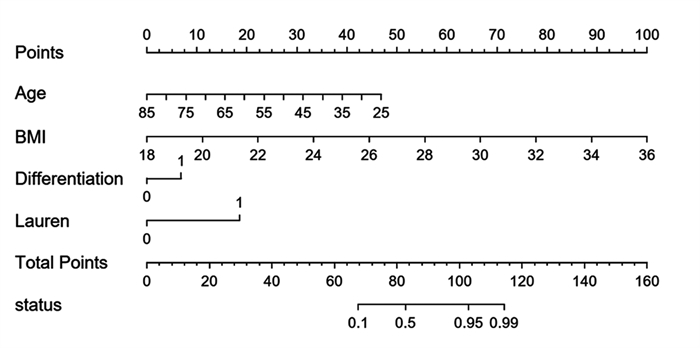
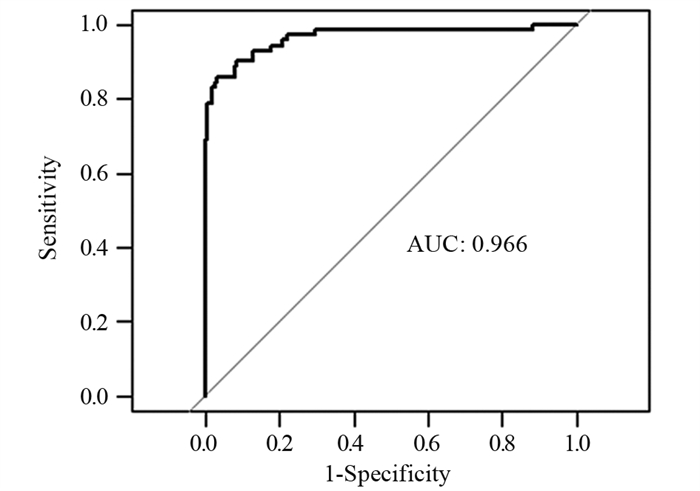
术前可评的危险因素有年龄、BMI值、分化程度以及Lauren分型,使用R软件建立上述四者基于Logistic回归的Nomogram图,将各因素计分,当总分 > 82分时预测N分期不足的可能 > 50%,见图 5。通过绘制ROC曲线,计算曲线下面积AUC为0.966(95%CI: 0.938~0.994),敏感度为85.9%,特异性为96.9%,见图 6。
|
| 图 5 胃癌术前N分期不足预测模型Nomogram图 Figure 5 Nomogram of preoperative N-stage deficiency prediction model for gastric cancer |
|
| 图 6 预测模型的ROC曲线 Figure 6 ROC curve of prediction model |
准确的术前分期对于胃癌治疗方案的选择、预后的评估均具有重要意义[12]。薄层多期增强CT能够在同一屏气时相中完成对整个胃脏的扫描,通过重建后可以获得高质量、多平面、多角度的MPR图像,能真实地反映脏器和周围组织的客观形态,包括肿瘤的大小、部位、密度、浸润范围等,还可以多角度地直观观察肿瘤病灶、病灶与周围组织的关系。对胃肿瘤的cT分期(术前T分期)准确性可达到80%[13],对远处转移的准确性为97%~100%[14]。然而,虽然1 mm薄层多期增强CT扫描可以发现大部分淋巴结转移,但是如果大小正常的淋巴结存在癌细胞侵犯且又无明显形态、密度改变时,增强CT就难以发现[15],进而出现术前N分期不足的情况。术前准确评估N分期有助于临床医师对患者选择最佳治疗方案。此外,通过本研究发现,术前N分期不足的胃癌患者预后显著差于术前N分期准确的患者,与之类似的是,黄昌明等的研究同样表明低估肿瘤分期将导致淋巴结清扫不足,进而影响胃癌患者的长期生存[16]。因此,术前准确预测或评估淋巴结转移对患者个体化管理至关重要[17-18]。但由于胃周淋巴结位置较隐匿且体积比较小,诊断有一定的难度,所以有必要找出导致术前N分期不足的危险因素,建立术前N分期评估模型。
本研究结合术前影像学检查与术后病理检查结果显示:cN0→pN1期39例、cN0→pN2期25例,cN1→pN2期7例。总体术前N分期准确率为74.5%。单因素分析结果显示,不同年龄、不同BMI、不同Lauren分型、不同分化程度的术前N分期预测情况差异有统计学意义(P < 0.05),年龄越小、BMI越大、低分化、Lauren分型为弥漫型的患者更容易出现N分期不足。Logistic多因素分析显示,年龄越小、BMI越大、低分化、弥漫型可能是影响N分期不足的独立危险因素。此前评估术前N分期不足危险因素的研究较少,仅有一篇类似的报道,该研究[19]是基于超声内镜分析影响术前N分期不足的危险因素,认为随着肿瘤浸润深度的增加,N分期准确率会下降。这与本研究结果有出入,可能是因为该研究仅仅是靠超声内镜判断淋巴结转移,与本研究判断标准不同,且该研究并未进一步作多因素分析。
Ahmad等[20]认为,老年患者淋巴结转移风险相比年轻患者低,可能是因为老年患者免疫细胞增殖减少,导致术前部分淋巴结对肿瘤的反应性不足[21]。另外,有研究证明,在各种肿瘤中,高龄与较低的淋巴结清扫数量高度相关[22],致使高龄胃癌患者术前N分期评估“相对准确”。目前对于肥胖与胃癌淋巴结转移的相关性仍存在广泛争议,有研究表明,高BMI会增加恶性肿瘤的发病率,这可能与瘦素、胰岛素样生长因子的分泌增加有关[23-25]。一篇荟萃分析[26]中指出,低分化是胃癌淋巴结转移的预测因素。另外,根据Lauren分型,胃癌可分为肠型和弥漫型。研究表明,与肠型胃癌相比,弥漫型胃癌扩散性侵入胃壁的倾向更大、淋巴结转移率更高,通常出现在晚期[27-30]。本研究亦证实弥漫性胃癌相对于肠型胃癌的术前淋巴结转移评判不足风险升高,是术前N分期不足的独立危险因素。
术前评估N分期不足对选择更适合治疗策略有重要参考价值。此前研究多是致力于建立胃癌术前淋巴结转移的预测模型[31-33],而其准确度却差强人意。如刘希胜等建立的术前淋巴结转移预测模型准确度仅为76.4%[32]。彭俊生和王悦基于CT扫描建立了预测术前淋巴结转移的模型,准确度分别为78.6%、88.6%[31, 33]。然而,随着现代影像学的研究进展,CT/MRI对判断术前淋巴结转移的准确度可达到71%~76%[34],所以以上模型临床意义有限。而本研究在1 mm薄层多期增强CT扫描的基础上建立了一个评估术前N分期不足的预测模型,旨在辅助影像学检查预测术前N分期,指导制定合适的治疗决策。我们以年龄、BMI、肿瘤分化程度和Lauren分型四个独立危险因素构建术前预测模型。使用R软件建立上述四者的Nomogram图,将风险计分便于临床操作。根据Nomogram图可以大致推测出年龄越小,BMI越大,计分越高,肿瘤为低分化计分约19分,Lauren分型为弥漫性计分约21分,当总分大于82分时预测术前N分期不足的可能大于50%。预测模型的ROC曲线下面积AUC为0.966(95%CI: 0.938~0.994),敏感度为85.9%,特异性为96.9%,可以看出模型具有较高的可信度,但由于本研究是单中心、小样本的研究,结果仍需多中心的研究和大数据样本验证。
中国2022版CSCO胃癌诊疗指南[35]中指出:对于食管胃结合部肿瘤,cT1-2N0M0建议单纯手术治疗,cT1-2N+M0/cT3-4aN0M0/cT3-4N+M0则建议新辅助治疗;而对于非食管胃结合部,cT1-2N0M0/cT1-2N+M0/cT3-4aN0M0建议直接手术治疗,cT3-4aN+M0则建议先行新辅助治疗。鉴于目前影像学检查对cT、cM分期的高准确性[13-14],所以决定术前治疗决策的重点和难点就在于分期为cT1-2N0M0/cT1-2N+M0食管胃结合部肿瘤的患者和cT3-4aN0M0/cT3-4aN+M0非食管胃结合部肿瘤的患者。根据本研究建立的预测模型,当cT1-2N0M0食管胃结合部肿瘤和cT3-4aN0M0非食管胃结合部肿瘤的总预测评分大于80分时,该部分患者也应该先行新辅助治疗,但是为避免引起过度医疗,建议对该部分患者行MDT讨论,重新评估CT等影像学检查。对于cT1-2N+M0食管胃结合部肿瘤和cT3-4aN+M0非食管胃结合部肿瘤的患者,虽然指南推荐先新辅助治疗,但这仅是ⅠB类证据类别,且临床实施率较低,那么通过本预测模型,当总预测评分大于80分时,则建议先行新辅助治疗。
本研究存在一些局限性:首先,本研究是一项回顾性研究,在收集数据的过程中可能存在一些数据遗漏和错误;其次,在选择病例过程中并没有纳入术前N分期过度的病例,原因是筛查的胃癌患者中只有3例术前N分期过度的患者,其研究意义有限,故将其排除,但这仍可能增加选择偏倚;第三,本研究是单中心的,尚需要前瞻性、多中心的研究支持。
综上,年龄越小、BMI越高、低分化、Lauren分型为弥漫型可能是术前N分期不足的独立危险因素,当术前检查发现此类患者,建议增加术前N分期,借以制定最佳的治疗决策。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
杜书祥:撰写文章
郭振、陈紫来、王尚鑫:数据搜索和分析
吴 刚:研究指导、论文修改
| [1] |
Sung H, Ferllay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
陈博晋, 胡星怡, 赵菁文, 等. 免疫治疗在胃癌新辅助治疗中的研究进展[J]. 肿瘤防治研究, 2022, 49(7): 727-732. [Cheng BJ, Hu XY, Zhao JW, et al. Current Status of Immunotherapy in Neoadjuvant Therapy for Gastric Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2022, 49(7): 727-732.] |
| [3] |
Su PF, Yu JC. Progress in neoadjuvant therapy for gastric cancer[J]. Oncol Lett, 2022, 23(6): 172. DOI:10.3892/ol.2022.13292 |
| [4] |
Panduro-Correa V, Cubas WS, Herrera-Matta JJ, et al. Survival and adequate preoperative staging in patients undergoing gastric cancer surgery at a Peruvian Police Hospital[J]. J Surg Oncol, 2021, 123(2): 425-431. DOI:10.1002/jso.26315 |
| [5] |
钟宝元, 刘艳秀, 黄文峰, 等. 64层CT三期动态增强扫描对胃癌术前TNM分期的判断价值[J]. 中华胃肠外科杂志, 2012, 15(7): 706-709. [Zhong BY, Liu YX, Huang WF, et al. Clinical value of 64-slice spiral 3-phase CT enhanced scanning for preoperative TNM staging assessment of gastric carcinoma[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2012, 15(7): 706-709.] |
| [6] |
In H, Solsky I, Palis B, et al. Validation of the 8th Edition of the AJCC TNM Staging System for Gastric Cancer using the National Cancer Database[J]. Ann Surg Oncol, 2017, 24(12): 3683-3691. DOI:10.1245/s10434-017-6078-x |
| [7] |
Chen YC, Fang WL, Wang RF, et al. Clinicopathological Variation of Lauren Classification in Gastric Cancer[J]. Pathol Oncol Res, 2016, 22(1): 197-202. DOI:10.1007/s12253-015-9996-6 |
| [8] |
Chen Z, Liu Y, Dou L, et al. The efficacy of the application of the curative criteria of the 5(rd) edition Japanese gastric cancer treatment guidelines for early adenocarcinoma of the esophagogastric junction treated by endoscopic submucosal dissection[J]. Saudi J Gastroenterol, 2021, 27(2): 97-104. DOI:10.4103/sjg.SJG_403_20 |
| [9] |
Jiang ZY, Kinami S, Nakamura N, et al. Diagnostic ability of multi-detector spiral computed tomography for pathological lymph node metastasis of advanced gastric cancer[J]. World J Gastrointest Oncol, 2020, 12(4): 435-446. DOI:10.4251/wjgo.v12.i4.435 |
| [10] |
Lim JS, Yun MJ, Kim MJ, et al. CT and PET in stomach cancer: preoperative staging and monitoring of response to therapy[J]. Radiographics, 2006, 26(1): 143-156. DOI:10.1148/rg.261055078 |
| [11] |
Wang FH, Zhang XT, Li YF, et al. The Chinese Society of Clinical Oncology (CSCO): Clinical guidelines for the diagnosis and treatment of gastric cancer, 2021[J]. Cancer Commun (Lond), 2021, 41(8): 747-795. DOI:10.1002/cac2.12193 |
| [12] |
刘颖斌, 董平, 吴文广. 加强胃癌的分期研究[J]. 中华普通外科杂志, 2013, 28(10): 729-731. [Liu YB, Dong P, Wu WG. Strengthening the staging study of gastric cancer[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2013, 28(10): 729-731.] |
| [13] |
Láinez Ramos-Bossini AJ, Ruiz Carazo E, Rabadán Caravaca MD. 'Back-and-Forth Stomach' CT Imaging Findings of a Pathophysiologic Entity Causing Acute Gastric Volvulus[J]. Tomography, 2022, 8(1): 245-256. DOI:10.3390/tomography8010019 |
| [14] |
武乐斌, 王锡明, 李振家, 等. 螺旋CT成像技术在胃癌CT分期及术前评估中的价值[J]. 中国医学影像技术, 2001, 17(4): 301-303. [Wu LB, Wang XM, Li ZJ, et al. Evaluation of Spiral CT Imaging Technique in Staging of Gastric Carcinoma and Preoperative Assessment[J]. Zhongguo Yi Xue Ying Xiang Ji Shu, 2001, 17(4): 301-303.] |
| [15] |
郗新娟, 曹波. 多层螺旋CT在胃癌术前分期诊断中的应用[J]. 延安大学学报(医学科学版), 2021, 19(1): 76-79. [Xi XJ, Cao B. Application of multislice spiral CT in the diagnosis of preoperative staging of gastric cancer[J]. Yan'An Da Xue Xue Bao (Yi Xue Ke Xue Ban), 2021, 19(1): 76-79.] |
| [16] |
Huang CM, Xu M, Wang JB, et al. Is tumor size a predictor of preoperative N staging in T2-T4a stage advanced gastric cancer?[J]. Surg Oncol, 2014, 23(1): 5-10. DOI:10.1016/j.suronc.2014.01.003 |
| [17] |
Ajani JA, Bentrem DeJ, Besh S, et al. Gastric cancer, version 2.2013: featured updates to the NCCN Guidelines[J]. J Natl Compr Canc Netw, 2013, 11(5): 531-546. DOI:10.6004/jnccn.2013.0070 |
| [18] |
Yamashita K, Hosoda K, Ema A, et al. Lymph node ratio as a novel and simple prognostic factor in advanced gastric cancer[J]. Eur J Sur Oncol, 2016, 42(9): 1253-1260. DOI:10.1016/j.ejso.2016.03.001 |
| [19] |
夏晨梅, 陈霞, 李倩倩, 等. 超声内镜对胃癌术前T、N分期准确率的评估及其影响因素分析[J]. 浙江医学, 2018, 40(3): 255-257, 265. [Xia CM, Chen X, Li QQ, et al. Accuracy of endoscopic ultrasonography in preoperative staging for patients with gastric cancer and its influencing factors[J]. Zhejiang Yi Xue, 2018, 40(3): 255-257, 265.] |
| [20] |
Ahmad A, Khan H, Cholankeril G, et al. The impact of age on nodal metastases and survival in gastric cancer[J]. J Surg Res, 2016, 202(2): 428-435. DOI:10.1016/j.jss.2016.02.043 |
| [21] |
Malaguarnera L, Cristaldi E, Malaguarnera M. The role of immunity in elderly cancer[J]. Crit Rev Oncol Hematol, 2010, 74(1): 40-60. |
| [22] |
Nienhueser H, Kunzmann R, Sisic L, et al. Surgery of gastric cancer and esophageal cancer: Does age matter?[J]. J Surg Oncol, 2015, 112(4): 387-395. |
| [23] |
Misleh JG, Santoro P, Strasser JF, et al. Multidisciplinary management of gastric cancer[J]. Surg Oncol Clin N Am, 2013, 22(2): 247-264. |
| [24] |
Comstock SS, Hortos K, Kovan B, et al. Adipokines and obesity are associated with colorectal polyps in adult males: a cross-sectional study[J]. PLoS One, 2014, 9(1): e85939. |
| [25] |
Sikalidis AK, Varamini B. Roles of hormones and signaling molecules in describing the relationship between obesity and colon cancer[J]. Pathol Oncol Res, 2011, 17(4): 785-790. |
| [26] |
Kwee RM, Kwee TC. Predicting lymph node status in early gastric cancer[J]. Gastric Cancer, 2008, 11(3): 134-148. |
| [27] |
Watanabe M, Kato J, Inoue I, et al. Development of gastric cancer in nonatrophic stomach with highly active inflammation identified by serum levels of pepsinogen and Helicobacter pylori antibody together with endoscopic rugal hyperplastic gastritis[J]. Int J Cancer, 2012, 131(11): 2632-2642. |
| [28] |
Kluijt I, Siemerink EJ, Ausems MG, et al. CDH1-related hereditary diffuse gastric cancer syndrome: clinical variations and implications for counseling[J]. Int J Cancer, 2012, 131(2): 367-376. |
| [29] |
Donner I, Kiviluoto T, Ristimäki A, et al. Exome sequencing reveals three novel candidate predisposition genes for diffuse gastric cancer[J]. Fam Cancer, 2015, 14(2): 241-246. |
| [30] |
Adachi Y, Yasuda K, Inomatam, et al. Pathology and prognosis of gastric carcinoma: well versus poorly differentiated type[J]. Cancer, 2000, 89(7): 1418-1424. |
| [31] |
Wang Y, Liu W, Yu Y, et al. CT radiomics nomogram for the preoperative prediction of lymph node metastasis in gastric cancer[J]. Eur Radiol, 2020, 30(2): 976-986. |
| [32] |
Feng QX, Liu C, Qi L, et al. An Intelligent Clinical Decision Support System for Preoperative Prediction of Lymph Node Metastasis in Gastric Cancer[J]. J Am Coll Radiol, 2019, 16(7): 952-960. |
| [33] |
Chen S, Nie RC, Ouyang LY, et al. Nomogram analysis and external validation to predict the risk of lymph node metastasis in gastric cancer[J]. Oncotarget, 2017, 8(7): 11380-11388. |
| [34] |
Saito T, Kurokawa Y, Takiguchi S, et al. Accuracy of multidetector-row CT in diagnosing lymph node metastasis in patients with gastric cancer[J]. Eur Radiol, 2015, 25(2): 368-374. |
| [35] |
中国肿瘤临床学会指南工作委员会. 2022年CSCO胃癌诊疗指南[M]. 北京: 人民卫生出版社, 2022. [Guidelines Working Committee of Chinese Clinical Society of Oncology. Guidelines for the diagnosis and treatment of gastric cancer in CSCO in 2022[M]. Beijing: People's Medical Publishing House, 2022.]
|
 2023, Vol. 50
2023, Vol. 50