文章信息
- 鼻咽癌细胞葡萄糖代谢的分子机制及其与侵袭转移关系的研究进展
- Research Progress on Correlation of Glucose Metabolism Mechanism with Invasion and Metastasis of Nasopharyngeal Carcinoma Cells
- 肿瘤防治研究, 2023, 50(6): 622-627
- Cancer Research on Prevention and Treatment, 2023, 50(6): 622-627
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1234
- 收稿日期: 2022-10-19
- 修回日期: 2023-02-24
2. 430060 武汉,武汉大学人民医院耳鼻咽喉头颈外科研究所
2. Institute of Otolaryngology-Head and Neck Surgery, Renmin Hospital of Wuhan University, Wuhan 430060, China
鼻咽癌是一种起源于鼻咽黏膜上皮的恶性肿瘤,具有明显的地域分布特征。鼻咽癌主要在东亚、东南亚与北非高发[1]。随着生活方式和环境的改变,以及筛查方式和诊疗技术的进步,过去十年的流行病学趋势表明鼻咽癌的发病率正逐渐降低,死亡率大幅下降[2]。鼻咽癌对放射治疗非常敏感,放疗是治疗非转移性鼻咽癌的主要手段。近年来调强放疗的应用也进一步提高了鼻咽癌的治愈率。然而,综合治疗后的局部复发和侵袭转移仍然是目前需要面对的挑战[2]。
在目前已知的癌症死因中,由肿瘤转移造成的疾病死亡为主要原因。因此,了解肿瘤转移的确切机制并开发特异性靶向治疗具有重要意义。一般来说,肿瘤的侵袭转移要经历上皮间充质转化(EMT)、定向侵袭、侵入血液或淋巴循环、渗出脉管、形成微转移灶和定植等系列过程[3],其中,EMT是癌细胞的一个典型内在机制,在癌细胞转移的初始阶段起着至关重要的作用。越来越多的研究表明,癌细胞的葡萄糖代谢从本质上发生了改变,其失调的代谢相较于正常代谢提供了更多的能量及异常的代谢产物,构成生化基础,进而影响癌细胞的侵袭与远处转移。本文从鼻咽癌细胞葡萄糖代谢的分子机制入手,对葡萄糖代谢异常与鼻咽癌侵袭转移关系的研究进行分析总结,旨在为从葡萄糖代谢途径靶向治疗鼻咽癌侵袭转移提供新思路与新途径。
1 鼻咽癌细胞有氧糖酵解途径生理状态下,人体正常细胞的葡萄糖代谢主要包括葡萄糖的有氧氧化、无氧糖酵解以及磷酸戊糖途径。但是在肿瘤组织中,葡萄糖代谢发生重要变化,这种变化主要体现在一直被认为是癌细胞标志性代谢表型的Warburg效应[4],即在有氧条件下,肿瘤细胞也优先依赖糖酵解以无氧参与的方式获取能量。众所周知,糖酵解的产能效率比线粒体氧化磷酸化低很多,但肿瘤细胞通过增加葡萄糖吸收来扭转这种劣势。下面从葡萄糖的摄取、代谢途径及代谢产物的去向来分析鼻咽癌细胞有氧糖酵解的异常。
1.1 鼻咽癌细胞葡萄糖摄取增加葡萄糖在哺乳动物细胞质膜上的转运是葡萄糖代谢的第一个限速步骤,由于葡萄糖无法自由通过细胞膜脂质双层结构进入细胞,因此细胞对葡萄糖的摄入需要由细胞膜上的葡萄糖转运蛋白(GLUTs)介导[5]。GLUTs是一类跨膜蛋白,调控细胞外葡萄糖进入细胞内。
18F-氟代脱氧葡萄糖(18F-FDG)常被应用于正电子发射计算机断层显像(PET-CT),18F-FDG PET-CT在鼻咽癌患者影像学中的应用,为鼻咽癌患者葡萄糖摄取增加提供了最好的证据[6]。同时,研究显示18F-FDG的吸收和鼻咽癌患者GLUT-1水平呈正相关[7],表明鼻咽癌细胞葡萄糖摄取增加可能是由GLUTs水平上升造成的。Zhou等的研究证实,GLUT-1在鼻咽癌患者鼻咽组织中高表达,其表达与临床分期、淋巴结转移和EB病毒感染有关[8]。
GLUT在鼻咽癌中的高表达由多种原因造成。首先肿瘤的发生是由癌基因突变累积而成,致癌突变最终会导致葡萄糖转运蛋白(例如GLUT 1、GLUT 3)的上调[9]。另外,EB病毒几乎存在于所有的鼻咽癌细胞中,其基因可整合到人宿主细胞基因组,从而诱发上皮细胞恶性转化。EB病毒编码的潜伏膜蛋白1(LMP1)可以通过激活mTORC1/NF-κB信号转导上调GLUT-1转录[10]。同时,研究证实PKM2的表达有助于增加GLUT-1的活性[11]。综上所述,GLUT表达水平的上升和活性的增加共同导致了鼻咽癌细胞葡萄糖摄取量增加。
1.2 鼻咽癌细胞进行高速率的有氧糖酵解有氧糖酵解指的是肿瘤细胞在有氧的条件下,将大部分葡萄糖转化为乳酸的过程,其每分子葡萄糖的ATP产量远不如线粒体氧化磷酸化。然而,在鼻咽癌细胞中,有氧糖酵解的关键酶几乎都高表达,因此保证了癌细胞高效的代谢速率,从而获得比氧化磷酸化更多的能量。有氧糖酵解共经历两个阶段:首先,葡萄糖被分解成为两个丙酮酸分子,这个阶段是有氧氧化和无氧糖酵解共同的阶段。此阶段有三种重要的酶决定糖酵解的速率和方向,分别是己糖激酶(HK,也称为葡萄糖激酶)、磷酸果糖激酶1(PFK1)和丙酮酸激酶M2型(PKM2)。研究表明FOXC2-YAP信号通路可以特异性上调HK在鼻咽癌细胞中的表达,HK与鼻咽癌患者的预后及结局有关[12]。PKM2的异常表达会增加磷酸烯醇式丙酮酸到丙酮酸的速率[11],其在鼻咽癌细胞中被PI3K/AKT信号通路激活而上调,PKM2的过表达将导致葡萄糖摄取、乳酸和ATP水平的增加[13]。PFK1可以催化果糖-6-磷酸磷酸化为果糖-1,6-二磷酸,其在鼻咽癌组织中过表达,且酶活性与临床阶段的进展显著正相关[14]。
此后,丙酮酸分子将被还原为乳酸。乳酸是肿瘤组织中最多的葡萄糖代谢产物,这一阶段由乳酸脱氢酶(LDH)催化。鼻咽癌患者血清中LDH表达水平升高,并且与预后不良和远处转移有关[15]。有研究表明血清的乳酸脱氢酶水平可以作为局部晚期鼻咽癌的独立预后因素[16]。LDH的高表达催化丙酮酸生成乳酸,导致大量的乳酸产生。
除去以上有氧糖酵解的关键酶异常过表达外,在EBV感染的鼻咽癌细胞中,EBV编码的LMP1的表达也已被证明可以通过调节多种信号通路(包括FGF1[17]、AMPK[18]和mTORC1[10])来增强糖酵解,以驱动葡萄糖代谢。LMP1通过上调c-Myc、HIF-1α和FGF2/FGFR1信号的转导,共同诱导丙酮酸激酶M2(PKM2)、丙酮酸脱氢酶激酶同工酶1(PDK1)、乳酸脱氢酶A(LDHA)和己糖激酶2(HK2)的表达[10, 17],导致有氧糖酵解的增强和乳酸的产生;同时LMP1表达还导致线粒体功能障碍,引发线粒体去极化,抑制了葡萄糖的氧化磷酸化过程[19]。
综上所述,鼻咽癌细胞中有氧糖酵解酶的异常表达以及EBV-LMP1引发的多信号通路的异常,有氧糖酵解被激活,从而通过高速率的有氧糖酵解获得大量能量及乳酸代谢产物。
1.3 鼻咽癌细胞产生的乳酸通过单羧酸转运蛋白转运单羧酸转运蛋白(MCTs)是一类质子偶联跨膜蛋白,催化单羧酸盐的跨膜运动。鼻咽癌细胞进行高速率的有氧糖酵解后,产生大量的乳酸代谢产物,这些乳酸代谢产物通过MCTs,尤其是MCT4被转运到细胞外。
肿瘤组织内部也会形成一个“代谢共生”的关系,即由MCT1和MCT4介导形成乳酸穿梭系统[20]。肿瘤组织内各部分的氧含量并不相同,在相对缺氧的区域,肿瘤细胞进行有氧糖酵解产生的乳酸更多,这些乳酸被MCT4排出到细胞外环境中,而相对含氧区域的肿瘤细胞可以通过MCT1将这些乳酸转运进细胞内,在有氧存在的情况下,将其作为TCA循环的燃料彻底氧化分解以产生能量。MCT1在鼻咽癌中过表达,其可能通过人鼻咽癌细胞中的PI3K/Akt信号通路促进了侵袭和迁移[21]。
1.4 有氧糖酵解促进鼻咽癌的侵袭转移已有研究证明,许多有氧糖酵解相关酶都和鼻咽癌的侵袭转移相关。有氧糖酵解第一阶段的第一个关键酶是HK2,HK2抑制剂3-BrPA的使用能有效抑制鼻咽癌细胞在体外的非贴壁生长以及体内肿瘤发生[12]。3-BrOP(另一种HK2抑制剂)可诱导鼻咽癌G1阶段细胞凋亡和细胞周期停滞,从而导致细胞增殖和侵袭能力的减弱[22]。第二个关键酶PFK1的表达与肿瘤增殖和侵袭能力呈正相关,沉默PFK1基因可以显著促进凋亡作用,抑制鼻咽癌CNE-2细胞的增殖、侵袭和迁移[14]。第三个关键酶PKM2可通过激活EGFR刺激的PKM2核转位从而促进鼻咽癌细胞侵袭转移[23];而DNA去甲基化酶TET2(ten-eleven translocation protein 2, TET2)可以阻断PKM核易位过程,从而抑制鼻咽癌细胞的糖酵解、增殖和侵袭转移[13, 24]。
抑制有氧糖酵解第二阶段关键酶LDH的表达可通过下调CDK1/cyclinB1通路诱导G2/M细胞周期阻滞,从而通过增加线粒体ROS生成促进细胞凋亡[25]、抑制鼻咽癌细胞的侵袭转移能力。另外,EBV-LMP1介导的FGF2/FGFR1激活有助于有氧糖酵解和上皮细胞间充质化,其诱导的FGFR1信号的转导也促进了细胞迁移和侵袭能力[17]。
有氧糖酵解对鼻咽癌侵袭转移的促进离不开乳酸的作用。高浓度乳酸与远处转移癌的发展密切相关。已有研究证明其可以通过促进肿瘤血管生成、癌细胞的侵袭及转移能力从而促进转移癌的发生[20, 26]。有氧糖酵解生成的乳酸被MCTs转运到细胞外环境,形成酸性TME,使得大量生长因子、细胞趋化因子和各种蛋白水解酶所产生的免疫炎性反应在TME中高度活跃,导致免疫抑制和肿瘤的免疫逃逸。在酸性微环境下,肿瘤细胞侵袭和转移相关的基因表达明显增强。Rohani等对生理pH和低pH条件下培养的肿瘤细胞进行转录组测序,结果发现低pH环境下有2 752个基因表现出活性变化,其中近300个基因发生RNA剪接和基因组装的改变,这些改变大部分有助于侵袭和转移分子的表达。外显子评估及基因集富集分析(GSEA)显示,TME的低pH值可以触发RNA剪接介导的细胞骨架机制的变化,这可能是其诱导细胞侵袭的重要原因[27]。另外,酸性的TME会促使上皮细胞失去极性和细胞间黏附,从而诱导其间充质化并造成细胞侵袭和迁移能力增强;同时酸性TME也将促进细胞外基质的降解从而利于脱落的癌细胞播散[28]。总之,有氧糖酵解通过产生乳酸及形成酸性的肿瘤微环境促进了鼻咽癌细胞的侵袭转移。
2 鼻咽癌细胞有氧氧化途径 2.1 鼻咽癌细胞中葡萄糖的有氧氧化被抑制尽管大部分葡萄糖被肿瘤细胞通过有氧糖酵解的方式代谢,但仍有部分葡萄糖在被转化为丙酮酸后进入线粒体内继续进行有氧氧化。相较于正常细胞,鼻咽癌细胞的有氧氧化在很大程度上受到抑制。
在葡萄糖有氧氧化的第二阶段,丙酮酸生成后被转运到线粒体,在丙酮酸脱氢酶复合体(PDHC)的催化下氧化脱羧生成乙酰辅酶A(CoA)。丙酮酸脱氢酶B(PDHB)是PDHC的成员之一,在鼻咽癌细胞中表达下调,从而抑制了丙酮酸向乙酰辅酶A的转化[29]。另外,丙酮酸脱氢酶(PDH)的活性还受到丙酮酸脱氢酶激酶同工酶(PDK)的调控。PDK1位于线粒体,可以使PDH在丝氨酸293处磷酸化失活。PDK1在鼻咽癌中过表达,进一步抑制了葡萄糖有氧氧化的第二阶段,与鼻咽癌预后不良有关[30]。
葡萄糖有氧氧化的第三阶段,乙酰辅酶A进入三羧酸循环(TCA),生成大量ATP,这一过程涉及多种酶及酶复合体,其中三种最重要的限速酶分别是柠檬酸合成酶(CS)、异柠檬酸脱氢酶(IDH)和α-酮戊二酸脱氢酶复合体(α-KGDH)。生理情况下,IDH2催化异柠檬酸转化为α-酮戊二酸(α-KG),但在病理情况下,IDH2的过度表达或突变都会导致异常生成2-羟基戊二酸(2-HG),它们的积累量有所不同,野生型IDH2表达上调会导致2-HG水平显著增加,但2-HG的积累量不如IDH2突变,后者可导致2-HG水平超过正常组织百倍之多。研究发现EBV-LMP1可通过c-Myc介导野生型IDH2在鼻咽癌组织中过表达,其消耗细胞内α-KG并产生通过野生型IDH2介导的2-HG[31]。此外,在未分化型鼻咽癌细胞中,IDH2发生显著突变,产生大量的2-HG积累,而α-KG水平大大降低[32],导致进入TCA循环的α-KG大幅减少,因此可以推断IDH2通过介导2-HG的异常生成抑制了有氧氧化过程。
2.2 有氧氧化抑制鼻咽癌细胞的侵袭转移葡萄糖的有氧氧化会促进肿瘤细胞的凋亡,抑制肿瘤生长;同时氧化过程中没有乳酸的生成。鉴于乳酸对鼻咽癌侵袭转移的促进作用,因此有氧氧化不利于肿瘤组织的侵袭转移。研究发现,在鼻咽癌细胞中过表达有氧氧化关键酶之一的PDHB后可以通过促进有氧氧化从而抑制鼻咽癌细胞的侵袭转移,反之敲低PDHB表达可以促进鼻咽癌细胞发生侵袭转移[29]。
上述研究表明,在鼻咽癌细胞中,有氧氧化酶的表达被抑制。研究发现,鼻咽癌细胞中有氧氧化的抑制性酶表达上调。抑制PDH活性的PDK1在原发性鼻咽癌中过表达,并与患者预后不良、临床分期和转移密切相关,而如果下调PDK1的表达则可以抑制鼻咽癌细胞的增殖和侵袭转移[33]。
此外,部分鼻咽癌中有氧氧化酶发生突变,共同抑制了正常的有氧氧化过程。由EBV-LMP1介导或突变型IDH2催化产生的2-HG与侵袭转移密切相关,2-HG水平与鼻咽癌区域淋巴结转移呈显著正相关[31]。2-HG还可以增加肿瘤血管生成,这是肿瘤转移的关键步骤[34]。总之,在鼻咽癌细胞中,有氧氧化过程被抑制,而利于转移的分子数量增多,最终促进了癌细胞的侵袭转移发生。
3 鼻咽癌细胞磷酸戊糖途径磷酸戊糖途径(PPP)是另一个葡萄糖的分解代谢途径,它可以调节细胞氧化还原稳态,促进脂肪酸、胆固醇及核苷酸等物质的生物合成。在该途径中,葡萄糖被HK2催化为葡萄糖-6-磷酸后,在细胞质中经过氧化和非氧化两个阶段,生成核糖-5-磷酸(R5P)和大量还原型辅酶Ⅱ(NADPH)[35]。R5P可以用于核苷酸的生物合成,对DNA修复及复制有重要意义,而NADPH则是一种关键的细胞内还原剂,是脂肪酸合成和活性氧清除过程中必需的。
PPP中氧化阶段的限速酶是葡萄糖-6-磷酸脱氢酶(G6PD)。肿瘤细胞中这种酶的表达相对正常细胞处于较高水平。在EBV感染的鼻咽癌细胞中,G6PD水平可以被EBV-miR-BART1上调[36],促癌信号通路(如PI3K/Akt、Ras和Src)的过度激活也可能通过翻译后机制促进G6PD激活并增强磷酸戊糖途径糖代谢[37]。此外,研究发现,转酮醇样酶1(TKTL1)在戊糖磷酸途径中也起重要作用,敲低TKTL1后引起PPP下调,鼻咽癌细胞的抗毒性出现明显降低[38]。
磷酸戊糖途径对癌细胞尤为重要,因为它不仅产生戊糖磷酸盐以提供高核酸合成率,而且还提供NADPH,这不但是脂肪酸合成所需的,更是细胞在应激条件下存活所必需的[37]。NADPH可以维持体内谷胱甘肽和其他ROS清除剂的氧化还原稳态,对抗应激状态下细胞内活性氧的产生[39]。在实体瘤发展的初始阶段,细胞会产生由基质附着丧失而造成的代谢缺陷,肿瘤细胞不能利用葡萄糖并承受能量应激,可能会在实体瘤形成过程中死亡;在转移过程中,当癌细胞从原发肿瘤部位分离并迁移到转移部位形成微转移灶时,它们也可能经历类似的能量应激。但是磷酸戊糖途径产生的大量NADPH,可以对抗能量应激过程中的活性氧,从而增强转移细胞的存活能力,促进肿瘤的转移过程。Guo等研究发现G6PD的表达可以显著促进鼻咽癌的侵袭转移能力,而miR-206可以通过负调控G6PD表达从而抑制鼻咽癌细胞的增殖、迁移和侵袭能力[40]。
4 小结与展望在鼻咽癌细胞中,葡萄糖代谢的速率和方向受多种途径调控并会发生很大程度的改变,在产生能量供癌细胞生长、增殖的同时,也会产生许多相关分子促进鼻咽癌细胞的侵袭与转移,见图 1。这些糖代谢的改变与鼻咽癌的发展及预后息息相关。同时,这些糖代谢的改变为鼻咽癌的靶向治疗提供了新的机会,对于改善鼻咽癌的预后具有重要意义。未来随着葡萄糖代谢与鼻咽癌侵袭转移关系相关研究的不断完善,更多异常表达的糖代谢相关酶及其影响鼻咽癌侵袭转移能力的通路将被一一揭晓,潜在靶点也会越来越丰富,在此基础上的干预策略及联合治疗策略将为大幅提高鼻咽癌的预后提供更大的可能性。
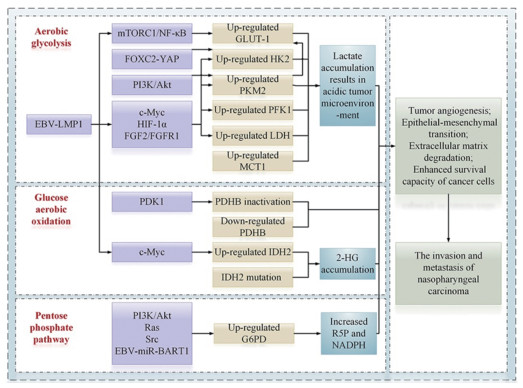
|
| EBV: Epstein−Barr virus; mTORC1: mechanistic target of rapamycin complex 1; NF-κB: nuclear factor κB; FOXC2: forkhead box protein C2; YAP: Yes-associated protein; PI3K: phosphoinositide 3-kinase; Akt: protein kinase B; HIF-1α: hypoxia-inducible factor 1α; FGF2: fibroblast growth factor 2; FGFR1: fibroblast growth factor receptor 1; PDK1: 3-phosphoinositide-dependent kinase 1; BART1: BamHI-A rightward transcript 1; GLUT-1: glucose transporter protein 1; HK2: hexokinase-Ⅱ; PKM2: pyruvate kinase M2; PFK1: phosphofructokinase 1; LDH: lactate dehydrogenase; MCT1: monocarboxylate transporters 1; PDHB: pyruvate dehydrogenase B; IDH2: isocitrate dehydrogenase 2; G6PD: glucose-6-phosphate dehydrogenase; TME: tumour microenvironment; 2-HG: 2-hydroxyglutarate; R5P: ribose 5-phosphate; NADPH: nicotinamide adenine dinucleotide phosphate 图 1 鼻咽癌细胞中异常的葡萄糖代谢机制及其与细胞侵袭转移的关系 Figure 1 Aberrant glucose metabolism mechanism of nasopharyngeal carcinoma cells and its relationship with cell invasion and metastasis |
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
王雨菲:文献查阅、论文撰写
续 珊:信号通路分析及绘图
邹 游:论文审校
陈始明:设计项目、论文审校
| [1] |
Bossi P, Chan AT, Licitra L, et al. Nasopharyngeal carcinoma: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2021, 32(4): 452-465. DOI:10.1016/j.annonc.2020.12.007 |
| [2] |
Tang LL, Chen YP, Chen CB, et al. The Chinese Society of Clinical Oncology (CSCO) clinical guidelines for the diagnosis and treatment of nasopharyngeal carcinoma[J]. Cancer Commun (Lond), 2021, 41(11): 1195-1227. DOI:10.1002/cac2.12218 |
| [3] |
Cheng GZ, Zhang W, Wang LH. Regulation of cancer cell survival, migration, and invasion by Twist: AKT2 comes to interplay[J]. Cancer Res, 2008, 68(4): 957-960. DOI:10.1158/0008-5472.CAN-07-5067 |
| [4] |
Pascale RM, Calvisi DF, Simile MM, et al. The Warburg Effect 97 Years after Its Discovery[J]. Cancers (Basel), 2020, 12(10): 2819. DOI:10.3390/cancers12102819 |
| [5] |
Macheda ML, Rogers S, Best JD. Molecular and cellular regulation of glucose transporter (GLUT) proteins in cancer[J]. J Cell Physiol, 2005, 202(3): 654-662. DOI:10.1002/jcp.20166 |
| [6] |
Zschaeck S, Li Y, Lin Q, et al. Prognostic value of baseline [18F]-fluorodeoxyglucose positron emission tomography parameters MTV, TLG and asphericity in an international multicenter cohort of nasopharyngeal carcinoma patients[J]. PLoS One, 2020, 15(7): e0236841. DOI:10.1371/journal.pone.0236841 |
| [7] |
Gu B, Liu S, Sun Y, et al. Predictive Value of [18F]ML-10 PET/CT in Early Response Evaluation of Combination Radiotherapy with Cetuximab on Nasopharyngeal Carcinoma[J]. Mol Imaging Biol, 2019, 21(3): 538-548. DOI:10.1007/s11307-018-1277-9 |
| [8] |
Zhou JC, Zhang JJ, Zhang W, et al. Expression of GLUT-1 in nasopharyngeal carcinoma and its clinical significance[J]. Eur Rev Med Pharmacol Sci, 2017, 21(21): 4891-4895. |
| [9] |
Pelicano H, Martin DS, Xu RH, et al. Glycolysis inhibition for anticancer treatment[J]. Oncogene, 2006, 25(34): 4633-4646. DOI:10.1038/sj.onc.1209597 |
| [10] |
Zhang J, Jia L, Lin W, et al. Epstein-Barr Virus-Encoded Latent Membrane Protein 1 Upregulates Glucose Transporter 1 Transcription via the mTORC1/NF-κB Signaling Pathways[J]. J Virol, 2017, 91(6): e02168-16. |
| [11] |
Zhao P, Zhou M, Chen R, et al. Suppressed "Warburg Effect" in Nasopharyngeal Carcinoma Via the Inhibition of Pyruvate Kinase Type M2-Mediated Energy Generation Pathway[J]. Technol Cancer Res Treat, 2020, 19: 1533033820945804. |
| [12] |
Song L, Tang H, Liao W, et al. FOXC2 positively regulates YAP signaling and promotes the glycolysis of nasopharyngeal carcinoma[J]. Exp Cell Res, 2017, 357(1): 17-24. DOI:10.1016/j.yexcr.2017.04.019 |
| [13] |
Zhang J, Zhou J, Xiao S. Shikonin inhibits growth, invasion and glycolysis of nasopharyngeal carcinoma cells through inactivating the phosphatidylinositol 3 kinase/AKT signal pathway[J]. Anticancer Drugs, 2020, 31(9): 932-941. DOI:10.1097/CAD.0000000000000920 |
| [14] |
Li S, He P, Wang Z, et al. RNAi-mediated knockdown of PFK1 decreases the invasive capability and metastasis of nasopharyngeal carcinoma cell line, CNE-2[J]. Cell Cycle, 2021, 20(2): 154-165. DOI:10.1080/15384101.2020.1866279 |
| [15] |
Zhou GQ, Tang LL, Mao YP, et al. Baseline serum lactate dehydrogenase levels for patients treated with intensity-modulated radiotherapy for nasopharyngeal carcinoma: a predictor of poor prognosis and subsequent liver metastasis[J]. Int J Radiat Oncol Biol Phys, 2012, 82(3): e359-e365. DOI:10.1016/j.ijrobp.2011.06.1967 |
| [16] |
Wan XB, Wei L, Li H, et al. High pretreatment serum lactate dehydrogenase level correlates with disease relapse and predicts an inferior outcome in locally advanced nasopharyngeal carcinoma[J]. Eur J Cancer, 2013, 49(10): 2356-2364. DOI:10.1016/j.ejca.2013.03.008 |
| [17] |
Lo AK, Dawson CW, Young LS, et al. Activation of the FGFR1 signalling pathway by the Epstein-Barr virus-encoded LMP1 promotes aerobic glycolysis and transformation of human nasopharyngeal epithelial cells[J]. J Pathol, 2015, 237(2): 238-248. DOI:10.1002/path.4575 |
| [18] |
Lu J, Tang M, Li H, et al. EBV-LMP1 suppresses the DNA damage response through DNA-PK/AMPK signaling to promote radioresistance in nasopharyngeal carcinoma[J]. Cancer Lett, 2016, 380(1): 191-200. DOI:10.1016/j.canlet.2016.05.032 |
| [19] |
Sung WW, Chen PR, Liao MH, et al. Enhanced aerobic glycolysis of nasopharyngeal carcinoma cells by Epstein-Barr virus latent membrane protein 1[J]. Exp Cell Res, 2017, 359(1): 94-100. DOI:10.1016/j.yexcr.2017.08.005 |
| [20] |
Pisarsky L, Bill R, Fagiani E, et al. Targeting Metabolic Symbiosis to Overcome Resistance to Anti-angiogenic Therapy[J]. Cell Rep, 2016, 15(6): 1161-1174. DOI:10.1016/j.celrep.2016.04.028 |
| [21] |
Zhang P, Ma J, Gao J, et al. Downregulation of monocarboxylate transporter 1 inhibits the invasion and migration through suppression of the PI3K/Akt signaling pathway in human nasopharyngeal carcinoma cells[J]. J Bioenerg Biomembr, 2018, 50(4): 271-281. DOI:10.1007/s10863-018-9763-y |
| [22] |
Zhang MX, Hua YJ, Wang HY, et al. Long-term prognostic implications and therapeutic target role of hexokinaseⅡ in patients with nasopharyngeal carcinoma[J]. Oncotarget, 2016, 7(16): 21287-21297. DOI:10.18632/oncotarget.7116 |
| [23] |
Chen S, Youhong T, Tan Y, et al. EGFR-PKM2 signaling promotes the metastatic potential of nasopharyngeal carcinoma through induction of FOSL1 and ANTXR2[J]. Carcinogenesis, 2020, 41(6): 723-733. DOI:10.1093/carcin/bgz180 |
| [24] |
Zhang X, Yang J, Shi D, et al. TET2 suppresses nasopharyngeal carcinoma progression by inhibiting glycolysis metabolism[J]. Cancer Cell Int, 2020, 20: 363. DOI:10.1186/s12935-020-01456-9 |
| [25] |
Zhai X, Yang Y, Wan J, et al. Inhibition of LDH-A by oxamate induces G2/M arrest, apoptosis and increases radiosensitivity in nasopharyngeal carcinoma cells[J]. Oncol Rep, 2013, 30(6): 2983-2991. DOI:10.3892/or.2013.2735 |
| [26] |
Justus CR, Dong L, Yang LV. Acidic tumor microenvironment and pH-sensing G protein-coupled receptors[J]. Front Physiol, 2013, 4: 354. |
| [27] |
Rohani N, Hao L, Alexis MS, et al. Acidification of Tumor at Stromal Boundaries Drives Transcriptome Alterations Associated with Aggressive Phenotypes[J]. Cancer Res, 2019, 79(8): 1952-1966. DOI:10.1158/0008-5472.CAN-18-1604 |
| [28] |
Boedtkjer E, Pedersen SF. The Acidic Tumor Microenvironment as a Driver of Cancer[J]. Ann Rev Physiol, 2020, 82: 103-126. DOI:10.1146/annurev-physiol-021119-034627 |
| [29] |
Tang H, Luo X, Li J, et al. Pyruvate dehydrogenase B promoted the growth and migration of the nasopharyngeal carcinoma cells[J]. Tumour Biol, 2016, 37(8): 10563-10569. DOI:10.1007/s13277-016-4922-4 |
| [30] |
Zhang W, Li L, Guo E, et al. Inhibition of PDK1 enhances radiosensitivity and reverses epithelial-mesenchymal transition in nasopharyngeal carcinoma[J]. Head Neck, 2022, 44(7): 1576-1587. DOI:10.1002/hed.27053 |
| [31] |
Shi F, He Y, Li J, et al. Wild-type IDH2 contributes to Epstein-Barr virus-dependent metabolic alterations and tumorigenesis[J]. Mol Metab, 2020, 36: 100966. DOI:10.1016/j.molmet.2020.02.009 |
| [32] |
Ali SM, Yao M, Yao J, et al. Comprehensive genomic profiling of different subtypes of nasopharyngeal carcinoma reveals similarities and differences to guide targeted therapy[J]. Cancer, 2017, 123(18): 3628-3637. DOI:10.1002/cncr.30781 |
| [33] |
Jia-Yuan X, Wei S, Fang-Fang L, et al. miR-375 Inhibits the Proliferation and Invasion of Nasopharyngeal Carcinoma Cells by Suppressing PDK1[J]. BioMed Res Int, 2020, 2020: 9704245. |
| [34] |
Seok J, Yoon SH, Lee SH, et al. The oncometabolite d-2-hydroxyglutarate induces angiogenic activity through the vascular endothelial growth factor receptor 2 signaling pathway[J]. Int J Oncol, 2019, 54(2): 753-763. |
| [35] |
Ge T, Yang J, Zhou S, et al. The Role of the Pentose Phosphate Pathway in Diabetes and Cancer[J]. Front Endocrinol (Lausanne), 2020, 11: 365. DOI:10.3389/fendo.2020.00365 |
| [36] |
Ye Y, Zhou Y, Zhang L, et al. EBV-miR-BART1 is involved in regulating metabolism-associated genes in nasopharyngeal carcinoma[J]. Biochem Biophys Res Commun, 2013, 436(1): 19-24. DOI:10.1016/j.bbrc.2013.05.008 |
| [37] |
Patra KC, Hay N. The pentose phosphate pathway and cancer[J]. Trends Biochem Sci, 2014, 39(8): 347-354. DOI:10.1016/j.tibs.2014.06.005 |
| [38] |
Dong Y, Wang M. Knockdown of TKTL1 additively complements cisplatin-induced cytotoxicity in nasopharyngeal carcinoma cells by regulating the levels of NADPH and ribose-5-phosphate[J]. Biomed Pharmacother, 2017, 85: 672-678. DOI:10.1016/j.biopha.2016.11.078 |
| [39] |
Traverso N, Ricciarelli R, Nitti M, et al. Role of glutathione in cancer progression and chemoresistance[J]. Oxid Med Cell Longev, 2013, 2013: 972913. |
| [40] |
Guo Q, Ren XH, Zhao CP, et al. MicroRNA-206 inhibits tumor metastasis of nasopharyngeal carcinoma through targeting G6PD[J]. J Biol Regul Homeost Agents, 2020, 34(2). Online ahead of print.
|
 2023, Vol. 50
2023, Vol. 50


