文章信息
- 四种肺癌预测模型对体检人群孤立性肺结节预测效能的比较
- Evaluation of Four Predictive Models for Identifying Malignancy of Solitary Pulmonary Nodules in Health Check-up Population
- 肿瘤防治研究, 2023, 50(5): 477-482
- Cancer Research on Prevention and Treatment, 2023, 50(5): 477-482
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1209
- 收稿日期: 2022-10-14
- 修回日期: 2023-02-12
我国肺癌的发病率和死亡率均位于所有恶性肿瘤之首[1]。美国肺癌筛查试验(NLST)研究提出低剂量螺旋CT(LDCT)相比胸部X片可以降低20%肺癌死亡率[2]。随着LDCT在肺癌早筛中的广泛应用,肺结节检出率呈逐年上升趋势。据研究显示:健康体检人群中肺结节的检出率可达20.65%~26.8%[3-4]。孤立性肺结节(solitary pulmonary nodules, SPN)被视为肺癌早期最常见的影像学征象,但也可能是结核球、错构瘤、炎性假瘤、腺瘤样改变等良性病变,相关研究显示SPN的恶性概率为10%~20%[5],高假阳性率常导致患者焦虑、不必要的辐射暴露、经肺穿刺活检及胸外科手术等不良事件[6],因此,肺癌早筛及SPN健康管理仍面临巨大挑战。
肺癌风险预测模型可定量评估肺结节的良恶性概率,可提高肺结节健康管理效率。吕章艳等[7]研究显示,肺癌风险预测模型共27个,但多数模型未进行有效外部验证,模型的外推性仍待商榷。用于SPN风险评估的经典肺癌预测模型,如Mayo模型、VA模型、北大模型(PKUPH)、Brock模型等预测效果在多个外部人群中得到了充分验证,但多以临床病例对照研究为主,以健康体检人群前瞻性队列研究较少,且研究结论仍存在一定争议[8-10]。本研究以健康体检人群作为研究对象,评价Mayo、VA、PKUPH及Brock四个肺癌预测模型对健康体检人群中SPN的预测效能,为健康体检人群SPN风险评估与健康管理提供参考依据。
1 资料与方法 1.1 研究对象纳入2018年6月—2019年6月经低剂量螺旋CT初次诊断为肺结节的479例受检者作为研究对象。纳入标准:(1)肺结节直径为(4~30)mm;(2)孤立性肺结节;(3)自愿签写知情同意书,愿意参加问卷调查;(4)追踪随访到肺结节结局。排除标准:(1)有严重基础性疾病患者;(2)明显的钙化结节;(3)5年内患过恶性肿瘤者;(4)结局追踪失访或结局无法判定者。本研究得到重庆市人民医院伦理委员会批准。
1.2 CT扫描参数采用螺旋CT容积扫描技术,依据受试者体重,管电压采用120~140 KVp;管电流 < 50 mAs。总辐射暴露剂量≤2 mSv。扫描后原始数据行薄层重建,重建层厚为(0.625~1.25)mm。为方便进行计算机辅助检测及容积分析,建议层间有20%~30%重叠。将薄层图像进行三维重建,采用最大密度投影(maximum intensify projection, MIP)重建,结合肺结节人工智能辅助诊断阅片。
1.3 肺癌风险预测模型1997年Mayo模型[11],计算公式:Y=ex/(1+ex),X=-6.8272+(0.0391×年龄)+(0.7917×吸烟)+(1.3388×肿瘤史)+(0.1274×直径)+(1.0407×毛刺)+(0.7838×上叶)。
2005年海军模型(VA模型)[12],计算公式:Y=ex/(1+ex),X=-8.404+(2.061×吸烟史)+(0.779×年龄/10)+(0.112×直径) −(0.567×戒烟年数/10)。
2011年北京大学模型(PKUPH模型)[13],计算公式:Y=ex/(1+ex),X=-4.496+(0.07×年龄)+(1.267×恶性肿瘤家族史)+(0.676×直径)+(0.736×毛刺)-(1.615×钙化)-(1.408×边界)。
2013年Brock模型[14],计算公式:Y=ex/(1+ex),X=-6.7892+(0.0287×年龄)+(0.6011×性别)+(0.2961×肺癌家族史)+(0.2953×肺气肿)-(5.3854×直径)-(0.1276×磨玻璃密度)/+(0.3770×混合型)+(0.6581×上叶)-(0.0824×结节数量)+(0.7729×毛刺)。
1.4 随访及结局事件采用电话、短信等方式前瞻性追踪结局事件,随访时间为3年及以上。恶性肿瘤的判断标准:通过外科手术、经肺穿刺病理诊断为恶性者。良性结节的诊断标准:经肺穿刺、外科手术等病理诊断为良性,或随访满3年结节无变化、缩小或消失者,且边界清楚、无恶性肿瘤征象、无家族恶性肿瘤病史、无恶性肿瘤病史、肺癌肿瘤标志物无异常等。
1.5 统计学方法数据统计分析采用SPSS23.0软件。以肺结节结局为分组变量,符合正态分布计量资料以均数±标准差(x±s)进行统计描述,组间比较采用独立样本t检验;非正态分布资料以中位数M(P25, P75)进行统计描述,组间比较采用非参数检验;分类变量以频数和构成比进行统计描述,组间比较采用χ2检验或Fisher精确检验。风险预测模型的比较通过受试者工作特征(ROC)曲线计算曲线下面积(AUC),确定最佳截断值,并计算各预测模型的灵敏度、特异度、约登指数、阳性似然比、阴性似然比、阳性预测值和阴性预测值等。检验水准α=0.05。
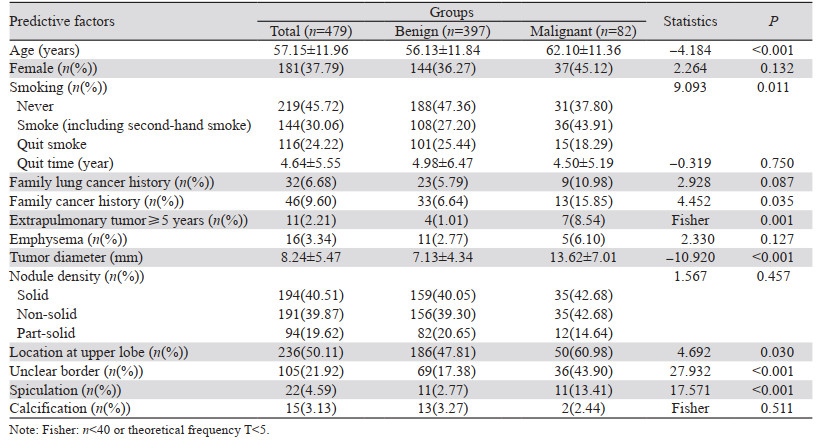
2 结果 2.1 影像学特征及临床特征分析756例肺结节患者被纳入,因信息资料不全131例肺结节患者被排除;因散发结节135例肺结节患者被排除;11例结局无法判定被排除。最终,本研究纳入479例孤立性肺结节,其恶性概率为17.12%。单因素分析结果显示,恶性肿瘤组平均年龄、吸烟率(包括二手烟)、恶性肿瘤家族史、肺外肿瘤5年及以上比例、结节直径、结节位于上叶、边界不清及毛刺比例高于良性结节组(均P < 0.05)。性别、肺癌家族史、肺气肿、戒烟率、戒烟时间、结节密度、钙化两组间比较差异无统计学意义,见表 1。
|
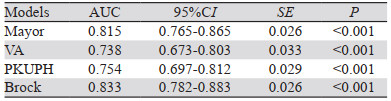
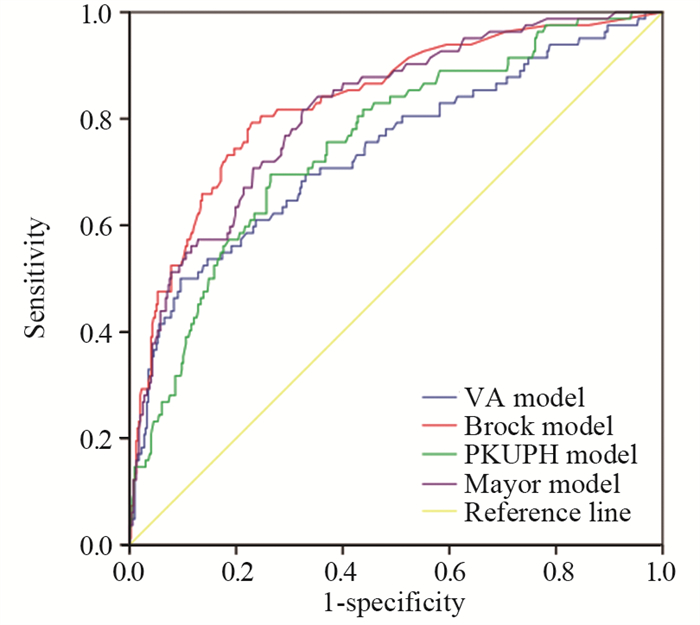
曲线下面积(AUC):Brock模型最大AUC=0.833, 95%CI: 0.782~0.883,其次为Mayor模型,VA模型最小(P < 0.001),见表 2、图 1。
|
| 图 1 四种肺癌预测模型的ROC曲线 Figure 1 ROC curve of four predictive model for SPN |
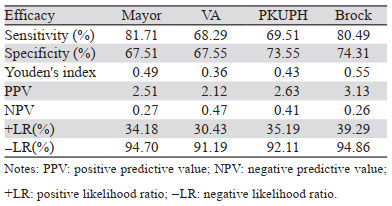
灵敏度与特异度:Mayor模型灵敏度最高,为81.71%,其次为Brock模型,VA模型灵敏度最低;Brock模型特异度最高74.31%,其次为PKUPH模型,Mayor模型特异度最差。约登指数:Brock模型最高为0.55,其次为Mayor模型,VA模型最低。阳性似然比与阴性似然比:Brock模型阳性似然比最高为3.13,其次为PKUPH模型,VA模型最低;Brock模型阴性似然比最低为0.26,其次为Mayor模型,VA模型最高。阳性预测值与阴性预测值:Brock模型阳性预测值最高为39.29%,其次为PKUPH模型,VA模型最低;Brock模型阴性预测值最高为94.86%,其次为Mayor模型,VA模型最低,见表 3。
肺癌风险预测模型是基于肺癌风险因素构建的数理模型,因此,风险预测因子是肺癌预测模型的基础。年龄、性别、吸烟、恶性肿瘤家族史、恶性肿瘤病史、结节直径、上叶位置、边界不清、毛刺已被相关研究证明是SPN的独立危险因素[15-16]。本研究结果显示,年龄、吸烟、恶性肿瘤家族史、肺外肿瘤5年及以上、结节位于上叶、边界、毛刺等因素是肺癌的风险因素,这与以上研究结果一致。性别、肺癌家族史、结节密度、钙化及戒烟等在本研究尚不能证明是肺癌的风险因素。Brock模型将女性作为SPN一个独立危险因素,这可能与女性血浆对尼古丁清除能力较差与EGFR在女性的突变频率高于男性,促使肺癌的发生有关[17-18]。Maldonado等[19]研究结果显示女性与肺癌发病风险无关。丹麦肺癌筛查试验研究显示:性别女性是肺癌的一个保护因素[20]。本研究中女性吸烟率仅为1.1%,二手烟吸烟率也仅为27.1%,不能证明女性是肺癌的风险因素可能与本研究女性吸烟率较低有关。尽管恶性肿瘤与良性结节组间肺癌家族史差异无统计学意义,但是恶性肿瘤组肺癌家族史比率高于良性结节组(10.98% vs. 5.79%)。有研究显示,混合密度结节恶性程度最高[21],提示结节密度可作为Brock模型的风险预测因子。Lung-RADS、Fleischner指南、ACCP指南、NCCN指南、亚洲指南和中国专家共识均将结节密度作为风险分层的重要因素。本研究实性结节(solid nodule, SN)、磨玻璃结节(non-solid nodule, NSN)、混合密度结节(part-solid nodule, PSN)恶性概率分别为18.04%、18.32%和12.77%,不同密度结节恶性概率差异无统计学意义。这可能与纳入的混合密度结节平均直径相对较低有关(SN vs. NSN vs. PSN直径:10.14 vs. 7.40 vs. 6.04 mm)。丁晓娟等[22]研究结果显示,PSN浸润性腺癌比例高于NSN,PSN浸润前腺癌比例低于NSN,PSN和NSN微浸润腺癌比例差异无统计学意义。因此,结节密度是否作为肺癌风险因素仍存在争议。有研究显示,结节中的钙化分布及钙化特征良恶性存在差异[23-24],提示PKUPH模型可将钙化作为肺癌风险的保护因素。本研究结节钙化两组间差异无统计学意义,可能与排除明显的钙化结节且未对结节钙化分布与特征加以鉴别有关。戒烟被VA模型作为肺癌的一个保护因素,本研究不能证明戒烟是肺癌的保护因素可能与本研究人群戒烟率较低(26%)与平均戒烟时间较短(4.5年)有关。
肺癌预测模型是基于研究人群数据构建的数学模型,其外部推广均存在局限,特别受到模型开发和验证的数据集限制。本研究结果显示,Brock模型对SPN良恶性预测效能最好AUC=0.833, 其次是Mayo模型AUC=0.815,PKUPH模型AUC=0.754,VA模型最差AUC=0.738,这与目前大部分研究结果一致[25-29]。武汉市中心医院研究显示,PKUPH模型优于Brock模型[30];中山大学癌症研究中心研究显示,北大模型优于Mayo模型[31]。这两项研究均是基于临床病例的回顾性研究,结节恶性概率分别为85.7%和64.1%。Brock模型是基于肺癌筛查人群构建的预测模型,模型开发数据集结节恶性概率为5.5%[14],PKUPH模型、Mayo模型及VA模型的开发数据集恶性概率分别为53%、23%和54%[11-13]。本研究是基于健康体检人群,研究人群更接近于Brock模型。本研究SPN的恶性概率(17.1%)相对较高,一方面,可能与本研究以上报异常值中的肺结节为主有关,研究同期间CT检查总例数为9 846,检出肺结节3 500余例,总的恶性概率约为2.34%;另一方面,可能与民众对磨玻璃结节过度恐慌导致过度诊疗有关,本研究原位癌共17例。此外,重庆特有的湿冷气候导致肺部疾病患病率较高,如本研究人群60岁以上老年人肺气肿患病率达17.77%。
此外,尽管总体上Brock模型预测效能最好,然而Mayor模型的灵敏度最高,PKUPH模型的特异度优于Mayor模型。肺癌风险预测模型是基于肺癌风险因素构建的数理模型,外推性均受限于模型构建的研究设计、研究人群等因素影响。由此提出假设:联合Brock、Mayor和PKUPH三种肺癌预测模型对肺结节良恶性进行综合评估是否可以弥补各预测模型的局限,进一步提高预测效能,仍需进一步研究。
本研究以健康体检人群前瞻性队列研究,比较分析了用于SPN风险评估的四种经典肺癌预测模型的预测效能,为健康体检人群SPN风险评估提供了一定的参考依据。随着肺结节的检出率上升,大众对肺结节越来越恐慌,低年龄人群做低剂量胸部CT越来越多。本研究发现,结合肺结节影像学特征和患者临床特征的肺癌预测模型比仅凭肺结节影像学特征对肺结节风险评估更客观准确,如患者X,女,37岁,右肺下叶有一混合密度结节,直径11 mm,形态较不规则,边界清楚,无吸烟习惯,无二手烟暴露,家族无肺癌病史,无肺结核等肺部疾病史。仅从影像学特征评价为高危结节,经Brock、Mayo、PKUPH和VA分别评估为高危、低危、低危,低危。因此,建议短期复查无变化,经三年随访观察结节仍无变化。同时,本研究仍存在局限,一方面,部分指南提出亚实性结节应随访5年,但由于课题研究时间的限制,本研究以随访满三年结节无变化作为良性结局存在一定的不足。本研究判定亚实性结节为良性结节,除了随访3年结节无变化外,还要求边界清楚、无肿瘤征象、无家族恶性肿瘤病史、无恶性肿瘤病史、肺癌肿瘤标志物无异常等。另一方面,本研究的失访率为17.3%,存在一定的选择偏倚。未来将进一步跟踪随访无变化的亚实性结节的临床结局及扩大样本量。
(致谢: 非常感谢李雪霖教授对本文内容的审阅,同时也非常感谢代杰、龚静、贺玲、刘欣、刘洋、聂周、孙娟、唐海玲、唐晓梅、王斯思、殷裕芳等对本研究数据收集的辛勤付出。)
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
刘雪娇:论文构思、数据资料收集及统计分析、论文撰写
李斌:论文构思、科研项目主持人、论文审核
李艳:论文构思、数据资料收集、论文修改
陈思:论文构思、数据资料收集
李必强:论文构思、数据资料收集、论文修改及审核
| [1] |
国家癌症中心. 2022年中国最新癌症报告[R/OL]. (2022-03-23)[2023-02-14]. https://www.cn-healthcare.com/articlewm/20220323/content-1329593.html. [National Cancer Center. Cancer report in China, 2022[R/OL]. (2022-03-23) [2023-02-14]. https://www.cn-healthcare.com/articlewm/20220323/content-1329593.html.]
|
| [2] |
National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409. DOI:10.1056/NEJMoa1102873 |
| [3] |
廖俊蕾, 柳弥. 健康体检人群胸部低剂量螺旋CT检出肺部结节及肺癌情况研究[J]. 临床肺科杂志, 2020, 25(11): 1722-1724, 1728. [Liao JL, Liu M. Analysis of the result of pulmonary nodules and lung cancer detected by low-dose spiral CT in healthy exami-nation people[J]. Lin Chuang Fei Ke Za Zhi, 2020, 25(11): 1722-1724, 1728. DOI:10.3969/j.issn.1009-6663.2020.11.023] |
| [4] |
林丹丹, 吴晓青, 刘婷, 等. 2082例行肺部低剂量高分辨螺旋CT检查的健康体检者结果分析[J]. 中华肺部疾病杂志(电子版), 2020, 13(5): 687-689. [Lin DD, Wu XQ, Liu T, et al. Analysis on lung LDCT examination results of 2082 health check-up cases[J]. Zhonghua Fei Bu Ji Bing Za Zhi (Dian Zi Ban), 2020, 13(5): 687-689. DOI:10.3877/cma.j.issn.1674-6902.2020.05.025] |
| [5] |
Wiener RS, Gould MK, Slatore CG, et al. Resource use and guideline concordance in evaluation of pulmonary nodules for cancer: too much and too little care[J]. JAMA Intern Med, 2014, 174(6): 871-880. DOI:10.1001/jamainternmed.2014.561 |
| [6] |
Bach PB, Mirkin JN, Oliver TK, et al. Benefits and harms of CT screening for lung cancer: a systematic review[J]. JAMA, 2012, 307(22): 2418-2429. DOI:10.1001/jama.2012.5521 |
| [7] |
吕章艳, 谭锋维, 林春青, 等. 肺癌风险预测模型构建与验证的系统综述[J]. 中华预防医学杂志, 2020, 54(4): 430-437. [Lyu ZY, Tan FW, Lin CQ, et al. The development and validation of risk prediction model for lung cancer: a systematic review[J]. Zhonghua Yu Fang Yi Xue Za Zhi, 2020, 54(4): 430-437.] |
| [8] |
冯洋洋, 徐兴祥. 孤立性肺结节诊断模型研究进展[J]. 现代肿瘤医学, 2020, 28(11): 1989-1993. [Feng YY, Xu XX. Advances in diagnosis models of solitary pulmonary nodules[J]. Xian Dai Zhong Liu Yi Xue, 2020, 28(11): 1989-1993. DOI:10.3969/j.issn.1672-4992.2020.11.042] |
| [9] |
王昭珏, 赵静, 王孟昭. 孤立性肺结节恶性概率预测模型的研究进展及临床应用[J]. 中国肺癌杂志, 2021, 24(9): 660-667. [Wang ZJ, Zhao J, Wang MZ. Advances and clinical application of malignant probability prediction models for solitary pulmonary nodule[J]. Zhongguo Fei Ai Za Zhi, 2021, 24(9): 660-667.] |
| [10] |
李梦乾, 张晓梅, 胡家蕊, 等. 孤立性肺结节良恶性预测模型的系统评价[J]. 肿瘤预防与治疗, 2022, 35(4): 318-328. [Li MQ, Zhang XM, Hu JR, et al. Systematic review of predictive models for benign and malignant solitary pulmonary nodules[J]. Zhong Liu Yu Fang Yu Zhi Liao, 2022, 35(4): 318-328.] |
| [11] |
Swensen SJ, Silverstein MD, Ilstrup DM, et al. The Probability of Malignancy in Solitary Pulmonary Nodules. Application to small radiologically indeterminate nodules[J]. Arch Intern Med, 1997, 157(8): 849-855. DOI:10.1001/archinte.1997.00440290031002 |
| [12] |
Gould MK, Ananth L, Barnett PG, et al. A clinical model to estimate the pretest probability of lung cancer in patients with solitary pulmonary nodules[J]. Chest, 2007, 131(2): 383-388. DOI:10.1378/chest.06-1261 |
| [13] |
李运, 陈克终, 隋锡朝, 等. 孤立性肺结节良恶性判断数学预测模型的建立[J]. 北京大学学报, 2011, 43(3): 450-454. [Li Y, Chen KZ, Sui XZ, et al. Establishment of a mathematical prediction model to evaluate the probability of malignancy or benign in patients with solitary pulmonary nodules[J]. Beijing Da Xue Bao, 2011, 43(3): 450-454. DOI:10.3969/j.issn.1671-167X.2011.03.027] |
| [14] |
McWilliams A, Tammemagi MC, Mayo JR, et al. Probability of Cancer in Pulmonary Nodules Detected on First Screening CT[J]. N Engl J Med, 2013, 369(10): 910-919. DOI:10.1056/NEJMoa1214726 |
| [15] |
陈陶阳, 姚红玉. 肺癌发病风险因素与预防对策[J]. 中国预防医学杂志, 2011, 12(9): 809-811. [Chen TY, Yao HY. Risk factors and preventive measures of lung cancer[J]. Zhongguo Yu Fang Yi Xue Za Zhi, 2011, 12(9): 809-811.] |
| [16] |
高冬青, 王家林. 肺癌危险因素研究现状[J]. 中华肿瘤防治杂志, 2019, 26(21): 1657-1662. [Gao DQ, Wang JL. Current status of research on risk factors of lung cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2019, 26(21): 1657-1662.] |
| [17] |
Visser O, van Leeuwen FE. Stage-specific survival of epithelial cancers in North-Holland/Flevoland, the Netherlands[J]. Eur J Cancer, 2005, 41(15): 2321-2330. DOI:10.1016/j.ejca.2005.03.037 |
| [18] |
代洁, 左卓, 郭鹏, 等. 非小细胞肺癌十基因突变联合检测分析[J]. 肿瘤预防与治疗, 2020, 33(12): 979-987. [Dai J, Zuo Z, Guo P, et al. Combined detection and analysis of ten driver gene mutations in non-small cell lung cancer[J]. Zhong Liu Yu Fang Yu Zhi Liao, 2020, 33(12): 979-987.] |
| [19] |
Maldonado SG, Delorme S, Hüsing A, et al. Evaluation of prediction models for identifying malignancy in pulmonary nodules detected via low-dose computed tomography[J]. JAMA Netw Open, 2020, 3(2): e1921221. DOI:10.1001/jamanetworkopen.2019.21221 |
| [20] |
Winkler Wille MM, van Riel SJ, Saghir Z, et al. Predictive accuracy of the PanCan lung cancer risk prediction model: external validation based on CT from the Danish Lung Cancer Screening Trial[J]. Eur Radiol, 2015, 25(10): 3093-3099. DOI:10.1007/s00330-015-3689-0 |
| [21] |
符程皓, 蒋以恒, 葛佳云, 等. 混合磨玻璃结节型肺腺癌脏层胸膜侵犯的临床特征和危险因素分析[J]. 中国肺癌杂志, 2022, 25(4): 236-244. [Fu CH, Jiang YH, Ge JY, et al. Clinical characteristics and risk factors analysis for visceral pleural invasion in mixed ground-glass nodular lung adenocarcinoma[J]. Zhongguo Fei Ai Za Zhi, 2022, 25(4): 236-244.] |
| [22] |
丁晓娟, 刘啸峰, 胡磊. 不同类型肺磨玻璃结节的CT表现及其与肺腺癌病理特征的关系研究[J]. 川北医学院学报, 2021, 36(6): 766-769. [Ding XJ, Liu XF, Hu L. CT findings in different types of lung ground-glass nodules and their rela-tionship with the pathological features of lung adenocarcinoma[J]. Chuan Bei Yi Xue Yuan Xue Bao, 2021, 36(6): 766-769.] |
| [23] |
王秋萍, 冯筠, 金晨望, 等. 钙化点大小对肺结节良恶性诊断的价值[J]. 临床放射学杂志, 2014, 33(11): 1661-1664. [Wang QP, Feng J, Jin CW, et al. The clinical value of pulmonary calcified lesion size in differentiating malignant from benign lung nodules[J]. Lin Chuang Fang She Xue Za Zhi, 2014, 33(11): 1661-1664.] |
| [24] |
樊呈强, 郑次浩, 伍冠生. CT下钙化特点对肺结节良恶性鉴别诊断的临床价值分析[J]. 影像研究与医学应用, 2021, 5(10): 181-182. [Fang CQ, Zheng CH, Wu GS. Analysis on CT calcification characteristics in diagnosis of benign and malignant pulmonary nodules[J]. Ying Xiang Yan Jiu Yu Yi Xue Ying Yong, 2021, 5(10): 181-182.] |
| [25] |
Talwar A, Rahman NM, Kadir T, et al. A retrospective validation study of three models to estimate the probability of malignancy in patients with small pulmonary nodules from a tertiary oncology follow-up centre[J]. Clin Radiol, 2017, 72(2): 177. e1-177. e8. |
| [26] |
Cui X, Heuvelmans MA, Han D, et al. Comparison of Veterans Affairs, Mayo, Brock classification models and radiologist diagnosis for classifying the malignancy of pulmonary nodules in Chinese clinical population[J]. Transl Lung Cancer Res, 2019, 8(5): 605-613. |
| [27] |
She Y, Zhao L, Dai C, et al. Development and validation of a nomogram to estimate the pretest probability of cancer in Chinese patients with solid solitary pulmonary nodules: A multi-institutional study[J]. J Surg Oncol, 2017, 116(6): 756-762. |
| [28] |
安杨, 李春笋, 赵微. 三种肺癌风险预测模型在肺结节患者中的验证性研究[J]. 解放军医学院学报, 2020, 41(12): 1193-1196, 1225. [An Y, Li CS, Zhao W. Validation of three lung cancer risk prediction models in patients with pulmonary nodules[J]. Jie Fang Jun Yi Xue Yuan Xue Bao, 2020, 41(12): 1193-1196, 1225.] |
| [29] |
欧兆荣, 陶连琴, 时国朝, 等. 孤立性肺结节的影像学特征及两种肺癌预测模型的比较[J]. 中国呼吸与危重监护杂志, 2012, 11(2): 168-171. [Ou ZR, Tao LQ, Shi GC, et al. Radiological features of solitary pulmonary nodules and diagnostic value of two lung cancer prediction models for distinguishing malignancy[J]. Zhongguo Hu Xi Yu Wei Zhong Jian Hu Za Zhi, 2012, 11(2): 168-171.] |
| [30] |
Li Y, Hu H, Wu Z, et al. Evaluation of models for predicting the probability of malignancy in patients with pulmonary nodules[J]. Biosci Rep, 2020, 40(2): BSR20193875. |
| [31] |
He X, Xue N, Liu X, et al. A novel clinical model for predicting malignancy of solitary pulmonary nodules: a multicenter study in Chinese population[J]. Cancer Cell Int, 2021, 21(1): 115. |
 2023, Vol. 50
2023, Vol. 50