文章信息
- 肺癌精准治疗的发展与展望
- Perspective of Precision Therapy on Lung Cancer
- 肿瘤防治研究, 2023, 50(5): 442-451
- Cancer Research on Prevention and Treatment, 2023, 50(5): 442-451
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1208
- 收稿日期: 2022-10-14
- 修回日期: 2023-03-02
肺癌作为严重危害人类健康的恶性肿瘤,约占我国新发癌症总数的20%和癌症死亡人数的27%[1]。放化疗的出现首次给中晚期肺癌带来了治疗希望,但5年生存率并没有显著提高,并且其所带来的不良反应也极大影响患者的生活质量。21世纪初肺癌靶向药物的面世以及对肺癌分子生物学的深入了解,开启了肺癌精准治疗新纪元。免疫治疗更进一步地推动肺癌精准治疗的发展。本文将概述肺癌靶向和免疫治疗的新进展、问题及未来发展方向。
1 靶向治疗过去二十年间,靶向治疗迅速发展,从第一个靶向表皮生长因子受体(EGFR)的药物吉非替尼面世开始,EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)药物不断被研发推出。其他驱动基因突变靶向治疗也接连突破,肺癌个体化精准治疗时代由此开始。目前,国内外批准肺癌靶向治疗药物的驱动基因突变靶点包括EGFR突变、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合、ROS原癌基因1(ROS1)重排、BRAF-V600E突变、神经营养因子受体酪氨酸激酶(neuro trophin receptor kinase, NTRK)融合、RET融合、间质-上皮细胞转化因子(mesenchymal-epithelial transition factor, MET)14外显子突变、KRAS鼠肉瘤病毒癌基因(Kristen rat sarcoma viral oncogene, KRAS)-G12C突变和人表皮生长因子受体-2(HER2)突变。国内获批靶向治疗药物及在研药物及其获批历程,见图 1。
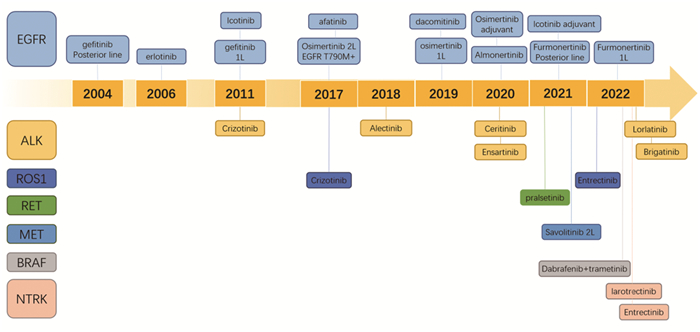
|
| This timeline demonstrated the approved targeted drugs for NSCLC in China. EGFR: epidermal growth factor receptor; ALK: anaplastic lymphoma kinase; ROS1: ROS1 proto-oncogene; RET: RET proto-oncogene; MET: mesenchymal-epithelial transition factor; BRAF: BRAF proto-oncogene; NTRK: neuro trophin receptor kinase. 图 1 中国靶向治疗药物获批历程 Figure 1 Timeline of targeted therapy approved for lung cancer in China |
EGFR突变在中国肺癌人群中发生率约为40%[2],是靶向领域研究最早、获得成果最多的靶点。目前国内获批用于临床的EGFR-TKI包括一代药物吉非替尼、厄洛替尼和埃克替尼,二代药物阿法替尼和达可替尼,三代药物奥希替尼、阿美替尼和伏美替尼。一、二代EGFR-TKIs取得了良好的临床效果,标志了精准靶向治疗在肺癌领域的成功,但靶向治疗最终不可避免地会出现耐药问题,以T790M突变耐药最为常见。对母环和侧链改进后的三代EGFR-TKI展示出了针对T790M突变的活性。Ⅲ期AURA3研究比较了奥希替尼与化疗方案对EGFR-TKI治疗后出现EGFR T790M耐药突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的疗效及安全性,奥希替尼组的中位无进展生存期(PFS)显著优于化疗组(10.1个月vs. 4.4个月),总生存期(OS)也有获益(26.8个月vs. 22.5个月)[3]。阿美替尼的APOLLO[4]和伏美替尼的ALSC003Ⅱ期研究[5]也均显示对耐药后伴T790M突变肺癌患者有效。随着后线治疗的成功,三代EGFR TKI也向一线治疗适应证进军,在Ⅲ期FLAURA研究中,奥希替尼对比一代EGFR-TKI一线治疗显著延长mPFS(18.9个月vs. 10.2个月),并且显示出mOS获益(38.6个月vs. 31.8个月)[6-7],对中枢神经系统转移的患者也显示出更好的疗效,但亚裔和中国人群亚组分析显示无论mPFS还是mOS均低于整组人群[8]。此外,阿美替尼的AENEAS和伏美替尼的FURLONGⅢ期研究也均显示其主要研究终点PFS时间显著优于一代EGFR-TKI,mPFS分别为19.3和20.8个月[9-10]。三代EGFR-TKIs奥希替尼、阿美替尼和伏美替尼已经成为EGFR突变NSCLC患者一线治疗优选方案。
而EGFR exon20ins难治性突变类型对一至三代EGFR-TKI大多不敏感,目前已有双特异性抗体Amivantamab和新的EGFR-TKI Mobocertinib两种药物在国际上获批,ORR分别为40%和35%,mPFS为8.3个月和7.3个月[11-12],使难治性突变患者也能从靶向治疗中获益。
除了晚期NSCLC,EGFR-TKI在早中期肿瘤辅助治疗及新辅助治疗中也发挥作用。ADJUVANT、EVAN、EVIDENCE、ADAURA等研究显示吉非替尼、厄洛替尼、埃克替尼和奥希替尼用于EGFR突变阳性、完全切除Ⅱ~ⅢA期NSCLC患者辅助治疗对比化疗改善了患者的中位无疾病生存期(DFS)[13-16]。目前,中国国家药品监督管理局已经批准了埃克替尼和奥希替尼辅助治疗的适应证。CTONG1103和NEOS研究分别评估了厄洛替尼和奥希替尼新辅助治疗EGFR突变可切除NSCLC的疗效评估,ORR分别达到54.1%和71.1%[17-18]。术前和术后辅助治疗是早中期NSCLC完全切除术后减少复发、延长生存和改善生活质量的重要治疗方式,但靶向辅助/新辅助治疗能否带来OS的获益,以及哪些人群需要接受该类治疗仍为关注的焦点,有待进一步的研究来阐明。
1.2 ALK融合ALK融合突变在NSCLC的发生率约为5%[19]。作为肺癌的“钻石突变”,ALK融合突变患者的五年生存率已超过60%。PROFILE 1014研究证明了第一代TKI克唑替尼治疗ALK阳性NSCLC的疗效优于化疗,但药物血脑屏障渗透性差,相当一部分患者疾病进展部位为中枢神经系统[20]。二代和三代ALK-TKIs克服了这一缺点,二代TKI阿来替尼的ALEX研究显示在既往未接受治疗的Ⅲ/Ⅳ期ALK阳性患者对比克唑替尼单药治疗,显著延长了mPFS(34.8个月vs. 10.9个月),五年OS率也显著提高(62.5% vs. 45.5%),且具有更好的中枢神经系统疗效,安全性数据较克唑替尼更优[21],针对亚洲人群的ALESIA研究数据与ALEX研究一致[22]。另外几种二代靶向药赛瑞替尼、布格替尼和恩沙替尼也分别在ASCEND-4[23]、ALTA-1L[24]和eXalt3[25]研究中展现出一线治疗ALK突变NSCLC的良好疗效,ORR分别达到65.8%、74%和74%。第三代ALK-TKI洛拉替尼对比克唑替尼在CROWN研究中,12个月PFS率更高(78% vs. 39%),颅内ORR也更高(66% vs. 20%),但洛拉替尼发生不良反应事件率明显升高[26],临床应用时需要综合考量疗效和不良反应。目前,以上6种ALK-TKI均已在国内获批,NCCN和CSCO指南均推荐一线优选二代阿来替尼、布格替尼和三代劳拉替尼。虽然ALK融合突变靶向治疗疗效好,但如何在临床实践中综合疗效、不良反应以及耐药机制选用药物治疗也是对临床医师的挑战。
1.3 ROS1融合ROS1融合在NSCLC中发生率为1%~2%,主要发生在不吸烟者和较年轻的群体中,大部分病理分型为腺癌且分级较高[27]。一项在东亚人群中评估克唑替尼用于ROS1突变NSCLC疗效的研究显示,ORR为71.7%,mPFS为15.9个月,安全性良好[28]。2017年国内已批准了克唑替尼用于ROS1融合突变的晚期NSCLC的治疗。但克唑替尼不可避免地产生了耐药,且血脑屏障穿透性差[29]。因此,仍需寻找新的靶向药物来治疗ROS1突变的NSCLC。2022年,恩曲替尼获批用于治疗ROS1阳性的局部晚期或转移性NSCLC,主要基于评估恩曲替尼用于治疗ROS1融合阳性患者(初治或经治但未使用克唑替尼)疗效和安全性的三个Ⅰ/Ⅱ期单臂临床试验(ALKA-372-001,STARTRK-1,STARTRK-2)的综合分析结果。2022年世界肺癌大会更新了其试验结果,ORR达到67.4%,mPFS为16.8个月,基线存在中枢神经系统转移的患者颅内病灶有效率高,多数不良反应相关事件是低级别的,安全性良好。目前其他在进行临床试验且展现出良好前景的靶向ROS1突变的药物包括洛拉替尼、他雷替尼和Repotrectinib。一项Ⅰ~Ⅱ期临床试验评估洛拉替尼用于ROS1突变NSCLC,未经治疗的亚组ORR为62%,mPFS为21个月,在接受过克唑替尼治疗的亚组中,疗效明显变低,ORR为35%,mPFS为8.5个月,但两组都表现出明显的颅内活性,颅内ORR都达到50%以上,且耐受性良好[30]。他雷替尼和Repotrectinib临床研究的mPFS和mOS都尚未达到,期待其能给患者带来生存获益。
1.4 KRAS G12CKRAS是人类RAS基因家族的一员,编码一个小的鸟苷三磷酸酶(guanosine triphosphatase, GTPase)膜结合蛋白,突变的KRAS基因导致GTPase的活性降低,使下游多条信号通路持续激活,诱导肿瘤发生发展。KRAS突变类型包括G12C、G12D、G13D等,最常见的KRAS G12C突变率约3%[22]。由于KRAS突变对于GTP结合力高,且KRAS蛋白表面呈现球形缺乏结合位点,KRAS突变一直被认为是不可成药靶点,半胱氨酸共价结合技术的突破改变了这一现状。2021年,基于Ⅰ/Ⅱ期CodeBreaK 100研究结果,sotorasib获得了FDA批准用于KRAS G12C突变晚期NSCLC患者的后线治疗。该研究两年随访结果在2022年美国癌症研究协会大会公布,既往接受过治疗的KRAS G12C突变的NSCLC患者,sotorasib治疗ORR达40.7%,mPFS和mOS分别为6.3和12.5个月,mDOR达12.3个月。另一款小分子KRAS G12C抑制剂Adagrasib在KRYSTAL-1Ⅱ期队列研究中评估了其后线治疗KRAS G12C突变NSCLC的疗效,ORR为42.9%,mPFS和mOS分别为6.5和12.6个月,mDOR为8.5个月,并对颅内病灶有一定有效率[31],有望成为下一个获批的KRAS G12C抑制剂。KRAS G12C作为热门研发靶点,除了sotorasib和adagrasib,还有JDQ443,D-1553,JAB-21822等新药处于早期临床试验阶段,期待其疗效上的突破。
1.5 HER2突变HER2作为表皮生长因子受体(ERBB)家族成员之一,通过与其他家族成员二聚化触发下游信号通路,HER2通路改变时通过二聚化增加和自磷酸化来驱动肿瘤的发生发展。HER2突变发生率为2%~4%,其中,绝大多数是HER2 exon20突变[32]。针对这一靶点的治疗,非选择性泛ERBB家族TKI如阿法替尼、达可替尼和来那替尼的获益很低。使用选择性HER2 TKI,如吡咯替尼[33]、Poziotinib[34]等药物后,药物活性有所增加,ORR在30%左右,但Poziotinib存在严重不良反应,FDA尚未通过其上市申请。抗体偶联药物(antibody-drug conjugate,ADC)的发展为HER2突变肺癌提供了新的选择,T-DM1治疗ORR为38.1%,成为NCCN指南推荐的治疗方案[35];此外trastuzumab deruxtecan(T-DXd)在DESTINY-Lung01研究中用于后线治疗HER2突变NSCLC患者,ORR为55%,mPFS和mOS分别达到8.2个月和17.8个月,mDOR为8.2个月[36],但值得注意的是,药物相关的间质性肺病在安全事件中发生率不低,具体的不良反应机制还需要进一步研究。
1.6 其他靶点除上述突变基因靶点外,RET融合突变、BRAF V600E突变、MET exon14跳跃突变、NTRK融合突变和神经调节蛋白-1(neuregulin 1, NRG1)也已成为药物靶点,为肺癌患者提供了治疗希望。此外,靶向抗肿瘤血管生成也是有效的治疗方式,如我国自主研发的多靶点小分子抗血管生成药物安罗替尼,作用于血管内皮生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)、c-Kit等靶点,具有抗肿瘤血管生成和抑制肿瘤生长的双重作用,是国内唯一同时获批用于NSCLC和小细胞肺癌(SCLC)的抗血管生成药物。获批基于ALTER0303和ALTER1202两项研究,结果显示三线及以上治疗NSCLC和SCLC的mOS分别为9.6个月vs. 6.3个月;7.3个月vs. 4.9个月,mPFS为5.4个月vs. 1.4个月;4.1个月vs. 0.7个月[37-38]。同时开展了多项联合治疗临床试验,包括ACTION和ALTER-L018研究等,探究安罗替尼联合化疗、靶向治疗以及免疫治疗在各线肺癌治疗中的作用。期望国产原研药能取得更好的临床试验结果,为肺癌治疗添加新的治疗组合。
2 免疫治疗驱动基因突变阳性的NSCLC患者开启了精准治疗之路,但驱动基因阴性NSCLC和SCLC仍不能从靶向治疗中获益,需要探索新的治疗策略。利用人体自身免疫能力抗衡肿瘤发生发展的研究已经进行了上百年,直到细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、程序性死亡受体-1(PD-1)和程序性死亡配体-1(PD-L1)在1990年前后被发现,以免疫检查点抑制剂(ICIs)为主的肺癌免疫治疗体系才逐步建立。国内肺癌获批免疫治疗药物包括PD-1抑制剂纳武利尤单抗、帕博利珠单抗、卡瑞利珠单抗、信迪利单抗、替雷利珠单抗和特瑞普利单抗,PD-L1抑制剂阿替利珠单抗、度伐利由单抗和舒格利单抗,CTLA-4抑制剂伊匹木单抗,见图 2。ICIs能激活人体免疫系统,依靠自身免疫能力杀灭肿瘤细胞,获得的抗肿瘤反应持久,患者生存率也明显提高。
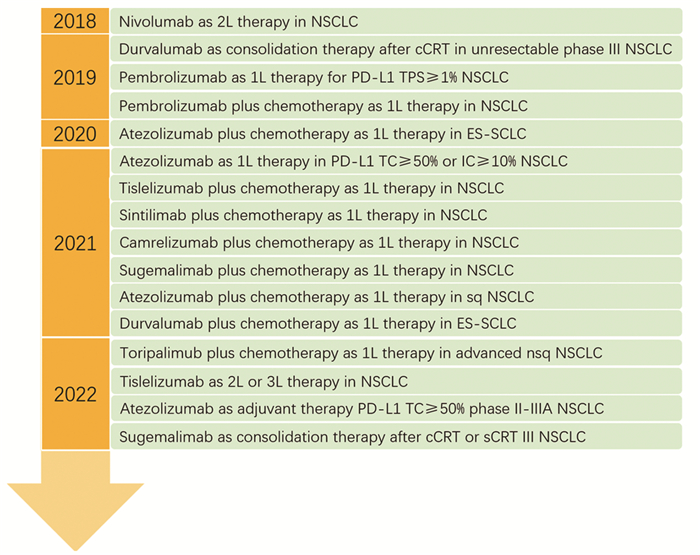
|
| 1L: first line; 2L: second line; NSCLC: non-small-cell lung cancer; CCRT: concurrent chemoradiotherapy; sCRT: sequential chemoradiotherapy. 图 2 肺癌免疫治疗发展及国内药物获批历程 Figure 2 Timeline of progression in immunotherapy and approved drugs for lung cancer |
ICIs单药治疗首先在二线或二线以上治疗中获得了适应证。根据CheckMate 017/057/078研究及RATIONALE-303研究的良好结果,纳武利尤单抗及替雷利珠单抗二线或三线治疗晚期NSCLC已获NMPA批准。ICIs单药一线治疗临床试验在二线及后线治疗获得成功后也陆续开展,既往临床试验标志物分析显示PD-L1高表达为疗效预测标志物,依据PD-L1表达量纳入患者的KEYNOTE-024和KEYNOTE-042Ⅲ期临床研究随后开展,比较帕博利珠单抗和标准含铂化疗对初治无驱动基因突变晚期NSCLC的临床疗效。KEYNOTE-024研究纳入PD-L1肿瘤比例评分(tumor proportion score, TPS)≥50%的患者,帕博利珠单抗治疗mOS明显获益(26.3个月vs. 13.4个月),5年OS率也明显增加(31.9% vs. 16.3%)[39]。为了扩大免疫治疗的获益人群,KEYNOTE-042研究进一步扩大至PD-L1 TPS≥1%人群,在整体人群中看到了OS的获益,但亚组分析提示获益主要为TPS≥50%人群[40]。此后的Ⅲ期临床研究IMpower110结果也提示阿替利珠单抗显著改善PD-L1高表达(阳性肿瘤细胞≥50%或阳性免疫细胞≥10%))的野生型Ⅳ期NSCLC患者的mOS(20.2个月vs. 14.7个月)和mPFS(8.2个月vs. 5.0个月)[41]。根据以上研究结果,帕博利珠单抗和阿替利珠单抗均在NMPA获批一线单药治疗。此外,EMPOWER-Lung 1研究结果显示,西米普利单抗用于PD-L1 TPS≥50%的EGFR/ALK阴性晚期NSCLC患者的一线治疗较化疗可改善PFS和DOR[42],其单药治疗已被FDA批准,这些研究开启了精准免疫治疗的先河。但免疫治疗发展也并不一帆风顺,CheckMate 026研究对比纳武利尤单抗与化疗在PD-L1 TPS≥5%NSCLC患者,mPFS和mOS无明显差异[43],表现出阴性结果,这可能是由于试验人群中PD-L1低表达患者占比较大,提示PD-L1作为免疫治疗疗效标志物存在不足。
2.2 免疫联合化疗免疫单药治疗获益人群主要还是PD-L1高表达人群,但这类人群占比仅约1/3,为了扩大免疫治疗适应人群,联合治疗是重要策略。化疗具有细胞毒性作用,能诱导免疫原性细胞死亡,增加肿瘤相关抗原和损伤相关模式分子的释放,同时诱导炎性肿瘤环境,从而增加免疫细胞活性,且能抑制肿瘤微环境中的免疫抑制性细胞[44]。
化疗联合免疫治疗目前已经成为EGFR/ALK野生型晚期NSCLC标准一线治疗方案,2022年EMSO会议更新了KEYNOTE-189和KEYNOTE-407研究五年随访结果,两项研究分别评估帕博利珠单抗联合培美曲塞和铂类或联合紫杉醇和卡铂用于突变基因阴性的非鳞状NSCLC和鳞状NSCLC的疗效。KEYNOTE-189研究结果显示帕博利珠单抗联合化疗对比化疗加安慰剂组治疗转移性非鳞状NSCLC明显改善了患者mOS(22个月vs. 10.6个月)和mPFS(9.0个月vs. 4.9个月)。针对鳞状NSCLC患者的KEYNOTE-407结果也显示延长了患者的mOS(17.2个月vs. 11.6个月)和mPFS(8.0个月vs. 5.1个月)[45]。此外,RATIONALE-304/RATIONALE-307[46-47]、ORIENT-11/ORIENT-12[48-49]、Camel/Camel-sq[50-51]、GEMSTONE-302、CHOICE-01[52]和IMpower132[53]研究结果表明替雷利珠单抗、信迪利单抗、卡瑞利珠单抗、舒格利单抗、特瑞普利单抗和阿替利珠单抗联合化疗运用于驱动基因阴性NSCLC均获得良好的疗效。目前特瑞普利单抗和阿替利珠单抗联合化疗都获批用于一线治疗驱动基因阴性晚期非鳞状NSCLC,其他五种单抗联合化疗均在国内获批用于晚期NSCLC一线治疗。
对于广泛期SCLC(extensive stage-SCLC, ES-SCLC),IMpower133研究是其一线免疫治疗的里程碑,试验评估了阿替利珠单抗联合依托泊苷和卡铂对比安慰剂联合化疗一线治疗ES-SCLC的疗效和安全性,结果显示阿替利珠联合化疗延长了患者的mOS(12.3个月vs. 10.3个月)和mPFS(5.2个月vs. 4.3个月)[54]。之后CASPIAN研究评估度伐利尤单抗联合化疗一线治疗ES-SCLC的结果显示,度伐利尤单抗联合依托泊苷和铂类患者的mOS延长(12.9个月vs. 10.5个月)[55]。基于以上研究结果,阿替利珠单抗和度伐利尤单抗均在国内获批用于治疗ES-SCLC,ICIs联合化疗成为一线治疗ES-SCLC的新标准。此外,2022年ASCO大会公布PD-1抑制剂斯鲁利单抗联合化疗治疗ES-SCLC的试验数据,mOS(15.4个月vs. 10.9个月)和mPFS(5.8个月vs. 4.3个月)均显著延长。
2.3 双免疫抑制剂治疗除了免疫与化疗联合之外,其他联合治疗方案也在积极的探索中。PD-(L)1抑制剂和CTLA-4抑制剂联合应用理论上可以协同激活抗肿瘤免疫反应,提高免疫治疗疗效。CheckMate 227研究的四年随访结果表明,纳武单抗联合伊匹木单抗与单纯化疗相比,可明显延长PD-L1 TPS≥1%患者的mOS(17.1个月vs.14.9个月)和4年OS率(29% vs. 18%),PD-L1 TPS < 1%的患者mOS也明显获益[56],目前FDA已批准纳武利尤单抗联合伊匹木单抗一线治疗PD-L1 TPS≥1%晚期NSCLC。而CheckMate 9LA研究在纳武利尤单抗和伊匹木单抗双免疫治疗的基础上叠加短周期的化疗,对比单纯化疗的疗效与安全性,结果显示mOS延长(15.8个月vs. 11.0个月),对比CheckMate 227研究,OS差异更明显,但是安全性方面,双免疫联合化疗对比单纯化疗安全事件发生率更大[57]。Ⅲ期POSEIDON临床研究评估度伐利由单抗联合tremelimumab和化疗对比单纯化疗用于晚期NSCLC一线治疗,PFS和OS均延长[58]。但度伐利由单抗联合tremelimumab在MYSTIC研究[59]和POSEIDON研究的亚组中均显示阴性结果。帕博利珠单抗联合伊匹木单抗对比帕博利珠单抗一线治疗驱动基因阴性、PD-L1 TPS≥50%的晚期NSCLC的疗效和安全性的KEYNOTE-598研究结果显示,不但没有mOS(21.4个月vs. 21.9个月)和mPFS(8.2个月vs. 8.4个月)的改善,反而增加了3级以上不良反应的发生率(62.4% vs. 50.2%)[60]。还需要更多的研究探索双重免疫治疗抑制剂适用人群。
2.4 免疫联合抗血管治疗抗血管生成药物作用于肿瘤微环境,可以使免疫抑制性微环境向支持性微环境转变。同时,使用抗血管生成药物可以重塑肿瘤血管,使免疫效应细胞有效浸润肿瘤[61]。IMpower150研究比较了阿替利珠单抗联合卡铂/紫杉醇(ACP)、阿替利珠单抗联合贝伐珠单抗/卡铂/紫杉醇(ABCP)及贝伐珠单抗联合卡铂/紫杉醇(BCP)一线治疗非鳞状NSCLC的疗效,结果显示,ABCP组较BCP组显著延长晚期NSCLC患者mOS(19.5个月vs. 14.7个月)[62]。基于此项研究,FDA批准了ABCP方案一线治疗转移性非鳞状NSCLC的适应证。ORIENT-31研究评估了信迪利单抗联合抗血管药物IBI305加化疗对比单独化疗在EGFR突变的非鳞状NSCLC患者的二线治疗效果,结果显示联合治疗得到了mPFS的改善(6.9个月vs. 4.3个月),ORR也有提高(45% vs. 24%)[63]。PASSION研究是一项Ⅱ期临床试验,评估卡瑞利珠单抗联合阿帕替尼在ES-SCLC的作用,每两周使用200 mg卡瑞利珠单抗和每日375 mg阿帕替尼联合使用,患者mOS为8.4个月,mPFS为3.6个月,ORR为34%[64],有一定的获益。但仑伐替尼联合帕博利珠单抗的Ⅲ期研究LEAP 007显示联合治疗较单纯帕博利珠单抗提高了ORR, 延长了PFS,但OS并未表现出获益[65],期待其他正在开展的大样本量的Ⅲ期临床试验验证这种联合治疗方案的效果。
2.5 免疫巩固治疗PACIFIC研究是免疫巩固治疗领域里程碑式的进展,比较了度伐利由单抗与安慰剂在同步放化疗(concurrent chemoradiotherapy,CCRT)后无疾病进展的不可切除Ⅲ期NSCLC患者中的疗效,5年随访结果显示,度伐利由单抗巩固治疗显著延长了mOS(47.5个月vs. 29.1个月)和mPFS(16.9个月vs. 5.6个月),提高了5年OS率(42.9% vs. 33.4%)[66]。这一研究改变了局部晚期NSCLC的治疗模式,在2019年被NMPA批准用于CCRT后未出现疾病进展的不可切除、Ⅲ期NSCLC患者的治疗。GEMSTONE-301研究则进一步探讨了CCRT或序贯放化疗(sequential chemoradiotherapy, sCRT)后舒格利单抗作为免疫巩固治疗在不可切除、Ⅲ期NSCLC治疗中的疗效,2022年世界肺癌大会上公布的结果显示舒格利单抗对比安慰剂mPFS显著延长(CCRT:15.7个月vs. 8.3个月;sCRT:8.1个月vs. 4.1个月)。GEMSTONE-301研究不仅再次证明了免疫巩固治疗的疗效,并且发现其对于sCRT患者也有可观的临床获益,为不能耐受CCRT的患者提供了治疗选择。舒格利单抗于2022年6月在国内获批治疗CCRT或sCRT后未发生疾病进展的不可切除的Ⅲ期NSCLC患者。
2.6 免疫新辅助/辅助治疗CheckMate 816研究探索了纳武利尤单抗联合化疗对比单独化疗作为新辅助治疗NSCLC患者的疗效,免疫联合化疗组病理完全缓解(pCR)率显著高于单纯化疗组(24.0% vs. 2.2%),无事件生存期(event-free survival, EFS)也显著延长,不良事件发生率无增加,并且新辅助治疗未阻碍手术的进行[67]。此外,免疫单药或联合化疗新辅助治疗的CheckMate-159、LCMC3、NADIM、SAKK16/14等研究都显示了良好的试验结果,但NEOSTAR研究显示双免疫新辅助治疗会造成更多患者失去手术机会[68],提示免疫新辅助治疗的应用仍需要谨慎。
免疫辅助治疗方面,IMpower010研究结果显示,阿替利珠单抗辅助免疫治疗对比最佳支持治疗显著改善了PD-L1 TC≥1%Ⅱ~ⅢA期NSCLC患者DFS,3年DFS率分别为60%和48.2%[69]。基于IMpower010的优秀结果,2022年3月NMPA批准阿替利珠单抗单药用于PD-L1 TC≥1%、经手术切除、以铂类为基础化疗之后的Ⅱ~ⅢA期NSCLC患者的辅助治疗。PEARL/KEYNOTE-091研究在2022年ASCO大会公布的结果显示,帕博利珠单抗辅助治疗ⅠB-ⅢA期NSCLC患者显著改善了mDFS(53.6个月vs. 42.0个月),且这一结果与手术类型、淋巴结累及程度、肿瘤大小以及辅助化疗的类型和范围无关。
3 问题及展望 3.1 精准检测随着肺癌精准治疗向纵深发展,精准检测的需求也越来越高。NCCN指南和CSCO指南均推荐患者基线时检查多个驱动基因突变状态如EGFR、ALK、ROS1等,还需对PD-L1进行检测评估免疫治疗疗效;患者耐药时需要进行再次检测以指导后续精准治疗。这就需要多基因的多重检测(PANEL)的指导。但每一种检测手段均具有其优点和缺点,例如融合基因突变检测,RNA-NGS检测方法要优于DNA-NGS和基于PCR的方法[70-71]。此外,由于组织活检对于肿瘤标本的含量要求高并且随着病程进展需要多次进行检测,液体活检逐渐成为研究热点,通过检测血液循环DNA(ctDNA),相比组织活检,更容易获取、无创,可以实现动态检测且可反映各转移灶的异质性[72],但液体活检敏感度低,容易出现假阴性,这些均对精准检测提出了挑战。
3.2 疗效标志物仍缺乏靶向治疗开启了肺癌精准治疗的大门,越来越多少见靶点靶向药物陆续出现,使得更多患者能获益于靶向治疗,但其疗效不如EGFR/ALK突变靶向药物,例如针对KRAS G12C、EGFR exon20ins患者的靶向治疗有效率小于50%。如何寻找合适的疗效标志物,扩大获益人群,使少见靶点靶向药也能成为一线标准治疗方案,对我们来说是挑战也是机遇。
寻找精准免疫治疗标志物仍为当前面临的主要难题,无论是免疫单药还是免疫联合治疗,都缺乏高效的标志物。PD-L1表达量是临床应用最广泛的免疫治疗生物标志物,但其并非完美的生物标志物。PD-L1在肺活检和相应切除肿瘤之间、原发部位和转移部位之间表达存在差异,存在一部分PD-L1阴性患者免疫治疗有效的情况。因此探索质量更高的免疫疗效标志物至关重要。肿瘤突变负荷、肿瘤浸润淋巴细胞也显示出一定的疗效预测潜能[73],但都未在Ⅲ期临床研究中得到证实。目前正在开展基因组、转录组、蛋白质组、代谢组等多组学探索免疫疗效标志物的研究,以及联合人工智能的方法,有望发现更优的免疫治疗疗效标志物。
此外,目前已经在临床上广泛应用的化疗、抗血管生成药物治疗也缺乏临床可用的疗效标志物,都极大阻碍了肺癌精准治疗的发展。
3.3 耐药靶向药物的耐药问题目前仍是不可避免的。耐药机制包括靶内突变——激酶结构域的获得性耐药突变和靶外突变——非靶向激酶改变介导(包括旁路信号激活或表型转化等)[74]。以奥希替尼为例,其靶外突变耐药的发生比靶内耐药更普遍,包括MET扩增、获得性RET重排、下游信号通路RAS-MAPK(丝裂原活化蛋白激酶)激活等[75]。针对靶向耐药问题,应进行二次活检,明确耐药机制再进行治疗。新一代TKI药物的研发是应对措施之一,第四代EGFR-TKI药物BLU-945等已经进入临床试验[76]。寻找药物联合应用方案也是一种途径,三代EGFR-TKI联合化疗、联合MET/RET抑制剂,以及联合抗血管生成药物治疗等都在评估中。
免疫治疗耐药可分为原发性、适应性和获得性耐药,机制包括肿瘤抗原免疫原性不足、主要组织相容性复合体功能障碍、T细胞耗竭、抑制性肿瘤微环境等[74]。免疫治疗耐药后缺乏有效治疗手段,多项联合治疗措施拟将低免疫应答的“冷肿瘤”变成反应性良好的“热肿瘤”,如联合LAG3、TIGIT,联合腺苷CD73拮抗剂、MEK1抑制剂都在研究中,但尚无突破性进展。
针对耐药问题,除了对现有的药物和方案进行改进和联合治疗,新的药物如ADC、多特异性抗体、CART和癌症疫苗等也在探索之中。
4 小结在传统放化疗之后,肺癌分子靶向治疗和免疫治疗飞速发展,近几年新药在国内的获批迅速增加,改变了肺癌总体治疗模式,进入了精准治疗的时代,肺癌患者生存时间显著延长,已经到了要求“慢性病化”的阶段。但肺癌治疗精准化发展不均衡:随着各靶点药物的健全和基因检测技术的发展靶向治疗走在精准治疗的最前沿;精准免疫治疗尚有较大的发展空间;而精准化疗或者抗血管治疗仍空缺,还需要更多的探索。更为重要的是,随着肺癌患者生存时间的延长,肿瘤全程管理越来越受到大家的重视,如何实现肺癌全程精准治疗对未来提出了更高的挑战。
作者贡献:
任胜祥:总体策划、论文构思、文稿撰写、修改与审校
邱天羽:文献收集、论文构思、文稿撰写
| [1] |
Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9. DOI:10.1016/j.jncc.2022.02.002 |
| [2] |
Yuan M, Huang L, Chen J, et al. The emerging treatment landscape of targeted therapy in non-small-cell lung cancer[J]. Signal Transduct Target Ther, 2019, 4: 61. DOI:10.1038/s41392-019-0099-9 |
| [3] |
Papadimitrakopoulou VA, Mok TS, Han JY, et al. Osimertinib versus platinum-pemetrexed for patients with EGFR T790M advanced NSCLC and progression on a prior EGFR-tyrosine kinase inhibitor: AURA3 overall survival analysis[J]. Ann Oncol, 2020, 31(11): 1536-1544. DOI:10.1016/j.annonc.2020.08.2100 |
| [4] |
Lu S, Wang QM, Zhang GJ, et al. Efficacy of Aumolertinib (HS-10296) in Patients With Advanced EGFR T790M+ NSCLC: Updated Post-National Medical Products Administration Approval Results From the APOLLO Registrational Trial[J]. J Thorac Oncol, 2022, 17(3): 411-422. DOI:10.1016/j.jtho.2021.10.024 |
| [5] |
Shi YK, Hu XS, Zhang SC, et al. Efficacy, safety, and genetic analysis of furmonertinib (AST2818) in patients with EGFR T790M mutated non-small-cell lung cancer: a phase 2b, multicentre[J]. Lancet Respir Med, 2021, 9(8): 829-839. DOI:10.1016/S2213-2600(20)30455-0 |
| [6] |
Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2018, 378(2): 113-125. DOI:10.1056/NEJMoa1713137 |
| [7] |
Ramalingam SS, Gray JE, Ohe Y, et al. Osimertinib vs comparator EGFR-TKI as first-line treatment for EGFRm advanced NSCLC (FLAURA): Final overall survival analysis[J]. Ann Oncol, 2019, 30(Suppl_5): V851-V934. |
| [8] |
Cho BC, Chewaskulyong B, Lee KH, et al. Osimertinib versus Standard of Care EGFR TKI as First-Line Treatment in Patients with EGFRm Advanced NSCLC: FLAURA Asian Subset[J]. J Thorac Oncol, 2019, 14(1): 99-106. DOI:10.1016/j.jtho.2018.09.004 |
| [9] |
Shi Y, Chen G, Wang X, et al. Furmonertinib (AST2818) versus gefitinib as first-line therapy for Chinese patients with locally advanced or metastatic EGFR mutation-positive non-small-cell lung cancer (FURLONG): a multicentre, double-blind, randomised phase 3 study[J]. Lancet Respir Med, 2022, 10(11): 1019-1028. DOI:10.1016/S2213-2600(22)00168-0 |
| [10] |
Lu S, Dong X, Jian H, et al. AENEAS: A Randomized Phase ⅢTrial of Aumolertinib Versus Gefitinib as First-Line Therapy for Locally Advanced or Metastatic Non-Small-Cell Lung Cancer With EGFR Exon 19 Deletion or L858R Mutations[J]. J Clin Oncol, 2022, 40(27): 3162-3171. DOI:10.1200/JCO.21.02641 |
| [11] |
Park K, Haura EB, Leighl NB, et al. Amivantamab in EGFR Exon 20 Insertion-Mutated Non-Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS PhaseⅠ Study[J]. J Clin Oncol, 2021, 39(30): 3391-3402. DOI:10.1200/JCO.21.00662 |
| [12] |
Han H, Li S, Chen T, et al. Targeting HER2 Exon 20 Insertion-Mutant Lung Adenocarcinoma with a Novel Tyrosine Kinase Inhibitor Mobocertinib[J]. Cancer Res, 2021, 81(20): 5311-5324. DOI:10.1158/0008-5472.CAN-21-1526 |
| [13] |
Zhong WZ, Wang Q, Mao WM, et al. Gefitinib Versus Vinorelbine Plus Cisplatin as Adjuvant Treatment for Stage Ⅱ-ⅢA (N1-N2) EGFR-Mutant NSCLC: Final Overall Survival Analysis of CTONG1104 PhaseⅢ Trial[J]. J Clin Oncol, 2021, 39(7): 713-722. DOI:10.1200/JCO.20.01820 |
| [14] |
Yue DS, Xu SD, Wang Q, et al. Erlotinib versus vinorelbine plus cisplatin as adjuvant therapy in Chinese patients with stage ⅢA EGFR mutation-positive non-small-cell lung cancer (EVAN): a randomised, open-label, phase 2 trial[J]. Lancet Respir Med, 2018, 6(11): 863-873. DOI:10.1016/S2213-2600(18)30277-7 |
| [15] |
Zhou C, He J, Su C, et al. Icotinib versus Chemotherapy as Adjuvant Treatment for Stage Ⅱ-ⅢA EGFR-Mutant NSCLC (EVIDENCE): A Randomized, Open-Label, Phase 3 Study[J]. J Thorac Oncol, 2021, 16(3): S232-S232. |
| [16] |
Wu Y, John T, Grohe C, et al. Postoperative Chemotherapy Use and Outcomes from ADAURA: Osimertinib as Adjuvant Therapy for Resected EGFR-Mutated NSCLC[J]. J Thorac Oncol, 2022, 17(3): 423-433. DOI:10.1016/j.jtho.2021.10.014 |
| [17] |
Zhong WZ, Wu YL, Chen KN, et al. LBA48_PRCTONG 1103: Erlotinib versus gemcitabine plus cisplatin as neo-adjuvant treatment for stage ⅢA-N2 EGFR-mutation non-small cell lung cancer (EMERGING): A randomised study[J]. Ann Oncol, 2018, 29(suppl_8): 738-738. |
| [18] |
Lyu C, Fang W, Jiao W, et al. Osimertinib as neoadjuvant therapy in patients with EGFR mutated resectable stage Ⅱ-ⅢB lung adenocarcinoma (NEOS): Updated results[J]. Ann Oncol, 2022, 33: S71-S72. |
| [19] |
Zhou CC, Kim SW, Reungwetwattana T, et al. Alectinib versus crizotinib in untreated Asian patients with anaplastic lymphoma kinase-positive non-small-cell lung cancer (ALESIA): a randomised phase 3 study[J]. Lancet Respir Med, 2019, 7(5): 437-446. DOI:10.1016/S2213-2600(19)30053-0 |
| [20] |
Mok T, Kim DW, Wu YL, et al. First-line crizotinib versus pemetrexed-cisplatin or pemetrexed-carboplatin in patients (pts) with advanced ALK-positive non-squamous non-small cell lung cancer (NSCLC): results of a phaseⅢ study (PROFILE 1014)[J]. J Clin Oncol, 2014, 32(15_Suppl): 8002. DOI:10.1200/jco.2014.32.15_suppl.8002 |
| [21] |
Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study[J]. Ann Oncol, 2020, 31(8): 1056-1064. DOI:10.1016/j.annonc.2020.04.478 |
| [22] |
Cai DJ, Hu CP, Li L, et al. The prevalence and prognostic value of KRAS co-mutation subtypes in Chinese advanced non-small cell lung cancer patients[J]. Cancer Med, 2020, 9(1): 84-93. DOI:10.1002/cam4.2682 |
| [23] |
Tan DS, Geater S, Yu CJ, et al. First-line ceritinib versus chemotherapy in patients (pts) with advanced ALK rearranged (ALK+) non-small cell lung cancer (NSCLC): ASCEND-4 Asian subgroup analysis[J]. Ann Oncol, 2019, 30(suppl 5): 599. |
| [24] |
Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib Versus Crizotinib in Advanced ALK Inhibitor-Naive ALK-Positive Non-Small Cell Lung Cancer: Second Interim Analysis of the PhaseⅢ ALTA-1L Trial[J]. J Clin Oncol, 2020, 38(31): 3592-3603. DOI:10.1200/JCO.20.00505 |
| [25] |
Horn L, Wang ZP, Wu G, et al. Ensartinib vs. Crizotinib for Patients With Anaplastic Lymphoma Kinase-Positive Non-Small Cell Lung Cancer A Randomized Clinical Trial[J]. JAMA Oncol, 2021, 7(11): 1617-1625. DOI:10.1001/jamaoncol.2021.3523 |
| [26] |
Shaw AT, Bauer TM, de Marinis F, et al. First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer[J]. N Engl J Med, 2020, 383(21): 2018-2029. DOI:10.1056/NEJMoa2027187 |
| [27] |
Bergethon K, Shaw AT, Ou SHI, et al. ROS1 Rearrangements Define a Unique Molecular Class of Lung Cancers[J]. J Clin Oncol, 2012, 30(8): 863-870. DOI:10.1200/JCO.2011.35.6345 |
| [28] |
Wu YL, Yang JCH, Kim DW, et al. PhaseⅡ Study of Crizotinib in East Asian Patients With ROS1-Positive Advanced Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2018, 36(14): 1405-1411. DOI:10.1200/JCO.2017.75.5587 |
| [29] |
D'Angelo A, Sobhani N, Chapman R, et al. Focus on ROS1-Positive Non-Small Cell Lung Cancer (NSCLC): Crizotinib, Resistance Mechanisms and the Newer Generation of Targeted Therapies[J]. Cancers (Basel), 2020, 12(11): 3293. DOI:10.3390/cancers12113293 |
| [30] |
Shaw AT, Solomon BJ, Chiari R, et al. Lorlatinib in advanced ROS1-positive non-small-cell lung cancer: a multicentre, open-label, single-arm, phase 1-2 trial[J]. Lancet Oncol, 2019, 20(12): 1691-1701. DOI:10.1016/S1470-2045(19)30655-2 |
| [31] |
Jaenne PA, Riely GJ, Gadgeel SM, et al. Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRASG12C Mutation[J]. N Engl J Med, 2022, 387(2): 120-131. DOI:10.1056/NEJMoa2204619 |
| [32] |
Mazieres J, Peters S, Lepage B, et al. Lung Cancer That Harbors an HER2 Mutation: Epidemiologic Characteristics and Therapeutic Perspectives[J]. J Clin Oncol, 2013, 31(16): 1997-2003. DOI:10.1200/JCO.2012.45.6095 |
| [33] |
Song ZB, Lv DQ, Chen SQ, et al. Pyrotinib in Patients with HER2-Amplified Advanced Non-Small Cell Lung Cancer: A Prospective, Multicenter, Single-Arm Trial[J]. Clin Cancer Res, 2022, 28(3): 461-467. DOI:10.1158/1078-0432.CCR-21-2936 |
| [34] |
Elamin YY, Robichaux JP, Carter BW, et al. Poziotinib for Patients With HER2 Exon 20 Mutant Non-Small-Cell Lung Cancer: Results From a PhaseⅡ Trial[J]. J Clin Oncol, 2022, 40(7): 702-709. DOI:10.1200/JCO.21.01113 |
| [35] |
Iwama E, Zenke Y, Sugawara S, et al. Trastuzumab emtansine for patients with non-small cell lung cancer positive for human epidermal growth factor receptor 2 exon-20 insertion mutations[J]. Eur J Cancer, 2022, 162: 99-106. DOI:10.1016/j.ejca.2021.11.021 |
| [36] |
Li BT, Smit EF, Goto Y, et al. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2022, 386(3): 241-251. DOI:10.1056/NEJMoa2112431 |
| [37] |
Han BH, Li K, Wang QM, et al. Effect of Anlotinib as a Third-Line or Further Treatment on Overall Survival of Patients With Advanced Non-Small Cell Lung Cancer The ALTER 0303 Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2018, 4(11): 1569-1575. DOI:10.1001/jamaoncol.2018.3039 |
| [38] |
Cheng Y, Wang QM, Li K, et al. Anlotinib vs. placebo as third- or further-line treatment for patients with small cell lung cancer: a randomised, double-blind, placebo-controlled Phase 2 study[J]. Brit J Cancer, 2021, 125(3): 366-371. DOI:10.1038/s41416-021-01356-3 |
| [39] |
Reck M, Rodriguez-Abreu D, Robinson AG, et al. Five-Year Outcomes With Pembrolizumab Versus Chemotherapy for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score≥50%[J]. J Clin Oncol, 2021, 39(21): 2339-2349. DOI:10.1200/JCO.21.00174 |
| [40] |
Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [41] |
Jassem J, de Marinis F, Giaccone G, et al. Updated Overall Survival Analysis From IMpower110: Atezolizumab Versus Platinum-Based Chemotherapy in Treatment-Naive Programmed Death-Ligand 1-Selected NSCLC[J]. J Thorac Oncol, 2021, 16(11): 1872-1882. DOI:10.1016/j.jtho.2021.06.019 |
| [42] |
Sezer A, Kilickap S, Gumus M, et al. Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial[J]. Lancet, 2021, 397(10274): 592-604. DOI:10.1016/S0140-6736(21)00228-2 |
| [43] |
Peters S, Creelan B, Hellmann MD, et al. Abstract CT082; Impact of tumor mutation burden on the efficacy of first-line nivolumab in stage iv or recurrent non-small cell lung cancer: An exploratory analysis of CheckMate 026[J]. Cancer Res, 2017, 77(13 Suppl): CT082-CT082.. |
| [44] |
Judd J, Borghaei H. Combining Immunotherapy and Chemotherapy for Non-Small Cell Lung Cancer[J]. Thorac Surg Clin, 2020, 30(2): 199-206. DOI:10.1016/j.thorsurg.2020.01.006 |
| [45] |
Cheng Y, Zhang L, Hu J, et al. Pembrolizumab Plus Chemotherapy for Chinese Patients With Metastatic Squamous NSCLC in KEYNOTE-407[J]. JTO Clin Res Rep, 2021, 2(10): 100225. |
| [46] |
Wang J, Lu S, Yu XM, et al. Tislelizumab Plus Chemotherapy vs. Chemotherapy Alone as First-line Treatment for Advanced Squamous Non-Small-Cell Lung Cancer A Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2021, 7(5): 709-717. DOI:10.1001/jamaoncol.2021.0366 |
| [47] |
Lu S, Wang J, Yu Y, et al. Tislelizumab Plus Chemotherapy as First-Line Treatment for Locally Advanced or Metastatic Nonsquamous NSCLC (RATIONALE 304): A Randomized Phase 3 Trial[J]. J Thorac Oncol, 2021, 16(9): 1512-1522. DOI:10.1016/j.jtho.2021.05.005 |
| [48] |
Yang Y, Wang Z, Fang J, et al. Final overall survival (OS) data of sintilimab plus pemetrexed (SPP) and platinum as first-line (1L) treatment for locally advanced or metastatic nonsquamous NSCLC (AMnsqNSCLC) in the phaseⅢ ORIENT-11 study[J]. Ann Oncol, 2022, 33: S28-S28. |
| [49] |
Zhou CC, Wu L, Fan Y, et al. Sintilimab Plus Platinum and Gemcitabine as First-Line Treatment for Advanced or Metastatic Squamous NSCLC: Results From a Randomized, Double-Blind, Phase 3 Trial (ORIENT-12)[J]. J Thorac Oncol, 2021, 16(9): 1501-1511. DOI:10.1016/j.jtho.2021.04.011 |
| [50] |
Zhou CC, Chen GY, Huang YC, et al. Camrelizumab plus carboplatin and pemetrexed versus chemotherapy alone in chemotherapy-naive patients with advanced non-squamous non-small-cell lung cancer (CameL): a randomised, open-label, multicentre, phase 3 trial[J]. Lancet Respir Med, 2021, 9(3): 305-314. DOI:10.1016/S2213-2600(20)30365-9 |
| [51] |
Zhou C, Cheng Y, Chen J, et al. First-line camrelizumab plus carboplatin and paclitaxel for advanced squamous non-small cell lung cancer: Updated overall survival results from the phase Ⅲ CameL-sq trial[J]. Ann Oncol, 2022, 33(suppl 2): S28. |
| [52] |
Wang J, Wang Z, Wu L, et al. CHOICE-01: A Phase 3 Study of Toripalimab Versus Placebo in Combination With First-Line Chemotherapy for Advanced NSCLC[J]. J Thorac Oncol, 2021, 16(10): S927-S928. DOI:10.1016/j.jtho.2021.08.181 |
| [53] |
Lu S, Fang J, Wang ZP, et al. Results from the IMpower132 China cohort: Atezolizumab plus platinum-based chemotherapy in advanced non-small cell lung cancer[J]. Cancer Med, 2023, 12(3): 2666-2667. DOI:10.1002/cam4.5144 |
| [54] |
Horn L, Mansfield AS, Szczesna A, et al. First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer[J]. N Engl J Med, 2018, 379(23): 2220-2229. DOI:10.1056/NEJMoa1809064 |
| [55] |
Paz-Ares L, Chen Y, Reinmuth N, et al. Durvalumab +/- tremelimumab plus platinum-etoposide in first-line extensive-stage SCLC (ES-SCLC): 3-year overall survival update from the phaseⅢ CASPIAN study[J]. Ann Oncol, 2021, 32(suppl 5): S1338-S1338. |
| [56] |
Paz-Ares LG, Ciuleanu TE, Lee JS, et al. Nivolumab (NIVO) plus ipilimumab (IPI) versus chemotherapy (chemo) as first-line (1L) treatment for advanced non-small cell lung cancer (NSCLC): 4-year update from CheckMate 227[J]. J Clin Oncol, 2021, 39(15 suppl): 9016. |
| [57] |
Reck M, Ciuleanu TE, Cobo M, et al. First-line nivolumab (NIVO) plus ipilimumab (IPI) plus two cycles of chemotherapy (chemo) versus chemo alone (4 cycles) in patients with advanced non-small cell lung cancer (NSCLC): Two-year update from CheckMate 9LA[J]. J Clin Oncol, 2021, 39(15_suppl): 9000. DOI:10.1200/JCO.2021.39.15_suppl.9000 |
| [58] |
Reinmuth N, Johnson M, Cho BC, et al. Durvalumab +/- Tremelimumab plus Chemotherapy as First-line Treatment for mNSCLC: Results from the Phase 3 POSEIDON Study[J]. J Thorac Oncol, 2021, 16(10_supplement): S844. |
| [59] |
Rizvi NA, Cho BC, Reinmuth N. Durvalumab With or Without Tremelimumab vs. Standard Chemotherapy in First-line Treatment of Metastatic Non-Small Cell Lung Cancer: The MYSTIC Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2020, 6(5): 661-674. DOI:10.1001/jamaoncol.2020.0237 |
| [60] |
Boyer M, Sendur MAN, Rodriguez-Abreu D, et al. Pembrolizumab Plus Ipilimumab or Placebo for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score≥50%: Randomized, Double-Blind PhaseⅢ KEYNOTE-598 Study[J]. J Clin Oncol, 2021, 39(21): 2327-2338. DOI:10.1200/JCO.20.03579 |
| [61] |
Ciciola P, Cascetta P, Bianco C, et al. Combining Immune Checkpoint Inhibitors with Anti-Angiogenic Agents[J]. J Clin Med, 2020, 9(3): 675. DOI:10.3390/jcm9030675 |
| [62] |
Socinski MA, Nishio M, Jotte RM, et al. IMpower150 Final Overall Survival Analyses for Atezolizumab Plus Bevacizumab and Chemotherapy in First-Line Metastatic Nonsquamous NSCLC[J]. J Thorac Oncol, 2021, 16(11): 1909-1924. DOI:10.1016/j.jtho.2021.07.009 |
| [63] |
Lu S, Wu L, Jian H, et al. Sintilimab plus bevacizumab biosimilar IBI305 and chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer who progressed on EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): first interim results from a randomised, double-blind, multicentre, phase 3 trial[J]. Lancet Oncol, 2022, 23(9): 1167-1179. DOI:10.1016/S1470-2045(22)00382-5 |
| [64] |
Fan Y, Zhao J, Wang QM, et al. Camrelizumab Plus Apatinib in Extensive-Stage SCLC (PASSION): A Multicenter, Two-Stage, Phase 2 Trial[J]. J Thorac Oncol, 2021, 16(2): 299-309. DOI:10.1016/j.jtho.2020.10.002 |
| [65] |
Yang JCH, Luft A, Jimenez ED, et al. Pembrolizumab (Pembro) with or without lenvatinib (Lenva) in first-line metastatic NSCLC with PD-L1 TPS≥1% (LEAP-007): A phaseⅢ, randomized, double-blind study[J]. Ann Oncol, 2021, 32: S1429-S1430. |
| [66] |
Spigel DR, Faivre-Finn C, Gray JE, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in StageⅢ Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2022, 40(12): 1301-1311. DOI:10.1200/JCO.21.01308 |
| [67] |
Forde PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer[J]. N Engl J Med, 2022, 386(21): 1973-1985. DOI:10.1056/NEJMoa2202170 |
| [68] |
Zhou N, Sepesi B, Leung CH, et al. Impact of genomic aberrations and additional therapies on survival outcomes of patients with operable non-small cell lung cancer (NSCLC) from the NEOSTAR study[J]. J Clin Oncol, 2021, 39(15_suppl): 8542. DOI:10.1200/JCO.2021.39.15_suppl.8542 |
| [69] |
Felip E, Altorki N, Zhou C, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stageⅠB-ⅢA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial[J]. Lancet, 2021, 398(10308): 1344-1357. DOI:10.1016/S0140-6736(21)02098-5 |
| [70] |
Wei J, Liu L, Chen X, et al. Improved sensitivity of integrative DNA and RNA NGS assay on fusion detection[J]. Ann Oncol, 2020, 31: S1105. |
| [71] |
Cohen D, Hondelink LM, Solleveld-Westerink N, et al. Optimizing Mutation and Fusion Detection in NSCLC by Sequential DNA and RNA Sequencing[J]. J Thorac Oncol, 2020, 15(6): 1000-1014. DOI:10.1016/j.jtho.2020.01.019 |
| [72] |
Kurata J, Price K, Banks K, et al. Multiomic, Plasma-Only ctDNA NGS Assay Developed for Minimal Residual Disease (MRD) Detection in Early-Stage NSCLC[J]. J Thorac Oncol, 2021, 16(10): S952-S953. |
| [73] |
Liu SY, Wu YL. Biomarker for personalized immunotherapy[J]. Transl Lung Cancer Res, 2019, 8(Suppl 3): S308-S317. |
| [74] |
Wang MN, Herbst RS, Boshoff C. Toward personalized treatment approaches for non-small-cell lung cancer[J]. Nat Med, 2021, 27(8): 1345-1356. DOI:10.1038/s41591-021-01450-2 |
| [75] |
Lim JU. Overcoming Osimertinib Resistance in Advanced Non-small Cell Lung Cancer[J]. Clin Oncol, 2021, 33(10): 619-626. DOI:10.1016/j.clon.2021.07.015 |
| [76] |
Lim SM, Park CW, Zhang Z, et al. BLU-945, a fourth-generation, potent and highly selective epidermal growth factor receptor (EGFR) tyrosine kinase inhibitor (TKI) with intracranial activity, demonstrates robust in vivo antitumor activity in models of osimertinib-resistant non-small cell lung cancer (NSCLC)[J]. Cancer Res, 2021, 81(13_Supplement): 1467. DOI:10.1158/1538-7445.AM2021-1467 |
 2023, Vol. 50
2023, Vol. 50

