文章信息
- 达芬奇机器人与电视辅助胸腔镜手术治疗肺癌短期疗效及术后炎性细胞因子变化比较
- Short-Term Efficacy and Postoperative Inflammatory Cytokine Changes in Lung Cancer Treated with Da Vinci Robot-assisted Versus Video-assisted Thoracoscopic Surgery
- 肿瘤防治研究, 2023, 50(4): 378-383
- Cancer Research on Prevention and Treatment, 2023, 50(4): 378-383
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1144
- 收稿日期: 2022-09-29
- 修回日期: 2022-11-27
2. 730000 兰州,甘肃省人民医院胸外科;
3. 510515 广州,南方医科大学公共卫生学院
2. Department of Thoracic Surgery, Gansu Provincial Hospital, Lanzhou 730000, China;
3. College of Public Health, Southern Medical University, Guangzhou 510515, China
根据2022年国家癌症中心发布的最新一期全国癌症统计数据显示[1],肺癌在男性及女性的死亡率中均居首位。早期非小细胞肺癌(NSCLC)治疗的金标准是手术切除。电视辅助胸腔镜手术(video-assisted thoracoscopic surgery, VATS)较传统开胸手术具有更轻的疼痛、更短的住院时间和更少的围手术期并发症,且在远期肿瘤学疗效上并不亚于开胸手术[2]。此外,既往研究表明[3],VATS与释放较少的炎性细胞因子有关,这可能是微创胸部手术优于开胸手术的重要原因。VATS在肺癌手术中的应用已经很成熟,但VATS存在一些不足之处:学习曲线较长、操作逻辑违反直觉、视野缺乏立体感、器械活动性欠佳等,达芬奇机器人辅助胸腔镜手术(robot-assisted thoracoscopic surgery, RATS)的应用则可更进一步解决这些问题[4]。
与VATS相比,RATS是否与更低的促炎介质释放相关尚不清楚。由于RATS具有放大10~15倍及三维可视化视野,可以提供更精确的解剖,故可能与更少的组织创伤和更少的炎性细胞因子释放相关。然而,国内尚无研究分析RATS和VATS的术后炎性细胞因子变化。故本研究比较了RATS与VATS肺癌根治术在我们单一医疗组中的短期疗效,并重点分析了RATS与VATS的术后炎性细胞因子变化。
1 资料与方法 1.1 临床资料选取2019年6月—2022年6月甘肃省人民医院胸外科经同一术者连续完成的270例行微创手术治疗的NSCLC患者。纳入标准:(1)18~80岁,术前检查并评估心肺功能可耐受手术;(2)术前行气管镜、CT引导穿刺活检或术中快速冰冻病理检查明确诊断为肺恶性肿瘤。排除标准:(1)术中发现胸膜播散;(2)不同术者或助手。本研究已经通过甘肃省人民医院伦理委员会审查(审批号:2022-357)。所有患者术前均签署手术知情同意书。
1.2 手术方法 1.2.1 RATS组患者双腔气管插管,采用静脉吸入复合全身麻醉,健侧单肺通气,取健侧卧位,垫高胸部,双上肢屈曲抱枕折刀体位,降低肩部及髋部避免机械挤压。达芬奇机器人装机及打孔采用三臂四孔法。早期本中心采用王述民教授团队5-7-8-8打孔策略[5],即镜孔置于腋中线或腋后线第8肋间,其余两个操作孔分别放置于肩胛线第8肋间、腋前线与锁骨中线间第5肋间,根据病变位置选择相应的操作孔,辅助操作口于腋中线第7肋间行3~4 cm切口。后期亦采用谭群友教授团队前侧入路3-4-6-8/9打孔策略[6],即镜孔置于腋后线第6肋间,其余两个操作孔分别放置于腋后线第8/9肋间、腋前线第3肋间,辅助操作口于锁骨中线第4肋间。手术首先游离下肺韧带,根据肺裂发育情况而定,如果肺裂发育良好则采用解剖式,如肺裂发育不良则采用单向式肺叶切除术;顺利切除病变肺叶后清扫肺门(10、11组)、纵隔淋巴结(左侧:5、6、7、8、9组淋巴结;右侧:2、4、7、8、9组淋巴结)[7]。术后,留置1根或2根引流管。
1.2.2 VATS组患者采用双腔气管插管,静脉吸入复合全身麻醉,健侧单肺通气,取健侧卧位,双上肢屈曲抱枕折刀体位。一般取腋中线第7或第8肋间1.2 cm切口作为进镜孔,取腋前线第4或第5肋间3 cm切口作为操作孔。
RATS组和VATS组均常规实施术后快速康复,包括术前戒烟、呼吸训练、镇痛、术后早期活动、术后拔管等。两组的镇痛方案相同,术后常规给予患者镇痛泵和非甾体抗炎药止痛。
1.3 血样处理在4个时间点采集患者血样:于术前1天和术后第1天、第3天、第5天采集患者的空腹静脉血,3 000×g离心30 min,通过酶联免疫吸附法测定血清CRP、IL-6、IL-8、IL-10和TNF-α水平,用电化学发光法测定血清PCT水平。
1.4 观察指标观察性别、年龄、体重指数(BMI)、吸烟史、基础疾病、肿瘤大小、手术方式、切除部位、病理类型、T分期、N分期和TNM分期。手术和术后数据包括手术时间、术中出血量、术后总胸腔引流量、术后胸腔引流时间、术后住院时间、淋巴结清扫枚数、淋巴结清扫站数、术后并发症、中转开胸、住院费用、CRP、PCT、IL-6、IL-8、IL-10和TNF-α的水平。
1.5 统计学方法采用SPSS26.0软件进行统计分析,连续变量以均数±标准差(x±s)表示,两组间比较采用独立样本t检验;分类变量以频数和百分比(%)表示,两组间比较采用卡方检验或Fisher检验。P < 0.05为差异有统计学意义。
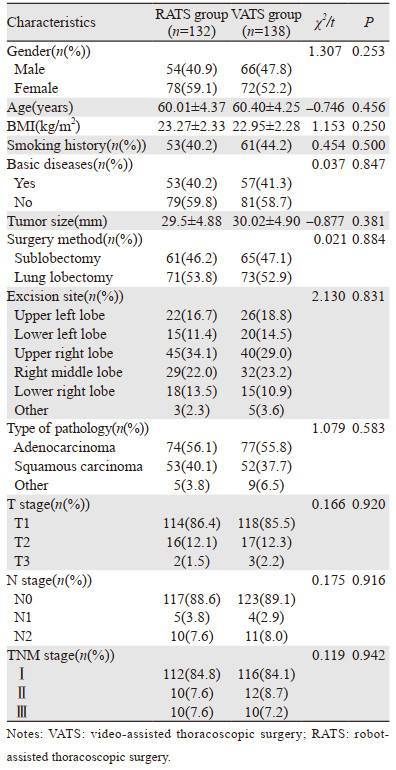
2 结果 2.1 患者一般资料最终纳入270例患者,其中RATS组132例,男54例、女78例;VATS组138例,男66例、女72例。所有入选患者均顺利完成手术,无围手术期死亡病例。两组在性别、年龄、体重指数(BMI)、吸烟史、基础疾病、肿瘤大小、手术方式、切除部位、病理类型、T分期、N分期和TNM分期等基线指标方面差异均无统计学意义(P > 0.05),见表 1。
与VATS组相比,RATS组术中出血量、术后引流时间、术后住院时间、淋巴结清扫枚数和淋巴结清扫组数更具优势(P < 0.05);与RATS组相比,VATS组手术时间、术后总胸腔引流量和住院费用更具优势(P < 0.05)。两组术后并发症和术中中转开胸情况比较差异无统计学意义(P > 0.05),见表 2。
RATS组与VATS组术前CRP、PCT、IL-6、IL-8、IL-10、TNF-α指标差异均无统计学意义(P > 0.05);RATS组与VATS组术后CRP、PCT、IL-6、IL-8、IL-10、TNF-α指标均比术前升高,且在术后第1天、第3天和第5天RATS组各指标升高幅度均小于VATS组,差异具有统计学意义(P < 0.05),见表 3。

|
VATS治疗NSCLC的安全性和肿瘤学疗效已得到充分证实[8-9]。随着VATS在临床中的广泛应用,手术医生也发现其在肺部手术中存在一些有待解决的问题[10-11]:二维平面术野缺乏一定的空间深度感觉,使得术者的手眼协调性有着不同程度的降低;在某些深部组织的操作中缺乏纵深视觉感受,在一定程度上增加了手术的风险。RATS的出现很好地解决了VATS面对的这些问题。近两年达芬奇机器人在国内的装机量快速增长,很多地级市医院也安装了达芬奇机器人手术系统。RATS与VATS治疗肺癌的整体疗效仍在不断探索,目前尚无研究对两种手术的炎性细胞因子进行分析。故本研究在对比RATS与VATS治疗肺癌短期疗效的同时重点分析了两种手术的术后炎性细胞因子变化。
有研究[12]结果显示,RATS的手术时间通常较长,可能归因于RATS有额外的装机时间和学习曲线的影响。本研究中,RATS组的手术时间长于VATS组,去除装机时间后发现RATS的手术时间几乎与VATS相当。此外,随着术者经验的积累和机器人团队配合的娴熟,RATS的手术时间可以明显缩短。淋巴结的清扫在NSCLC的微创手术中至关重要,既往多项研究评估了RATS清扫淋巴结的情况,并产生了相互矛盾的结果,这可能与术者的手术经验及纳入分析的病例数相关。Nelson等[13]研究表明,与VATS相比,RATS可以清扫更多的淋巴结枚数和淋巴结组数。这一结论也被多项回顾性研究[14-15]验证。然而,根据Kneuertz等[16]的研究,两种手术方式清扫的淋巴结枚数和淋巴结组数相当。本研究表明,RATS可以清扫更多的淋巴结枚数和淋巴结组数。我们分析主要是因为RATS可以提供三维高清晰度的视野、更好的操作性和灵活性,使胸外科医生能够更好地解剖血管和支气管周围的淋巴结。
在本研究中,RATS组的术后引流时间短于VATS组,而RATS组的术后总胸腔引流量多于VATS组。目前较少有研究分析RATS和VATS在肺部手术之间胸腔引流量的差异。根据我们的经验,RATS可以切除更多的淋巴结,这可能导致切除过程中与淋巴结连接的支气管动脉、静脉和淋巴管受损,因此术后胸腔引流量增加。在进行淋巴结剥离时,RATS与VATS使用能量装置的差异也可能对术后引流量产生影响。另一种可能的解释是手术创伤引起的胸腔引流量增加,RATS组常规有四个切口,而VATS组仅需要一个或两个切口。虽然RATS组的术后总胸腔引流量更多,但是RATS组的术后引流时间却更短。这可能是因为RATS组术后肺漏气发生率更低,且术中对患者的整理创伤更小。本研究中,RATS组的术中出血量显著低于VATS组,且RATS组的术后住院时间短于VATS组,笔者分析这可能是因为RATS可以在手术中提供三维放大的视野、更灵活的操作且消除术者手部的颤抖,从而可以准确地暴露出切除目标周围的复杂解剖结构。这有助于医生在手术过程中进行精确的操作,更好地控制小血管的出血。同时由于RATS更具微创性,故产生的术后疼痛更少,能更快恢复。患者术后恢复较快,也在一定程度上缩短了术后住院时间,这也符合加速康复外科的理念[17]。通过对RATS与VATS在肺癌手术的短期疗效进行分析可以发现,RATS的整体短期疗效要优于VATS,但RATS高昂的手术费用限制了其广泛开展。
CRP属于肝脏合成型物质,作为急性时相性蛋白,在机体受到炎性反应感染时,其水平升高能反映出机体的损伤情况[18]。PCT是降钙素的前体,主要是通过细菌脂多糖形成,如机体产生感染,则可能导致其水平上升[19]。IL-6、IL-8及IL-10均为炎性反应细胞因子,对炎性反应的敏感度均较好,在机体发生感染后其水平也会明显上升[20]。TNF-α可以活化单核巨噬细胞、提高中性粒细胞吞噬能力、促进T淋巴细胞和B淋巴细胞的增殖,适量的TNF-α对机体的反应是有利的,但过度升高的TNF-α会引起炎性反应加剧、多器官功能损伤[21]。本研究结果表明,RATS组与VATS组术后CRP、PCT、IL-6、IL-8、IL-10和TNF-α指标均比术前升高,但在术后第1天、第3天、第5天RATS组各指标升高幅度均小于VATS组。这表明RATS组患者治疗后机体的炎性指标水平更低,炎性反应症状也更为轻微,分析原因主要是因为RATS组具有更佳的微创特性,对患者的整体创伤更小,患者机体的应激程度相对更低,炎性指标的表达也明显下降[22]。促炎细胞因子(如IL-6)的升高与机体创伤的程度相关,并随后在整个修复过程中引发全身炎性反应[23]。因此,VATS组中更显著的全身炎性反应意味着围手术期的各种潜在临床表现,如呼吸衰竭、肾功能不全、凝血障碍和肝功能不全等。然而,需进行进一步研究以确定出现临床表现的阈值。
由于免疫系统参与伤口修复过程,在VATS组患者中观察到的特异性炎性反应升高可能导致免疫系统失调和功效降低[24]。例如,IL-6水平升高可以促进炎性反应且通常与产生强烈的免疫反应有关,其可以通过抑制TNF-α的水平导致机体处于免疫抑制状态(TNF-α在免疫反应中起着关键作用)[25]。事实上,由于TNF-α在启动促炎细胞因子级联反应和动员免疫系统细胞方面发挥着关键作用,创伤后会迅速大量释放TNF-α[26]。因此,作为细胞因子级联中IL-6的诱导剂和前驱物,按照经典的细胞因子级联途径,TNF-α水平与IL-6一起上升是合乎逻辑的。此外,肺癌的发病人群主要是老年人,随着年龄的增长,易发生转移[26],对手术应激反应的生理储备及对手术的耐受性也随之降低,以最小的手术创伤达到最佳的治疗效果,提高术后患者的生活质量是现代医学发展的趋势。
本研究存在一定的缺点和不足:首先,由于纳入研究的数据来源为单中心,结果可能存在偏倚;其次,缺少长期生存分析,未来将进一步通过随访完善数据。
综上所述,RATS治疗肺癌具有技术上和短期疗效上的优势,但是伴有高昂费用的劣势。与VATS相比,RATS术后炎性细胞因子升高幅度更低,对机体的炎性反应更轻。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
洪子强:数据整理与分析,论文设计及撰写
苟文曦:数据整理与分析,论文审阅与修改
盛燕楠:论文指导与统计分析
白向豆、崔百强:论文审阅与指导
金大成:协助数据收集
苟云久:研究选题与设计,论文审阅与修改
| [1] |
国家癌症中心, 国家肿瘤质控中心肺癌质控专家委员会. 中国原发性肺癌规范诊疗质量控制指标(2022版)[J]. 中华肿瘤杂志, 2022, 44(7): 594-599. [National Cancer Center, Quality Control Expert Committee of Lung Cancer, National Cancer Quality Control Center. Quality control index for standardized diagnosis and treatment of lung cancer in China (2022 edition)[J]. Zhonghua Zhong Liu Za Zhi, 2022, 44(7): 594-599. DOI:10.3760/cma.j.cn112152-20220418-00266] |
| [2] |
Yan TD, Black D, Bannon PG, et al. Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer[J]. J Clin Oncol, 2009, 27(15): 2553-2562. DOI:10.1200/JCO.2008.18.2733 |
| [3] |
Erus Suat, Öztürk Ayşe Bilge, Albayrak Özgür, et al. Immune profiling after minimally invasive lobectomy[J]. Interact Cardiovasc Thorac Surg, 2021, 32(2): 291-297. DOI:10.1093/icvts/ivaa296 |
| [4] |
Yang HX, Woo KM, Sima CS, et al. Long-term Survival Based on the Surgical Approach to Lobectomy For Clinical StageⅠNonsmall Cell Lung Cancer: Comparison of Robotic, Video-assisted Thoracic Surgery, and Thoracotomy Lobectomy[J]. Ann Surg, 2017, 265(2): 431-437. DOI:10.1097/SLA.0000000000001708 |
| [5] |
代锋, 许世广, 徐惟, 等. 达芬奇机器人与电视胸腔镜辅助非小细胞肺癌根治术近期疗效配对的病例对照研究[J]. 中国肺癌杂志, 2018, 21(3): 206-211. [Dai F, Xu SG, Xu W, et al. A Paired Case Controlled Study Comparing the Short-term Outcomes of Da Vinci RATS and VATS Approach for Non-small Cell Lung Cancer[J]. Zhongguo Fei Ai Za Zhi, 2018, 21(3): 206-211.] |
| [6] |
陶绍霖, 康珀铭, 谭群友, 等. 经前侧入路达芬奇机器人辅助肺段切除术的临床分析[J]. 中国胸心血管外科临床杂志, 2020, 27(2): 178-182. [Tao SL, Kang PM, Tan QY, et al. Experience of robot-assisted lung segmentectomy through anterior approach[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2020, 27(2): 178-182.] |
| [7] |
贺生亮, 郭天康, 柏启州, 等. 达芬奇机器人系统在高龄患者肺癌根治术中的应用[J]. 中国胸心血管外科临床杂志, 2021, 28(5): 514-518. [He SL, Guo TK, Bai QZ, et al. da Vinci robot system for radical surgery of lung cancer in elderly patients[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2021, 28(5): 514-518.] |
| [8] |
Paul S, Sedrakyan A, Chiu YL, et al. Outcomes after lobectomy using thoracoscopy vs. thoracotomy: a comparative effectiveness analysis utilizing the Nationwide Inpatient Sample database[J]. Eur J Cardiothorac Surg, 2013, 43(4): 813-817. DOI:10.1093/ejcts/ezs428 |
| [9] |
Paul S, Altorki NK, Sheng S, et al. Thoracoscopic lobectomy is associated with lower morbidity than open lobectomy: a propensity-matched analysis from the STS database[J]. J Thorac Cardiovasc Surg, 2010, 139(2): 366-378. DOI:10.1016/j.jtcvs.2009.08.026 |
| [10] |
史博文, 孙冰生, 岳东升, 等. 达芬奇手术系统与胸腔镜在肺癌根治术中的对比分析[J]. 肿瘤防治研究, 2018, 45(2): 91-95. [Shi BW, Sun BS, Yue DS, et al. A Comparative Study of Da Vinci Robotic Surgery and Video-assisted Thoracoscopic Surgery in Radical Resection of Lung Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(2): 91-95. DOI:10.3971/j.issn.1000-8578.2018.16.1513] |
| [11] |
柴新春, 许世广, 刘博, 等. ⅠA期非小细胞肺癌行达芬奇机器人和电视胸腔镜肺段切除术近期疗效对比分析[J]. 中华胸心血管外科杂志, 2021, 37(11): 644-648. [Chai XC, Xu SG, Liu B, et al. A comparative analysis of the short-term efficacy of lung segmentectomy by Da Vinci robot and video-assisted thoracoscopy for stage ⅠA non-small cell lung cancer[J]. Zhonghua Xiong Xin Xue Guan Wai Ke Za Zhi, 2021, 37(11): 644-648. DOI:10.3760/cma.j.cn112434-20200926-00440] |
| [12] |
O'Sullivan KE, Kreaden US, Hebert AE, et al. A systematic review and meta-analysis of robotic versus open and video-assisted thoracoscopic surgery approaches for lobectomy[J]. Interact Cardiovasc Thorac Surg, 2019, 28(4): 526-534. DOI:10.1093/icvts/ivy315 |
| [13] |
Nelson DB, Mehran RJ, Mitchell KG, et al. Robotic-Assisted Lobectomy for Non-Small Cell Lung Cancer: A Comprehensive Institutional Experience[J]. Ann Thorac Surg, 2019, 108(2): 370-376. DOI:10.1016/j.athoracsur.2019.03.051 |
| [14] |
Li JT, Liu PY, Huang J, et al. Perioperative outcomes of radical lobectomies using robotic-assisted thoracoscopic technique vs. video-assisted thoracoscopic technique: retrospective study of 1, 075 consecutive p-stageⅠ non-small cell lung cancer cases[J]. J Thorac Dis, 2019, 11(3): 882-891. DOI:10.21037/jtd.2019.01.78 |
| [15] |
Li C, Hu Y, Huang J, et al. Comparison of robotic-assisted lobectomy with video-assisted thoracic surgery for stageⅡB-ⅢA non-small cell lung cancer[J]. Transl Lung Cancer Res, 2019, 8(6): 820-828. DOI:10.21037/tlcr.2019.10.15 |
| [16] |
Kneuertz PJ, Cheufou DH, D'Souza DM, et al. Propensity-score adjusted comparison of pathologic nodal upstaging by robotic, video-assisted thoracoscopic, and open lobectomy for non-small cell lung cancer[J]. J Thorac Cardiovasc Surg, 2019, 158(5): 1457-1466. DOI:10.1016/j.jtcvs.2019.06.113 |
| [17] |
Shen C, Che GW. Tubeless minimally invasive treatment: taking a new step in enhanced recovery after surgery (ERAS)[J]. Thorac Cancer, 2019, 10(11): 2067-2070. DOI:10.1111/1759-7714.13206 |
| [18] |
He WY, Zhang W. The curative effect comparison between prolonged third generation of gamma nail and prolonged dynamic hip screw internal fixation in treating femoral intertrochanteric fracture and the effect on infection[J]. Cell Biochem Biophys, 2015, 71(2): 695-699. DOI:10.1007/s12013-014-0251-7 |
| [19] |
Gazzoni FF, Hochhegger B, Severo LC, et al. High-resolution computed tomographic findings of Aspergillus infection in lung transplant patients[J]. Eur J Radiol, 2014, 83(1): 79-83. DOI:10.1016/j.ejrad.2013.03.026 |
| [20] |
Hadinoto K, Cheow WS. Nano-antibiotics in chronic lung infection therapy against Pseudomonas aeruginosa[J]. Colloids Surf B Biointerfaces, 2014, 116: 772-785. DOI:10.1016/j.colsurfb.2014.02.032 |
| [21] |
Jang DI, Lee AH, Shin HY, et al. The Role of Tumor Necrosis Factor Alpha (TNF-α) in Autoimmune Disease and Current TNF-α Inhibitors in Therapeutics[J]. Int J Mol Sci, 2021, 22(5): 2719. DOI:10.3390/ijms22052719 |
| [22] |
周国华, 谢敬廉, 高子琨, 等. 单/三孔胸腔镜根治术对肺癌细胞因子及术后感染的影响[J]. 中华医院感染学杂志, 2019, 29(15): 2322-2325, 2338. [Zhou GH, Xie JL, Gao ZK, et al. Effect of single/three-port thoracoscopic radical resection on cytokines and postoperative infection of lung cancer patients[J]. Zhonghua Yi Yuan Gan Ran Xue Za Zhi, 2019, 29(15): 2322-2325, 2338.] |
| [23] |
Midwood KS, Williams LV, Schwarzbauer JE. Tissue repair and the dynamics of the extracellular matrix[J]. Int J Biochem Cell Biol, 2004, 36(6): 1031-1037. DOI:10.1016/j.biocel.2003.12.003 |
| [24] |
Amodeo G, Bugada D, Franchi S, et al. Immune function after major surgical interventions: the effect of postoperative pain treatment[J]. J Pain Res, 2018, 11: 1297-1305. DOI:10.2147/JPR.S158230 |
| [25] |
Lopez-Castejon G, Brough D. Understanding the mechanism of IL 1β secretion[J]. Cytokine Growth Factor Rev, 2011, 22(4): 189-195. |
| [26] |
Mao L, Chen J, Lu X, et al. Proteomic analysis of lung cancer cells reveals a critical role of BCAT1 in cancer cell metastasis[J]. Theranostics, 2021, 11(19): 9705-9720. |
 2023, Vol. 50
2023, Vol. 50