文章信息
- Merkel细胞癌单中心治疗及转归
- Treatment and Outcome of Merkel Cell Carcinoma in A Single Center
- 肿瘤防治研究, 2023, 50(4): 364-369
- Cancer Research on Prevention and Treatment, 2023, 50(4): 364-369
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.1101
- 收稿日期: 2022-09-22
- 修回日期: 2022-12-25
2. 100000 北京,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科;
3. 100000 北京,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院病理科
2. Department of Medical Oncology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100000, China;
3. Department of Pathology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100000, China
Merkel细胞癌(Merkel cell carcinoma, MCC)是一种罕见的侵袭性皮肤恶性肿瘤,多发于老年人暴露于阳光的皮肤部位,具有高度复发和转移倾向[1]。目前的治疗手段以手术、放疗为主,可实现较高的局部控制率,但患者远期进展率仍然较高。化疗在转移性Merkel细胞癌患者中可以达到较高的治疗反应率,但疾病控制持续时间同样有限[2]。近年来,靶向程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)途径的免疫检查点抑制剂在此类患者的治疗中显示出持久的高应答率,目前已成为晚期MCC患者的一线治疗药物[3]。本文回顾分析了中国医学科学院肿瘤医院2017年以来收治的6例Merkel细胞癌患者临床资料,总结其临床特点,以期提高肿瘤医师对此疾病的认识。
1 资料与方法入选对象为2017年8月—2022年7月在中国医学科学院肿瘤医院住院、资料完整且经病理活检确诊的6例MCC患者,采用电话或门诊复查形式对所有患者进行随访,随访日期截至2022年7月31日。回顾性分析患者的一般情况、临床表现、实验室检查、影像检查、治疗及预后等资料,总结其特点。
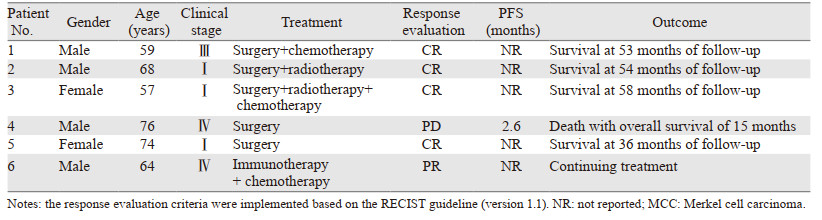
2 结果 2.1 一般资料6例患者中,男4例、女2例,中位发病年龄66岁(57~76岁)。6例患者均以出现皮肤肿物起病,临床分期:Ⅰ期3例、Ⅲ期1例、Ⅳ期2例。单纯手术治疗2例、手术联合放疗和(或)化疗3例,免疫治疗联合化疗1例,详细信息见表 1。
例2、3、5患者临床分期为Ⅰ期,经病理活检确诊为MCC后,均行根治性手术切除肿瘤。例2、3患者术后行局部容积调强放射治疗(volumetric modulated arc therapy, VMAT)。例2患者放疗结束后未行其他治疗,例3患者放疗结束后行环磷酰胺+长春新碱+多柔比星脂质体方案化疗3周期。上述3例患者截至随访日期,疾病均无复发。
例1患者2016年12月9日发现左臀部肿物,于当地医院行肿物切除术,术后病理示:Merkel细胞癌,再次行局部扩大切除术,术后病理示:可见癌组织残存。术后3个月患者再次发现右腹股沟肿物,并逐渐增大,来我院就诊并行PET-CT后考虑为右腹股沟淋巴结转移。2017年8月4日行右腹股沟淋巴结清扫术,术后病理提示Merkel细胞癌转移,临床分期为Ⅲ期。于2017年11月9日起行吉西他滨+顺铂方案化疗4周期,复查CT示:腹盆腔、腹膜后及腹股沟区未见明显肿大淋巴结。之后患者未行其他进一步治疗,截至随访日期,疾病无复发。
例4患者2017年12月22日发现右肩皮肤局部隆起性肿物,于当地医院行局部活检,病理考虑皮肤原发Merkel细胞癌。之后患者就诊于我院,PET-CT示右肩部皮下肿物、左侧腹股沟区皮肤增厚,伴代谢增高,考虑为恶性。右侧腋窝淋巴结代谢增高,考虑转移的可能性大。腰4-5椎体水平椎管内条状代谢增高,高度警惕转移。2018年4月19日行左腹股沟肿物切除+右肩前肿物切除术,术后病理:(左腹股沟肿物)皮肤中分化鳞状细胞癌。(右肩部肿物)分化差的癌,结合病史,首先考虑为高级别神经内分泌癌(Merkel细胞癌),伴少部分鳞状细胞癌及鳞状上皮原位癌(约占比10%)。免疫组织化学结果示:AE1/AE3(++),Vimentin(-),P63(-),CK5/6(散灶-),CK7(散灶+),CK20(+),Syno(+),CD56(+++),ChrA(+),CK18(+),Ki-67(约40%)。术后3周患者右腋前、右胸壁新发2处肿物、且进行性增大,遂于2018年5月24日再次行肿物切除+右腋窝淋巴结清扫术,术后病理示:Merkel细胞癌,局灶伴鳞状分化(< 5%)。淋巴结可见转移性癌(4/22),部分呈Merkel细胞癌形态,少部分呈鳞状细胞癌形态。腰椎增强MRI示:腰4-5椎体水平椎管内条状异常信号灶,考虑转移可能性大。患者临床分期Ⅳ期,建议行全身化疗,但患者及家属拒绝继续治疗,于2019年3月7日疾病进展死亡。
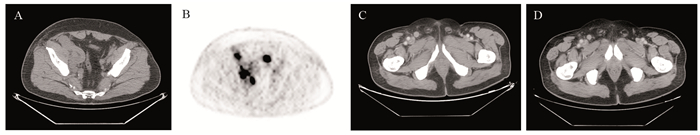
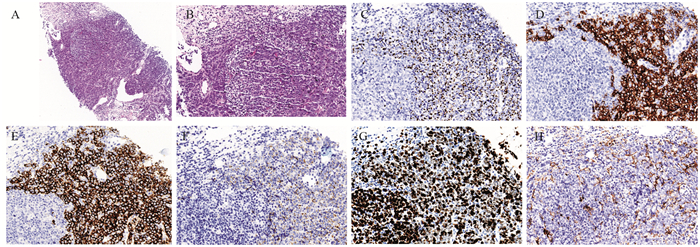
例6患者2020年11月6日无意中发现右膝关节处皮肤肿物,直径约2 cm,2021年4月13日于外院行皮肤肿物切除术,术后未行病理检查。2021年10月1日患者无意中再次发现右腹股沟区肿物,直径约3 cm,外院病理活检示:神经内分泌癌,不排除转移的可能。患者于2022年2月21日来我院就诊,PET-CT示:左侧锁骨上/下区、胸主动脉旁、腹膜后、双侧髂血管旁、右侧腹股沟多发肿大淋巴结,伴摄取增高,大者最大截面约4.9 cm×3.0 cm,见图 1A,SUVmax 8.0,见图 1B。再次行右腹股沟肿物穿刺活检,病理回报示:符合高级别神经内分泌癌(小细胞型),建议结合临床,进一步鉴别转移性小细胞癌及发生于皮肤的Merkel细胞癌,见图 2。免疫组织化学结果显示:AE1/AE3(+),CD56(++),ChrA(++),Syno(+++),Ki-67(+,80%),Rb-1(++),P53(-),LCA(-),CK18(+++),WT-1(+),Desmin(-),MyoD1(-),EMA(-),Mammaglobin(-),CK20(+),PD-L1 Neg(-),PD-L1(22C3)(CPS=5)。结合患者以皮肤肿物起病,PET-CT肺部检查仅见双肺多发小结节、类结节,未见摄取增高,同时文献报道肺转移性小细胞癌很少为CK20阳性[4],因此患者最终诊断为皮肤Merkel细胞癌,临床分期Ⅳ期,2022年3月15日起行替雷利珠单抗+依托泊苷+顺铂方案(替雷利珠单抗200 mg d1+依托泊苷200 mg d1~3+顺铂50 mg d1~3/q21d)治疗。1周期化疗后患者中性粒细胞计数最低降至0.05×109/L,依据CTCAE 5.0不良反应评价标准,为4级中性粒细胞减少。患者未发热,予G-CSF对症升白细胞治疗后好转,后续治疗结束后予加用PEG-G-CSF治疗,患者未再出现血细胞减少。2周期后复查CT示:原左侧锁骨上/下区、胸主动脉旁、腹膜后、双侧髂血管旁、右侧腹股沟多发肿大淋巴结,较前明显缩小,部分已显示不具体,可测大者最大截面约1.5 cm×1.5 cm,见图 1C,疗效评价为PR。继续原方案治疗至4周期后复查CT示:原左侧锁骨上/下区、胸主动脉旁、腹膜后、双侧髂血管旁、右侧腹股沟多发肿大淋巴结,较前明显缩小,部分已显示不具体,可测大者直径约1.3 cm,见图 1D,疗效评价维持PR。患者目前继续原方案治疗中,耐受尚可。
|
| A: pre-treatment PET-CT (CT image); B: pre-treatment PET-CT (PET image); C: CT after two cycles of treatment; D: CT after four cycles of treatment 图 1 例6患者影像检查 Figure 1 Imaging examinations of patient No. 6 |
|
| A: HE (×40); B: HE (×100); C: AE1/AE3 (×100); D: CD56 (×100); E: Syn (×100); F: CgA (×100); G: Ki-67 (×100); H: PD-L1 (×100) 图 2 例6患者HE染色及免疫组织化学染色 Figure 2 HE staining and immunohistochemical staining of patient No. 6 |
MCC是一种罕见的侵袭性皮肤神经内分泌恶性肿瘤,是最具侵略性的皮肤癌之一,其增长迅速,并常出现早期转移。Toker于1972年首次描述该病,并根据组织病理学模式将其命名为“皮肤小梁癌”[5]。在发病时,65%的患者表现为局部病变,26%的患者合并局部淋巴结受累,8%的患者合并全身转移,其对应的5年生存率分别为51%、35%和14%[6]。疾病复发的中位时间为7~9个月,其中80%~90%患者疾病复发发生于2年内[7]。已知的MCC的风险因素包括:浅色皮肤、老年、男性、免疫抑制及合并其他恶性肿瘤[1]。
目前的发病机制模型将MCC分为两种类型:80%的MCC由Merkel细胞多瘤病毒(MCPyV)感染引起,为MCPyV阳性肿瘤,肿瘤突变负荷(tumor mutational burden, TMB)通常较低;而其余20%MCPyV阴性肿瘤往往多发生在头部、颈部或躯干,并且有研究报道MCPyV阴性肿瘤中与复发率增加、总生存率下降有关[3]。最近的遗传学分析也发现MCPyV阴性肿瘤的TMB较高,高通量测序(NGS)和全外显子组测序(WES)可见TP53、RB1基因突变,提示其发病机制可能与紫外线介导的损伤相关[8]。应用免疫组织化学或PCR方法检测MCPyV感染,有助于MCC的精确诊断、治疗选择和预后评估。MCPyV血清学检测也可应用于MCPyV阳性患者的随访监测。
MCC通常发生于老年患者的头部、颈部等暴露于阳光照射的部位,但也可发生于躯干及四肢皮肤,黏膜表面极少发病[1]。临床上,MCC的皮肤原发病灶多表现为快速生长、无痛、红紫色的结节或斑块。最常见的转移部位是区域淋巴结、远处皮肤、肺、骨和脑[5]。一些罕见MCC病例表现为单纯的淋巴结肿大、而没有可识别的皮肤原发病变,约占所有MCC患者的4%[9]。组织病理学上,MCC与其他小圆细胞肿瘤形态类似,可见具有稀疏细胞质的小圆形细胞、丰富的有丝分裂和细胞质中致密的核心颗粒[3]。MCC患者的免疫组织化学染色通常表现为CK20、神经内分泌标志物(包括CgA、Syn、CD56、NSE)、NF、SATB2阳性[5]。MCC可与鳞状细胞癌(SCC)、Bowen病和(或)基底细胞癌(BCC)同时发生,其中SCC是最常见的并发肿瘤,占所有MCC的5%~34%[10]。现有的病例报道多提示与单纯MCC相比,MCC合并SCC患者的发病年龄更大,肿瘤侵袭性更强、更易发生转移,预后更差[10-11]。
MCC的罕见性使其难以开展前瞻性临床研究,因而在很长一段时间内,缺乏对MCC有效治疗手段的权威共识。2009年起,美国国家综合癌症网络(NCCN)开始发布针对MCC患者治疗的相关指南。根据最新的NCCN指南,目前手术切除及辅助放疗仍然是治疗局部疾病的首选策略。局限期MCC患者一般要进行扩大切除术和前哨淋巴结活检,手术边缘通常为距肿瘤边缘1~2 cm,手术切除后,高危肿瘤患者应接受原发部位50~66 Gy的辅助放射治疗。对于无法手术或不适合手术的患者,可行根治性放射治疗,建议剂量60~66 Gy[12]。
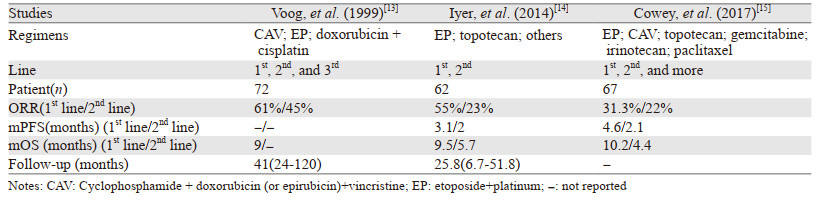
对于转移性MCC患者,其治疗手段应当联合手术、放射治疗及全身治疗。既往对MCC患者应用的化疗方案大多基于小细胞肺癌方案,一线治疗药物通常选择依托泊苷联合卡铂/顺铂,而治疗失败后,二线治疗可能选择包括蒽环类药物、紫杉醇、吉西他滨、伊立替康、环磷酰胺、长春新碱、博莱霉素和5-氟尿嘧啶等在内的各种组合。联合化疗在转移性MCC患者中的客观缓解率(ORR)为31.3%~61%,一线治疗的ORR高于二线治疗,中位无进展生存期(mPFS)只有大约3个月[2],见表 2。
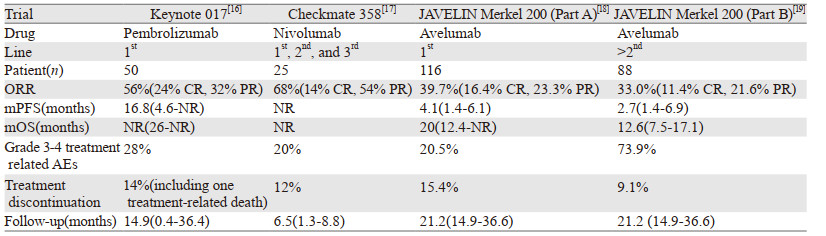
近年来,随着免疫疗法的迅速发展,已有多种涉及PD-1和PD-L1途径的免疫检查点抑制剂(ICIs)在晚期MCC患者中进行了Ⅰ/Ⅱ期临床试验。基于已知的MCC免疫敏感度,ICIs治疗可以实现与化疗类似的反应率及更长的有效时间,ORR为33.0%~68.0%,mPFS为2.7~16.8个月,见表 3。ICIs治疗的耐受性良好,11.4%~28.0%的患者治疗后发生3~4级不良事件,9.1%~15.4%的患者因发生治疗相关不良事件而停止治疗,现有的临床研究中仅有1例治疗相关死亡。同时,在MCC患者中,已有研究证明在TMB低(MCPyV阳性)和TMB高(MCPyV阴性)的病例中均可以看到对ICI治疗的反应性[20]。与黑色素瘤和非小细胞肺癌等肿瘤不同,近期有研究提示MCC患者肿瘤微环境中PD-1(而非PD-L1)的表达程度可能与ICIs治疗的反应性相关,提示其可能有希望作为预测治疗反应的生物标志物[21]。
|
针对特定突变或致癌驱动基因的治疗也可能在MCC的治疗中发挥一定的作用。帕唑帕尼、卡博替尼等血管内皮生长因子受体酪氨酸激酶抑制剂[22]和奥曲肽、兰瑞肽等生长抑素类似物[23]在小规模的病例报道中显示出良好的前景,但其结论仍有待于通过更大规模的临床试验进一步证实。
MCC在我国发病率极低,既往国内相关研究多为个案报道,且多为早期患者,治疗上一般采用手术扩大切除及放射治疗等局部根治手段。本研究所纳入的6例MCC患者中,临床分期Ⅰ期患者共3例,手术及局部放疗后疾病控制良好、随访至今未见肿瘤复发,提示对于局限期疾病,手术及放射治疗可作为有效的首选治疗手段;而临床分期Ⅲ~Ⅳ期的局部晚期和转移性MCC患者共3例,且均为60岁以上老年患者,此类患者大多已丧失手术机会,或因体力状态、并发症等原因无法耐受手术治疗,疾病通常进展迅速、生存率低,对于他们而言,选择合适的全身药物治疗方案控制肿瘤发展、最大限度延长生存期则显得至关重要。本研究中此3例患者,除1例手术后疾病迅速复发、因个人意愿放弃全身药物治疗后最终疾病进展死亡外,其余2例患者均在应用化疗、免疫治疗后实现了肿瘤的缓解和长期生存。基于现有的临床研究,ICIs治疗显示出的令人鼓舞的疗效使其逐渐替代传统的细胞毒性化疗,成为转移性MCC的标准一线治疗,但是,仍有大约50%的晚期MCC患者对ICIs治疗无反应[20],化疗基于其较高的ORR仍可作为此类患者的重要治疗手段,可以减轻肿瘤负荷、改善患者生活质量。此外,ICIs辅助/新辅助治疗及与化疗的联合治疗也需要更多的临床数据进一步验证,其疗效同样值得期待。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
任梦薇:查阅文献、论文撰写
薛学敏:病例筛选、资料收集
刘鹏:论文修改、研究指导
| [1] |
Walsh NM, Cerroni L. Merkel cell carcinoma: A review[J]. J Cutan Pathol, 2021, 48(3): 411-421. DOI:10.1111/cup.13910 |
| [2] |
Nghiem P, Kaufman HL, Bharmal M, et al. Systematic literature review of efficacy, safety and tolerability outcomes of chemotherapy regimens in patients with metastatic Merkel cell carcinoma[J]. Future Oncol, 2017, 13(14): 1263-1279. DOI:10.2217/fon-2017-0072 |
| [3] |
Xue Y, Thakuria M. Merkel Cell Carcinoma Review[J]. Hematol Oncol Clin North Am, 2019, 33(1): 39-52. DOI:10.1016/j.hoc.2018.08.002 |
| [4] |
Bobos M, Hytiroglou P, Kostopoulos I, et al. Immunohistochemical distinction between merkel cell carcinoma and small cell carcinoma of the lung[J]. Am J Dermatopathol, 2006, 28(2): 99-104. DOI:10.1097/01.dad.0000183701.67366.c7 |
| [5] |
Becker JC, Stang A, DeCaprio JA, et al. Merkel cell carcinoma[J]. Nat Rev Dis Primers, 2017, 3: 17077. DOI:10.1038/nrdp.2017.77 |
| [6] |
Harms KL, Healy MA, Nghiem P, et al. Analysis of Prognostic Factors from 9387 Merkel Cell Carcinoma Cases Forms the Basis for the New 8th Edition AJCC Staging System[J]. Ann Surg Oncol, 2016, 23(11): 3564-3571. DOI:10.1245/s10434-016-5266-4 |
| [7] |
Allen PJ, Bowne WB, Jaques DP, et al. Merkel cell carcinoma: prognosis and treatment of patients from a single institution[J]. J Clin Oncol, 2005, 23(10): 2300-2309. DOI:10.1200/JCO.2005.02.329 |
| [8] |
Wong SQ, Waldeck K, Vergara IA, et al. UV-Associated Mutations Underlie the Etiology of MCV-Negative Merkel Cell Carcinomas[J]. Cancer Res, 2015, 75(24): 5228-5234. DOI:10.1158/0008-5472.CAN-15-1877 |
| [9] |
Vandeven N, Lewis CW, Makarov V, et al. Merkel Cell Carcinoma Patients Presenting Without a Primary Lesion Have Elevated Markers of Immunity, Higher Tumor Mutation Burden, and Improved Survival[J]. Clin Cancer Res, 2018, 24(4): 963-971. DOI:10.1158/1078-0432.CCR-17-1678 |
| [10] |
Suárez AL, Louis P, Kitts J, et al. Clinical and dermoscopic features of combined cutaneous squamous cell carcinoma (SCC)/neuroendocrine[Merkel cell] carcinoma (MCC)[J]. J Am Acad Dermatol, 2015, 73(6): 968-975. DOI:10.1016/j.jaad.2015.08.041 |
| [11] |
Ansai SI, Noro S, Ogita A, et al. Case of Merkel cell carcinoma with squamous cell carcinoma possibly arising in chronic radiodermatitis of the hand[J]. J Dermatol, 2015, 42(2): 207-209. DOI:10.1111/1346-8138.12737 |
| [12] |
National Comprehensive Cancer Network. Merkel Cell Carcinoma (Version 2.2022)[DB/OL]. https://www.nccn.org/professionals/physician_gls/pdf/mcc.pdf.
|
| [13] |
Voog E, Biron P, Martin JP, et al. Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma[J]. Cancer, 1999, 85(12): 2589-2595. DOI:10.1002/(SICI)1097-0142(19990615)85:12<2589::AID-CNCR15>3.0.CO;2-F |
| [14] |
Iyer JG, Blom A, Doumani R, et al. Response rates and durability of chemotherapy among 62 patients with metastatic Merkel cell carcinoma[J]. Cancer Med, 2016, 5(9): 2294-2301. DOI:10.1002/cam4.815 |
| [15] |
Cowey CL, Mahnke L, Espirito J, et al. Real-world treatment outcomes in patients with metastatic Merkel cell carcinoma treated with chemotherapy in the USA[J]. Future Oncol, 2017, 13(19): 1699-1710. DOI:10.2217/fon-2017-0187 |
| [16] |
Nghiem P, Bhatia S, Lipson EJ, et al. Durable Tumor Regression and Overall Survival in Patients With Advanced Merkel Cell Carcinoma Receiving Pembrolizumab as First-Line Therapy[J]. J Clin Oncol, 2019, 37(9): 693-702. DOI:10.1200/JCO.18.01896 |
| [17] |
Topalian SL, Bhatia S, Hollebecque A, et al. Non-comparative, open-label, multiple cohort, phase 1/2 study to evaluate nivolumab (NIVO) in patients with virus-associated tumors (CheckMate 358): Efficacy and safety in Merkel cell carcinoma (MCC)[J]. Cancer Res, 2017, 77(13_suppl): CT074. |
| [18] |
D'Angelo SP, Russell J, Lebbé C, et al. Efficacy and Safety of First-line Avelumab Treatment in Patients With Stage ⅣMetastatic Merkel Cell Carcinoma: A Preplanned Interim Analysis of a Clinical Trial[J]. JAMA Oncol, 2018, 4(9): e180077. DOI:10.1001/jamaoncol.2018.0077 |
| [19] |
D'Angelo SP, Bhatia S, Brohl AS, et al. Avelumab in patients with previously treated metastatic Merkel cell carcinoma: long-term data and biomarker analyses from the single-arm phase 2 JAVELIN Merkel 200 trial[J]. J Immunother Cancer, 2020, 8(1): e000674. DOI:10.1136/jitc-2020-000674 |
| [20] |
Harms PW, Harms KL, Moore PS, et al. The biology and treatment of Merkel cell carcinoma: current understanding and research priorities[J]. Nat Rev Clin Oncol, 2018, 15(12): 763-776. DOI:10.1038/s41571-018-0103-2 |
| [21] |
Knepper TC, Montesion M, Russell JS, et al. The Genomic Landscape of Merkel Cell Carcinoma and Clinicogenomic Biomarkers of Response to Immune Checkpoint Inhibitor Therapy[J]. Clin Cancer Res, 2019, 25(19): 5961-5971. DOI:10.1158/1078-0432.CCR-18-4159 |
| [22] |
Tarabadkar ES, Thomas H, Blom A, et al. Clinical Benefit from Tyrosine Kinase Inhibitors in Metastatic Merkel Cell Carcinoma: A Case Series of 5 Patients[J]. Am J Case Rep, 2018, 19: 505-511. DOI:10.12659/AJCR.908649 |
| [23] |
Akaike T, Qazi J, Anderson A, et al. High somatostatin receptor expression and efficacy of somatostatin analogues in patients with metastatic Merkel cell carcinoma[J]. Br J Dermatol, 2021, 184(2): 319-327. DOI:10.1111/bjd.19150 |
 2023, Vol. 50
2023, Vol. 50