文章信息
- 外周血生物标志物与免疫检查点抑制剂治疗晚期食管癌疗效的相关性
- Correlation Between Peripheral Blood Biomarkers and Immune Checkpoint Inhibitors in Treatment of Advanced Esophageal Cancer
- 肿瘤防治研究, 2023, 50(1): 58-62
- Cancer Research on Prevention and Treatment, 2023, 50(1): 58-62
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0695
- 收稿日期: 2022-06-21
- 修回日期: 2022-10-31
食管癌是全球第七大常见癌症和第六大癌症相关死亡原因,2020年约有60.4万例新发病例和54.4万例死亡病例[1]。晚期食管癌患者的预后较差,5年生存率低于5%。近年来随着免疫治疗的不断发展,晚期食管癌的治疗已经全线进入以免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)为代表的时代,ICIs在晚期食管癌治疗中从后线向前线推进[2]。以CheckMate649为代表的多项临床试验数据均显示ICIs联合化疗能显著改善晚期食管癌患者的无进展生存期(PFS)和总生存期(OS)[3]。尽管如此,部分食管癌患者仍无法从免疫治疗中获益,甚至一部分接受ICIs治疗的患者出现了疾病的超进展或致命的不良反应。因此需要新型生物标志物识别可获益患者。目前常用的生物标志物,如程序性死亡蛋白配体1(PD-L1)、肿瘤突变负荷(tumormutation burden, TMB)、微卫星不稳定性(microsatellite instability, MSI)都需要侵入性操作,并且有一定比例的PD-L1表达阴性或TMB低表达的患者仍然可以从免疫治疗中受益[4]。因此,迫切需要发现具有成本效益且有效的生物标志物来筛选可从免疫治疗中受益的人群。有研究表明,肿瘤发生、进展与炎性反应密切相关,因为炎性细胞促进癌细胞增殖、血管生成和肿瘤侵袭,甚至影响一些抗癌药物的疗效[5]。中性粒细胞淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、单核细胞与淋巴细胞的比率(monocyte to lymphocyte ratio, MLR)和血小板淋巴细胞比值(platelet to lymphocyte ratio, PLR)作为预后生物标志物已用于预测非小细胞肺癌(NSCLC)、肾癌和卵巢癌等恶性肿瘤对免疫治疗的反应[5-8]。本研究回顾性分析了61例接受ICIs治疗的食管癌患者治疗前(记为0)后(记为1)外周血标志物表达特征,确定LDH0/1、NLR0/1、PLR0/1、LDH0/1与ICIs疗效和预后的相关性。
1 资料与方法 1.1 一般资料收集武汉大学人民医院肿瘤中心2018年12月至2022年2月间接受PD-1/PD-L1治疗的晚期食管癌患者临床资料,共61例。患者纳入标准:(1)病理组织学明确诊断为食管癌;(2)TNM分期Ⅲb~Ⅳ期;(3)接受PD-1/PD-L1免疫检查点抑制剂治疗;(4)至少接受2个周期的PD-1/PD-L1免疫检查点抑制剂治疗(21天为1周期)。临床资料主要包括性别、年龄、吸烟状态、病理类型、临床分期、ICIs的选用情况、治疗方案、免疫治疗前及免疫治疗两周期后外周血指标。
1.2 研究内容ICIs药物包括信迪利单抗、帕博利珠单抗、卡瑞利珠单抗、替雷利珠单抗、特瑞普利单抗、度伐利尤单抗。化疗药物包括白蛋白紫杉醇、奥沙利铂、卡铂、吉西他滨、奈达铂、多西他赛、紫杉醇、卡培他滨等;ICIs和化疗药物多采用静脉注射方法,每21天重复一次。免疫联合治疗模式:免疫单药、免疫联合化疗、免疫联合抗血管治疗、免疫联合化疗及抗血管治疗。
外周血生物指标主要来自两个时间点:患者第一次接受ICIs治疗前(T0)、ICIs治疗两周期时(T1)。指标主要包括中性粒细胞淋巴细胞比值(NLR)=中性粒细胞的绝对数/淋巴细胞的绝对数,血小板淋巴细胞比值(PLR)=血小板/淋巴细胞的绝对数,纤维蛋白原白蛋白比值(fibrinogen to albumin ratio, FAR)=纤维蛋白原/白蛋白,乳酸脱氢酶(lactate dehydrogenase, LDH)由血生化结果直接获取。
1.3 观察指标根据《实体瘤疗效评价标准1.1版本》进行疗效评价,包括完全缓解(CR):所有靶病灶消失;部分缓解(PR):目标病灶直径之和至少减少30%;疾病进展(PD):靶病灶的直径之和至少增加20%;疾病稳定(SD):疗效评价介于PR和PD之间。计算客观缓解率(ORR)及疾病控制率(DCR)。PFS为从接受ICIs治疗开始到第一次记录疾病进展或末次随访时间,或者任何原因死亡的时间。患者随访方式主要包括电话随访及门诊复查。
1.4 统计学方法采用SPSS26.0软件进行数据分析,计数资料以例数和率(%)描述,计量资料以最大值、最小值及中位数进行统计描述。Pearson卡方检验(当列联表中少于5个预期计数时采用Fisher精确检验)用于分析短期疗效与基线特征的关系。Kaplan-Meier法进行生存分析,Log rank检验进行比较。Cox回归模型寻找与PFS相关的独立指标。X-tile软件确定连续性疗效预测指标的最佳截断值。P < 0.05为差异有统计学意义。
2 结果 2.1 患者基线临床特征本研究共纳入61例晚期食管癌患者。患者临床资料完整,见表 1。

|
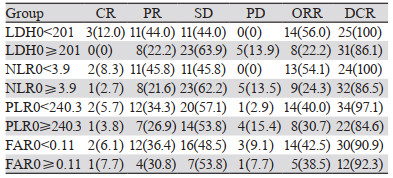
61例接受免疫检查点抑制剂治疗晚期食管癌患者中,CR 3例、PR 19例、SD 34例、PD 5例。按外周血生物指标截断值分层进行亚组分析,结果显示:LDH0 < 201组患者ORR为56.0%,DCR为100%,优于LDH0≥201组,且ORR差异有统计学意义(χ2=11.086, P=0.011);NLR0 < 3.9组患者ORR为54.1%,DCR为100%,优于NLR0≥3.9组,但ORR差异无统计学意义(χ2=7.681, P=0.055);PLR0 < 240.3组患者ORR为40.0%,DCR为97.1%,优于PLR0≥240.3组,但ORR差异无统计学意义(χ2=3.251, P=0.355);FAR0 < 0.11组患者ORR为42.5%,优于FAR0≥0.11组,但ORR差异无统计学意义(χ2=0.197, P=0.978),见表 2。
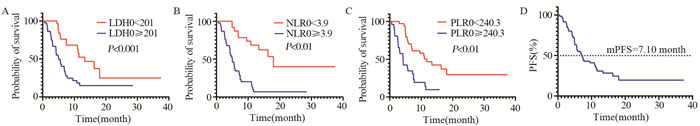
入组患者中位PFS为7.10个月(95%CI: 5.12~9.07)。根据X-tile软件确定的最佳截断值分组显示,接受免疫治疗前LDH0 < 201.0的患者PFS明显优于LDH0≥201.0的患者(13.4月vs. 5.0月,P < 0.01);接受免疫治疗前NLR0 < 3.9的患者PFS明显优于NLR0≥3.9的患者(18.0月vs. 5.0月,P < 0.01);接受免疫治疗前PLR0 < 240.3的患者PFS明显优于NLR0≥240.3的患者(11.7月vs. 4.2月,P < 0.01);然而接受免疫治疗前FAR0 < 0.11的患者较FAR0≥0.11的患者PFS无明显改变(7.5月vs. 5.6月,P=0.065),差异无统计学意义,见图 1。
|
| A: Kaplan-Meier survival curves of LDH0 at the cutoff value (P < 0.001); B: Kaplan-Meier survival curves of NLR0 at the cutoff value (P < 0.01); C: Kaplan-Meier survival curves of PLR0 at the cutoff value (P < 0.01); D: survival curve of PFS of 61 patients. 图 1 基线外周血标志物与PFS之间的关系 Figure 1 Association between baseline peripheral blood markers and PFS |
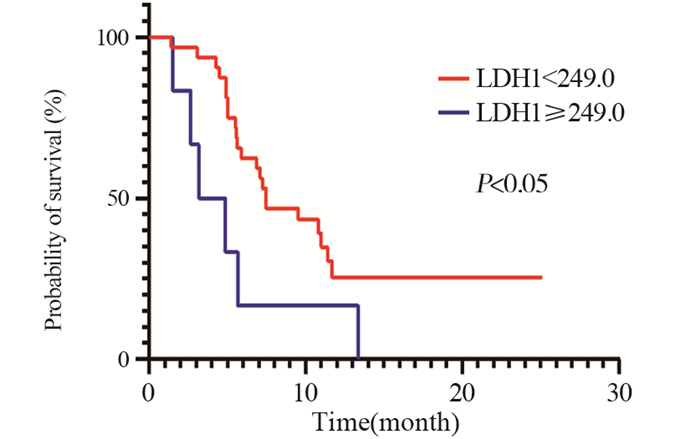
免疫治疗两周后LDH1 < 249.0的患者较LDH1≥249.0的患者PFS明显延长(7.5月vs. 3.2月,P < 0.05),见图 2,然而免疫治疗两周后NLR1、PLR1、FAR1对于患者PFS无明显提升(均P > 0.05)。
|
| 图 2 LDH1在截止值处的Kaplan-Meier生存曲线 Figure 2 Kaplan-Meier survival curves of LDH1 at the cutoff value |
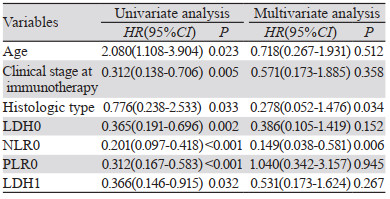
纳入7个变量,包括年龄、疾病分期、病理类型、LDH0、NLR0、PLR0、LDH1。Cox多元回归分析结果显示:病理类型、NLR0是食管癌患者PFS的独立预后因素,见表 3。
免疫治疗已然引领肿瘤进入全新的治疗时代,但仍然缺乏可以评估治疗反应和预测预后的生物标志物。此前PD-L1、错配修复或微卫星不稳定性(MMR/MSI)以及肿瘤突变负荷被美国食品药品监督管理局(FDA)推荐为免疫治疗常规检测指标[9-10]。然而以上生物标志物均受限于肿瘤组织活检,且对于患者成本效益不高。外周血生物标志物具有方便操作、成本较低等优点,与肿瘤发生发展有着密切关联,因此,探讨外周血生物标志物对于免疫治疗疗效及预测十分迫切。
近年来,多项研究表明外周血生物标志物如LDH、NLR、PLR是多种接受ICIs治疗的癌症患者的预测指标。此外,营养状况和炎性反应状况与多种癌症患者的预后相关。Diem等[11]研究表明,在52例晚期NSCLC患者中,NLR较高组与较差的OS及较低的反应率明显相关。Murakami等[12]研究报告,在不可切除食管癌患者中,NLR高组和NLR低组中位生存时间分别为9.1个月和17.1个月(P < 0.0001)。Hernando-Calvo等[13]研究表明,高LDH组患者较低LDH组患者OS与PFS均有明显改善。Pu等[14]研究表明,在184例患者中,PLR(≥200)、NLR(≥5)与较差的ORR、PFS、OS显著相关。本研究结果与既往已有研究结果基本一致,LDH、NLR、PLR与晚期食管癌患者免疫治疗疗效相关。我们进一步探究了免疫治疗后患者外周血指标与预后的关系,结果显示免疫治疗两周后LDH1 < 249.0的患者较LDH1≥249.0的患者PFS明显延长(7.5月vs. 3.2月,P < 0.05)。这对接受免疫治疗患者在治疗过程中动态观察外周血指标有重要的临床意义。
炎性和营养指标可预测免疫治疗疗效可能归因于中性粒细胞通过激活促血管生成因子(包括血管内皮生长因子)和炎性细胞因子(白细胞介素-1、转化生长因子-β等)参与炎性反应过程,可以抑制淋巴细胞和自然杀伤细胞对肿瘤细胞的杀伤活性[15-18];而淋巴细胞在抗肿瘤免疫中具有重要的作用,肿瘤区域淋巴细胞浸润的增加已被证明在实体肿瘤中有更好的治疗效果,而淋巴细胞减少反映了细胞介导免疫应答的损害[19-20];血小板支持肿瘤细胞逃避免疫系统,可以保护肿瘤细胞免疫耐受,还可以释放一些细胞因子促进肿瘤细胞的黏附[21-22];快速生长的肿瘤可产生大量LDH,因此LDH可反映肿瘤负荷[23];白蛋白直接反映肿瘤患者营养状态。在消化系统肿瘤中,营养不良发生率极高,良好的营养状态对于肿瘤患者生存结局有着不可忽视的影响[24-26]。因此,NLR、PLR和LDH的变化可预测免疫治疗疗效,这与本研究的结果基本一致。
本研究仍有许多不足之处:首先,仅涉及一个中心,总体样本量以及亚组样本量有限;其次本研究为回顾性研究,随访时间不足,无法得到足够的OS数据用于分析;再次,样本量较小,混杂因素较多,无法进行进一步的亚组分析。鉴于以上局限性,未来需要更大样本量以及相关前瞻性研究进一步验证本结论。
综上所述,NLR、PLR、LDH与食管癌患者接受免疫检查点抑制剂治疗后的预后相关,其中LDH0 < 201、NLR0 < 3.9、PLR0 < 240.3、LDH1 < 249.0与接受ICIs治疗晚期食管癌患者的预后呈正相关。这项研究结果或许能够为如何筛选晚期食管癌接受免疫检查点抑制剂治疗获益人群提供参考,有望为进一步的前瞻性研究提供有价值的线索。
作者贡献:
王培伟:设计研究方案、收集与统计数据、撰写及修改论文
翁一鸣:指导研究方案设计
崔雪:收集及整理数据
彭敏:指导研究方案设计及修改论文
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Allaire JC, Balk M, Azmi S, et al. Use of PD-1 and PD-L1 inhibitors after first-line therapy in esophageal cancer patients in the US[J]. Curr Med Res Opin, 2021, 37(8): 1403-1407. DOI:10.1080/03007995.2021.1929134 |
| [3] |
Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40. DOI:10.1016/S0140-6736(21)00797-2 |
| [4] |
Magbanua MJM, Swigart LB, Wu HT, et al. Circulating tumor DNA in neoadjuvant-treated breast cancer reflects response and survival[J]. Ann Oncol, 2021, 32(2): 229-239. DOI:10.1016/j.annonc.2020.11.007 |
| [5] |
Bartlett EK, Flynn JR, Panageas KS, et al. High neutrophil-to-lymphocyte ratio (NLR) is associated with treatment failure and death in patients who have melanoma treated with PD-1 inhibitor monotherapy[J]. Cancer, 2020, 126(1): 76-85. DOI:10.1002/cncr.32506 |
| [6] |
Russo A, Russano M, Franchina T, et al. Neutrophil-to-Lymphocyte Ratio (NLR), Platelet-to-Lymphocyte Ratio (PLR), and Outcomes with Nivolumab in Pretreated Non-Small Cell Lung Cancer (NSCLC): A Large Retrospective Multicenter Study[J]. Adv Ther, 2020, 37(3): 1145-1155. DOI:10.1007/s12325-020-01229-w |
| [7] |
柯萍, 江波, 何文杰, 等. 外周血生物标志物与PD-1/PD-L1抑制剂治疗肺癌疗效的相关性[J]. 肿瘤防治研究, 2021, 48(11): 1006-1011. [Ke P, Jiang B, He WJ, et al. Correlation Between Peripheral Blood Biomarkers and Efficacy of PD-1/PD-L1 Inhibitors Treatment on Lung Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(11): 1006-1011. DOI:10.3971/j.issn.1000-8578.2021.21.0357] |
| [8] |
Simonaggio A, Elaidi R, Fournier L, et al. Variation in neutrophil to lymphocyte ratio (NLR) as predictor of outcomes in metastatic renal cell carcinoma (mRCC) and non-small cell lung cancer (mNSCLC) patients treated with nivolumab[J]. Cancer Immunol Immunother, 2020, 69(12): 2513-2522. DOI:10.1007/s00262-020-02637-1 |
| [9] |
Kim H, Kwon HJ, Park SY, et al. Clinicopathological analysis and prognostic significance of programmed cell death-ligand 1 protein and mRNA expression in non-small cell lung cancer[J]. PLoS One, 2018, 13(6): e0198634. DOI:10.1371/journal.pone.0198634 |
| [10] |
Moretto R, Elliott A, Zhang J, et al. Homologous Recombination Deficiency Alterations in Colorectal Cancer: Clinical, Molecular, and Prognostic Implications[J]. J Natl Cancer Inst, 2022, 114(2): 271-279. DOI:10.1093/jnci/djab169 |
| [11] |
Diem S, Schmid S, Krapf M, et al. Neutrophil-to-Lymphocyte ratio (NLR) and Platelet-to-Lymphocyte ratio (PLR) as prognostic markers in patients with non-small cell lung cancer (NSCLC) treated with nivolumab[J]. Lung Cancer, 2017, 111: 176-181. DOI:10.1016/j.lungcan.2017.07.024 |
| [12] |
Murakami Y, Saito H, Shimizu S, et al. Neutrophil-to-Lymphocyte Ratio as a Prognostic Indicator in Patients With Unresectable Gastric Cancer[J]. Anticancer Res, 2019, 39(5): 2583-2589. DOI:10.21873/anticanres.13381 |
| [13] |
Hernando-Calvo A, García-Alvarez A, Villacampa G, et al. Dynamics of clinical biomarkers as predictors of immunotherapy benefit in metastatic melanoma patients[J]. Clin Transl Oncol, 2021, 23(2): 311-317. DOI:10.1007/s12094-020-02420-9 |
| [14] |
Pu D, Xu Q, Zhou LY, et al. Inflammation-nutritional markers of peripheral blood could predict survival in advanced non-small-cell lung cancer patients treated with PD-1 inhibitors[J]. Thorac Cancer, 2021, 12(21): 2914-2923. DOI:10.1111/1759-7714.14152 |
| [15] |
Galdiero MR, Marone G, Mantovani A. Cancer Inflammation and Cytokines[J]. Cold Spring Harb Perspect Biol, 2018, 10(8): a028662. DOI:10.1101/cshperspect.a028662 |
| [16] |
Teijeira A, Garasa S, Ochoa MC, et al. IL8, Neutrophils, and NETs in a Collusion against Cancer Immunity and Immunotherapy[J]. Clin Cancer Res, 2021, 27(9): 2383-2393. DOI:10.1158/1078-0432.CCR-20-1319 |
| [17] |
Swierczak A, Mouchemore KA, Hamilton JA, et al. Neutrophils: important contributors to tumor progression and metastasis[J]. Cancer Metastasis Rev, 2015, 34(4): 735-751. DOI:10.1007/s10555-015-9594-9 |
| [18] |
Hagerling C, Werb Z. Neutrophils: Critical components in experimental animal models of cancer[J]. Semin Immunol, 2016, 28(2): 197-204. DOI:10.1016/j.smim.2016.02.003 |
| [19] |
Suzuki R, Wei X, Allen PK, et al. Prognostic Significance of Total Lymphocyte Count, Neutrophil-to-lymphocyte Ratio, and Platelet-to-lymphocyte Ratio in Limited-stage Small-cell Lung Cancer[J]. Clin Lung Cancer, 2019, 20(2): 117-123. DOI:10.1016/j.cllc.2018.11.013 |
| [20] |
Wang H, Zhao J, Zhang M, et al. The combination of plasma fibrinogen and neutrophil lymphocyte ratio (F-NLR) is a predictive factor in patients with resectable non small cell lung cancer[J]. J Cell Physiol, 2018, 233(5): 4216-4224. DOI:10.1002/jcp.26239 |
| [21] |
Schlesinger M. Role of platelets and platelet receptors in cancer metastasis[J]. J Hematol Oncol, 2018, 11(1): 125. |
| [22] |
Palacios-Acedo AL, Mège D, Crescence L, et al. Platelets, Thrombo-Inflammation, and Cancer: Collaborating With the Enemy[J]. Front Immunol, 2019, 10: 1805. DOI:10.3389/fimmu.2019.01805 |
| [23] |
Manerba M, Di Ianni L, Govoni M, et al. LDH inhibition impacts on heat shock response and induces senescence of hepatocellular carcinoma cells[J]. Eur J Pharm Sci, 2017, 105: 91-98. |
| [24] |
Egenvall M, Karlsson E, Nygren-Bonnier M, et al. Associations between a composite score of hemoglobin, CRP and albumin and physical performance in older patients undergoing gastrointestinal cancer surgery[J]. Clin Nutr ESPEN, 2021, 46: 330-335. |
| [25] |
Yamamoto T, Kawada K, Hida K, et al. Combination of lymphocyte count and albumin concentration as a new prognostic biomarker for rectal cancer[J]. Sci Rep, 2021, 11(1): 5027. |
| [26] |
Ouyang X, Dang Y, Zhang F, et al. Low Serum Albumin Correlates with Poor Survival in Gastric Cancer Patients[J]. Clin Lab, 2018, 64(3): 239-245. |
 2023, Vol. 50
2023, Vol. 50