文章信息
- 102例直肠癌侧方淋巴结转移患者临床病理特点及生存预后分析
- Clinicopathological Characteristics and Survival Prognosis Analysis of 102 Rectal Cancer Patients with Lateral Pelvic Lymph Node Metastases
- 肿瘤防治研究, 2023, 50(1): 33-37
- Cancer Research on Prevention and Treatment, 2023, 50(1): 33-37
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0655
- 收稿日期: 2022-06-13
- 修回日期: 2022-08-23
2. 140900 忻州,山西医科大学附属忻州医院、第十临床医学院/忻州市人民医院普外科;
3. 050000 石家庄,国家中医临床研究基地/河北省中医院外一科
2. Department of General Surgery, Xinzhou City People's Hospital, Xinzhou 140900, China;
3. Department of General Surgery, Hebei Province Hospital of Chinese Medicine; Affiliated Hospital of Hebei University of Chinese Medicine, Shijiazhuang 050000, China
约16%~23%的局部中晚期直肠癌患者合并侧方淋巴结(LPLN)转移[1-2]。侧方淋巴结清扫术(LPLND)作为直肠癌LPLN转移的主要治疗手段之一,其疗效已被广泛证实[3-5]。日本临床肿瘤学组(JCOG)0212试验表明,与单独的全直肠系膜切除术(TME)相比,TME联合LPLND的应用并不会改善Ⅱ期和Ⅲ期直肠癌患者的总体生存率(OS),但在抑制包括LPLN在内的侧盆壁区域的局部复发有着明显积极作用[3]。此外,一项纳入来自日本两个大容量中心的1 191例行TME+LPLND的直肠癌患者的研究显示,髂内淋巴结和闭孔淋巴结转移与直肠上动脉淋巴结转移清扫后的治疗效果相当,而单侧LPLND术后局部复发的风险是双侧LPLND的两倍[4]。然而,上述研究探讨的是预防性LPLND在局部中晚期直肠癌的疗效,JCOG0212试验排除了近20%的术前影像学评估LPLN转移的患者,这与临床实际情况不符。因此,本研究旨在探讨LPLND在LPLN转移患者中的治疗效果及预后意义。
1 资料与方法 1.1 资料来源回顾性分析2012年1月—2020年12月在中国医学科学院肿瘤医院和北京大学第一医院行TME联合LPLND的中低位直肠癌患者的临床病例资料。纳入标准:(1)病理证实LPLN转移;(2)病理类型为腺癌;(3)肿瘤下缘位于腹膜返折以下。排除标准:(1)同时性远处转移;(2)既往合并其他恶性肿瘤病史;(3)未按照日本大肠癌协会(JSCCR)指南进行规范化LPLND。所有患者签署手术知情同意,本研究设计与开展经过医院伦理委员会审批通过。
1.2 诊断与治疗所有入组患者术前均完善实验室检查、胸腹盆CT、直肠MRI与肠镜。入组患者的治疗策略(例如是否行新辅助放化疗、开腹或腹腔镜)均是由多学科会诊讨论制定的结果与患者主观意愿共同决定。新辅助放化疗采用长程同步放化疗(50 Gy/25 f/ 2 Gy),放疗期间口服卡培他滨。新辅助放化疗结束后6~8周进行TME+LPLND。采用第八版AJCC分期系统进行TNM分期[6]。侧方淋巴结分为5个区域,分别为髂内淋巴结近端、髂内淋巴结远端、闭孔淋巴结、髂外淋巴结与髂总淋巴结[7]。上述区域出现的淋巴结转移定义为LPLN转移,LPLND的清扫范围定义为上述整个区域淋巴与脂肪组织的剔除。两家机构均采用保留盆腔自主神经的LPLND。
1.3 随访术后病理证实LPLN转移的患者均推荐于术后4~6周后行辅助化疗。对于术前接受新辅助放化疗的患者,术后无论病理分期均推荐行共6个月的围手术期化疗。患者术后采用门诊的方式进行随访。前两年每三个月随访一次,两年后每6个月进行一次。每次随访需完善体格检查、肿瘤标志物以及胸腹盆CT。肠镜每1年完善一次。本研究的随访截止日期为2021年12月31日。本研究的终点是3年OS与3年无瘤生存率(DFS)。
1.4 统计学方法用SPSS24.0软件对数据进行统计分析。计数资料以例数(%)表示,计量资料符合正态分布以平均数表示,否则采用中位数表示,Kaplan-Meier法进行生存曲线绘制,Long rank法进行生存时间比较,将有意义的因素纳入Cox比例风险回归模型进行多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料共102例病理LPLN转移的患者纳入本研究。其中男57例、女45例,平均年龄(56.5±12.6)岁。35例患者接受了新辅助放化疗。术后病理结果提示,LPLN转移的患者中,T分期与N分期分别以T3~T4(n=89, 87.3%)和N1~N2(n= 87, 85.3%)为主。低分化腺癌/黏液腺癌/印戒细胞癌的患者比例为44.1%(n=45)。LPLN常见转移部位依次为髂内淋巴结(n=68, 66.7%)、闭孔淋巴结(n=44, 43.1%)和髂总/髂外淋巴结(n=12, 11.8%)。10例(9.8%)患者出现双侧LPLN转移,平均LPLN转移数量为2.2±2.4,其中16例(15.7%)患者LPLN转移数量 > 2。手术入路主要以腹腔镜LPLND为主(n=75, 73.5%),其中行直肠前切除术者44例(43.1%),腹会阴联合切除术者44例(43.1%),Hartmann术者8例(7.8%),全盆腔脏器切除术者6例(5.9%)。中位手术时间与术中出血量分别为277 min和100 ml。术后恢复方面,有31例(30.4%)患者出现术后并发症,1例(1.0%)患者围手术期死亡。术后平均住院时间为(12.9±10.2)天。共有82例(78.4%)患者接受了术后辅助化疗,见表 1。

|
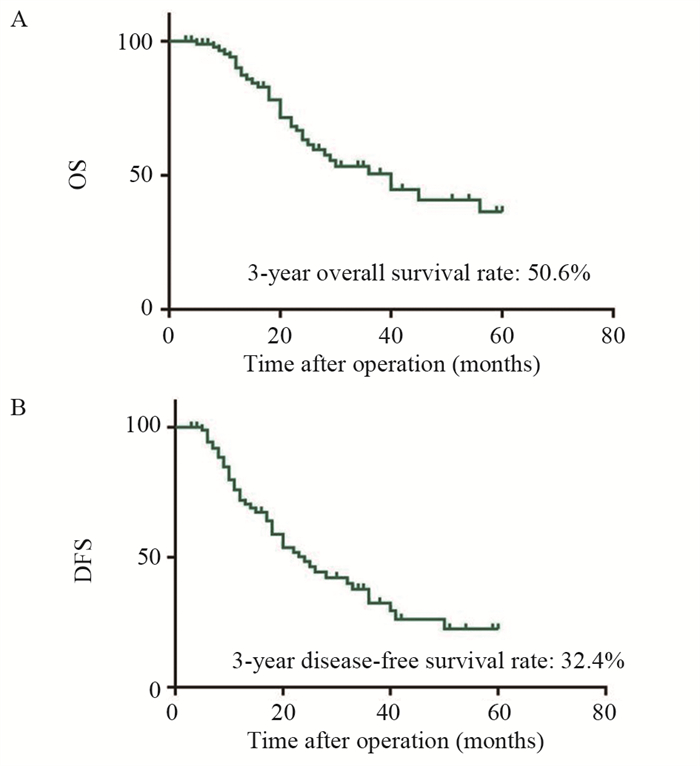
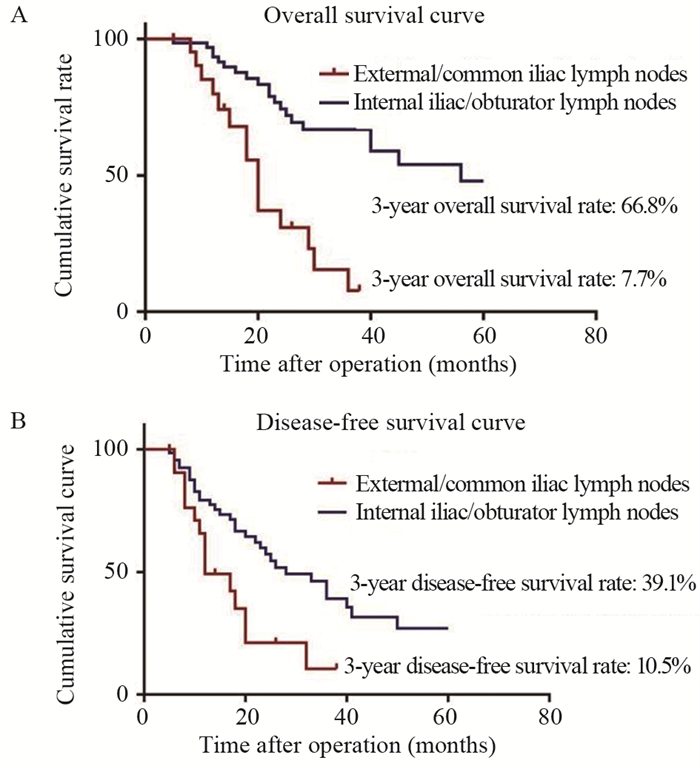
本研究中位随访时间为30个月,总体队列的3年OS与3年DFS分别为50.6%和32.4%,见图 1。单因素分析显示LPLN转移区域、LPLN转移位置、LPLN转移数量和术后并发症显著影响OS(P < 0.05)。此外,术前CEA水平、病理N分期、LPLN转移区域、LPLN转移位置、LPLN转移数量和术后并发症显著影响DFS(P < 0.05)。多因素分析显示LPLN转移至髂外/髂总是影响OS(HR=3.53; 95%CI: 1.50~8.31; P=0.004)和DFS(HR=2.40; 95%CI: 1.05~5.47; P=0.037)的共同独立危险因素,见表 2。LPLN转移至髂外/髂总淋巴结的患者的3年OS(66.8% vs. 7.7%, P < 0.001)与DFS(39.1% vs. 10.5%, P=0.012)明显低于转移至髂内/闭孔淋巴结转移的患者,见图 2。
|
| 图 1 102例直肠癌侧方淋巴结转移患者的总体生存曲线(A)无瘤生存曲线(B) Figure 1 Overall survival curve(A) and disease-free survival curve(B) of 102 rectal cancer patients with lateral pelvic lymph node metastases |
|
|
| 图 2 侧方淋巴结转移转移至髂内/闭孔和髂总/髂外患者的总体生存曲线(A)与无瘤生存曲线(B) Figure 2 Overall survival curve(A) and disease-free survival curve(B) of patients with lateral pelvic lymph node metastasis to external/common iliac lymph nodes or internal iliac/obturator lymph node |
LPLN转移是中低位直肠癌常见的转移途径之一,其治疗手段在东西方国家间仍存在争议。西方国家将LPLN转移视为远处转移(髂内淋巴结转移除外),不常规推荐LPLND,依靠新辅助放化疗来清除盆腔侧方转移灶。相反,日本学者认为LPLN转移为局部淋巴结转移,JSCCR推荐局部中晚期(cT3、T4/N+)的直肠癌患者进行标准的预防性LPLND来降低局部复发率,JCOG0212试验显示与单独TME相比,TME联合LPLND的应用并不会改善Ⅱ期和Ⅲ期直肠癌患者的OS,但在抑制包括LPLN在内的侧盆壁区域的局部复发有着明显积极作用[3]。然而,目前针对病理LPLN转移患者,治疗性LPLND的疗效与有效清扫范围仍存在争议。本研究分析了102例病理诊断LPLN转移的患者,LPLN转移区域主要局限于髂内淋巴结(n=68, 66.7%)与闭孔淋巴结(n=44, 43.1%),双侧LPLN转移率为9.8%(n=10)。预后分析发现,LPLN转移至髂外或髂总是OS和DFS的独立不良预后危险因素。
LPLN转移患者能否通过LPLND达到生存获益取决于转移灶是局部可切除治愈的还是无法控制的远处转移。日本等相关研究甚至显示LPLN转移的患者即使进行LPLND后,其远期预后亦未达到明显改善[5, 8-10]。一方面,这可能是由于LPLN转移的患者多合并肝、肺等远处微转移灶,初次就诊时难以发现,是导致LPLND术后复发转移的主要因素。另一方面,需术前对LPLN转移患者精确评估,严格把握LPLND指征。LPLN转移数量、位置往往是影响预后的关键因素[1, 11-13]。日本一项全国性多机构研究纳入了5 789例行LPLND的患者,结果显示髂内淋巴结转移预后较好,其预后与N2b期相似[1]。Kanemitsu等进行了一项纳入两个中心1 191例直肠癌患者的回顾性研究显示,髂内淋巴结和闭孔淋巴结转移在LPLND后与直肠上动脉淋巴结转移清扫后的治疗效果相当[4]。同样,Yokoyama等纳入了一项131例LPLN转移患者的回顾性研究显示,局限于髂内或者闭孔的单个LPLN转移的患者在LPLND后可以取得较好的远期预后[11]。与上述研究相似,本研究发现即使进行LPLND,髂外和髂总淋巴结转移患者的OS与DFS仅为7.7%和10.5%,明显低于髂内与闭孔转移的患者。此外,我们将LPLN转移区域、位置、数量等因素纳入Cox回归分析显示,髂外和髂总淋巴结转移是OS(HR=3.53; 95%CI: 1.50~8.31; P=0.004)和DFS(HR=2.40; 95%CI: 1.05~5.47; P=0.037)的独立不良预后因素。因此,我们认为髂外淋巴结或髂总淋巴结转移可视为全身性转移,此类患者无法通过LPLND中达到生存获益,全身综合性治疗往往是此类患者最佳的治疗选择[8]。
LPLND清扫范围直接决定了肿瘤根治性效果与预后,同时较大范围的额外清扫也会引起相应副损伤。《日本大肠癌处理规约》第9版中,将髂内血管近端、髂内血管远端、闭孔区域、髂总血管、髂外血管、骶外侧、骶正中、髂总血管规定为LPLND范围[7]。文献报道95%以上的LPLN转移发生于髂内血管与闭孔区域[14],本研究发现,88.2%的患者LPLN转移局限于髂内血管与闭孔区域。同时,LPLN转移超过闭孔和髂内血管范围后,其发生同时性转移的比例明显升高,即使行LPLND后,其5年OS依然较低[10, 13]。因此,除非在术前影像学提示有明确转移的情况下,推荐行LD2(髂内动脉近端、髂内动脉远端、闭孔区域)淋巴结清扫,在保证肿瘤根治性效果的前提下,尽可能降低手术风险与副损伤。
综上所述,LPLN转移主要位于髂内血管与闭孔区域。此外,转移至髂外或髂总淋巴结患者的生存预后无法通过LPLND改善,全身性综合治疗往往是此类患者的最佳治疗选择。随着进一步的临床实践,结论仍需大样本研究证实。
作者贡献:
周思成、武海峰:研究设计、实验实施、论文撰写及修改
潘雨婷、云红、曹少木、聂红霞:数据收集与统计学分析
兴伟:研究设计、写作指导与文章修改
梁建伟:研究设计
| [1] |
Akiyoshi T, Watanabe T, Miyata S, et al. Results of a Japanese nationwide multi-institutional study on lateral pelvic lymph node metastasis in low rectal cancer: is it regional or distant disease?[J]. Ann Surg, 2012, 255(6): 1129-1134. DOI:10.1097/SLA.0b013e3182565d9d |
| [2] |
Sugihara K, Kobayashi H, Kato T, et al. Indication and benefit of pelvic sidewall dissection for rectal cancer[J]. Dis Colon Rectum, 2006, 49(11): 1663-1672. DOI:10.1007/s10350-006-0714-z |
| [3] |
Fujita S, Mizusawa J, Kanemitsu Y, et al. Mesorectal Excision With or Without Lateral Lymph Node Dissection for Clinical Stage Ⅱ/Ⅲ Lower Rectal Cancer (JCOG0212): A Multicenter, Randomized Controlled, Noninferiority Trial[J]. Ann Surg, 2017, 266(2): 201-207. DOI:10.1097/SLA.0000000000002212 |
| [4] |
Kanemitsu Y, Komori K, Shida D, et al. Potential impact of lateral lymph node dissection (LLND) for low rectal cancer on prognoses and local control: A comparison of 2 high-volume centers in Japan that employ different policies concerning LLND[J]. Surgery, 2017, 162(2): 303-314. DOI:10.1016/j.surg.2017.02.005 |
| [5] |
Zhou S, Jiang Y, Pei W, et al. Prognostic significance of lateral pelvic lymph node dissection for middle-low rectal cancer patients with lateral pelvic lymph node metastasis: a propensity score matching study[J]. BMC Cancer, 2022, 22(1): 136. DOI:10.1186/s12885-022-09254-4 |
| [6] |
Nicholls RJ, Zinicola R, Haboubi N. Extramural spread of rectal cancer and the AJCC Cancer Staging Manual 8th edition, 2017[J]. Ann Oncol, 2019, 30(8): 1394-1395. |
| [7] |
Hashiguchi Y, Muro K, Saito Y, et al. Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2019 for the treatment of colorectal cancer[J]. Int J Clin Oncol, 2020, 25(1): 1-42. DOI:10.1007/s10147-019-01485-z |
| [8] |
Sato H, Maeda K, Maruta M. Prognostic significance of lateral lymph node dissection in node positive low rectal carcinoma[J]. Int J Colorectal Dis, 2011, 26(7): 881-889. DOI:10.1007/s00384-011-1170-3 |
| [9] |
Wang L, Hirano Y, Heng G, et al. The signifcance of lateral lymph node metastasis in low rectal cancer: a propensity score matching study[J]. J Gastrointest Surg, 2021, 25(7): 1866-1874. DOI:10.1007/s11605-020-04825-x |
| [10] |
Numata M, Tamagawa H, Kazama K, et al. Lateral lymph node dissection for mid-to-low rectal cancer: is it safe and efective in a practice-based cohort?[J]. BMC Surg, 2021, 21(1): 51. DOI:10.1186/s12893-021-01053-1 |
| [11] |
Yokoyama S, Takifuji K, Hotta T, et al. Survival beneft of lateral lymph node dissection according to the region of involvement and the number of lateral lymph nodes involved[J]. Surg Today, 2014, 44(6): 1097-1103. DOI:10.1007/s00595-013-0815-y |
| [12] |
汤坚强, 李华玉, 刘涛, 等. 低位直肠癌侧方淋巴结清扫策略30年变迁: 单中心289例治疗体会及预后分析[J]. 中华胃肠外科杂志, 2021, 24(10): 889-896. [Tang JQ, Li Huayu, Liu Tao, et al. Thirty years' changes of the strategy of lateral lymph node dissection in low rectal cancer: treatment experience and prognostic analysis of 289 cases in one single center[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2021, 24(10): 889-896. DOI:10.3760/cma.j.cn.441530-20200920-00530] |
| [13] |
Morohashi H, Sakamoto Y, Miura T, et al. Effective dissection for rectal cancer with lateral lymph node metastasis based on prognostic factors and recurrence type[J]. Int J Colorectal Dis, 2021, 36(6): 1251-1261. DOI:10.1007/s00384-021-03870-5 |
| [14] |
Ogura A, Konishi T, Cunningham C, et al. Neoadjuvant (Chemo)radiotherapy With Total Mesorectal Excision Only Is Not Sufficient to Prevent Lateral Local Recurrence in Enlarged Nodes: Results of the Multicenter Lateral Node Study of Patients With Low cT3/4 Rectal Cancer[J]. J Clin Oncol, 2019, 37(1): 33-43. DOI:10.1200/JCO.18.00032 |
 2023, Vol. 50
2023, Vol. 50


