文章信息
- 阿克替苷通过调控ERK1/2信号通路抑制肝癌细胞上皮间质转化
- Acteoside Inhibits Epithelial Mesenchymal Transformation of Hepatoma Cells Through Regulation of ERK1/2 Signaling Pathway
- 肿瘤防治研究, 2023, 50(1): 12-17
- Cancer Research on Prevention and Treatment, 2023, 50(1): 12-17
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0535
- 收稿日期: 2022-05-17
- 修回日期: 2022-11-22
肝细胞癌(hepatocellular carcinoma, HCC)是全球危害人类健康常见的恶性肿瘤之一。由于肿瘤复杂的发病机制和异质性,就诊时多数已发生肝内外转移,预后较差。阿克替苷(acteoside, ACT),是一种水溶性的苯丙素苷类化合物,具有抗氧化[1]、抗炎[2]、抗菌[3]、抗动脉粥样硬化[4]、抗肿瘤[5]等多种药理活性。ACT在肝癌细胞中的具体作用和机制尚无更深入的研究。
上皮间质转化(epithelial-mesenchymal transitions, EMT)作为恶性肿瘤侵袭和转移的第一步,是一个动态、可逆的过程,而抑制EMT发生可作为抑制肿瘤侵袭及转移的一种重要手段。恶性肿瘤的发生和发展与细胞信号转导通路的异常调控有关[6]。细胞外信号调节激酶1/2(extracellular signal regulated kinase1/2, ERK1/2)作为MAPK信号通路的亚通路在肝癌细胞的EMT、侵袭及迁移过程中发挥重要作用[7]。目前尚未见有关ACT通过ERK1/2信号通路影响肝癌细胞EMT的具体作用和机制的研究报道。因此,本实验拟初步探讨ERK1/2信号通路在肝癌细胞中的表达,并通过细胞学实验探讨中草药化合物ACT与肝癌生物学机制的相关性,为ACT治疗肝癌提供实验依据和理论基础。
1 材料与方法 1.1 细胞株和试剂人肝癌HCCLM3细胞(中国上海科学院上海细胞库);ACT(南京景竹生物科技有限公司);高糖DMEM培养基、0.25%胰蛋白、CCK-8试剂(均购自美国Gibco公司);胎牛血清(美国沃卡威生物技术有限公司);PBS(美国Labconco公司);无血清冻存液(英国Whatman公司);0.1%结晶紫(北京索莱宝生物科技有限公司);ERK1/2抑制剂PD98059、SteadyPure通用型RNA提取试剂盒、Evo M-MLV反转录试剂预混液、SYBR Green Premix Pro Taq HS qPCR Kit(均购自美国MedChemExpress公司);5×蛋白上样缓冲液、RIPA强裂解液、PMSF裂解液、10% SDS、Tris-HCL缓冲液、PAGE胶凝固剂、促凝剂、BCA蛋白浓度测定试剂盒和ECL Plus化学发光显色液(均购自北京Solarbio科技有限公司);E-cadherin抗体(ab231303)、N-cadherin抗体(ab76011)(均购自英国Abcam公司);ERK1/2抗体(AF0155)、p-ERK1/2抗体(AF1015)、Beta actin抗体(AF7018)、辣根酶标记酶山羊抗兔IgG(S0001)(均购自美国Affinity公司)。
1.2 方法 1.2.1 细胞培养肝癌HCCLM3细胞用含10%胎牛血清、青霉素和链霉素双抗(1×105u/L)的高糖DMEM培养液,常规复苏细胞后,置于37℃、5% CO2细胞培养箱中培养,待细胞生长至80%~90%时,用0.25%胰蛋白酶消化,进行细胞换液、传代、冻存或用于后续实验。
1.2.2 CCK-8法检测细胞的增殖按药物浓度设置5组(0、40、80、120、160 µmol/L),取对数生长期的肝癌HCCLM3细胞,各组按5×103个细胞/孔接种于3个96孔板,每组设置5个复孔,细胞培养板置于培养箱中培养24 h。待细胞贴壁后,加入上述不同浓度的ACT药物,分别继续培养24、48、72 h后,每孔加入10 µl CCK-8溶液培养30 min,酶标仪检测450 nm波长处各孔吸光度(OD)值,分析细胞的增殖能力,根据OD值计算细胞抑制率,并筛选出最佳抑制浓度和时间。
细胞抑制率=(对照组OD值-实验组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3 划痕实验检测细胞的运动能力在铺板前用Marker笔在6孔板背面均匀划横线,每孔3~5条。将肝癌HCCLM3细胞按5×105个/孔接种于培养板中,每组设置3个复孔,置于37℃、5%CO2恒温培养箱中,待75%~85%细胞贴壁后用10 µl枪头垂直划痕。磷酸盐缓冲溶液PBS洗细胞3次,加入不同浓度ACT。分别在0、12、24 h后每孔选取5个视野在显微镜下拍照记录。
1.2.4 Transwell实验检测肝癌细胞侵袭及迁移实验在4℃条件下将基质胶按1:8稀释,吸取60 µl包被Transwell小室上室面,置于培养箱使基质胶聚合成凝胶。取对数生长期的细胞,细胞贴壁后加入不同浓度的ACT处理24 h。制备细胞悬液,用无血清培养基重悬细胞。计数并调整细胞密度为(1×104~1×105)个/毫升。吸取200 µl细胞悬液加入小室。24孔板下室加入600 µl含20%血清的培养基,培养24 h。取出小室,放入烧杯中PBS洗2遍,95%乙醇固定30 min。用0.1%结晶紫染色30 min,PBS清洗3遍。放置在显微镜下观察,分别选取五个视野,用Image J软件计数穿过小室的肝癌细胞数。迁移实验在小室底部膜的上室不铺胶,其余步骤同侵袭实验。实验重复3次。
1.2.5 实时定量PCR检测ACT对ERK1/2信号通路和EMT相关基因mRNA的表达不同浓度的ACT处理细胞24 h,按照SteadyPure通用型RNA提取试剂盒说明书进行操作,分别提取细胞的总RNA,荧光定量PCR仪检测ERK1/2信号通路和EMT相关基因在mRNA水平的表达量。ERK1基因上游引物序列为5'-TCAACACCACCTGCGACCT-3',下游为5'-CGTAGCCACCTGCGACCT-3';ERK2基因上游引物为5'-TGGAGCAGTATTACGACCCG-3',下游为5'-TTGAGCTTTTCCTTAGGCAAGT-3';E-cadherin基因上游引物为5'-GCCCCGCCTTATGATTCTC-3';下游为5'-GCCCCATTCGTTCAAGTAGTC-3';N-cadherin上游基因引物为5'-ACCAGGTTTGGAATGGGACA-3',下游为5'-TTGGGTGAAGGGGTGCTTG-3';GAPDH基因上游引物为5'-TGTGTCCGTCGTGGATCTGA-3',下游为5'-TTGCTGTTGAAGTCGCAGAG-3'。反转录条件为37℃ 15 min,85℃ 5 s,4℃。PCR扩增反应采用Real-time PCR试剂盒SYBR Green Premix Pro Taq HS qPCR Kit进行,反应条件为95℃预变性30 s,95℃ 5 s,60℃ 30 s进行40个循坏,所有信息由荧光定量PCR仪收集。2-ΔΔct法分析实验数据。
1.2.6 蛋白质印迹实验检测ACT对ERK1/2信号通路和EMT相关蛋白的表达取对数生长期的肝癌细胞,加入无血清培养基饥饿细胞24 h,加入不同浓度ACT处理24 h,按细胞裂解液说明书提取细胞蛋白。按照BCA试剂盒说明书,检测各组蛋白浓度。蛋白上样每孔取20 µg蛋白。蛋白电泳条件是上胶80 V,30 min,分离胶120 V,1.5 h,电泳后用1×TBST清洗3次、每次8 min后进行转膜,转膜条件是2300 MA、转膜2 h。转膜后用含5%脱脂奶粉封闭2 h,封闭完成后分别添加一抗anti-ERK1/2(1:1 000)、anti-p-ERK1/2(1:2 000)、anti-E-cadherin(1:1 000)、anti-N-cadherin(1:10 000)、anti-Beta actin(1:1 0000),4℃孵育过夜,1×TBST缓冲液洗膜3次,添加二抗IgG(1:5 000)室温孵育1 h,洗膜,ECL化学发光液曝光,拍照记录,使用Image J软件计算条带灰度值,并分析结果。
1.3 统计学方法采用SPSS25.0和GraphPad Prism 8.0软件进行数据统计分析。计量资料用均数±标准差(x±s)表示;多组之间比较用单因素方差分析,两组间比较用t检验分析;P < 0.05为差异有统计学意义。
2 结果 2.1 ACT对肝癌细胞增殖的影响随着ACT药物浓度和作用时间的增加,可明显抑制肝癌HCCLM3细胞的增殖。当ACT浓度在160 µmol/L且作用时间为24 h时,其对人肝癌HCCLM3细胞的抑制作用最明显,并计算IC50约为102 µmol/L,见表 1。因此,依据上述实验结果,我们拟选择ACT低浓度80 µmol/L和高浓度120 µmol/L、且作用时间为24 h进行后续实验。
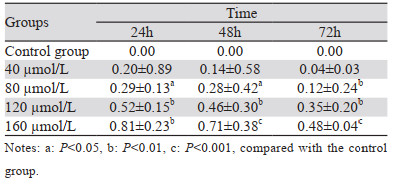
|
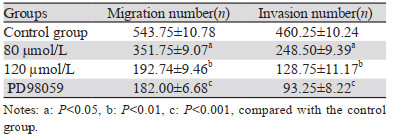
将实验分为4组,即对照组(0 µmol/L)、ACT浓度80 µmol/L组、ACT浓度120 µmol/L组、阳性对照组(PD98059抑制剂组)。划痕实验结果显示,四组肝癌HCCLM3细胞作用0、12、24 h后,与对照组相比,随着ACT药物浓度增加细胞迁移能力明显降低;与PD98059抑制剂组相比,ACT浓度80 µmol/L和120 µmol/L组细胞迁移能力差异无统计学意义(P > 0.05),见图 1、表 2。Transwell迁移实验表明,4组肝癌细胞作用24 h后,80 µmol/L和120 µmol/L ACT组细胞的迁移数与对照组相比,差异有统计学意义(P < 0.001),PD98059抑制剂组与120 µmol/L组相比,差异无统计学意义(P > 0.05),见图 2、表 2。

|
| 图 1 划痕实验检测ACT对肝癌HCCLM3细胞迁移能力的影响(×10) Figure 1 Effect of ACT on migration ability of hepatocellular carcinoma HCCLM3 cells by scratch test (×10) |
|

|
| 图 2 Transwell实验检测ACT对肝癌HCCLM3细胞迁移能力的影响(×20) Figure 2 Effect of ACT on migration ability of hepatocellular carcinoma HCCLM3 cells by Transwell test (×20) |
Transwell侵袭实验表明,作用24 h后,与对照组相比,ACT 80 µmol/L组侵袭细胞数差异有统计学意义(P < 0.05);PD98059抑制剂组与120 µmol/L组相比,差异无统计学意义(P > 0.05),见图 3和表 2。这表明ACT能抑制肝癌HCCLM3细胞的侵袭能力,并随药物浓度增加其能力越弱。

|
| 图 3 Transwell侵袭实验检测ACT对肝癌HCCLM3细胞侵袭能力的影响(×20) Figure 3 Effect of ACT on invasion ability of hepatoma HCCLM3 cells by Transwell test (×20) |
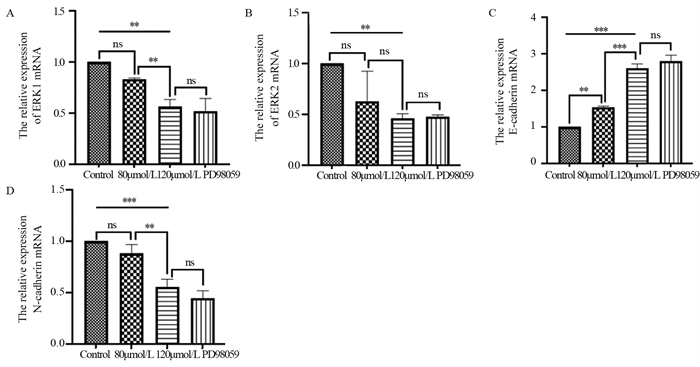
对照组ERK1 mRNA的表达与ACT 120 µmol/L组比较,差异有统计学意义(P < 0.01),见图 4A;ACT 120 µmol/L组和PD98059抑制剂组比较,差异无统计学意义(P > 0.05)。ACT 120 µmol/L组ERK2 mRNA的表达与对照组相比,差异有统计学意义(P < 0.01);而其余各组差异均无统计学意义,见图 4B。这表明ACT对肝癌细胞的作用与ERK1/2信号通路相关。
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, ns: no statistical difference. 图 4 ACT对肝癌细胞ERK1(A)、ERK2(B)、E-cadherin(C)、N-cadherin(D) mRNA的表达 Figure 4 Effect of ACT on mRNA expression of ERK1(A), ERK2(B), E-cadherin(C), and N-cadherin(D) in hepatocellular carcinoma cells |
与对照组相比,各实验组E-cadherin mRNA表达上调,见图 4C;而ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05)。与对照组相比,各实验组N-cadherin mRNA表达明显下调,且随着药物浓度的增高下调更显著;ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05),见图 4D。
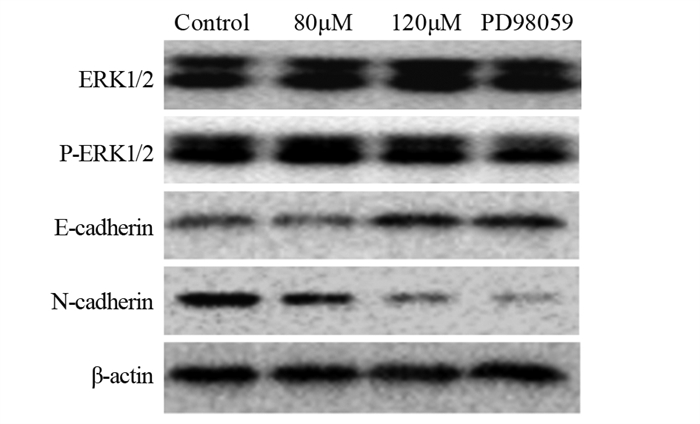
2.5 ACT通过ERK1/2信号通路对肝癌细胞EMT相关蛋白的影响 2.5.1 ACT对ERK1/2信号通路蛋白的影响Western blot法测定各组细胞中ERK1/2、p-ERK1/2信号通路关键蛋白的表达水平,见图 5。各组ERK1/2蛋白的表达差异无统计学意义(P > 0.05),见图 6A~B。
|
| 图 5 肝癌细胞ERK1/2、p-ERK1/2、E-cadherin、N-cadherin蛋白表达 Figure 5 Protein expression of ERK1/2, p-ERK1/2, E-cadherin and N-cadherin in hepatocellular carcinoma cells |
与对照组相比,各实验组E-cadherin蛋白的表达明显上调,其中,ACT 120 μmol/L组上调更显著(P < 0.0001);而ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05),见图 6C。与对照组相比,各实验组间N-cadherin蛋白的表达明显下调,差异有统计学意义;ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05),见图 6D。
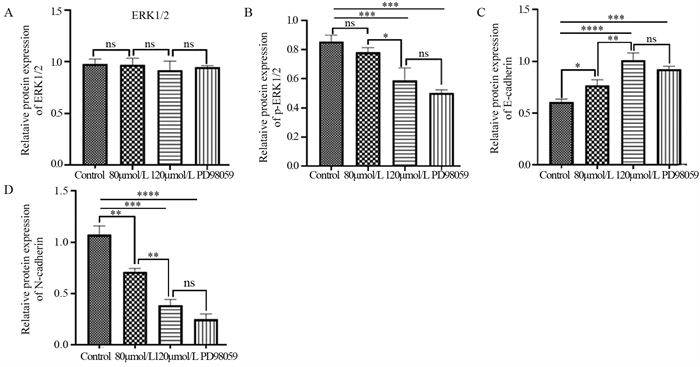
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, ****: P < 0.0001; ns: no statistical difference. 图 6 ACT对肝癌细胞ERK1/2(A)、p-ERK1/2(B)、E-cadherin(C)、N-cadherin(D)蛋白水平的影响 Figure 6 Effect of ACT on protein levels of ERK1/2(A), p-ERK1/2(B), E-cadherin(C) and N-cadherin(D) |
ACT是从多种中草药中提取的一种水溶性化合物,可通过多靶点、多途径抑制恶性肿瘤,如口腔鳞状细胞癌[8]、结肠癌[9]和胶质细胞瘤[10]的发生和发展。本课题组前期研究表明,ACT可通过调控ERK5、p38MAPK、JNK信号通路进而抑制肝癌细胞的生物学变化[7, 11-12]。ERK1/2作为MAPK信号通路的亚通路,其是否也可影响肝癌细胞的EMT尚无报道。为了进一步研究ACT是否通过调控ERK1/2信号通路抑制肝癌HCCLM3细胞的EMT、侵袭和转移,本实验发现,ACT可明显抑制肝癌HCCLM3细胞的增殖、侵袭和迁移。
ERK1/2是MAPK信号通路的亚通路,越来越多的研究表明其在肝细胞癌中异常表达。Zhao等[13]的研究表明槲皮素作为一种有效的肝脏保护剂,在肝癌晚期可通过MEK1/ERK1/2信号通路进而抑制癌细胞增殖和扩散。赵嘉琪[14]发现,人参皂苷CK可通过调控ERK1/2通路诱导人肝癌细胞的增殖和线粒体凋亡。李玉龙等[15]的研究表明,高浓度健脾解毒方能延缓荷瘤鼠恶液质的发生和进展,这提示可能与健脾解毒方上调TCR、ERK1/2及p-ERK1/2有关。吴志贤等[16]通过构建慢病毒表达载体介导siRNA沉默Id-1,抑制人肝癌细胞HepG2裸鼠皮下移植瘤的生长,其机制可能与调控ERK1/2 MAPK信号通路有关。本研究结果显示,ACT作用于肝癌细胞后p-ERK1/2蛋白和mRNA的表达显著降低(P < 0.05),且呈浓度依赖性,而120 µmol ACT与PD98059抑制剂组相比差异无统计学意义(P > 0.05)。据此,我们推测ACT可通过下调ERK1/2信号通路进而抑制人肝癌HCCLM3细胞的增殖、侵袭及迁移。
EMT的发生是多种蛋白分子、生长因子和转录因子共同作用的结果。肝癌细胞的侵袭迁移与EMT的发生发展密切相关。EMT发生的特点为上皮细胞连接蛋白E-钙黏蛋白基因的表达下调,蛋白质产物N-钙黏蛋白、波形蛋白上调,进而促进间充质黏附。文献[17]表明,小檗胺可抑制人肝癌SMMC-7721细胞侵袭转移,其机制可能与其调控EMT相关蛋白的表达有关。刘博佳等[18]实验显示,羽扇豆醇可抑制异种移植HepG2细胞荷瘤小鼠肿瘤的生长,肿瘤组织中E-cadherin蛋白表达增高,N-cadherin蛋白表达降低。本实验前期研究也证实,ACT可抑制肝癌HepG2细胞基质金属蛋白酶的表达,进而抑制肝癌的侵袭及转移[7]。在前期研究的基础上进一步发现,ACT处理后人肝癌HCCLM3细胞中E-cadherin蛋白和mRNA表达明显增加,而N-cadherin的表达明显下降。进一步证实ACT可抑制肝癌细胞EMT的发生,其可能通过下调ERK1/2信号通路来实现,其具体作用机制与EMT相关蛋白E-cadherin、N-cadherin的表达有关。
综上,ACT可通过调控ERK1/2信号通路进而抑制人肝癌HCCLM3细胞上皮间质转化,其具体作用与E-cadherin表达的上调和N-cadherin表达的下调有关。本实验仅是在体外细胞水平研究,仍需行体内实验进一步研究,进而为后续中草药化合物ACT在临床上的进一步开发利用提供理论基础和实验依据。
作者贡献:
袁倩倩:实验操作、结果整理及论文撰写
何昱静、温雪、张久聪、郑英、卢利霞、李斌:数据统计分析
于晓辉:实验设计及文稿审校
| [1] |
Alipieva K, Korkina L, Orhan IE, et al. Verbascoside——a review of its occurrence, (bio)synthesis and pharmacological significance[J]. Biotechnol Adv, 2014, 32(6): 1065-1076. DOI:10.1016/j.biotechadv.2014.07.001 |
| [2] |
Pesce M, Franceschelli S, Ferrone A, et al. Verbascoside down-regulates some pro-inflammatory signal transduction pathways by increasing the activity of tyrosine phosphatase SHP-1 in the U937 cell line[J]. J Cell Mol Med, 2015, 19(7): 1548-1556. DOI:10.1111/jcmm.12524 |
| [3] |
Maquiaveli CDC, Rochetti AL, Fukumasu H, et al. Antileishmanial activity of verbascoside: Selective arginase inhibition of intracellular amastigotes of Leishmania (Leishmania) amazonensis with resistance induced by LPS plus IFN-γ[J]. Biochem Pharmacol, 2017, 127: 28-33. DOI:10.1016/j.bcp.2016.12.018 |
| [4] |
Fan Y, Zhang K. Verbascoside inhibits the progression of atherosclerosis in high fat diet induced atherosclerosis rat model[J]. J Physiol Pharmacol, 2021, 72(3): 329-337. |
| [5] |
Zhang Y, Yuan Y, Wu H, et al. Effect of verbascoside on apoptosis and metastasis in human oral squamous cell carcinoma[J]. Int J Cancer, 2018, 143(4): 980-991. DOI:10.1002/ijc.31378 |
| [6] |
潘琦璐, 马礼兵. 上皮-间质转化在恶性肿瘤发病和侵袭转移中的作用研究进展[J]. 实用医学杂志, 2020, 36(17): 2443-2447. [Pan QL, Ma LB. The role of epithelial-mesenchymal transition in the pathogenesis, invasion and metastasis of malignant tumors[J]. Shi Yong Yi Xue Za Zhi, 2020, 36(17): 2443-2447.] |
| [7] |
熊婉媛, 侯怀晶, 于晓辉, 等. 肝细胞癌的发生、发展与p38MAPK信号通路关系的研究进展[J]. 肝脏, 2018, 23(8): 736-739. [Xiong WY, Hou HJ, Yu XH, et al. Study on the relationship between p38MAPK signaling pathway and hepatocellular carcinoma[J]. Gan Zang, 2018, 23(8): 736-739. DOI:10.3969/j.issn.1008-1704.2018.08.029] |
| [8] |
Yan Z, Xiao Y, Chen Y, et al. Screening and identification of epithelial-to-mesenchymal transition-related circRNA and miRNA in prostate cancer[J]. Pathol Res Pract, 2020, 216(2): 152784. DOI:10.1016/j.prp.2019.152784 |
| [9] |
Gunaratne A, Chan E, El-Chabib TH, et al. Apkc alters the tgfbeta response in nsclc cells through both smad-dependent and smad-independent pathways[J]. J Cell Sci, 2015, 128(3): 487-498. |
| [10] |
Sorrentino A, Thakur N, Grimsby S, et al. The type i tgf-beta receptor engages traf6 to activate tak1 in a receptor kinase-independent manner[J]. Nat Cell Biol, 2008, 10(10): 1199-1207. DOI:10.1038/ncb1780 |
| [11] |
张裕. 毛蕊花糖苷通过ERK5信号通路影响肝癌细胞侵袭及迁移的实验研究[D]. 甘肃中医药大学, 2020. [Zhang Y. The study of Verbascoside on invasion and migration of hepatocarcinoma cells through ERK5 signaling pathway[D]. Gansu University of Chinese Medicine, 2020.]
|
| [12] |
朱博兰. 毛蕊花糖苷通过JNK信号通路影响肝癌细胞增殖及自噬的实验研究[D]. 兰州大学, 2020. [Zhu BL. Verbascoside affect the proliferation and autophagy of HCC cells by regulating the JNK signaling pathway[D]. Lanzhou University, 2020.]
|
| [13] |
Zhao X, Wang J, Deng Y, et al. Quercetin as a protective agent for liver diseases: A comprehensive descriptive review of the molecular mechanism[J]. Phytother Res, 2021, 35(9): 4727-4747. DOI:10.1002/ptr.7104 |
| [14] |
赵嘉琪, 苏杰琳, 陈佳欣, 等. 人参皂苷CK通过调控ERK1/2通路诱导人肝癌细胞线粒体凋亡作用机制的研究[J]. 时珍国医国药, 2021, 32(5): 1094-1097. [Zhao JQ, Su JL, Chen JX, et al. Effect of ginsenoside CK on mitochondrial apoptosis in human hepatocellular carcinoma cells by regulating ERK1/2 pathway[J]. Shi Zhen Guo Yi Guo Yao, 2021, 32(5): 1094-1097. DOI:10.3969/j.issn.1008-0805.2021.05.19] |
| [15] |
李玉龙, 卢丽莎, 孙保国, 等. 健脾解毒方对脾虚肝癌大鼠生存的影响及与TCR、ERK1/2信号通路的关系[J]. 光明中医, 2019, 34(12): 1813-1817. [Li YL, Lu LS, Sun BG, et al. Effect of Jianpi Jiedu Decoction on survival of liver cancer rats with spleen deficiency and its relationship with TCR and ERK1/2 signaling pathways[J]. Guang Ming Zhong Yi, 2019, 34(12): 1813-1817. DOI:10.3969/j.issn.1003-8914.2019.12.016] |
| [16] |
吴志贤, 曾达武, 林苏, 等. 慢病毒载体介导siRNA沉默Id-1通过ERK1/2信号通路抑制裸鼠人肝癌移植瘤生长[J]. 福建医科大学学报, 2018, 52(2): 69-74. [Wu ZX, Zeng DW, Lin S, et al. Inhibitory effect of lentiviral vector for siRNA of Id-1 on human transplanted carcinoma in nude mice[J]. Fujian Yi Ke Da Xue Xue Bao, 2018, 52(2): 69-74.] |
| [17] |
余彬彬, 钱金娥, 曹剑波. 小檗胺对肝癌SMMC-7721细胞侵袭转移的影响[J]. 中国现代应用药学, 2018, 35(12): 1771-1775. [Yu BB, Qian JE, Cao JB. Effect of berbamine on migration and invasion of human liver cancer SMMC-7721 cells[J]. Zhongguo Xian Dai Ying Yong Yao Xue, 2018, 35(12): 1771-1775.] |
| [18] |
刘博佳, 宁青, 钟荣玲, 等. 羽扇豆醇对人肝癌细胞HepG2和SK-HEP-1侵袭、转移的影响及机制研究[J]. 中国中药杂志, 2020, 45(24): 6028-6035. [Liu BJ, Ning Q, Zhong RL, et al. Effects of lupinol on invasion and metastasis of human hepatoma HepG2 and SK-HEP-1 cells and its mechanism[J]. Zhongguo Zhong Yao Za Zhi, 2020, 45(24): 6028-6035.] |
 2023, Vol. 50
2023, Vol. 50


