文章信息
- 基于CiteSpace的肺癌免疫治疗研究的可视化分析
- Visual Analysis of Research on Lung Cancer Immunotherapy by Using CiteSpace
- 肿瘤防治研究, 2023, 50(1): 43-51
- Cancer Research on Prevention and Treatment, 2023, 50(1): 43-51
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0495
- 收稿日期: 2022-05-06
- 修回日期: 2022-08-15
2. 350008 福州,福州肺科医院呼吸内科;
3. 350001 福州,福建医科大学附属协和医院肿瘤内科
2. Department of Respiratory Medicine, Fuzhou Pulmonary Hospital, Fuzhou 350008, China;
3. Department of Oncology, Union Hospital of Fujian Medical University, Fuzhou 350001, China
肺癌是人类发病率和死亡率最高的恶性肿瘤。目前,肺癌的发病率逐步上升,其病死率在恶性肿瘤中居首位[1]。肺癌的组织学亚型主要包括两类:非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)[2]。SCLC占新诊断的肺癌病例的13%~15%,NSCLC占80%~85%[3]。手术切除往往是早期NSCLC的首选治疗方法,Ⅰ期~ⅢA期NSCLC五年生存率为14%~49%,而ⅢB/Ⅳ期的生存率不到5%[4]。SCLC具有较高的突变负荷,并可能对免疫检查点抑制剂产生反应。免疫治疗作为一种通过重塑肿瘤患者免疫系统以杀灭肿瘤细胞的综合治疗方法,与化疗相结合可增加抗肿瘤免疫,有效改善预后[5]。
在肿瘤的免疫治疗中,常用到免疫组织化学法检测程序性死亡因子配体-1(PD-L1)表达水平、聚合酶链式反应技术检测微卫星稳定性以及单细胞测序(single-cell sequencing, SCS)技术等检测方法。SCS技术是从单细胞水平揭示细胞基因组、转录组或表观遗传变化的技术,从不同角度揭示细胞在不同阶段的功能和特性,可以通过一次建库,测得数百上千个单细胞的信息[6]。SCS技术能更精准地从分子层面阐释肿瘤发生、发展、转移和耐药的机制,提高肿瘤的诊断效率、预测肿瘤转归并提高个体化治疗水平。
鉴于此,本文检索了中国知网数据库(CNKI)、Web of Science数据库肺癌免疫治疗和SCS的相关文章,以文献计量学分析的方法,提炼肺癌免疫治疗及SCS领域的相关前沿和热点多元的研究结果。
1 资料与方法 1.1 资料本研究资料来源于中国知网和Web of Science数据库。在知网中采用主题词的检索方式,主题词为肺癌和免疫治疗,检索时间限制为2005年1月1日—2021年3月1日,排除综述、目录、会议通知、产品推广、征文启事等与研究主题不相关的内容,共检索到肺癌免疫治疗中文文献400篇,并以Refwork格式保存。在Web of Science数据库采用主题词的检索方式,主题词为Lung Cancer和Immunotherapy,检索时间限制为2005—2021年,排除综述、目录、会议通知、产品推广、征文启事等与研究主题不相关的内容,共检索到肺癌免疫治疗英文文献5 001篇,并以纯文本格式保存。在Web of Science数据库采用主题词的检索方式检索,主题词为Lung Cancer、Immunotherapy和Single cell sequencing”,检索时间限制为2005—2021年,排除条件同上,共检索到肺癌免疫治疗英文文献17篇,并以纯文本格式保存。
1.2 研究方法将知网上导出的Refworks格式文献进行格式转化后导入CiteSpace5.7.R2,Web of Science上导出的纯文本格式文献导入CiteSpace5.7.R2。参数设置中时间跨度从2005年至2021年,每1年为一个时间切片,分别对纳入的中文文献和英文文献进行相关分析,对肺癌免疫治疗以及SCS在肺癌免疫治疗中的应用相关文献绘制知识图谱,对该领域的研究现状、研究热点及研究趋势进行系统梳理,形成可视化分析。根据结果分析与讨论提出未来的研究方向。
1.2.1知网数据库对检索到的400篇文章采用CiteSpace5.7.R2软件进行关键词分析,总结中文文章的研究热点。
1.2.2Web of Science核心集数据库对检索到的5 001篇肺癌免疫治疗文章采用CiteSpace5.7.R2软件进行文献可视化分析。
1.2.3Web of Science核心集数据库对检索到的17篇SCS技术在肺癌免疫治疗文章采用CiteSpace5.7.R2软件进行文献可视化分析。
(1)节点类型:根据需要分别对所选文献的国家、机构、关键词进行共现分析,生成共现(Co-occurrence)分析图谱;对来自Web of Science核心集数据库的文献进行共被引分析,生成共被引(Co-citation)分析图谱;(2)爆发(Burst)检测:即突发主题检测,用于发现研究的热点词汇;(3)分析中应用可视化图谱标识的解读:在CiteSpace绘制的图谱中,图中的环形部分称为引文年轮(Citation tree-rings),它代表该文献的引文历史。引文年轮最中心部分的颜色代表该文献的发表年份;节点半径的大小在作者合作网络、机构合作网络中表示发文量的多少,在关键词共现网络中表示关键词的出现频次。
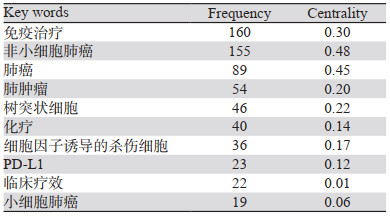
2 结果 2.1 中国知网肺癌免疫治疗中文文章的研究热点 2.1.1 关键词共现分析本研究梳理出高频次与高中心性的关键词,见表 1。通过分析关键词共现图谱,设置最低频次为19,最低中心性为0.01。
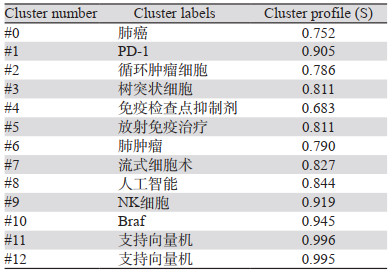
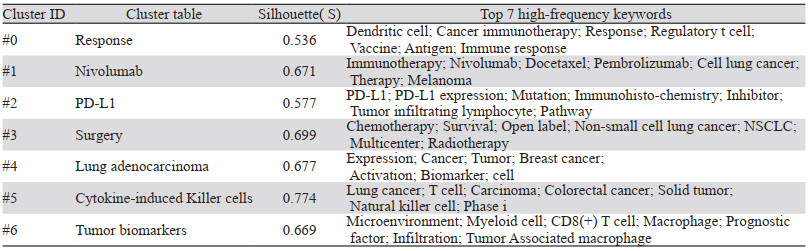
为更进一步客观反映肺癌免疫治疗发展的研究方向,以对数似然率(log-likelihood ratio, LLR)为聚类方法,根据覆盖度和唯一性选择最佳的聚类标签,从而得到13个聚类模块,模块化Q值=0.5554,平均轮廓值0.6624,聚类有效,各聚类成员一致性高,见表 2。目前我国肺癌免疫治疗的研究热点主要是肺癌、树突状细胞以及与化疗的联合治疗、放射免疫治疗、免疫检查点抑制剂几个方面。
关键词突变分析发现13个爆发关键词:(1)2005年,肺肿瘤、过继免疫治疗、肺癌为初期研究热点的爆发关键词;(2)2007—2014年,树突状细胞、细胞因子诱导的杀伤细胞、CIK细胞、杀伤细胞、小细胞肺癌为第二阶段研究热点的爆发关键词;(3)2017年至今,PD-L1、肺腺癌、免疫检查点抑制剂、不良反应和非小细胞肺癌为第三阶段研究热点的爆发关键词,见图 1。

|
| 图 1 2005—2021年中国知网排名前13的肺癌免疫治疗突现关键词 Figure 1 Top 13 keywords with the strongest citation bursts of lung cancer immunotherapy in CNKI from 2005 to 2021 |
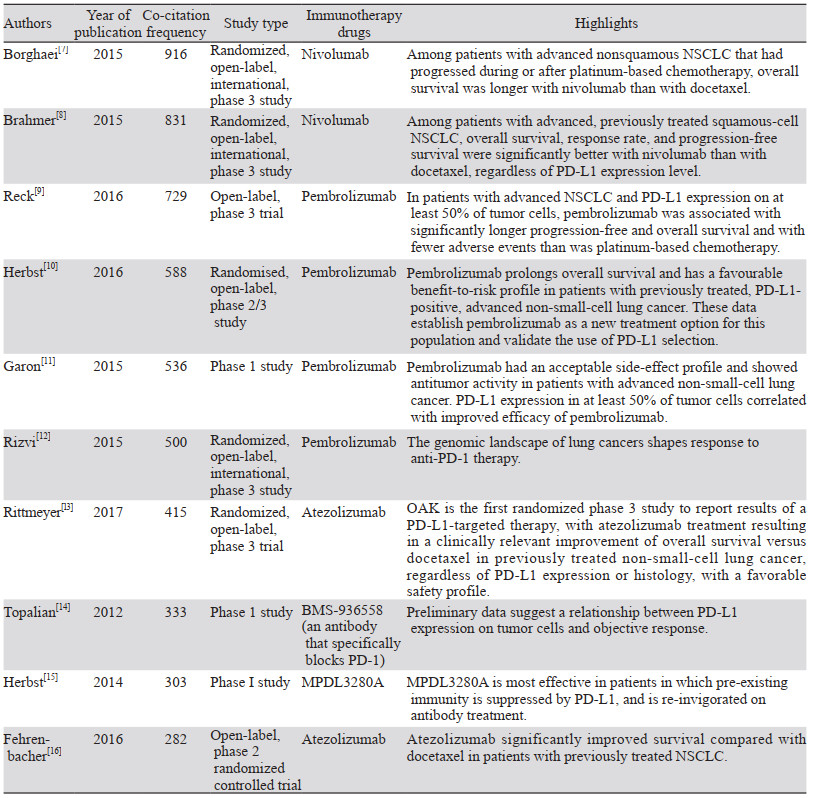
合成后的网络中共计含有1 426个共被引文献,有7 157条引文关联线,密度为0.007。高被引前10位的文章内容主要集中在免疫检查点抑制剂,包括PD-1抑制剂和PD-L1抑制剂;重点使用药物为纳武单抗(Nivolumab)、帕博利珠单抗(Pembrolizumab)、阿特珠单抗(Atezolizumab)和德瓦鲁单抗(Durvalumab)[7-16],而这些药物现成为目前国际肺癌免疫治疗的主要药物。从共被引次数上来看,文献[7]是目前最被国际同行认可的肺癌免疫治疗领域的SCI文章,见表 3。
|
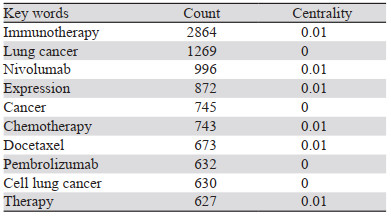
对纳入的5 001篇英文文章的全部关键词进行共现分析,得到关键词节点906个,词语间连线8 579个,密度为0.0209。得到排名前十的关键词,见表 4。进一步分析肺癌免疫治疗的研究情况,可以看出目前肺癌的免疫治疗热点主要集中在单抗药物方面的治疗。免疫检查点抑制剂和相关生物标志物是免疫治疗的重要方面,常用的免疫药物有Nivolumab和Pembrolizumab。
|
运用LLR算法对关键词进行聚类,共得到7个聚类,见表 5。可知,国外对肺癌免疫治疗的研究除相关因素分析外,目前肺癌免疫治疗的研究热点主要是树突状细胞、免疫检查点抑制剂、免疫治疗后的不良反应、细胞因子诱导的杀伤细胞和肿瘤生物标志物。
|
关键词突变分析发现共237个爆发关键词:(1)2009年开始,树突状细胞、疫苗、免疫反应、基因治疗等为初期研究热点的爆发关键词;(2)2016—2019年,抗PD-1、抗PD-L1、免疫细胞、免疫治疗等为第二阶段研究热点的爆发关键词;(3)2019—2021年,奥西替尼、免疫检查点抑制剂、PD-L1表达、不良反应等为第三阶段研究热点的爆发关键词,见图 2。可知早期对肺癌免疫治疗主要集中在疫苗、基因治疗等,属于探索阶段。2016年左右开始对肺癌免疫单抗药物进行相关研究,并注重抗体药物对肺癌患者的安全疗效,以及临床反应。自2019年开始对免疫检查点抑制剂、PD-L1表达、不良反应等方面进行研究,并持续至今。可见该研究方向已逐渐成为主流,研究内容也在逐渐具体深入,有望持续作为研究热点,引领肺癌免疫治疗研究领域进展。

|
| 图 2 2005—2021年Web of Science排名前237的肺癌免疫治疗突现关键词 Figure 2 Top 237 keywords with the strongest citation bursts of articles on lung cancer immunotherapy in the Web of Science database from 2005 to 2021 |
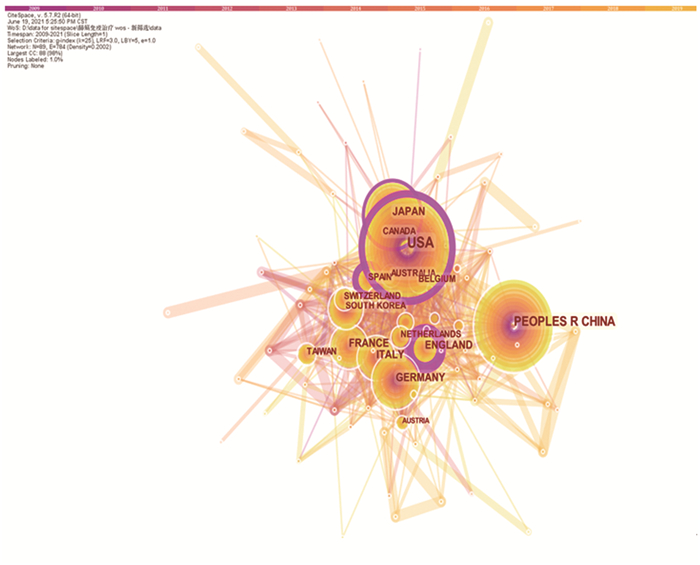
权威机构排名前5位的分别是美国德克萨斯大学安德森癌症中心202篇,美国斯隆凯特森癌症研究中心143篇,美国国际癌症研究所和哈佛医学院均为117篇,中山大学97篇,丹娜-法伯癌症研究院94篇,见图 3。权威国家和地区排名前5位的分别是美国1 968篇,中国1 501篇,日本514篇,德国385篇,法国382篇,见图 4。

|
| 图 3 纳入的Web of Science英文肺癌免疫治疗文章的机构合作图谱 Figure 3 Institutional cooperation map of English articles on lung cancer immunotherapy in the Web of Science database |
|
| 图 4 纳入的Web of Science英文肺癌免疫治疗文章的国家和地区图 Figure 4 Country and region map of English articles on lung cancer immunotherapy in the Web of Science database |
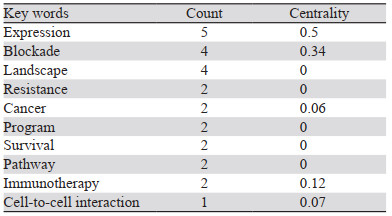
关键词热点分析:对纳入的17篇关于单细胞测序在肺癌免疫治疗中的应用的英文文章关键词进行共现分析,得到关键词节点71个,词语间连线128个,密度为0.0515,见图 5。得到排名前十的关键词,根据中心性值在知识图谱网络中起连接作用大小的度量,中心性值越大,说明在各节点间联系越密切,起到枢纽作用,一般认为中心性值≥0.1为该网络的重要节点。结果显示,“expression”为中心性最高的关键词,见表 6。

|
| 图 5 单细胞测序技术在肺癌免疫治疗中的关键词图谱 Figure 5 Keyword map of single-cell sequencing technology in lung cancer immunotherapy |
|
本文分别从CNKI、Web of Science数据库以“肺癌和免疫治疗”为主题,检索到400篇中文文献以及5 001篇英文文献;此外,在Web of Science数据库以“单细胞测序、肺癌、免疫治疗”为主题,检索到17篇英文文献,再将知识图谱可视化分析和文献计量法相结合,应用CiteSpace5.7.R2软件分析并明确了作者、机构、研究方向与研究热点等文献特征。
3.1 国内肺癌免疫治疗领域研究现状关键词是学术文献的高度概括和凝练,能够大致反映文章的核心研究内容与价值。对知网中检索的文献进行关键词共现分析显示:NSCLC的免疫治疗和细胞免疫疗法方面是研究的热点。关键词突变分析显示研究方向由早期对肺肿瘤、肺癌相关的过继免疫治疗转变为PD-L1相关免疫检查点抑制剂在NSCLC的治疗和出现的不良反应为主要的研究热点。以上关键词概括由于只纳入了知网数据库的中文文献,尚不能代表国内免疫治疗的整体研究现状。另有研究表明,化疗联合CIK细胞治疗能显著提高不同阶段NSCLC患者临床疗效、延长生存期、提高近期生存质量,尤其对晚期患者的疗效更佳[17]。目前,临床中应用较广的免疫检查点抑制剂通常有两类,一类是PD-1抑制剂(Nivolumab和Pembrolizumab),一类是PD-L1抑制剂(Atezolizumab和Durvalumab)[18-19]。现Pembrolizumab单药或联合化疗可用于一线治疗肺癌。Nivolumab单药可用于二线治疗晚期NSCLC,而一线治疗现尚无明确研究证实其疗效[20]。2016年,Atezolizumab被美国食品药品监督管理局(FDA)批准用于二线治疗晚期NSCLC[21],而Durvalumab被批准用于治疗局部不可切除的Ⅲ期NSCLC。通过可视化分析,对肺癌免疫治疗的深入研究和未来研究方向有一定参考意义。
3.2 国外肺癌免疫治疗领域研究现状目前,肺癌的治疗已经进入精准分层治疗时代[22]。免疫治疗尤其集中在免疫检查点抑制剂的应用。通过关键词共现图谱可以得知,免疫治疗与化疗联合治疗、PD-L1的表达、树突状细胞相关的研究也成为持续研究重点。基于新抗原的树突状细胞疫苗在某些恶性肿瘤的治疗中具有显著作用,是一种很有前景的治疗方式[23]。免疫治疗后的不良反应也成为重点关注方面,表明目前也十分注重抗体药物对肺癌患者的安全疗效以及临床反应。关键词爆发图谱分析显示,自2019年开始,免疫检查点抑制剂、PD-L1表达等方面研究成为热点,并持续至今,已逐渐成为主流。权威机构和国家地区可视化分析发现,目前对于肺癌免疫治疗研究机构最多的为美国,其次为中国,可见目前国内外对于肺癌免疫治疗正在进行深入研究。
3.3 单细胞测序技术在肺癌免疫中的应用肿瘤细胞的异质性是肿瘤研究和诊断治疗中亟待解决的关键问题,对此,SCS技术是一种理想的方法[24]。通过SCS技术获取特定阶段的单个肿瘤细胞的动态基因组、转录组数据以及细胞表观遗传信息,并构建与肿瘤发生、发展和转移以及产生耐药性等机制相关的遗传图谱[25]。有研究证明,免疫治疗后可能出现非典型反应模式,包括超进展、假性进展和延迟应答,这在常规细胞毒性抗肿瘤治疗中没有观察到[26-27],而通过SCS技术可用于识别新辅助免疫化疗后的确切浸润细胞图谱,揭示CD8+T细胞和CD14+、CD16+单核细胞之间可能的相互作用。有研究发现,肿瘤免疫微环境对肺癌的发展有很大影响,表明不同类型免疫细胞的浸润可能是新的诊断和判断预后的生物标志物的来源[28-29]。通过SCS技术分析肺癌免疫细胞浸润特征及相关标志基因[30]。在肺癌患者中以高分辨率表征了他们的T细胞景观[31],表征肿瘤内免疫反应相关基因的异质性,并以此证明它们对免疫治疗疗效的潜在影响[32],将有助于推进肺癌免疫治疗。
了解免疫检查点阻断后T细胞的功能状态和克隆动态对改善肺癌的治疗策略也是有价值的。通过肺癌患者在启动PD-1阻断前后的外周T细胞进行Smart-seq2单细胞RNA测序(single cell RNA sequencing, scRNA-seq)分析,并监测它们在免疫治疗过程中的动力学[33]。基于相应的scRNA-seq和基因表达数据,鉴定差异表达的配体-受体对,并进行系统分析,从而提高我们对肿瘤微环境促进癌症进展的潜在机制的理解,并有助于确定未来免疫治疗的潜在靶点[34]。
3.4 小结通过肺癌免疫治疗研究文献的可视化分析,可以了解到肺癌治疗方案的转变趋势,较为直观地反映了肺癌免疫治疗的研究热点,与此同时,还了解到目前肺癌免疫治疗研究领域的现状以及出现的相关问题。但本文也有不足之处,在中文数据库分析中,只选取了来自中国知网数据库收录的中文文章,因此,尚不能代表国内免疫治疗的整体研究现状。在英文数据库分析中,限于CiteSpace软件自身的约束,只分析研究了Web of Science数据库收录的相关文章,而国外其他的数据库,如PubMed等未进行检索分析,就目前所能收集的信息及相关分析尚不能代表所有肺癌免疫治疗领域的国际信息。另外,本研究未对期刊共被引图谱、基金资助等全部共现进行分析,也限于CiteSpace软件自身的约束,不能对中国知网数据库的文献做共被引分析,后续需要研究人员结合主题动态变化规律及具体的实践需求对研究结果进行完善与更新。
综上所述,通过CiteSpace软件对肺癌免疫治疗研究的相关文献进行分析,直观展现出目前该领域研究的现状及发展趋势。目前,关于肺癌的免疫治疗研究主要集中在免疫抑制剂相关的研究,而树突状细胞等细胞免疫治疗也正在成为深入研究方向。本文对肺癌免疫治疗研究进行了系统的可视化分析,以期为该领域的深入研究和未来选题提供一定的参考。
作者贡献:
杨淑燕:数据检索分析、图表绘制、论文撰写及修改
庄金满、刘宇航:数据检索
朱金秀、林梦心:指导数据分析
何斐:论文指导和审核
| [1] |
Sundar R, Soong R, Cho BC, et al. Immunotherapy in the treatment of non-small cell lung cancer[J]. Lung Cancer, 2014, 85(2): 101-109. DOI:10.1016/j.lungcan.2014.05.005 |
| [2] |
王丽萍. 肺癌免疫治疗现状及展望[J]. 中华实用诊断与治疗杂志, 2017, 31(2): 105-110. [Wang LP. Current Situation and Prospect of Immunotherapy for Lung Cancer[J]. Zhonghua Shi Yong Zhen Duan Yu Zhi Liao Za Zhi, 2017, 31(2): 105-110. DOI:10.13507/j.issn.1674-3474.2017.02.001] |
| [3] |
Konala VM, Madhira BR, Ashra S, et al. Use of Immunotherapy in Extensive-Stage Small Cell Lung Cancer[J]. Oncology, 2020, 98(11): 749-754. DOI:10.1159/000508516 |
| [4] |
Ko EC, Raben D, Formenti SC, et al. The Integration of Radiotherapy with Immunotherapy for the Treatment of Non-Small Cell Lung Cancer[J]. Clin Cancer Res, 2018, 24(23): 5792-5806. DOI:10.1158/1078-0432.CCR-17-3620 |
| [5] |
Horn L, Mansfield AS, Szczesna A, et al. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer[J]. N Engl J Med, 2018, 379(23): 2220-2229. DOI:10.1056/NEJMoa1809064 |
| [6] |
孙凤环, 陈健, 张鹏. 单细胞测序在肿瘤基因检测中的研究进展[J]. 同济大学学报(医学版), 2019, 40(1): 117-122. [Sun FH, Chen J, Zhang P. Research progress of single-cell sequencing in tumor gene detection[J]. Tongji Da Xue Xue Bao(Yi Xue Ban), 2019, 40(1): 117-122. DOI:10.16118/j.1008-0392.2019.01.022] |
| [7] |
Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2015, 373(17): 1627-1639. DOI:10.1056/NEJMoa1507643 |
| [8] |
Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2015, 373(2): 123-135. DOI:10.1056/NEJMoa1504627 |
| [9] |
Reck M, Rodríguez-Abreu D, Robinson AG, et al. KEYNOTE-024 Investigators. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. DOI:10.1056/NEJMoa1606774 |
| [10] |
Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial[J]. Lancet, 2016, 387(10027): 1540-1550. DOI:10.1016/S0140-6736(15)01281-7 |
| [11] |
Garon EB, Rizvi NA, Hui R, et al. KEYNOTE-001 Investigators.Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018-2028. DOI:10.1056/NEJMoa1501824 |
| [12] |
Rizvi NA, Hellmann MD, Snyder A, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230): 124-128. DOI:10.1126/science.aaa1348 |
| [13] |
Rittmeyer A, Barlesi F, Waterkamp D, et al. OAK Study Group. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial[J]. Lancet, 2017, 389(10066): 255-265. DOI:10.1016/S0140-6736(16)32517-X |
| [14] |
Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26): 2443-2454. DOI:10.1056/NEJMoa1200690 |
| [15] |
Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J]. Nature, 2014, 515(7528): 563-567. DOI:10.1038/nature14011 |
| [16] |
Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial[J]. Lancet, 2016, 387(10030): 1837-1846. DOI:10.1016/S0140-6736(16)00587-0 |
| [17] |
马晓骉, 罗峰, 高永亮, 等. CIK细胞免疫疗法联合化疗治疗非小细胞肺癌的临床疗效[J]. 昆明医科大学学报, 2020, 41(12): 60-67. [Ma XB, Luo F, Gao YL, et al. Clinical efficacy of CIK cell immunotherapy combined with chemotherapy in the treatment of non-small cell lung cancer[J]. Kunming Yi Ke Da Xue Xue Bao, 2020, 41(12): 60-67.] |
| [18] |
Wang L, Ma Q, Yao R, et al. Current status and development of anti-PD-1/PD-L1 immunotherapy for lung cancer[J]. Int Immunopharmacol, 2020, 79: 106088. DOI:10.1016/j.intimp.2019.106088 |
| [19] |
程颖. 晚期非小细胞肺癌免疫治疗的研究进展[J]. 肿瘤防治研究, 2021, 48(8): 745-750. [Cheng Y. Research Progress of Immunotherapy for Advanced Non-small Cell Lung Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(8): 745-750. DOI:10.3971/j.issn.1000-8578.2021.21.0472] |
| [20] |
王奎, 张宏毅, 王泽权, 等. PD-1和PD-L1抑制剂治疗肺癌及其不良反应的研究现状及进展[J]. 中国医药科学, 2021, 11(3): 45-48. [Wang K, Zhang HY, Wang ZQ, et al. Research status and progress of PD-1 and PD-L1 inhibitors in the treatment of lung cancer and its adverse reactions[J]. Zhongguo Yi Yao Ke Xue, 2021, 11(3): 45-48. DOI:10.3969/j.issn.2095-0616.2021.03.012] |
| [21] |
付烊, 朱波, 章必成. 晚期肺癌免疫治疗的现状与未来[J]. 医药导报, 2019, 38(8): 993-996. [Fu Y, Zhu B, Zhang BC. Current status and future of immunotherapy for advanced lung cancer[J]. Yi Yao Dao Bao, 2019, 38(8): 993-996.] |
| [22] |
张秀梅, 翟运开, 赵杰, 等. 肺癌靶向治疗研究: 以文献计量学和可视化分析述的热点与趋势[J]. 现代肿瘤医学, 2020, 28(19): 3417-3427. [Zhang XM, Zhai YK, Zhao J, et al. Lung cancer targeted therapy research: hotspots and trends described by bibliometrics and visual analysis[J]. Xian Dai Zhong Liu Yi Xue, 2020, 28(19): 3417-3427. DOI:10.3969/j.issn.1672-4992.2020.19.031] |
| [23] |
Ding Z, Li Q, Zhang R, et al. Personalized neoantigen pulsed dendritic cell vaccine for advanced lung cancer[J]. Signal Transduct Target Ther, 2021, 6(1): 26. DOI:10.1038/s41392-020-00448-5 |
| [24] |
周莹, 黄华艺. 单细胞测序技术及其在肿瘤研究和临床诊断中的应用[J]. 分子诊断与治疗杂志, 2017, 9(3): 147-153, 172. [Zhou Y, Huang HY. Single-cell sequencing technology and its application in tumor research and clinical diagnosis[J]. Fen Zi Zhen Duan Yu Zhi Liao Za Zhi, 2017, 9(3): 147-153, 172. DOI:10.3969/j.issn.1674-6929.2017.03.001] |
| [25] |
Eberwine J, Sul JY, Bartfai T, et al. The promise of single -cell sequencing[J]. Nat Methods, 2014, 11(1): 25-27. DOI:10.1038/nmeth.2769 |
| [26] |
Borcoman E, Kanjanapan Y, Champiat S, et al. Novel patterns of response under immunotherapy[J]. Ann Oncol, 2019, 30(3): 385-396. DOI:10.1093/annonc/mdz003 |
| [27] |
Billan S, Kaidar-Person O, Gil Z. Treatment after progression in the era of immunotherapy[J]. Lancet Oncol, 2020, 21(10): e463-e476. DOI:10.1016/S1470-2045(20)30328-4 |
| [28] |
Mollaoglu G, Jones A, Wait SJ, et al. The lineage-defining transcription factors SOX2 and NKX2-1 determine lung cancer cell fate and shape the tumor immune microenvironment[J]. Immunity, 2018, 49(4): 764-779. DOI:10.1016/j.immuni.2018.09.020 |
| [29] |
Rosenthal R, Cadieux EL, Salgado R, et al. Neoantigen-directed immune escape in lung cancer evolution[J]. Nature, 2019, 567(7749): 479-485. DOI:10.1038/s41586-019-1032-7 |
| [30] |
Xing XD, Yang F, Huang Q, et al. Decoding the multicellular ecosystem of lung adenocarcinoma manifested as pulmonary subsolid nodules by single-cell RNA sequencing[J]. Sci Adv, 2021, 7(5): eabd9738. DOI:10.1126/sciadv.abd9738 |
| [31] |
Guo X, Zhang Y, Zheng L, et al. Publisher Correction: Global characterization of T cells in non-small-cell lung cancer by single-cell sequencing[J]. Nat Med, 2018, 24(10): 1628. |
| [32] |
Ma KY, Schonnesen AA, Brock A, et al. Single-cell RNA sequencing of lung adenocarcinoma reveals heterogeneity of immune response-related genes[J]. JCI Insight, 2019, 4(4): e121387. DOI:10.1172/jci.insight.121387 |
| [33] |
Zhang F, Bai H, Gao R, et al. Dynamics of peripheral T cell clones during PD-1 blockade in non-small cell lung cancer[J]. Cancer Immunol Immun, 2020, 69(12): 2599-2611. |
| [34] |
Chen Z, Yang X, Bi G, et al. Ligand-receptor interaction atlas within and between tumor cells and T cells in lung adenocarcinoma[J]. Int J Biol Sci, 2020, 16(12): 2205-2219. DOI:10.7150/ijbs.42080 |
 2023, Vol. 50
2023, Vol. 50