文章信息
- 卡瑞利珠单抗联合安罗替尼三线治疗晚期非小细胞肺癌的疗效观察
- Efficacy of Combination of Camrelizumab with Anlotinib as Third-line Therapy for Patients with Advanced Non-small Cell Lung Cancer
- 肿瘤防治研究, 2023, 50(6): 593-597
- Cancer Research on Prevention and Treatment, 2023, 50(6): 593-597
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2023.22.0098
- 收稿日期: 2022-01-28
- 修回日期: 2022-04-28
肺癌是世界上发病率第二的恶性肿瘤,也是我国发病率和死亡率最高的癌肿,严重危害着人类健康,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌的85%[1]。由于早期症状不明显,大多数NSCLC患者确诊时已是晚期,错过了最佳治疗时机,治疗上多局限于放化疗,预后较差,容易复发和转移,5年生存率低[2-3]。近年来,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)、抗血管生成药物等药物的出现给晚期NSCLC患者带来了新的希望。
安罗替尼是我国自主研发的小分子多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI),可抑制VEGFR、PDGFR、FGFR、SCFR等多个促血管生成的激酶,已于2018年获批用于晚期NSCLC的三线及以上单药治疗[4-6]。卡瑞利珠单抗是一种国产ICIs,在NSCLC中表现出良好的抗肿瘤活性[7],但因易发生耐药,单药治疗的疗效往往有限[8],且关于三线治疗NSCLC的研究较少。免疫治疗响应与肿瘤微环境(tumor microenvironment, TME)的免疫浸润状态有关,而抗血管生成药物除了参与TME中异常血管的重构、调节肿瘤免疫细胞浸润外,还能逆转TME的免疫抑制状态[9]。两种药物联合可协同增效,理论上有较好抗肿瘤活性,本研究就此进行了观察。
1 资料与方法 1.1 纳入和排除标准纳入标准:(1)年龄≥18岁;(2)东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分0~1分;(3)病理学或细胞学证实为NSCLC;(4)第八版TNM分期为ⅢB~Ⅳ期;(5)根据RECIST1.1评价标准至少有一个可测量病灶;(6)经一线及二线(包括化疗或靶向)治疗后进展或无法耐受治疗者。
排除标准:(1)合并其他部位原发的恶性肿瘤;(2)中央型肺鳞癌或既往有咯血病史、凝血功能异常、有控制不良的高血压、有出血倾向的血液病或心血管疾病、肝肾功能不全等;(3)一线二线治疗曾用过ICIs或抗血管生成药物者。
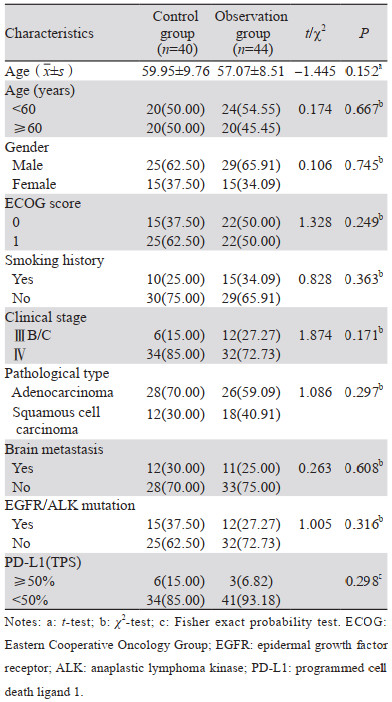
1.2 一般资料根据上述标准,选取郑州大学第一附属医院在2019年5月至2021年5月期间收治的84例经二线治疗后进展的晚期NSCLC患者作为研究对象,收集并分析相关临床资料。采用回顾性分析的方法,依据三线治疗方案分组:观察组44例患者接受卡瑞利珠单抗联合安罗替尼治疗,对照组40例患者接受单药安罗替尼治疗。两组患者年龄、性别、ECOG评分、吸烟史、临床分期、病理类型、有无脑转移、EGFR/ALK突变、PD-L1(TPS)表达水平等比较差异无统计学意义(P > 0.05),两组资料具有可比性,见表 1。
|
对照组给予盐酸安罗替尼胶囊(正大天晴药业集团公司,国药准字H20180004),早餐前口服,每次12 mg,口服14天、停用7天,每21天为1个治疗周期。当患者不能耐受每日12 mg时,可逐渐减量至每天10 mg或8 mg,若仍不能耐受或出现病情进展则停药。观察组在对照组的基础上联合卡瑞利珠单抗(苏州盛迪亚公司,国药准字S20190027),静脉注射,200毫克/次,第1天使用,21天为一个周期。
1.4 观察指标所有患者均以三线治疗开始前最近一次的影像学检查作为参考基线,根据CT、MRI、骨扫描、PET-CT等影像学检查或血常规、肿瘤标志物、电解质、肝肾功、甲功、凝血功能等实验室检查指标,于治疗后每2周期评价疗效,以RECIST1.1作为疗效评价标准。近期疗效在治疗2个周期后进行评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。并比较客观缓解率(ORR)、疾病控制率(DCR),ORR=CR+PR,DCR=CR+PR+SD。远期疗效为无进展生存期(PFS),定义为从接受三线治疗开始到疾病进展或死亡、或出现严重不良反应致停药的时间。不良事件(adverse events, AE)根据CTCAE5.0版进行分级。
1.5 统计学方法采用SPSS26.0软件进行统计分析。计量资料用(x±s)表示,比较采用t检验;定性资料用(n(%))表示,比较采用χ2检验或用Fisher’s精确概率检验法。用Kaplan-Meier绘制生存曲线,比较组间PFS用Log rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 近期疗效观察组的ORR为29.55%(13/44),对照组为15.00%(6/40),差异无统计学意义(χ2=2.533, P=0.112);但二者值差距较大,可能与本研究纳入病例数过少造成的偏倚有关。观察组的DCR为90.91%(40/44),对照组为85.00%(34/40),差异无统计学意义(P=0.508),见表 2。

|
观察组的中位PFS(7.0月,95%CI: 2.648~11.352)长于对照组(5.6月,95%CI: 4.724~6.476),差异有统计学意义(P=0.001),见图 1。

|
| 图 1 卡瑞利珠单抗联合安罗替尼组与单药安罗替尼组PFS的比较 Figure 1 Comparison of PFS between observation group and control group |
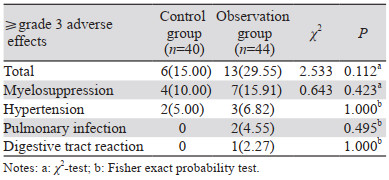
观察组总AE发生率低于对照组,差异无统计学意义(77.27% vs. 87.50%, χ2=1.494, P=0.222)。且观察组各种AE发生率与对照组相比,差异均无统计学意义(P > 0.05),AE发生率较高的有骨髓抑制(61.36% vs. 47.50%)、乏力(50.00% vs. 67.50%)、消化道反应(43.18% vs. 40.00%)、高血压(22.73% vs. 37.50%)、口腔黏膜炎(20.45% vs. 17.50%)等,见表 3。观察组≥3级AE发生率与对照组相比差异无统计学意义(29.55% vs. 15.00%, χ2=2.533, P=0.112),见表 4。

|
|
近年来,NSCLC的发病率和死亡率不断升高,且预后较差,部分患者在接受一线二线治疗后仍出现明显进展,需要进一步接受抗肿瘤治疗[6]。随着不同治疗机制药物联用的广泛推广,以及抗血管生成治疗和免疫治疗等新型治疗方式的不断涌现,所谓“去化疗”模式引起了人们的关注,二线治疗失败后的晚期NSCLC患者也有了更丰富的治疗方案选择,但目前NSCLC三线治疗仍没有标准的方案。因此如何让更多的晚期NSCLC患者获益是目前亟需解决的问题。
多项研究结果显示,免疫联合抗血管生成治疗有协同抗癌的作用,一方面抗血管生成药物可以逆转VEGF导致的免疫抑制,促使肿瘤血管正常化,促进抗原呈递和淋巴细胞的浸润迁移;另一方面,ICIs可以通过激活效应T细胞、上调IFN-γ的分泌,使肿瘤血管系统正常化,增强抗血管生成药物的作用[10-11],二者之间存在正反馈效应。还有研究证明,ICIs联合抗血管生成治疗能显著改善恶性肿瘤患者的预后。IMbrave150[12]结果显示对初治的局部晚期或转移的HCC患者,阿特利珠单抗联合贝伐单抗比单用索拉非尼有更好的疗效(mOS: 未达到vs. 11.4月、mPFS: 5.7月vs. 3.2月),这与本研究结果(mPFS: 7.0月vs. 5.6月)一致,证实了联合方案的可行性。此外,美国一项Ⅱ期临床试验[13]结果显示,帕博利珠单抗联合仑伐替尼治疗非MSI-H/dMMR的晚期子宫内膜癌的ORR为38.3%,中位DCR未达到,此联合方案也被批准用于非MSI-H/dMMR晚期子宫内膜癌的治疗,该研究同样证实了免疫联合抗血管治疗对恶性肿瘤的有效性。
有学者对免疫联合抗血管治疗在NSCLC中的有效性进行了探讨。一项信迪利单抗联合安罗替尼一线治疗无突变晚期NSCLC的研究结果显示,ORR为72.7%、DCR高达100%,mPFS为15月(95%CI: 8.3月~未达到),提示联合方案治疗晚期NSCLC有很好的效果[14]。本研究ORR为29.55%,DCR为90.91%,mPFS为7.0月,虽然低于上述结果,但也取得了明显效果,仍能说明免疫联合抗血管三线治疗NSCLC与一线治疗同样有较好效果。此外,一项队列研究结果表明[15],初治的晚期NSCLC患者一线接受帕博利珠单抗联合雷莫芦单抗治疗,mPFS为9.3月。虽然本研究观察组的mPFS(7.0月)明显小于此队列研究,但考虑到三线治疗时晚期NSCLC患者的病情一般较重,对药物的耐受性也逐渐变差,且尽管本研究纳入的患者ECOG评分为0~1,但体力状态仍普遍认为较初治时差,综合考虑这些因素,可以认为免疫联合抗血管三线治疗NSCLC患者有较好的效果。而IMpower150研究结果[16]显示:在所有入组的初治晚期NSCLC患者中,ABCP组(阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇)相比于BCP组(贝伐珠单抗+卡铂+紫杉醇)有明显生存获益(mPFS 8.4月vs. 6.8月;mOS 19.8月vs. 14.9月,P < 0.05);此外不同效应T细胞表达水平、不同的PD-L1表达水平、EGFR突变阳性、有肝转移等亚组分析中,ABCP组比BCP组有更好的生存获益。
在安全性方面,观察组总AE发生率低于对照组,但差异无统计学意义(P > 0.05)。各种AE以及≥3级AE发生率相比,两组之间差异均无统计学意义(P > 0.05),且在给予对症处理后大多可以得到缓解。值得注意的是反应性毛细血管增生(reactive capillary hemangiomas, RCHs)是卡瑞利珠单抗的常见不良反应[17],而在本研究中,观察组RCHs的发生率为9.09%,明显低于文献报道[17-18]。可能原因是,卡瑞利珠单抗是通过调节VEGFR2等来刺激血管新生、促进血管瘤形成的,而安罗替尼恰恰可以有效地抑制VEGFR2,进而阻止了血管瘤的生成[19]。RCHs、甲状腺功能减退等认为属于免疫治疗引起的相关不良反应,两组在该不良反应发生率之间差异无统计学意义(P > 0.05)。本研究免疫相关不良事件发生率较低,可能原因为样本量较小或是早期轻度症状常不典型,临床工作中未能及时发现。
综上所述,卡瑞利珠单抗联合安罗替尼三线治疗晚期NSCLC相比单用安罗替尼可延长患者的PFS,且安全性良好。但由于本研究是回顾性的队列研究,且样本量小,尚未对患者的总生存时间进行随访,所以是否标志着所谓“去化疗”模式的到来,仍有待进一步扩大样本量的前瞻性研究验证。
利益冲突声明:
所有作者均声明不存在利益冲突。
作者贡献:
张晓娟:选题设计、资料与数据收集、文章撰写和修改
岳冬丽:选题设计、数据收集
杨双宁、郝娜:数据收集
王丽萍、董文杰:指导选题与设计、指导文章写作与修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Miller KD, Nogueira L, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-385. DOI:10.3322/caac.21565 |
| [3] |
Bonomi PD. Implications of key trials in advanced nonsmall cell lung cancer[J]. Cancer, 2010, 116(5): 1155-1164. DOI:10.1002/cncr.24815 |
| [4] |
金振兴, 杜秀平. 盐酸安罗替尼治疗晚期非小细胞肺癌的临床观察[J]. 临床与病理杂志, 2020, 40(4): 905-912. [Jin ZX, Du XP. Clinical observation of anlotinib hydrochloride in the treatment of advanced non-small cell lung cancer[J]. Lin Chuang Yu Bing Li Za Zhi, 2020, 40(4): 905-912.] |
| [5] |
Xie C, Wan X, Quan H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4): 1207-1219. DOI:10.1111/cas.13536 |
| [6] |
陈海峰. 安罗替尼三线及以上治疗66例中晚期非小细胞肺癌的疗效及影响因素分析[J]. 浙江医学, 2020, 42(14): 1524-1528. [Chen HF. Efficacy of anlotinib as third-line treatment and above for patients with advanced non-small cell lung cancer[J]. Zhejiang Yi Xue, 2020, 42(14): 1524-1528. DOI:10.12056/j.issn.1006-2785.2020.42.14.2020-1198] |
| [7] |
涂建仁, 付华珍. 卡瑞利珠单抗联合化疗一线治疗晚期/转移性非鳞状非小细胞肺癌疗效观察[J]. 药品评价, 2020, 17(19): 38-40. [Tu JR, Fu HZ. Efficacy of Camrelizumab Combined with First-line Chemotherapy in Treatment of Advanced/Metastatic Non-squamous Non-small Cell Lung Cancer[J]. Yao Pin Ping Jia, 2020, 17(19): 38-40. DOI:10.3969/j.issn.1672-2809.2020.19.012] |
| [8] |
周永慧, 陈鸿志. 免疫检查点抑制剂联合放化疗在晚期非小细胞肺癌治疗中的研究进展[J]. 临床肿瘤学杂志, 2021, 26(10): 947-954. [Zhou YH, Chen HZ. Progression of immune checkpoint inhibitors combined with chemoradiotherapy in the treatment ofadvanced non-small cell lung cancer[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2021, 26(10): 947-954. DOI:10.3969/j.issn.1009-0460.2021.10.014] |
| [9] |
Liang H, Wang M. Prospect of immunotherapy combined with anti-angiogenic agents in patients with advanced non-small cell lung cancer[J]. Cancer Manag Res, 2019, 11: 7707-7719. DOI:10.2147/CMAR.S212238 |
| [10] |
王婧怡, 彭文颖, 江美林, 等. 抗血管生成药物联合免疫检查点抑制剂治疗晚期非小细胞肺癌的研究进展[J]. 中国肺癌杂志, 2021, 24(3): 196-203. [Wang JY, Peng WY, Jiang ML, et al. Research Progress of Anti-angiogenic Agents Combined with Immunotherapy in Patients with Advanced Non-small Cell Lung Cancer[J]. Zhongguo Fei Ai Za Zhi, 2021, 24(3): 196-203.] |
| [11] |
宋羽霄, 章必成. 免疫联合抗血管生成: 肿瘤治疗的新策略[J]. 医药导报, 2020, 39(8): 1068-1072. [Song YX, Zhang BC. Anti-angiogenic Agents in Combination with Immune Checkpoint Inhibitors: APromising Strategy for Cancer Treatment[J]. Yi Yao Dao Bao, 2020, 39(8): 1068-1072.] |
| [12] |
Qin S, Ren Z, Feng Y, et al. Atezolizumab plus Bevacizumab versus Sorafenib in the Chinese Subpopulation with Unresectable Hepatocellular Carcinoma: Phase 3 Randomized, Open-Label IMbrave150 Study[J]. Liver Cancer, 2021, 10(4): 296-308. DOI:10.1159/000513486 |
| [13] |
齐瑞丽, 张勇丹, 王华庆, 等. 免疫检查点抑制剂联合抗血管生成治疗恶性肿瘤的作用机制[J]. 临床肿瘤学杂志, 2020, 25(7): 664-668. [Qi RL, Zhang YD, Wang HQ, et al. Mechanism of immune checkpoint inhibitor combined with antiangiogenic therapy in the treatment of malignanttumors[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2020, 25(7): 664-668.] |
| [14] |
程颖. 晚期非小细胞肺癌免疫治疗的研究进展[J]. 肿瘤防治研究, 2021, 48(8): 745-750. [Cheng Y. Research Progress of Immunotherapy for Advanced Non-small Cell Lung Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(8): 745-750.] |
| [15] |
Herbst RS, Arkenau HT, Bendell J, et al. Phase 1 Expansion Cohort of Ramucirumab Plus Pembrolizumab in Advanced Treatment-Naive NSCLC[J]. J Thorac Oncol, 2021, 16(2): 289-298. |
| [16] |
Reck M, Mok TSK, Nishio M, et al. Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lung cancer (IMpower150): key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised, open-label phase 3 trial[J]. Lancet Respir Med, 2019, 7(5): 387-401. |
| [17] |
龙方园, 何芳, 涂洁, 等. PD-1抑制剂(卡瑞利珠单抗)致反应性毛细血管增生症三例并文献复习[J]. 中国麻风皮肤病杂志, 2020, 36(4): 219-223. [Long FY, He F, Tu J, et al. Reactive capillary hemangiomas caused by PD-1 inhibitor (Calerizumab): a report of three cases and literature review[J]. Zhongguo Ma Feng Pi Fu Bing Za Zhi, 2020, 36(4): 219-223.] |
| [18] |
Chen X, Ma L, Wang X, et al. Reactive capillary hemangiomas: a novel dermatologic toxicity following anti-PD-1 treatment with SHR-1210[J]. Cancer Biol Med, 2019, 16(1): 173-181. |
| [19] |
Finlay WJJ, Coleman JE, Edwards JS, et al. Anti-PD1 'SHR-1210' aberrantly targets pro-angiogenic receptors and this polyspecificity can be ablated by paratope refinement[J]. MAbs, 2019, 11(1): 26-44. |
 2023, Vol. 50
2023, Vol. 50


