文章信息
- 单细胞转录组测序在鼻咽癌免疫微环境中的研究进展
- Research Progress of Single-cell Transcriptome Sequencing in Immune Microenvironment of Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2022, 49(12): 1291-1295
- Cancer Research on Prevention and Treatment, 2022, 49(12): 1291-1295
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0566
- 收稿日期: 2022-05-26
- 修回日期: 2022-09-05
2. 400021 重庆,重庆市中医院中医药基础研究室
2. Basic Research Laboratory of Traditional Chinese Medicine, Chongqing Traditional Chinese Medicine Hospital, Chongqing 400021, China
鼻咽癌(nasopharyngeal carcinoma, NPC)好发于人咽隐窝及侧壁。据2020年全球癌症统计,约有13.3万新发鼻咽癌病例,其中,超过75%的鼻咽癌病例分布在东亚和东南亚,尤其是在中国南部[1],我国5年内诊断为鼻咽癌的患者达13.85万[2]。鼻咽癌的产生与环境因素、遗传易感性和EB病毒(Epstein-Barr virus, EBV)感染密切相关[2],其病理特征表现为肿瘤病灶周围和内部的免疫细胞大量浸润,提示NPC中存在复杂的肿瘤免疫微环境(tumor immune microenvironment, TIME)[3]。
单细胞测序技术在解析鼻咽癌免疫微环境方面具有重要作用。目前单细胞技术应用于NPC的研究主要是使用单细胞转录组测序(single-cell RNA sequencing, scRNA-seq)技术分析NPC患者的外周血和肿瘤组织中的免疫微环境,而单细胞表观组测序、单细胞DNA测序、单细胞蛋白组测序在鼻咽癌中的应用尚未见相关报道。本文系统分析了鼻咽癌的单细胞转录组文献,发现鼻咽癌免疫微环境中的免疫细胞主要包括髓系细胞、T细胞、B细胞、自然杀伤(NK)细胞和非免疫细胞的成纤维细胞。本文将介绍scRNA-seq技术在鼻咽癌中的应用,并根据其在NPC免疫微环境中的应用,按照细胞类型分别进行综述。
1 单细胞转录组测序技术scRNA-seq技术能够对肿瘤组织的单个细胞mRNA水平进行分析[4]。scRNA-seq技术的迅速发展,为解析肿瘤浸润性免疫细胞的异质性及其与肿瘤中各种细胞类型的相互作用提供强有力的工具支撑。肿瘤浸润性免疫细胞研究经常使用两种类型的scRNA-seq技术:一种基于微孔板,将单个细胞分选到板孔道中制备RNA文库,如SMART-seq2、MATQ-seq、SUPeR-seq测序,检测基因表达敏感度高,但是一次只能分析数十到数百个细胞;另一种是将单个细胞包裹在液滴中制备RNA文库,如Drop-seq、STRT-seq、Seq-Well测序,检测基因表达敏感度较低,但是一次实验可获得数千个细胞的scRNA-seq数据,可对组织中的细胞类型进行更全面的采样,特别是对于稀有细胞类型更具优势。尽管这两种技术各有优缺点,但结合互补优势可更加全面地研究肿瘤免疫微环境。
针对NPC的scRNA-seq研究主要过程包括选取NPC患者和非NPC患者的鼻咽活检组织样本或外周血样本,制备单细胞混悬液,构建文库,上机测序和数据分析。临床样本的病理特征、取样部位、处理方法会影响组织中的细胞亚群构成。对NPC患者标本进行scRNA-seq检测,可为剖析肿瘤免疫微环境的组成、异质性、动态变化和调控带来新的见解。如scRNA-seq技术可识别参与调节肿瘤免疫逃逸细胞亚群和信号通路,鉴定细胞的功能、状态、分化发育,分析单核苷酸变异、RNA水平的基因表达变化、细胞间的相互作用和放化疗后细胞的改变[5],有利于发现新的细胞亚群、免疫耐药的靶点及分析药物引起的信号通路和细胞反应[6]。scRNA-seq技术被广泛应用于鼻咽癌免疫微环境的研究中,根据目前的研究结果对NPC免疫微环境中不同类型的细胞分类进行综述。
2 scRNA-seq技术分析鼻咽癌免疫微环境中的髓系细胞肿瘤浸润髓系细胞由几个主要的谱系组成,包括单核细胞、巨噬细胞、肥大细胞、浆细胞样树突状细胞(plasmacytoid dendritic cells, pDC)和常规树突状细胞(conventional dendritic cells, cDC)。cDC又可以分为CLEC9A+ DC(cDC1)和CD1C+ DC(cDC2)。cDC1与鼻咽癌的良好预后和EBV阴性相关[7],构成了负责交叉启动抗肿瘤CD8+ T细胞的关键亚型,并且对抗肿瘤免疫至关重要[8]。干扰素(IFN)反应相关通路在cDC和巨噬细胞中均上调[9]。巨噬细胞对NPC的特殊适应可能与EBV感染有关,这可能触发并维持TIME中高水平的炎性反应。人颗粒酶B(granzyme B, GZMB)和免疫球蛋白J链(joining chain of multimeric IgA and IgM, JCHAIN)在pDC中高度表达,表明该群体中的细胞可能表现出GZMB依赖性细胞毒性[7, 9]。
多篇报道证实NPC中存在不同于cDC1、cDC2的细胞亚群,这类DC细胞亚群以溶酶体膜蛋白3(LAMP3)为标志物,命名为LAMP3+ DC细胞[7, 9-11]。这类细胞也出现在肝癌[12]、乳腺癌[13]、肺癌[14]和结直肠癌[15]中。LAMP3+ DC是成熟态的DC,且具有较高的迁移能力,它可能起源于cDC1和cDC2[9]。LAMP3+ DC细胞发挥广泛调节淋巴细胞的作用,与T细胞、NK细胞相互作用的配体-受体数量较多[7]。LAMP3+ DC细胞通过配体CCL19、CCL22分别与T细胞、DC细胞上的受体CCR7、CCR4的相互作用,并通过配体CD86作用于Treg细胞上的受体CD28、CTLA4[12, 16]。LAMP3+ DC细胞和Treg细胞之间的联系也在其他肿瘤中得到证实[17],其中LAMP3+ DC细胞增强外周血中Treg细胞的趋化募集并促进它们在肿瘤中的浸润[18]。此外,LAMP3+ DC细胞在NPC中高表达吲哚胺2, 3-双加氧酶1(indoleamine 2, 3-dioxygenase 1, IDO1),可以促进抑制性Treg细胞的增殖[19]。
DC细胞与毒性CD8+T细胞或Treg细胞之间的交互作用已在多种肿瘤中得到证实[12, 20-21]。LAMP3+ DC和Treg细胞之间的相互作用可以增强NPC中耗竭CD8+T细胞的免疫抑制作用[9]。这些研究表明,不同细胞类型之间的相互作用在维持TIME的稳态中起重要作用,LAMP3+ DC与Treg细胞和耗竭CD8+T细胞也可能是NPC的潜在免疫治疗靶点[9]。多色免疫组织化学对高表达PD-1的耗竭T细胞与表达PD-L1的LAMP3+ DC进行空间位置分析,发现二者出现在相邻的位置,这为其相互作用提供了蛋白水平的证据[12]。然而,LAMP3+ DC在NPC中的作用与功能仍需要进一步的研究。
通过转录因子分析构建NPC患者外周血与肿瘤微环境之间树突状细胞的迁移、分化和调控网络[22],发现KDM2B、KLF6、NFKB1、TRAFD1、HMGN3和JUN等转录因子对促进LAMP3+ DC细胞的成熟,降低抗原呈递能力和增强免疫调节能力至关重要。靶向这些转录因子可能会使LAMP3+ DC细胞重塑为正常的抗原呈递表型,从而使LAMP3+ DC细胞在NPC患者体内重新发挥激活免疫的功能[23]。
鼻咽癌中的肥大细胞与更好的预后相关,表现出抗肿瘤表型。通过细胞间相互作用分析证实,NPC组织内肥大细胞上的受体ADRB2可与巨噬细胞分泌的配体IL1B结合,从而激发抗肿瘤特性[11],而其详细机制有待进一步探索。
3 scRNA-seq技术分析鼻咽癌免疫微环境中的T细胞T细胞是适应性免疫系统的主要成分,不同类型的T细胞与其他免疫细胞合作起到抗肿瘤的作用。在NPC免疫微环境中存在CD4+ CXCL13 Th细胞亚群[24-25],通过分泌趋化因子CXCL13作为配体,与B细胞上的CXCR5受体结合,促进TIME中三级淋巴样结构的形成与成熟,这群细胞为TIME中CXCL13的来源之一,且不存在于正常组织中[24]。细胞活性调节因子TGF-β和转录因子SOX4被确定为调节CD4+Th细胞中CXCL13表达的两个关键因素[26]。NFATC1在T细胞激活后调节PD-1表达,并提示NFATC1作为CD4+ PD-1+ T细胞的潜在调节因子,促使CD4+ Th细胞在NPC中功能失调[7]。
NPC的研究发现TIME中存在三个耗竭CD8+T细胞亚群[7, 9-10],分别高表达耗竭标志物LAG3、HAVCR2和TOX。NPC肿瘤组织中的耗竭CD8+T细胞亚群表现出较高的趋化因子CXCL13表达水平[25]。在鼻咽癌患者中,高表达CXCL13与更好的无进展生存相关,提示CXCL13高的耗竭T细胞可能仍然有利于免疫调节[9],同样在三阴性乳腺癌和非小细胞肺癌中CXCL13+ T细胞有利于PD-L1治疗[27-28]。通过构建CD8+ T细胞的发育轨迹,表明初始CD8+ T细胞向细胞毒性CD8+ T细胞转化,进而向耗竭CD8+T细胞转化。通过TIME调节重新编程耗竭T细胞成为重新激活抗肿瘤免疫的可行疗法[7, 25, 29]。W03-(EBV+)肿瘤细胞和新鲜NPC组织活检中获得的T细胞共培养实验发现肿瘤细胞具有“上皮-免疫”双重特征,可以抑制肿瘤浸润的T淋巴细胞分泌IFN-γ,这可能是造成CD8+ T细胞耗竭的重要原因[29]。
Treg细胞根据其状态主要分为抑制性与静息性。抑制性Treg与静息性Treg相比,IFN反应增强,表明IFN相关途径可能导致Treg相关的免疫抑制[25]。IFN-γ和IFN-α在NPC的T细胞亚群中上调,表明1型和2型干扰素过度产生,说明这种全局性干扰素反应上调普遍存在于NPC免疫微环境的T细胞亚群中[25, 29],病毒感染与肿瘤细胞对TIME存在协同影响。scRNA-seq和TCR测序整合分析揭示效应T细胞在肿瘤和肿瘤邻近组织中的克隆型扩增,在外周血中也得到了相同的结果[22, 25]。此外,已证实肿瘤内T细胞来自外周血[22]。
通过以上研究,我们可以得出在NPC免疫微环境中,CXCL13主要由CD4+ Th细胞和耗竭CD8+ T细胞产生。在接受PD-1阻断的非小细胞肺癌患者的PD-1+ T细胞中也发现CXCL13的产生增加,且细胞毒性受损[30]。CXCL13被确定为B细胞化学引诱物,在三级淋巴结构形成中发挥重要作用,并广泛参与自身免疫性疾病和淋巴组织增生性疾病的发生[24]。根据中位基因表达将NPC患者分为CXCL13高表达和CXCL13低表达组,并观察到CXCL13高表达患者中CXCR5+ B细胞的比例更高[9],说明CXCL13-CXCR5协调T细胞-B细胞相互作用,调节TIME中的淋巴细胞浸润。
4 scRNA-seq技术分析鼻咽癌免疫微环境中的B细胞单细胞分析表明,浸润的B细胞已成为NPC重要的预后因素和治疗靶点[7, 9]。T细胞中CXCL13的研究提示,B细胞的浸润可能是通过CXCL13-CXCR5从周围淋巴结和外周血进入TIME[24]。考虑到肿瘤浸润性B细胞的预后价值,增加肿瘤内B细胞可能是一种有效的辅助治疗。
IFN+B细胞和双阴性B细胞(IGHD-/CD27-)富集在TIME中。而初始B细胞、未活化B细胞和先天样B细胞,优先富集在非恶性微环境中。NPC和癌旁来源的B细胞之间的差异基因较少,这表明B细胞的功能可能在很大程度上取决于丰度,而不是遗传调控或细胞因子分泌的差异。双阴性B细胞在NPC微环境中扩增,占总B细胞12.6%,并与较差的预后相关[9]。拟时序分析表明,NPC中双阴性B细胞是成熟效应B细胞的前体,可进一步分化为浆B细胞和记忆B细胞。然而,在NPC肿瘤微环境中,双阴性B细胞的分化被肿瘤或TIME阻止,被迫维持在中间分化且无效的表型[7, 9]。因此,抑制NPC微环境中双阴性B细胞的扩增或诱导分化可能会增强炎性反应激活。此外,量化NPC患者肿瘤内或外周双阴性B细胞的丰度可能对患者分层和预后是可行的,并可作为治疗的生物标志物[7, 9]。
NPC中的B细胞差异表达基因主要是干扰素诱导和免疫球蛋白编码基因,包括IFITM1、IFI44L、IGHA1、IGKC和IGHG3[9]。与T细胞亚群中显示的结果一致,B细胞的通路分析显示,NPC中的B细胞也很大程度上受到IFN-γ和IFN-α过度释放的影响,而癌旁组织的B细胞主要受炎性反应通路的影响[9]。研究报道IFN影响B细胞的成熟、分化和免疫激活[31-32],推测IFN可能触发免疫抑制机制[33],但IFN诱导的B细胞的浸润是否对NPC患者具有预后意义仍不清楚。
在研究中发现TIEM中含FCRL4+记忆B细胞和生发中心(germinal centers, GC)B细胞亚群,这在以往的报道中很少见。FCRL4+记忆B细胞中CCR1高表达促使这类细胞归巢到发炎的组织,具有较高亲和力的GC B细胞可以被诱导成为浆细胞[7, 9]。GC B细胞表现出丙酮酸代谢和MYC通路的激活,而糖酵解途径在浆细胞中上调[6]。此外,还在浆细胞中检测到巨噬细胞趋化途径的高活性,表明这些途径在促进巨噬细胞募集到TIME的潜在作用[7, 9]。受转录因子调节的基因如BCL6和ATF4的表达分别在GC B细胞和浆细胞中特异性上调。BCL6对GC B细胞发育至关重要,它重新激活B细胞转录程序以增强对外部刺激的反应,而ATF4在免疫球蛋白产生中起作用[7]。生存分析显示,FCRL4+记忆B细胞特征和浆细胞特征基因(CD79A、MS4A1、FCRL4和IGHD)与NPC患者更好的无进展生存显著相关,表明FCRL4+记忆B细胞在抗NPC免疫中发挥积极作用[9]。
5 scRNA-seq技术分析鼻咽癌免疫微环境中的NK细胞NK细胞中与毒性CD8+ T细胞的部分转录因子(EOMES, RUNX3和XBP1)均显著上调[7],说明这些转录因子在NPC中增强CD8+ T和NK细胞在鼻咽癌中的细胞毒性。DC1细胞表达相对较高水平的受体XCR1,NK细胞过表达XCR1的配体XCL1和XCL2[7],说明NK细胞可能会募集DC1细胞到TIME中[34]。
6 scRNA-seq技术分析鼻咽癌免疫微环境中的成纤维细胞成纤维细胞虽然不属于免疫细胞,已有研究证实在NPC患者的肿瘤组织中有成纤维细胞浸润,成纤维细胞表达更多数量的有效配体,其受体由肿瘤细胞表达[9-10]。细胞配体-受体相互作用,如COL1A1-ITGB1和COL6A1-ITGB1,可能促进肿瘤进展。COL1A2、COL6A1、COL6A3、COL14A1和CD248在成纤维细胞中高表达,并与TIME中的内皮细胞丰度呈正相关,说明它们在内皮细胞募集和血管生成中的潜在作用[9-10]。补体基因(C2、C3和SERPING1)由成纤维细胞表达,与T细胞丰度高度相关;另外,肿瘤来源的成纤维细胞中上调的基因在IFN反应相关途径中富集[10]。
7 总结与展望鼻咽癌中的IFN在TIME中的T细胞、DC、巨噬细胞、成纤维细胞和内皮细胞中显著上调[10]。尽管IFN应答在战胜病毒感染中的作用已得到充分确立,但IFN在NPC免疫功能失调发挥着重要作用。既往研究提示NPC患者的不良预后部分是由于IFN赋予肿瘤细胞的免疫抑制能力,由此推测IFN反应在NPC中起到“双刃剑”的作用[10]。虽然其最初的功能是对抗病毒感染,但恶性转化后的IFN反应有助于肿瘤细胞在TIME中存活[10]。
LAMP3+ DC在NPC中诱导肿瘤浸润抑制Treg细胞的增殖,可以增强NPC中耗竭CD8+ T细胞的免疫抑制作用。CXCL13在NPC中CD4+ Th和耗竭CD8+ T细胞中促使高度免疫抑制状态的调节性T细胞浸润增加,并且通过CXCR5+B细胞募集参与三级淋巴结构的形成[24]。细胞毒性CD8+ T细胞广泛表达免疫检查点因子(PDCD1和LAG3),可以考虑免疫检查点阻断。
在这篇综述中,我们基于scRNA-seq在NPC中的应用,分析和探讨NPC免疫微环境,见图 1,可以利用免疫细胞的浸润,减少LAMP3+ DC细胞、耗竭CD8+ T细胞的生成,激活T细胞杀伤作用以助于鼻咽癌的治疗。目前的NPC单细胞研究主要集中于免疫细胞,对于肿瘤细胞、免疫细胞、成纤维细胞和内皮细胞之间的相互作用研究较少,全面了解不同细胞之间的相互关系有助于设计新型靶向免疫调节疗法,从而找到治疗鼻咽癌新策略。
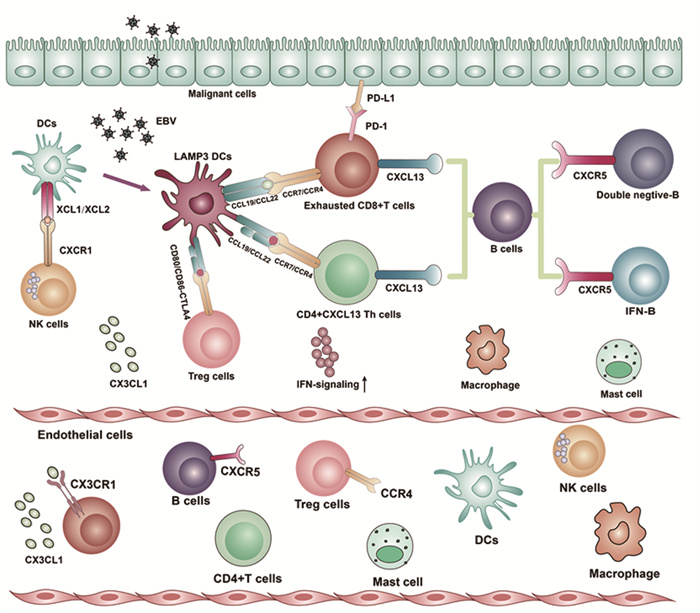
|
| Immune cells infiltrate into the tumor tissue from blood vessels under the effect of chemokines, thereby interacting with tumor cells. 图 1 鼻咽癌免疫微环境中细胞募集和细胞间相互作用的示意图 Figure 1 Schematic illustration of cell recruitment and cell–cell interactions in the nasopharyngeal carcinoma immune microenvironment |
作者贡献:
应敏:文献整理、论文构思及撰写
刘金坤:论文指导、校对及修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Zhu Q, Zhao G, Li Y, et al. Advances in pathogenesis and precision medicine for nasopharyngeal carcinoma[J]. MedComm, 2021, 2(2): 175-206. DOI:10.1002/mco2.32 |
| [3] |
Wang YQ, Chen YP, Zhang Y, et al. Prognostic significance of tumor-infiltrating lymphocytes in nondisseminated nasopharyngeal carcinoma: A large-scale cohort study[J]. Int J Cancer, 2018, 142(12): 2558-2566. DOI:10.1002/ijc.31279 |
| [4] |
Lei Y, Tang R, Xu J, et al. Applications of single-cell sequencing in cancer research: progress and perspectives[J]. J Hematol Oncol, 2021, 14(1): 1-26. DOI:10.1186/s13045-020-01025-7 |
| [5] |
Luecken MD, Theis FJ. Current best practices in single-cell RNA-seq analysis: a tutorial[J]. Mol Syst Biol, 2019, 15(6). |
| [6] |
Ren X, Zhang L, Zhang Y, et al. Insights Gained from Single-Cell Analysis of Immune Cells in the Tumor Microenvironment[J]. Annu Rev Immunol, 2021, 39: 583-609. DOI:10.1146/annurev-immunol-110519-071134 |
| [7] |
Chen YP, Yin JH, Li WF, et al. Single-cell transcriptomics reveals regulators underlying immune cell diversity and immune subtypes associated with prognosis in nasopharyngeal carcinoma[J]. Cell Res, 2020, 30(11): 1024-1042. DOI:10.1038/s41422-020-0374-x |
| [8] |
Zhang L, Li Z, Skrzypczynska KM, et al. Single-Cell Analyses Inform Mechanisms of Myeloid-Targeted Therapies in Colon Cancer[J]. Cell, 2020, 181(2): 442-459. DOI:10.1016/j.cell.2020.03.048 |
| [9] |
Gong L, Kwong DLW, Dai W, et al. Comprehensive single-cell sequencing reveals the stromal dynamics and tumor-specific characteristics in the microenvironment of nasopharyngeal carcinoma[J]. Nat Commun, 2021, 12(1): 1-18. DOI:10.1038/s41467-020-20314-w |
| [10] |
Jin S, Li R, Chen MY, et al. Single-cell transcriptomic analysis defines the interplay between tumor cells, viral infection, and the microenvironment in nasopharyngeal carcinoma[J]. Cell Res, 2020, 30(11): 950-965. DOI:10.1038/s41422-020-00402-8 |
| [11] |
Cheng S, Li Z, Gao R, et al. A pan-cancer single-cell transcriptional atlas of tumor infiltrating myeloid cells[J]. Cell, 2021, 184(3): 792-809. DOI:10.1016/j.cell.2021.01.010 |
| [12] |
Zhang Q, He Y, Luo N, et al. Landscape and Dynamics of Single Immune Cells in Hepatocellular Carcinoma[J]. Cell, 2019, 179(4): 829-845. DOI:10.1016/j.cell.2019.10.003 |
| [13] |
Michea P, Noël F, Zakine E, et al. Adjustment of dendritic cells to the breast-cancer microenvironment is subset specific[J]. Nat Immunol, 2018, 19(8): 885-897. DOI:10.1038/s41590-018-0145-8 |
| [14] |
Zilionis R, Engblom C, Pfirschke C, et al. Single-Cell Transcriptomics of Human and Mouse Lung Cancers Reveals Conserved Myeloid Populations across Individuals and Species[J]. Immunity, 2019, 50(5): 1317-1334. DOI:10.1016/j.immuni.2019.03.009 |
| [15] |
Liu Y, Zhang Q, Xing B, et al. Immune phenotypic linkage between colorectal cancer and liver metastasis[J]. Cancer Cell, 2022, 40(4): 424-437. DOI:10.1016/j.ccell.2022.02.013 |
| [16] |
Podolsky MA, Bailey JT, Gunderson AJ, et al. Differentiated state of initiating tumor cells is key to distinctive immune responses seen in H-RasG12V-induced squamous tumors[J]. Cancer Immunol Res, 2017, 5(3): 198-210. DOI:10.1158/2326-6066.CIR-16-0304 |
| [17] |
Ren XW, Zhang L, Zhang YY, et al. Insights Gained from Single-Cell Analysis of Immune Cells in the Tumor Microenvironment[J]. Annu Rev Immunol, 2021, 39: 583-609. DOI:10.1146/annurev-immunol-110519-071134 |
| [18] |
Mizukami Y, Kono K, Kawaguchi Y, et al. CCL17 and CCL22 chemokines within tumor microenvironment are related to accumulation of Foxp3+ regulatory T cells in gastric cancer[J]. Int J Cancer, 2008, 122(10): 2286-2293. DOI:10.1002/ijc.23392 |
| [19] |
Wu H, Gong J, Liu Y. Indoleamine 2, 3-dioxygenase regulation of immune response[J]. Mol Med Rep, 2018, 17(4): 4867-4873. |
| [20] |
Jang JE, Hajdu CH, Liot C, et al. Crosstalk between Regulatory T Cells and Tumor-Associated Dendritic Cells Negates Anti-tumor Immunity in Pancreatic Cancer[J]. Cell Rep, 2017, 20(3): 558-571. DOI:10.1016/j.celrep.2017.06.062 |
| [21] |
Sánchez-Paulete AR, Teijeira A, Cueto FJ, et al. Antigen cross-presentation and T-cell cross-priming in cancer immunology and immunotherapy[J]. Ann Oncol, 2017, 28: 74. |
| [22] |
Liu Y, He S, Wang XL, et al. Tumour heterogeneity and intercellular networks of nasopharyngeal carcinoma at single cell resolution[J]. Nat Commun, 2021, 12(1): 1-18. DOI:10.1038/s41467-020-20314-w |
| [23] |
Peng WS, Zhou X, Yan WB, et al. Dissecting the heterogeneity of the microenvironment in primary and recurrent nasopharyngeal carcinomas using single-cell RNA sequencing[J]. Oncoimmunology, 2022, 11(1): 2026583. DOI:10.1080/2162402X.2022.2026583 |
| [24] |
Li JP, Wu CY, Chen MY, et al. PD-1+CXCR5-CD4+Th-CXCL13 cell subset drives B cells into tertiary lymphoid structures of nasopharyngeal carcinoma[J]. J Immunother Cancer, 2021, 9(7): e002101. DOI:10.1136/jitc-2020-002101 |
| [25] |
Gong L, Kwong DL, Dai W, et al. Comprehensive single-cell sequencing reveals the stromal dynamics and tumor-specific characteristics in the microenvironment of nasopharyngeal carcinoma[J]. Nat Commun, 2021, 12(1): 1-18. DOI:10.1038/s41467-020-20314-w |
| [26] |
Workel HH, Lubbers JM, Arnold R, et al. A Transcriptionally Distinct CXCL13+CD103+CD8+ T-cell Population Is Associated with B-cell Recruitment and Neoantigen Load in Human Cancer[J]. Cancer Immunol Res, 2019, 7(5): 784-796. DOI:10.1158/2326-6066.CIR-18-0517 |
| [27] |
Zhang Y, Chen H, Mo H, et al. Single-cell analyses reveal key immune cell subsets associated with response to PD-L1 blockade in triple-negative breast cancer[J]. Cancer Cell, 2021, 39(12): 1578-1593. DOI:10.1016/j.ccell.2021.09.010 |
| [28] |
He J, Xiong X, Yang H, et al. Defined tumor antigen-specific T cells potentiate personalized TCR-T cell therapy and prediction of immunotherapy response[J]. Cell Res, 2022, 32(6): 530-542. DOI:10.1038/s41422-022-00627-9 |
| [29] |
Jin S, Li R, Chen MY, et al. Single-cell transcriptomic analysis defines the interplay between tumor cells, viral infection, and the microenvironment in nasopharyngeal carcinoma[J]. Cell Res, 2020, 30(11): 950-965. DOI:10.1038/s41422-020-00402-8 |
| [30] |
Thommen DS, Koelzer VH, Herzig P, et al. A transcriptionally and functionally distinct pd-1+ cd8+ t cell pool with predictive potential in non-small-cell lung cancer treated with pd-1 blockade[J]. Nat Med, 2018, 24(7): 994-1004. DOI:10.1038/s41591-018-0057-z |
| [31] |
De Groen RA, Groothuismink ZM, Liu BS, et al. IFN-is able to augment TLR-mediated activation and subsequent function of primary human B cells[J]. J Leukoc Biol, 2015, 98(4): 623-630. DOI:10.1189/jlb.3A0215-041RR |
| [32] |
Hervas-Stubbs S, Perez-Gracia JL, Rouzaut A, et al. Direct effects of type I interferons on cells of the immune system[J]. Clin Cancer Res, 2011, 17(9): 2619-2627. DOI:10.1158/1078-0432.CCR-10-1114 |
| [33] |
Kyriakidis NC, Kapsogeorgou EK, Gourzi VC, et al. Toll-like receptor 3 stimulation promotes Ro52/TRIM21 synthesis and nuclear redistribution in salivary gland epithelial cells, partially via type I interferon pathway[J]. Clin Exp Immunol, 2014, 178(3): 548-560. DOI:10.1111/cei.12432 |
| [34] |
Böttcher JP, Bonavita E, Chakravarty P, et al. NK Cells Stimulate Recruitment of cDC1 into the Tumor Microenvironment Promoting Cancer Immune Control[J]. Cell, 2018, 172(5): 1022-1037. DOI:10.1016/j.cell.2018.01.004 |
 2022, Vol. 49
2022, Vol. 49


