文章信息
- 基于肿瘤微环境探讨六神丸对结肠癌小鼠移植瘤的抗肿瘤作用
- Antitumor Effect of Liu-Shen-Wan on Transplanted Tumors of Mice with Colon Cancer from Perspective of Tumor Microenvironment
- 肿瘤防治研究, 2022, 49(12): 1212-1216
- Cancer Research on Prevention and Treatment, 2022, 49(12): 1212-1216
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0508
- 收稿日期: 2022-05-11
- 修回日期: 2022-09-01
2. 200062 上海,上海市普陀区中心医院普外科
2. Department of General Surgery, Shanghai Putuo District Center Hospital, Shanghai 200062, China
结直肠癌是一种发病率较高的恶性肿瘤,其发病率和死亡率在全球分别位列第三和第二[1]。目前在结直肠癌的治疗上,主要以手术治疗为主,结合放化疗等手段进行综合治疗。然而化疗耐药与肿瘤转移是目前结直肠癌治疗效果的最大障碍,也是导致治疗失败的主要原因。越来越多的证据表明,肿瘤微环境(TME)是一个复杂的环境,包括细胞(T细胞、B细胞、巨噬细胞、髓源性抑制细胞、癌症相关成纤维细胞等)和非细胞成分,在癌症进展的多个方面发挥重要作用,而作为TME的重要组成部分,M2型巨噬细胞可调节多个关键的致癌过程,即肿瘤的发生、增殖、转移和耐药性等[2-3]。大量研究表明传统中医药可通过调控M2型巨噬细胞极化发挥抗肿瘤作用[4-5]。近年来,六神丸治疗恶性肿瘤的作用被逐渐关注,其抗肿瘤作用主要体现在抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抗肿瘤细胞转移、逆转耐药性等方面[6-7]。但在结直肠癌中,六神丸抗肿瘤作用机制仍不十分清楚。本研究通过开展动物体内实验,对此进行探讨。
1 材料与方法 1.1 材料 1.1.1 动物18只健康6周龄18~22 g雄性BALB/c小鼠(上海斯莱克实验动物有限公司),12 h光照/黑暗循环,室温控制在20℃~24℃,相对湿度45%~70%,分笼、自由饮用水饲养。
1.1.2 细胞株鼠源结肠癌细胞株(CT26)(中国科学院上海细胞生物学研究所),RPMI 1640培养液(含1%青霉素/链霉素双抗溶液、10%胎牛血清),细胞培养箱中进行恒温培养(37℃、5% CO2)。
1.1.3 药品与试剂IL-10、TGF-β、IFN-γ和IL-12P40的ELISA试剂盒(中国博士德公司);奥沙利铂(50毫克/支,江苏恒瑞医药股份有限公司,H20000337);六神丸(10粒/支×6支/盒,每1000粒重3.125 g,上海雷允上药业,Z20020069);RNA提取试剂盒(湖南艾科瑞生物,AG21022)。
1.1.4 仪器设备BioRad-680多功能酶标仪(美国BioRad公司);Leica Dmi1倒置显微镜(德国徕卡公司);台式高速冷冻离心机(德国Eppendorf公司);HERAcell240iCO2恒温培养箱(美国ThermoFisher Scientific公司)。
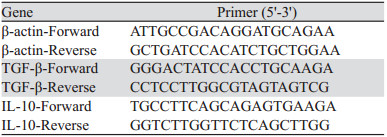
1.2 实验方法 1.2.1 分组与给药取生长状态良好的1×106个CT26细胞制备为0.2 ml单细胞悬液,皮下接种于小鼠背部近右上肢部位,造模成功后将所有BALB/c小鼠随机分成3组,每组6只:对照组(Vehicle, 0.9%氯化钠溶液200 μl/d)、奥沙利铂组(OXA, 3 mg/(kg·d))、奥沙利铂(3 mg/(kg·d))联合六神丸(19.2 mg/(kg·d))(LSW+OXA)组,给药剂量为每只0.2 ml,0.9%氯化钠溶液和奥沙利铂通过腹腔注射,六神丸灌胃处理(取六神丸颗粒研钵研细粉末,随后加入PBS,超声处理30 min,混匀器充分混匀,4℃静置3 h,用0.22 μm微孔滤膜过滤),两天1次,共三周。培养一周后测量肿瘤体积并开始给药,治疗结束后通过颈椎脱位法处死小鼠,实验流程图见图 1。本研究经上海中医药大学附属普陀医院动物伦理委员会批准。
|
| 图 1 小鼠实验流程图 Figure 1 Flow chart of mouse experiment |
眼球取血,自然条件下静置血液使其分层,3 000 r/min低温离心10 min,取上清液,-80℃冻存用于后续ELISA实验。将皮下移植瘤剥离并称重,脾脏取出后滤纸吸干称重,计算脾脏指数。将肿瘤组织一部分置于福尔马林溶液中用于后续免疫组织化学实验,其余肿瘤组织-80℃冻存用于后续荧光定量PCR实验。
1.2.3 荧光定量PCR实验将肿瘤组织放入研钵中,加入少量液氮,迅速研磨,将组织样品转移至离心管,加入1 ml TRIzol裂解液,根据试剂盒说明书中的步骤提取RNA,并完成反转录:37℃ 15 min, 85℃ 5 s, 4℃保存。20 μl PCR反应体系(1 μl DNA模板,8 μl dH2O,10 μl的2×Premix,上下游引物各0.5 μl),95℃ 30 s, 95℃ 5 s, 60℃ 30 s, 72℃ 30 s,45个循环。引物序列见表 1。
将小鼠血清解冻后,通过鼠源IFN-γ、IL-12P40、IL10和TGF-β的ELISA试剂盒检测各组不同因子表达水平。
1.2.5 免疫组织化学实验移植瘤组织用10%福尔马林固定,石蜡包埋,切片,厚度为5 μm。之后脱蜡水化,加入相关抗体:CD68(ab955,美国Abcam公司),CD206(ab64693, 美国Abcam公司)。4℃过夜,滴加生物素标记二抗,二氨基联苯胺(diaminobenzidine, DAB)显色,蒸馏水冲洗,苏木精对比染色,梯度乙醇脱水,二甲苯透明,封片,在400倍光学显微镜下观察。
1.3 统计学方法采用SPSS22.0软件行统计分析,计量资料以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P < 0.05表示差异有统计学意义。
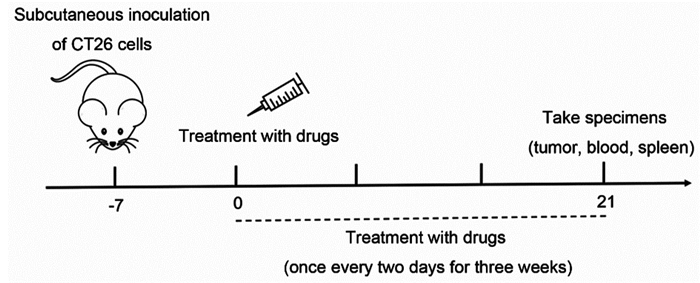
2 结果 2.1 六神丸对结肠癌小鼠移植瘤的抑制作用小鼠给药三周后,对照组、奥沙利铂组和联合组的移植瘤体积分别为(1882.30±459.44)、(1148.55±154.23)和(572.15±36.77)mm3;瘤重分别为(4.39±0.53)、(3.29±0.19)和(1.63±0.16)g,见图 2A~B,与对照组相比,六神丸联合奥沙利铂可明显抑制肿瘤的生长,可降低肿瘤的体积及质量,差异有统计学意义(P=0.0054, P=0.0013)。药物处理后小鼠体质量未明显降低,同时各组小鼠的相关血生化指标水平之间无明显差异,一定程度说明药物处理无明显不良反应,见图 2C~H。
|
| A: change in the tumor volume of mice in each group; B: change in the tumor weight of mice in each group; C: change in the body weight of mice in each group; D-H: detection of relevant blood biochemical indicators of mice in each group; *: P < 0.05, **: P < 0.01, compared with vehicle group. ns: no significance. 图 2 六神丸对结肠癌小鼠移植瘤的抑制作用 Figure 2 Inhibitory effect of Liu-Shen-Wan on the transplanted tumor of mice with colon cancer |
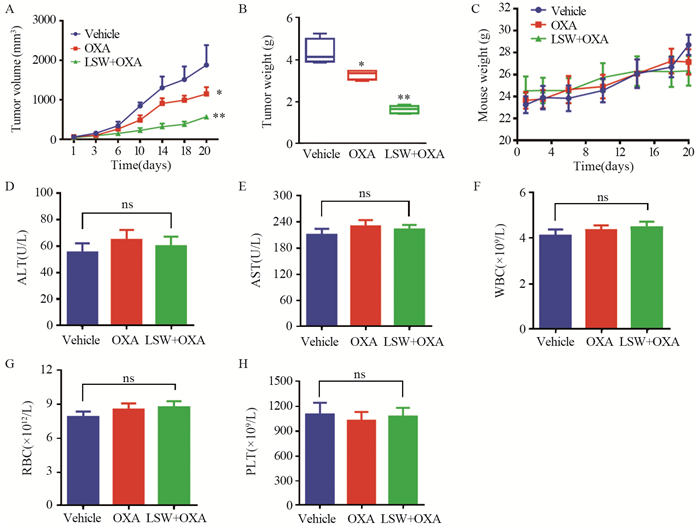
对照组、奥沙利铂组和联合组的脾脏指数分别为(4.67±0.52)、(6.48±0.45)和(10.45±0.94)mg/g。与对照组相比,六神丸联合奥沙利铂可明显提高小鼠的脾脏指数水平,差异有统计学意义(P=0.0071),见图 3A。对照组、奥沙利铂组和联合组的血清IFN-γ表达分别为(112±7.5)、(210±9.5)和(290±10)pg/ml。与对照组相比,六神丸联合奥沙利铂可明显提高小鼠的血清IFN-γ表达水平,差异有统计学意义(P=0.0049),见图 3B。另外对照组、奥沙利铂组和联合组的血清IL-12P40表达分别为(110±10)、(240±10)和(380±15)pg/ml。与对照组相比,六神丸联合奥沙利铂可明显提高小鼠的血清IL-12P40表达水平,差异有统计学意义(P=0.0043),见图 3C。这些结果初步表明六神丸可能具有提高小鼠免疫水平的作用。
|
| A: changes in the spleen index of mice in each group; B: IFN-γ expression level in the serum of mice in each group; C: IL-12P40 expression level in the serum of mice in each group; *: P < 0.05, **: P < 0.01, compared with vehicle group. 图 3 六神丸对免疫相关指标的影响 Figure 3 Effects of Liu-Shen-Wan on immune-related indices |
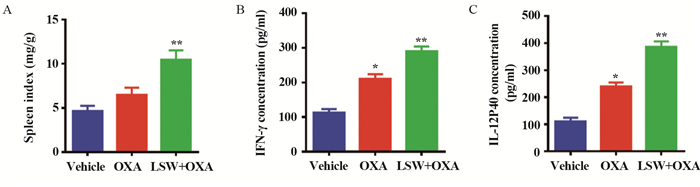
对照组、奥沙利铂组和联合组血清中IL-10的表达水平分别为(61.60±1.21)、(56.45±2.05)和(32.37±2.75)pg/ml,TGF-β的表达水平分别为(342.03±10.45)、(308.04±7.32)和(137.42±9.19)pg/ml,与对照组相比,六神丸联合奥沙利铂可明显降低小鼠血清中的IL-10及TGF-β水平,差异有统计学意义(P=0.0025, P=0.0046),见图 4A~B;对照组、奥沙利铂组和联合组的肿瘤组织中IL-10 mRNA相对表达量分别为1.05±0.04、0.88±0.08和0.62±0.06,TGF-β mRNA相对表达量分别为1.01±0.06、0.88±0.04和0.52±0.04,联合组与对照组相比差异有统计学意义(P=0.0280, P=0.0078),说明六神丸联合奥沙利铂可降低肿瘤组织中IL-10及TGF-β的mRNA水平,见图 4C~D。用CD68标记巨噬细胞,用CD206标记M2型巨噬细胞,免疫组织化学实验发现对照组、奥沙利铂组和联合组肿瘤组织中CD68的阳性表达分别为(19.25±1.25)%、(17.95±0.85)%和(8.5±0.7)%,CD206的阳性表达分别为(24.1±0.9)%、(22.05±0.85)%和(10.95±0.85)%,联合组与对照组相比差异有统计学意义(P=0.0173, P=0.0087),说明六神丸联合奥沙利铂可降低肿瘤组织中CD68及CD206的表达强度,见图 4E~F。结果表明六神丸可一定程度降低M2型巨噬细胞极化水平从而发挥抗肿瘤作用。
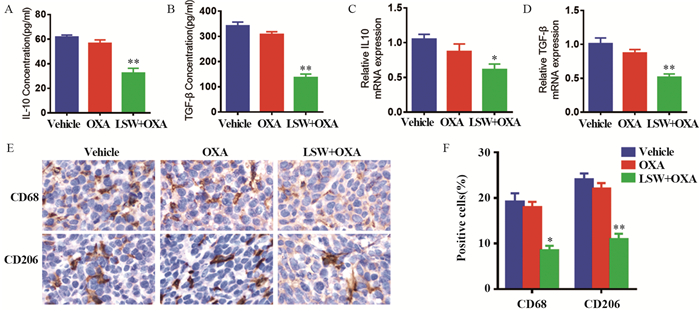
|
| A-B: effect of Liu-Shen-Wan on serum IL10 and TGF-β; C-D: effect of Liu-Shen-Wan on the mRNA expression of IL10 and TGF-β in tissue; E-F: immunohistochemical experiments to detect the infiltration of M2 macrophages in tumor tissue; *: P < 0.05, **: P < 0.01, compared with vehicle group. 图 4 六神丸对M2型巨噬细胞极化的影响 Figure 4 Effect of Liu-Shen-Wan on the polarization of M2 macrophages |
近年来,恶性肿瘤患病者例数逐年增加,已经成为了一个重大公共卫生问题。肿瘤细胞或肿瘤干细胞所处微环境与肿瘤的发生、发展和转移密切相关。本课题组前期研究发现M2型巨噬细胞极化可促进结肠癌耐药发生[8]。中医药治疗是以整体观念为指导的辨证论治,对结肠癌的治疗展现了独特的优势。有研究指出传统中医药可通过调控肿瘤微环境发挥抗肿瘤作用,包括抑制肿瘤细胞生长及转移、逆转耐药等[9]。
六神丸作为一个传统药物,其组成药物牛黄清热解毒,与活血散结药麝香配伍,发挥清热解毒活血功效。雄黄燥湿化痰,冰片辟浊散火,辅以以毒攻毒蟾酥,佐以解毒生肌珍珠,诸药合用,共奏清热解毒、消肿止痛功效,在攻毒方面具有独特作用。六神丸在临床上应用广泛,包括抗肿瘤、麻醉、强心、增强免疫、抗炎等[10-12]。梁世霞等研究结果显示,六神丸能够使MMP-9基因表达水平显著降低,从而抑制肝癌细胞转移,同时还能减缓基质降解,进一步降低血管通透性[13]。还有学者指出六神丸在治疗食管癌方面的作用主要是通过促进癌症细胞凋亡以及抑制Bcl-2表达来实现[14]。此外有研究表明人参半夏汤联合六神丸可较好改善Ⅲ、Ⅳ期食管癌患者临床症状,提高生活质量,稳定并增加体质量,是治疗中晚期食管癌的有效方法之一[15]。本研究构建了结肠癌移植瘤小鼠模型,结果发现六神丸联合化疗药物奥沙利铂可明显降低小鼠肿瘤体积及肿瘤质量,表明其可抑制肿瘤生长。我们进一步观察了其对免疫相关指标的影响,发现六神丸联合奥沙利铂可明显提高小鼠的脾脏指数水平,同时增强血清中IFN-γ及IL-12P40表达水平,表明其可一定程度增强小鼠的免疫水平。
肿瘤微环境中M2型巨噬细胞极化在肿瘤发生发展过程中发挥着重要作用。此外有证据表明,M2型巨噬细胞的表型和浸润与结直肠癌患者的预后有关[16]。巨噬细胞的表型可塑性为治疗提供了新的见解。因此,M2型巨噬细胞靶向治疗有利于提高治疗效果和改善患者预后。目前从肿瘤微环境角度阐述六神丸对结直肠癌的作用鲜有报道,本研究发现六神丸联合奥沙利铂可明显降低小鼠血清及肿瘤组织中M2型巨噬细胞极化相关因子IL10与TGF-β,同时肿瘤组织中CD68及CD206蛋白表达水平下降,这些结果表明六神丸可抑制M2型巨噬细胞极化。由此表明,六神丸对结肠癌小鼠移植瘤的抗肿瘤作用与抑制肿瘤微环境中M2型巨噬细胞极化密切相关。本研究方案设计存在一定的不足之处:动物实验分组缺乏六神丸单独给药组,未能直接地观察到其抗肿瘤疗效及与其他分组之间的疗效比较,以及其单独给药及与联合化疗药后对M2型巨噬细胞极化的作用;未进行体外实验及临床试验进一步观察六神丸对M2型巨噬细胞极化作用的影响。后续将进一步深入研究六神丸调节M2型巨噬细胞极化进而发挥抗肿瘤作用的具体机制。
作者贡献:
陈进宝:实验操作及论文撰写
贾琳琳、汪红平:收集标本
唐东豪:实验操作
吴宏磊:数据统计
殷佩浩:实验设计及实施指导
| [1] |
Xi Y, Xu P. Global colorectal cancer burden in 2020 and projections to 2040[J]. Transl Oncol, 2021, 14(10): 101174. DOI:10.1016/j.tranon.2021.101174 |
| [2] |
Li Y, Chen Z, Han J, et al. Functional and Therapeutic Significance of Tumor-Associated Macrophages in Colorectal Cancer[J]. Front Oncol, 2022, 12: 781233. DOI:10.3389/fonc.2022.781233 |
| [3] |
Li W, Zhang X, Wu F, et al. Gastric cancer-derived mesenchymal stromal cells trigger M2 macrophage polarization that promotes metastasis and EMT in gastric cancer[J]. Cell Death Dis, 2019, 10(12): 918. DOI:10.1038/s41419-019-2131-y |
| [4] |
He J, Yin P, Xu K. Effect and Molecular Mechanisms of Traditional Chinese Medicine on Tumor Targeting Tumor-Associated Macrophages[J]. Drug Des Devel Ther, 2020, 14: 907-919. DOI:10.2147/DDDT.S223646 |
| [5] |
Xu B, Zhang H, Wang Y, et al. Mechanism of Xu Li's Experiential Prescription for the Treatmentof EGFR-Positive NSCLC[J]. Evid Based Complement Alternat Med, 2020, 2020: 8787153. |
| [6] |
吴宏磊, 陈进宝, 徐可, 等. 六神丸对结肠癌CT26荷瘤小鼠移植瘤生长的影响[J]. 中国临床药理学杂志, 2022, 38(11): 1203-1206. [Wu HL, Chen JB, Xu K, et al. Effect of Liushen pills on the growth of colon cancer CT26 tumor-bearing mice[J]. Zhongguo Lin Chuang Yao Li Xue Za Zhi, 2022, 38(11): 1203-1206.] |
| [7] |
韩珊珊, 刘寨东. 六神丸抗肿瘤作用研究进展[J]. 江苏中医药, 2022, 54(6): 79-82. [Han SS, Liu ZD. Research progress on antitumor effect of Liushen Pill[J]. Jiangsu Zhong Yi Yao, 2022, 54(6): 79-82.] |
| [8] |
Chen J, Wang H, Jia L, et al. Bufalin targets the SRC-3/MIF pathway in chemoresistant cells to regulate M2 macrophage polarization in colorectal cancer[J]. Cancer Lett, 2021, 513: 63-74. DOI:10.1016/j.canlet.2021.05.008 |
| [9] |
Lin WF, Lu JY, Cheng BB, et al. Progress in research on the effects of traditional Chinese medicine on the tumor microenvironment[J]. J Integr Med, 2017, 15(4): 282-287. DOI:10.1016/S2095-4964(17)60345-5 |
| [10] |
苗万, 刘亚平. 六神丸的药理研究[J]. 中国药物与临床, 2011, 11(8): 935. [Miao W, Liu YP. Pharmacological Research on Liushen Pills[J]. Zhongguo Yao Wu Yu Lin Chuang, 2011, 11(8): 935.] |
| [11] |
邱艳艳. 基于SRC-3途径探讨六神丸抑制结肠癌转移的机制[D]. 上海: 上海中医药大学, 2019. [Qiu YY. To explore the mechanism of Liushen pill inhibiting colorectal cancer metastasis by SRC-3 pathway[D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2019.]
|
| [12] |
Li XJ, Jia MM, Li YS, et al. Involvement of substance p/neurokinin-1 receptor in the analgesic and anticancer activities of minimally toxic fraction from the traditional Chinese medicine Liu-Shen-Wan in vitro[J]. Biol Pharm Bull, 2014, 37(3): 431-438. DOI:10.1248/bpb.b13-00794 |
| [13] |
梁世霞, 刘正芸, 余丽梅, 等. 六神丸和砷化合物对人肝癌Hep3B细胞增殖的影响[J]. 遵义医学院学报, 2016, 39(6): 558-562. [Liang SX, Liu ZY, Yu LM, et al. Effects of Liu-Shen-Wan and arsenic compounds on hepatoma Hep3B cells[J]. Zunyi Yi Xue Yuan Xue Bao, 2016, 39(6): 558-562.] |
| [14] |
黄立中, 张慧, 田莎, 等. 六神丸对食管癌移植瘤细胞凋亡指数及B淋巴细胞瘤-2基因的影响[J]. 吉林中医药, 2015, 35(1): 53-56. [Huang LZ, Zhang H, Tian S, et al. Effect of Liushen Pill on the apoptosis index and expression of Bcl-2 of esophagus carcinoma xenografts[J]. Jilin Zhong Yi Yao, 2015, 35(1): 53-56.] |
| [15] |
詹行闻. 人参半夏汤联合六神丸治疗Ⅲ-Ⅳ期食管癌的临床疗效观察[D]. 长沙: 湖南中医药大学, 2018. [Zhan XW. Clinical observation of renshen banxia decoction combined with liushen pills in the treatment of stage Ⅲ-Ⅳ esophageal cancer[D]. Changsha: Hunan Zhong Yi Yao Da Xue, 2018.]
|
| [16] |
Li J, Li L, Li Y, et al. Tumor-associated macrophage infiltration and prognosis in colorectal cancer: systematic review and meta-analysis[J]. Int J Colorectal Dis, 2020, 35(7): 1203-1210. |
 2022, Vol. 49
2022, Vol. 49