文章信息
- 营养干预对结直肠癌术后辅助化疗患者营养状况及生活质量的影响
- Effects of Nutritional Intervention on Nutritional Status and Quality of Life of Patients with Colorectal Cancer Treated with Postoperative Adjuvant Chemotherapy
- 肿瘤防治研究, 2022, 49(12): 1286-1290
- Cancer Research on Prevention and Treatment, 2022, 49(12): 1286-1290
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0417
- 收稿日期: 2022-04-21
- 修回日期: 2022-08-17
2. 450000 郑州,郑州市第三人民医院(郑州市肿瘤医院)消化肿瘤科
2. Department of Digestive Oncology, The Third People's Hospital of Zhengzhou (Cancer Hospital of Zhengzhou), Zhengzhou 450000, China
结直肠癌作为常见的恶性肿瘤之一,其发病率在过去的三十年中呈现出稳步增长的趋势,从1990年的14.25/10万到2016年的25.27/10万,年平均变化百分比(average annual percentage change, AAPC)高达2.34,其中15~49岁的年轻人群最为明显(AAPC=2.76),严重威胁居民健康,已成为我国重要的公共卫生问题[1]。单纯外科手术容易复发,所以同步放化疗是临床上经常采用的治疗模式[2]。大部分结直肠癌患者本来就存在营养不良的情况[3-4],手术还会进一步影响其消化和吸收功能,从而减少饮食摄入量,同时术后应激反应也会引起患者蛋白质分解增加和糖代谢紊乱,最终造成免疫力下降、加剧营养不良。再加上放化疗所带来的恶心、呕吐、食欲降低等不良反应,结直肠癌患者术后的生活质量一般较低、营养状况也较差。近年来,国内外多项研究显示,营养干预在消化系统恶性肿瘤的治疗和预后中均有积极作用,不仅可以有效补充患者所需营养,提高机体免疫系统抵抗力,还能加快术后恢复的速度,减少并发症的发生,改善患者预后,促进患者早日康复[5-10]。多数研究着重结直肠癌患者营养状况的评价,缺乏对其生命质量评价的关注。基于此,本研究以结直肠癌术后辅助化疗患者为研究对象,探讨营养干预在改善其营养状况和生活质量方面的作用。
1 资料与方法 1.1 一般资料本研究选取郑州市第三人民医院2020年6月—2021年6月收治的56例结直肠癌术后辅助化疗患者作为研究对象,根据其营养干预情况分为对照组(36例)和营养干预组(20例),比较两组患者手术4周后营养状况和生命质量的差异。纳入标准:(1)年龄50~78周岁;(2)TNM分期为Ⅲ期的结直肠癌术后辅助化疗第一周期患者;(3)采用XELOX方案进行化疗;(4)KPS评分 > 70分;(5)能正常进食,且参与研究前未接受其他营养补充;(6)配合随访且自愿参与此次研究。排除标准:(1)有内分泌疾病、营养代谢性疾病或其他消化系统类疾病病史;(2)存在心理障碍或精神障碍者;(3)重要脏器功能不全或合并感染、发热患者;(4)正在参与其他临床课题研究者。
1.2 干预方法对照组:入院后由责任护士对患者进行营养风险筛查、饮食指导和宣教;为患者提供《化疗营养健康指导手册》,包括最佳营养饮食搭配和相关营养摄入要求等内容;在饮食方面对其家属多加叮嘱,必要时由管床医生进行处理。
营养干预组:入院后,由营养师根据“五阶梯”营养治疗方案对患者开展营养干预,内容如下:(1)成立多学科营养小组,主要由临床医师、营养师、营养专科护士、精神科医师、药剂师等人员组成。(2)具体分工:入院后由营养专科护士完成营养风险筛查,由营养师及营养专科护士共同完成营养评估;医师及营养师根据患者身高、体重、现病情计算患者的营养需要量,并采用“五阶梯”营养治疗方案对患者进行营养干预,当下一阶梯不能满足患者需要量60%以上时,选择上一阶梯进行营养支持治疗,以更好地满足机体需要量。(3)患者每日能量供给量为25~30 kcal/kg,蛋白质供给量约为58~135 g,饮食以高优质蛋白、低糖、低脂、易消化治疗餐为主,少量多餐,如患者能量或蛋白质摄入不足,可增加口服营养补充或肠外营养;营养小组每日查房1~2次,观察记录患者进食、口服营养补充及肠外营养等情况,与患者、家属、管床医生和护士进行有效沟通,增强营养观念,促进患者合理进餐增加营养,并根据实际情况及时调整营养方案,最大程度满足患者的营养需求。(4)营养师根据患者的身高、体重、饮食情况及偏好等制订个体化营养干预方案。对于食欲一般、进食量少需要口服营养补充的患者,给予合适的肠内营养制剂;如口服营养补充与饮食仍无法满足患者机体需要,则增加肠外营养。(5)专科护士协助精神科医师定期对患者进行心理疏导。(6)患者出院后,营养师及专科护士通过微信或电话对其进行随访,根据反馈情况及时调整营养干预措施并指导患者实施。
1.3 观察指标 1.3.1 体格检查根据患者体重和身高计算体质量指数(body mass index, BMI),BMI=体重/身高2(kg/m2)。
1.3.2 营养筛查采用NRS-2002(Nutrition Risk Screening 2002)进行营养风险筛查,患者NRS-2002评分3分及以上即为存在营养风险。
1.3.3 血液指标检查包括血红蛋白、血清前白蛋白和白蛋白,采用溴甲酚氯、免疫比浊法测定。
1.3.4 营养状况评分采用患者提供的主观整体营养状况评分量表(patient-generated subjective global nutrition assessment, PG-SGA)量表[11]进行营养评估,该量表由患者自我评估及医务人员评估两部分组成,包括体重变化、摄食情况、影响饮食因素、活动及身体功能、疾病与营养需求、代谢应激状态、体格检查(肌肉消耗情况)7部分,其中前4个部分由患者自评,后3个部分由医务人员评估。总分相加,分值越高,代表被评估者营养状况越差。
1.3.5 生活质量评分采用SF-36量表(36-Item Short Form Health Survey)评价患者生活质量,涉及8项指标,分别为精神健康、情感职能、社会功能、一般健康状况、生理机能、躯体疼痛、生理智能和精力。
1.4 统计学方法采用SPSS25.0进行统计学分析。对于定量资料,若服从正态分布采用均数±标准差进行描述,若不服从正态分布采用中位数和上、下四分位数进行描述,组间比较采用t检验或Mann-Whitney检验;对于定性资料,采用频数和百分比(%)进行描述,组间比较采用χ2检验。检验水准α为0.05。
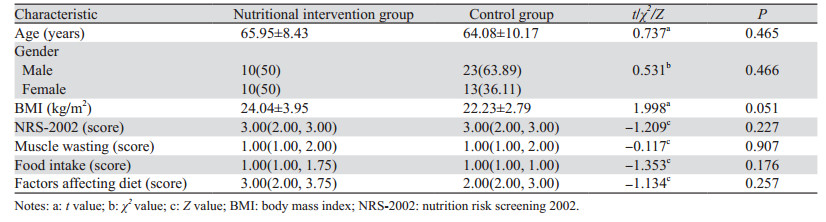
2 结果 2.1 基本情况入院时营养干预组和对照组患者在年龄、性别、BMI、NRS-2002评分、肌肉消耗、进食量、影响饮食因素(如胃肠道并发症、经济、疼痛及其他客观因素)方面差异均无统计学意义(P > 0.05),见表 1。
|
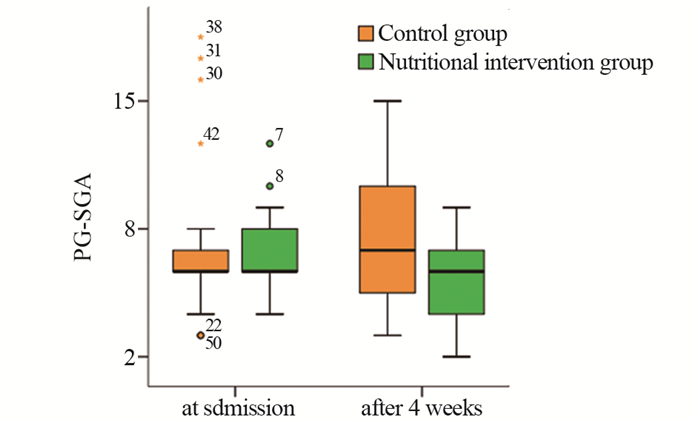
营养干预组和对照组患者在入院时的PG-SGA评分分别为(6.70±2.03)和(6.97±3.84)分,差异无统计学意义(t=-0.347, P=0.730)。手术4周后,营养干预组和对照组患者的PG-SGA评分分别为(5.45±1.79)和(7.50±3.10)分,差异有统计学意义(t=-2.708, P=0.009),见图 1。
|
| PG-SGA: Patient-generated Subjective Global Nutrition Assessment. 图 1 营养干预组和对照组入院时和4周后PG-SGA评分的比较 Figure 1 Comparison of PG-SGA scores between nutritional intervention group and control group at admission and four weeks after the surgery |
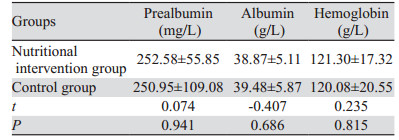
手术4周后,营养干预组和对照组的血清前白蛋白、白蛋白和血红蛋白差异均无统计学意义(P > 0.05),见表 2。
|
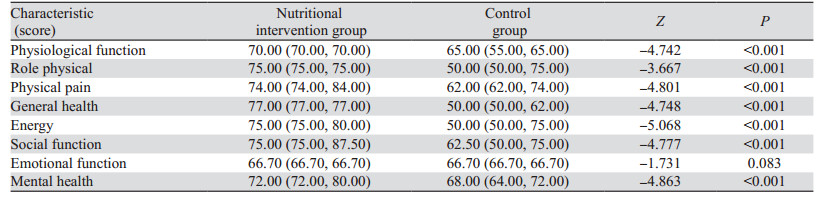
手术4周后,营养干预组和对照组患者在生活质量评分方面,除了情感职能这一指标差异无统计学意义(P=0.083),其他指标的差异均有统计学意义(P < 0.05),见表 3。
|
目前已知的结直肠癌危险因素有很多,饮食结构、生活方式和生活环境等都会对其发病概率和程度造成影响[12],其中高热量、高脂肪、低膳食纤维的不健康饮食方式占据主要地位[13],所以营养不良在结直肠癌患者中发生率很高。再叠加肿瘤抑制因子的作用、手术治疗的应激反应和化疗带来的不良反应,结直肠癌患者普遍存在免疫力低下、生活质量较差和营养状况持续恶化的情况。本研究从营养状况评分、血液检查和生活质量评分三个层面综合评估营养干预对于改善结直肠癌术后辅助化疗患者营养状况和生活质量的影响。
本研究结果显示,营养干预组和对照组患者入院时的PG-SGA评分差异无统计学意义(t=-0.347, P=0.730)。手术4周后,两组患者的PG-SGA评分差异有统计学意义(t=-2.708, P=0.009)。PG-SGA评分主要通过收集信息或主观资料,对患者各项身体机能和营养状况开展全面评估,已经在肿瘤患者特异性营养状况评估方面得到广泛应用[14-15]。总分分值越高,代表营养状况越差。营养干预组患者的PG-SGA评分在经过4周的营养干预后,评分明显降低,且与对照组患者评分比较差异有统计学意义,表明营养状况得到有效改善,与以往研究结果基本一致[16-17]。
张欢等[18]将60例接受放疗的肿瘤患者进行随机分组并实施营养干预后发现,实验组和对照组在出院时白细胞、红细胞和血清前白蛋白比较,差异无统计学意义(P > 0.05),但血清白蛋白比较差异有统计学意义(P < 0.05)。邱丹等研究[19]则指出,采用五阶梯营养治疗的观察组与对照组的结直肠癌术后辅助化疗患者在化疗前及第1、2、3个化疗周期后的血清总蛋白、白蛋白水平比较差异无统计学意义(P > 0.05),但从第4个化疗周期开始直至化疗末,观察组的血清总蛋白、白蛋白水平均高于对照组(P < 0.05)。造成结果差异的原因一方面在于研究对象选择的不同,例如患者年龄、基础营养状况、肿瘤分期等因素;另一方面可能在于观测时间的不同,例如开始时间点、时间长短及是否连续等。考虑到营养状况的变化反映到血液指标需要一定的时间,本研究将继续进行随访,持续监测患者指标的变化,以便更全面地评价营养干预的效果。
有研究证实,患者的营养状况和其生活质量之间存在正相关关系,即营养状况良好者的社会功能、决策功能和躯体功能普遍更强[20]。而基于营养风险评估的个体化科学干预有助于降低营养风险发生可能性[21],本研究所采用的多学科模式营养干预,综合医生、护士、营养师、精神科医师和药剂师等人员对患者的个性化分析和评估,并在此基础上适时给予心理疏导,提高患者接受营养指导的配合度,从而提高生活质量。Lin等[22]对晚期结直肠癌患者开展了以专科护士和营养师为主导的个体化营养干预,在经过电话随访、胃肠道反应管理和饮食评估等营养相关服务后发现,患者营养状况明显改善,生活质量也有所提高,与本研究结果基本一致。
总之,由临床医师、营养师、营养专科护士、精神科医师、药剂师等人员组成的多学科模式营养干预小组共同合作,依据患者的实际情况设计营养干预方案,从而在短期内有效提高患者营养状况和生活质量,值得借鉴和实施。但因本研究患者均来自同一个研究中心,且样本量较小,缺乏代表性,后期可通过增加样本量的方式更加准确地评价营养干预的效果。此外,本研究回顾性收集患者信息,并未进行随机分组,虽然营养干预组和对照组患者的基本情况无统计学差异,但仍会存在选择偏倚。
作者贡献:
倪婷:分析数据和论文撰写
高红玉、赵丹:收集和整理数据
王海存:研究选题、设计和论文指导
| [1] |
Zhang L, Cao F, Zhang G, et al. Trends in and Predictions of Colorectal Cancer Incidence and Mortality in China From 1990 to 2025[J]. Front Oncol, 2019, 9: 98. DOI:10.3389/fonc.2019.00098 |
| [2] |
刘寒雪, 陆箴琦, 谢茗珠. 直肠癌患者新辅助放化疗期间营养状况调查分析[J]. 护理学杂志, 2018, 33(11): 5-8. [Liu HX, Lu ZQ, Xie MZ. Nutritional status assessment in rectal cancer patients undergoing neoadjuvant chemoradiotherapy[J]. Hu Li Xue Za Zhi, 2018, 33(11): 5-8. DOI:10.3870/j.issn.1001-4152.2018.11.005] |
| [3] |
Thanikachalam K, Khan G. Colorectal Cancer and Nutrition[J]. Nutrients, 2019, 11(1): 164. DOI:10.3390/nu11010164 |
| [4] |
Ziętarska M, Krawczyk-Lipiec J, Kraj L, et al. Nutritional status assessment in colorectal cancer patients qualified to systemic treatment[J]. Contemp Oncol (Pozn), 2017, 21(2): 157-161. |
| [5] |
Ordovas JM, Ferguson LR, Tai ES, et al. Personalised nutrition and health[J]. BMJ, 2018, 361: bmj.k2173. |
| [6] |
Wallace TC, Bultman S, D'Adamo C, et al. Personalized Nutrition in Disrupting Cancer-Proceedings From the 2017 American College of Nutrition Annual Meeting[J]. J Am Coll Nutr, 2019, 38(1): 1-14. DOI:10.1080/07315724.2018.1500499 |
| [7] |
Aruoma OI, Hausman-Cohen S, Pizano J, et al. Personalized Nutrition: Translating the Science of NutriGenomics Into Practice: Proceedings From the 2018 American College of Nutrition Meeting[J]. J Am Coll Nutr, 2019, 38(4): 287-301. DOI:10.1080/07315724.2019.1582980 |
| [8] |
de Toro-Martín J, Arsenault BJ, Després JP, et al. Precision Nutrition: A Review of Personalized Nutritional Approaches for the Prevention and Management of Metabolic Syndrome[J]. Nutrients, 2017, 9(8): 913. DOI:10.3390/nu9080913 |
| [9] |
Nacis JS, Galang MR, Labrador JPH, et al. "Right diet for the right person": a focus group study of nutritionist-dietitians' perspectives on nutritional genomics and gene-based nutrition advice[J]. J Community Genet, 2022, 13(1): 49-57. DOI:10.1007/s12687-021-00560-1 |
| [10] |
甘孝红. 患者参与直肠癌术后饮食护理对其营养状况的影响[J]. 中华临床营养杂志, 2018, 26(5): 288-292. [Gan XH. Effect of postoperative diet nursing with patient involved on nutritional status of the patients with rectal cancer[J]. Zhonghua Lin Chuang Ying Yang Za Zhi, 2018, 26(5): 288-292. DOI:10.3760/cma.j.issn.1674-635X.2018.05.006] |
| [11] |
Balstad TR, Bye A, Jenssen CR, et al. Patient interpretation of the Patient-Generated Subjective Global Assessment (PG-SGA) Short Form[J]. Patient Prefer Adherence, 2019, 13: 1391-1400. DOI:10.2147/PPA.S204188 |
| [12] |
Shivappa N, Godos J, Hébert JR, et al. Dietary Inflammatory Index and Colorectal Cancer Risk-A Meta-Analysis[J]. Nutrients, 2017, 9(9): 1043. DOI:10.3390/nu9091043 |
| [13] |
Wang J, Liu L, Cai Y, et al. Trends in the age-related incidence of colon and rectal cancers inChina, 2005-2015[J]. Dig Liver Dis, 2021, 53(7): 908-914. DOI:10.1016/j.dld.2021.01.009 |
| [14] |
Abbott J, Teleni L, McKavanagh D, et al. Patient-Generated Subjective Global Assessment Short Form (PG-SGA SF) is a valid screening tool in chemotherapy outpatients[J]. Support Care Cancer, 2016, 24(9): 3883-3887. DOI:10.1007/s00520-016-3196-0 |
| [15] |
文红梅, 舒同, 张海英, 等. PG-SGA评分对结肠癌患者根治术后并发症的预测价值[J]. 中华普外科手术学杂志(电子版), 2019, 13(4): 376-378. [Wen HM, Shu T, Zhang HY, et al. Predictive value of PG-SGA score for postoperative complications in patients with colon cancer[J]. Zhonghua Pu Wai Ke Shou Shu Xue Za Zhi(Dian Zi Ban), 2019, 13(4): 376-378.] |
| [16] |
韦燕萍, 高铭云, 梁桂花, 等. 个体化营养干预对老年消化道恶性肿瘤患者围术期的影响[J]. 中国老年学杂志, 2017, 37(9): 2193-2195. [Wei YP, Gao MY, Liang GH, et al. Effect of individualized nutritional intervention on perioperative period of elderly patients with gastrointestinal malignant tumors[J]. Zhongguo Lao Nian Xue Za Zhi, 2017, 37(9): 2193-2195.] |
| [17] |
黄秀艳, 林金香, 杨晋杰. MDT营养干预模式改善结直肠肿瘤化疗患者营养状况的研究[J]. 中国保健营养, 2016, 26(14): 328-329. [Huang XY, Lin JX, Yang JJ. MDT nutritional intervention model to improve the nutritional status of colorectal cancer patients undergoing chemotherapy[J]. Zhongguo Bao Jian Ying Yang, 2016, 26(14): 328-329.] |
| [18] |
张欢, 徐征, 那立欣. 营养干预对肿瘤患者放疗承受能力的影响[J]. 中国现代医学杂志, 2017, 27(23): 75-78. [Zhang H, Xu Z, Na LX. Nutritional intervention affects radiation tolerance of cancer patients[J]. Zhongguo Xian Dai Yi Xue Za Zhi, 2017, 27(23): 75-78.] |
| [19] |
邱丹, 吕杨波, 陈震宏. 五阶梯营养治疗对结直肠癌患者术后辅助化疗所致骨髓抑制的作用[J]. 浙江医学, 2021, 43(5): 497-501. [Qiu D, Lyu YB, Chen ZH. Five-step nutrition therapy alleviates bone marrow suppression caused by postoperative adjuvant chemotherapy in patients with colorectal cancer[J]. Zhejiang Yi Xue, 2021, 43(5): 497-501.] |
| [20] |
Velasco Jr RN, Catedral LIG, Chua Jr AV, et al. The Impact of Malnutrition on the Quality of Life of Colorectal Cancer Patients in a Tertiary Hospital[J]. Nutr Cancer, 2022, 74(8): 2937-2945. |
| [21] |
赵利平, 朱晓峰, 韩光明, 等. 对晚期结直肠癌化疗患者个体化目标营养的临床研究[J]. 中外医学研究, 2020, 18(20): 179-181. [Zhao LP, Zhu XF, Han GM, et al. Clinical Study of Individualized Target Nutrition in Patients with Advanced Colorectal Cancer Undergoing Chemotherapy[J]. Zhong Wai Yi Xue Yan Jiu, 2020, 18(20): 179-181.] |
| [22] |
Lin JX, Fang HY, Chen ZH, et al. Single-center experience with nutrition intervention on patients with advanced colorectal cancer undergoing chemotherapy[J]. J Clin Oncol, 2016, 34: e21615-e21615. |
 2022, Vol. 49
2022, Vol. 49


