文章信息
- 整合素β样1在肝细胞癌中的表达及作用
- Expression and Role of Integrin β-like 1 in Hepatocellular Carcinoma
- 肿瘤防治研究, 2022, 49(12): 1232-1239
- Cancer Research on Prevention and Treatment, 2022, 49(12): 1232-1239
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0260
- 收稿日期: 2022-03-18
- 修回日期: 2022-09-18
原发性肝癌是全球最常见的恶性肿瘤之一。2020年全球癌症统计数据显示,肝癌发病率位居第6位,死亡率居第3位,全球每年新发肝癌病例905 677例,死亡病例达到830 180例。在原发性肝癌中肝细胞癌(hepatocellular carcinoma, HCC)占比75%~85%[1]。我国肝癌死亡病例达391 152例,与2018年统计数据相比,死亡率由第4位升至第2位[2]。尽管近年来针对肝细胞癌的研究取得了较大的进展,但肝细胞癌的发病率和死亡率并没有明显的下降,其发生发展、侵袭转移以及复发的机制仍然备受关注,寻找能够有效预测患者预后的指标及新治疗靶点仍是现阶段肿瘤研究重点。
整合素β样1(integrin subunit β like 1, ITGBL1)是与整合素β相关的细胞基质蛋白,首先在成骨细胞的cDNA文库中发现,其编码蛋白包括一个典型的信号肽和一个由10个EGF样串连重复序列组成的共471个氨基酸的亲水性功能区,与整合素β亚基具有高度同源性[3]。ITGBL1在多种肿瘤中表达升高,并与患者不良预后相关,如胃癌[4]、前列腺癌[5]、结肠癌[6]及卵巢癌[7]等,但是ITGBL1在HCC中的研究较少。本研究通过RT-qPCR检测人HCC组织中ITGBL1的表达情况,探讨其蛋白表达水平与患者临床病理学参数及预后的关系,以及ITGBL1基因在HCC细胞株中的作用,为寻找新的肝癌预后标志物和治疗靶点提供依据。
1 资料与方法 1.1 资料选取2018年1月—2018年6月在福建省肿瘤医院行根治切除,且术前未行治疗的新鲜HCC样本12例,离体后30 min内置于-70℃冰箱保存,每例包含癌和癌旁肝组织(距肿瘤边缘2 cm以上),用于RT-qPCR检测。回顾性收集2011年1月—2018年6月在福建省肿瘤医院行根治切除且术前未行治疗的HCC患者术后标本共160例,用于免疫组织化学检测。纳入标准:(1)术后病理诊断确诊为肝细胞癌;(2)手术前未进行其他的抗肿瘤治疗方式如介入治疗、化疗或放疗等。排除标准:(1)术后病理诊断为非肝细胞癌的其他类型肿瘤;(2)术前接受过其他抗肿瘤治疗方式。本研究通过福建省肿瘤医院伦理委员会的审查。
1.2 随访电话随访每3个月1次,随访截止时间为2020年11月1日。总生存时间(OS)定义为从手术当日至患者死亡或末次随访日期的间隔时间。无病生存时间(DFS)定义为患者手术时间至第一次复发的时间间隔。160例HCC患者中DFS随访资料完整者有111例,随访率为69.4%,复发病例66例,复发率为59.5%。随访满5年且具有完整OS资料的患者有53例,其中38例死亡,死亡率为71.7%,失访原因为未进行门诊复诊或电话无法联系。
1.3 手术后治疗情况入组病例28例未定期复查,5例术后未进行治疗,单纯经动脉化疗栓塞术(transarterial chemoembolization, TACE)治疗79例,放射治疗2例,化疗1例,靶向治疗1例,射频消融治疗1例,单纯细胞因子诱导的杀伤细胞(CIK)治疗9例,TACE联合CIK治疗14例,TACE联合靶向治疗9例,TACE联合靶向及免疫治疗3例,TACE联合消融治疗5例,中药治疗2例,复发后二次手术1例。
1.4 实验材料人肝癌细胞株HUH7、LM3、MHCC97H(购自中科院上海细胞库),293T细胞(购自上海吉凯公司),TRIZOL抽提试剂(上海赛默飞公司),qRT-PCR试剂盒(北京NEB公司),ITGBL1、GAPDH正反义链引物(由上海生物工程有限公司设计合成),RIPA裂解液(上海碧云天公司),ITGBL1抗体(美国Sigma公司),GAPDH抗体(美国Abcam公司),即用型免疫组织化学EliVision super试剂盒(鼠/兔)、DAB显色试剂盒(福州迈新生物技术开发有限公司),Transwell小室(美国Millipore公司),Matrigel基质胶(美国Corning公司),CCK8试剂(美国Biosharp公司),携带表达绿色荧光蛋白(green fluorescent protein, GFP)的ITGBL1的重组慢病毒过表达载体和干扰载体(由上海吉凯公司筛选、构建并包装),胎牛血清(中国Gibco公司)。
1.5 总RNA提取及实时荧光定量PCR实验应用TRIzol试剂,分别提取12例新鲜HCC样本及配对癌旁肝组织的总RNA,利用一步法RT-qPCR试剂盒进行组织样本中ITGBL1基因表达量检测,ITGBL1引物:上游引物序列5’-GGTTGGCATGGAGATAAATGTGA-3’,下游引物序列5’-CGGATCAACATCGTGACAGGTA-3’;内参GAPDH引物:上游引物序列5’-CAAGGTCATCCATGACAACTTTG-3’,下游引物序列5’-GTCCACCACCCTGTTGCTGTAG-3’。采用2-ΔΔCt法分析数据:ΔCt=目的基因Ct值-内参基因Ct值;-ΔΔCt=对照组ΔCt平均值-各样品ΔCt值;2-ΔΔCt反映各样品相对于对照组样品目的基因的相对表达水平。
1.6 免疫组织化学染色采用EnVision plus两步法对HCC石蜡组织样本中ITGBL1蛋白进行免疫组织化学分析,石蜡切片均常规烤片、脱蜡、水化后,用柠檬酸热修复法进行抗原修复。一抗选择ITGBL1(1:100,美国Sigma公司),二抗选择即用型辣根过氧化物酶标羊抗鼠/兔抗体(福州迈新生物技术开发有限公司)。采用PBS代替一抗作为阴性对照。根据染色强度和阳性细胞比例综合评分,ITGBL1蛋白阳性定位在细胞质上。染色强度评分定义为:0分:无色;1分:浅黄色;2分:棕黄色;3分:棕褐色。阳性细胞数比例评分定义:0分:无阳性细胞;1分:阳性细胞比例 < 25%;2分:阳性细胞比例26%~50%;3分:阳性细胞比例51%~75%;4分:阳性细胞比例 > 76%。最终结果由染色强度评分和阳性细胞数评分乘积判定,0~3分为低表达,> 3分为高表达。
1.7 构建ITGBL1过表达及干扰慢病毒载体通过查询PubMed的GeneBank数据库获得人ITGBL1基因信息及序列(NM_004791),合成基因片段并构建至慢病毒载体GV492上,构建ITGBL1过表达慢病毒载体;以ITGBL1基因为模板,根据RNAi干扰序列设计原则,获取多个RNAi靶点序列,选择最佳动力学参数的靶点进入后续实验。设计的RNAi靶点序列分别为:5’-ATGGGAAGTGTTACTGTGGAA-3’、5’-TTGCGGAAGATGTGACTGCAA-3’、5’-ATGGATGGAATGGAAATGCAT-3’,并以GV248为载体,构建ITGBL1慢病毒干扰载体。根据病毒包装手册,使用Lipofectamine 2000为转染试剂,将ITGBL1-GV492质粒、ITGBL1-GV248质粒、对照质粒分别与包装质粒(Helper 1.0和Helper 2.0载体)共同转染至293T细胞,待48 h后收获上清液,以0.45 μm滤器过滤后进行滴度测定,并分装保存在病毒管中,-80℃长期保存。
1.8 重组慢病毒载体感染人肝癌细胞株HUH7和LM3消化后重悬HUH7和LM3细胞接种于6孔板内,待细胞融合度达40%~50%,用ITGBL1过表达慢病毒载体和对照组空载体慢病毒感染HUH7细胞,感染复数(multiplicity of infection, MOI)为10,聚凝胺终浓度为5 μg/ml,两组细胞标记为HUH7/OE和HUH7/Ctrl;ITGBL1-RNAi慢病毒干扰载体和对照组空载体慢病毒感染LM3细胞,感染复数为30,聚凝胺终浓度为5 μg/ml,两组细胞标记为LM3/ShITGBL1和LM3/Ctrl。12 h后更换新鲜完全培养基,72 h后用荧光显微镜观察GFP表达情况,并计算感染效率。
1.9 细胞总蛋白提取及Western blot检测感染后第3天,收集细胞于离心管中,加入细胞裂解液冰上裂解10 min,用BCA法测定蛋白浓度,加入制备好的SDS-PAGE上样缓冲液,经电泳、转膜后将PVDF膜置于脱脂牛奶中室温封闭2 h,孵育稀释的一抗ITGBL1(1:1 000),4℃过夜,TBST洗膜后,室温孵育辣根过氧化物酶(HRP)标记的二抗2 h,经增强化学发光(ECL)荧光底物反应后,胶片曝光显影。
1.10 CCK8实验胰酶消化细胞后,加入培养基终止,1 200 rpm离心5 min,弃上清液,加入培养基混匀后计数;接细胞到96孔板中,5 000个/孔(100 μl培养基);细胞贴壁后,弃去旧培养基,加入100 μl CCK8工作液(10 μl CCK8母液+90 μl培养基),60 min后在酶标仪上检测吸光值(450 nm波长),连续4天检测细胞活力并根据结果作统计学分析。
1.11 划痕实验用马克笔在6孔板背后划竖线,每孔1条;消化细胞后,调整细胞浓度,孔中加入约1×106个细胞;第二天用枪头垂直于背后的竖线划痕,PBS洗细胞3次,去除划下的细胞,加入无血清培养基;放入37℃、5%CO2培养箱,培养0、48 h后进行拍照。
1.12 Transwell实验将Matrigel基质胶稀释50倍(冰上操作),在每个小室中加入10 μl Matrigel胶,铺匀,放到细胞培养箱中待胶干后方将细胞消化,接种至小室中;每个小室接种合适细胞数量(HUH7接种1×105个,LM3接种1.5×105个),上室中的培养基为无血清培养基,下室培养基为含20%FBS的完全培养基,放入细胞培养箱中培养;48 h进行结晶紫染色:用棉签擦去上室未穿过的细胞后,用4%多聚甲醛固定30 min,再用PBS洗两遍,加入1%结晶紫染色30 min,PBS洗三遍,室温晾干,随机挑选视野拍照(100倍镜)。
1.13 统计学方法所有数据均采用统计学软件SPSS20.0进行分析。采用Mann-Whiteney U检验统计分析癌组织与癌旁组织中ITGBL1 mRNA和蛋白表达差异;卡方检验分析ITGBL1蛋白表达水平与一般临床资料的相关性;Kaplan-Meier单因素分析HCC患者DFS和OS,用Log rank进行显著性检验;并用多因素Cox回归模式评估死亡危险比及95%CI,探讨可能影响患者生存时间的独立预后因素;细胞实验计量资料以(x±s)表示,采用Student's t检验对实验结果进行统计。P < 0.05为差异有统计学意义。
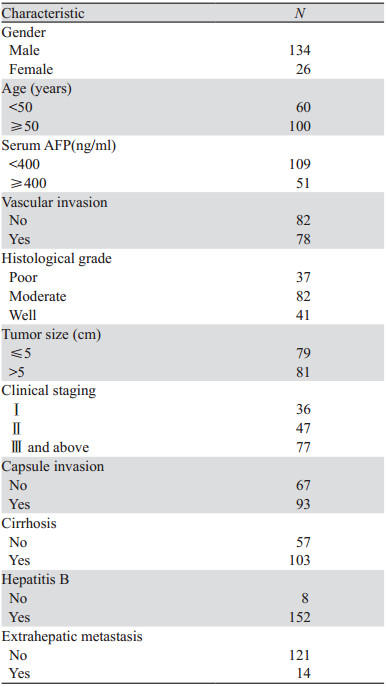
2 结果 2.1 ITGBL1在癌组织和癌旁组织中的表达160例患者的一般临床资料见表 1。与癌旁肝组织相比,癌组织中ITGBL1基因表达高于癌旁肝组织,差异具有统计学意义(Z=-3.233, P=0.001),见图 1A。ITGBL1蛋白表达定位于细胞质中,组织中的小胆管及间质中的纤维细胞也呈阳性表达,可以作为内部阳性对照。结果显示,癌组织ITGBL1蛋白高表达率为55.0%(88/160),而相应的癌旁肝组织高表达率为31.9%(51/160),差异有统计学意义(Z=-3.860, P=0.000),见图 1B。在多个样本中也观察到,ITGBL1在肿瘤包膜侵犯处及癌巢浸润性边缘的表达明显高于肿瘤内部。此外,在脉管周围的癌组织中,ITGBL1的表达也高于周围的癌组织,见图 1C。
|
| A: The mRNA expression of ITGBL1 in HCC tissues and adjacent liver tissues; B: Immunohistochemistry analysis of ITGBL1 expression in HCC tissues and adjacent liver tissues. scale bar=50μm; C: The special expression pattern of ITGBL1: a: expression of ITGBL1 around the vessel; b: expression of ITGBL1 in the interior of the tumor; c: expression of ITGBL1 in the capsule invasion area; d: expression of ITGBL1 in the interior of the tumor; e: expression of ITGBL1 in the invasive edge of the tumor nest; f: a partial enlargement of the box in image e. a-e: ×100, scale bar=100 μm, f: ×200, the scale bar=50 μm. 图 1 ITGBL1在HCC中的表达情况及临床意义 Figure 1 Expression of ITGBL1 in HCC and its clinical significance |
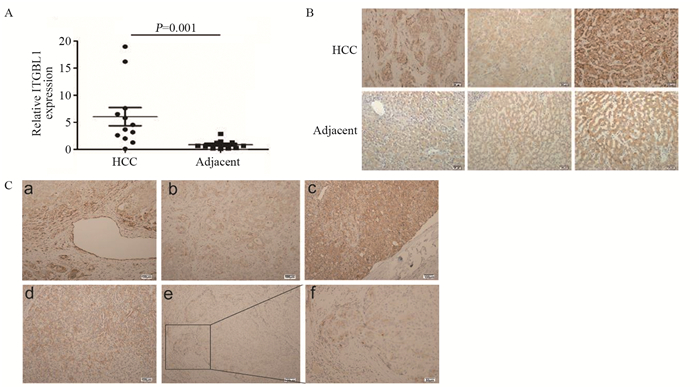
结果显示,ITGBL1蛋白表达与血清AFP水平、包膜侵犯、脉管癌栓、肿瘤分化及临床分期相关(均P < 0.05),而与患者性别、年龄、肿瘤大小、周围肝硬化情况、乙肝病毒感染情况及是否肝外转移无关,见表 2。
|
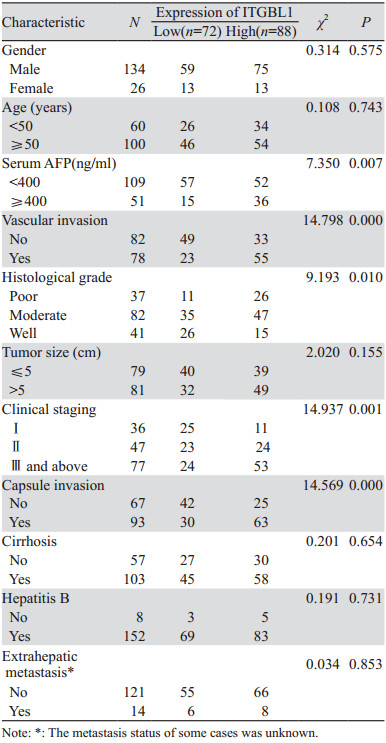
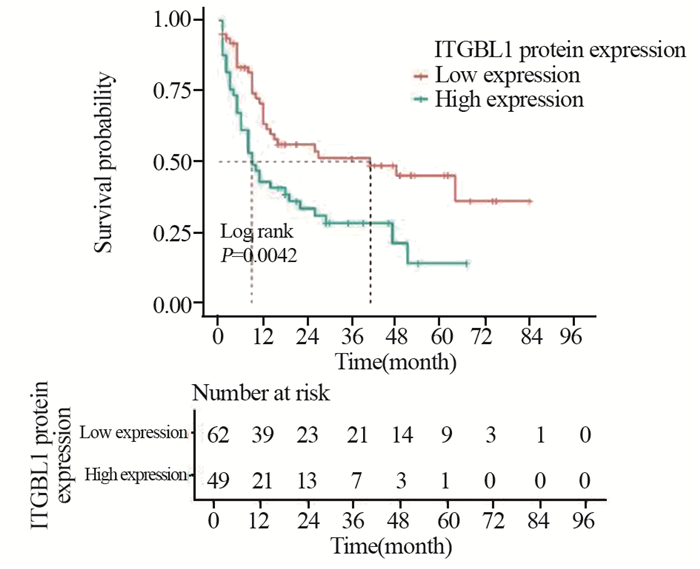
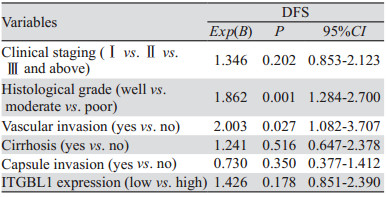
Kaplan-Meier单因素分析结果显示,160例HCC患者中,ITGBL1蛋白高表达患者3、5年无病生存率分别为14.3%、2.0%,低表达患者3、5年无病生存率分别为33.9%、14.5%。Log rank检验显示,ITGBL1高表达组患者DFS低于低表达组,差异有统计学意义(P=0.0042),见表 3、图 2。但多因素Cox回归分析显示,肿瘤分化及脉管癌栓是影响HCC患者术后DFS的独立危险因素,见表 4。两组病例OS差异无统计学意义(P > 0.05)。
|
|
| 图 2 Kaplan-Meier单因素分析ITGBL1表达与HCC患者无病生存时间的关系 Figure 2 Kaplan-Meier analysis to identify the relationship between ITGBL1 expression and disease-free survival of HCC patients |
|
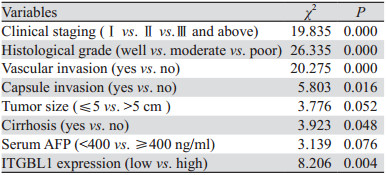
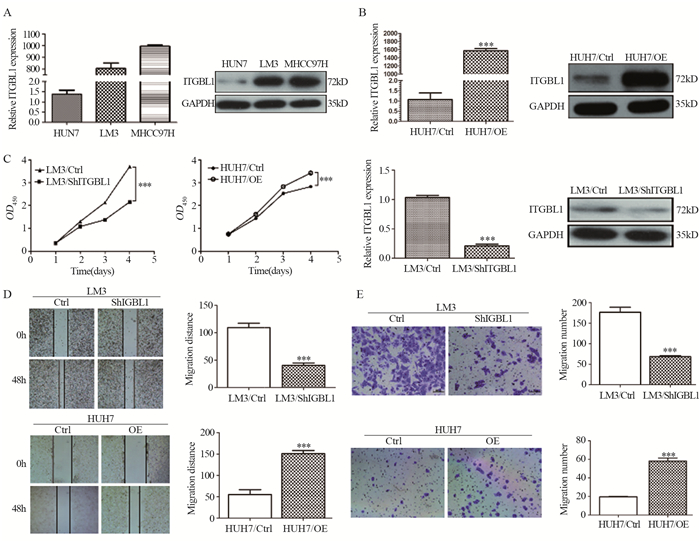
三株HCC细胞株HUH7、LM3和MHCC97H中ITGBL1基因mRNA和蛋白的本底表达情况见图 3A,ITGBL1基因在低转移潜能的HUH7细胞株中表达较低,而在高侵袭潜能的细胞株LM3和MHCC97H中高表达,因此,选择ITGBL1基因mRNA/蛋白表达最低的HUH7构建ITGBL1基因上调表达的细胞株模型,而ITGBL1基因mRNA/蛋白表达较高的细胞株LM3构建ITGBL1基因表达下调的细胞株模型,从两个方面探讨ITGBL1在HCC细胞中的作用。
|
| A: ITGBL1 mRNA and protein expression in three human HCC cell lines; B: expression of ITGBL1 in HUH7 cells infected with overexpression lentiviral vector and LM3 cells infected with ITGBL1-RNAi lentiviral vector; C: effects of ITGBL1 knockdown and overexpression on the proliferation of HCC cells in the CCK8 assay; D: effects of ITGBL1 knockdown and overexpression on the migration of HCC cells in the wound-healing assay; E: effects of ITGBL1 knockdown and overexpression on the invasion of HCC cells in Transwell assays. ***: P < 0.001. 图 3 ITGBL1促进HCC细胞的增殖、迁移和侵袭 Figure 3 ITGBL1 promoted HCC cell growth, migration and invasion in vitro |
过表达慢病毒载体感染HUH7细胞后,实验组HUH7/OE与对照组HUH7/Ctrl比较,ITGBL1基因mRNA及蛋白的表达均明显升高(P=0.001);ITGBL1-RNAi慢病毒载体感染LM3细胞后,实验组LM3/ShITGBL1与对照组LM3/Ctrl比较,ITGBL1基因mRNA及蛋白水平较对照组表达明显下降(P=0.006),见图 3B。CCK8实验结果显示,过表达ITGBL1基因后细胞增殖能力增强(t=16.726, P=0.000),敲降ITGBL1基因后,细胞增殖能力减低(t=-48.702, P=0.000),见图 3C。划痕实验结果发现,过表达ITGBL1后,细胞迁移能力增强(t=7.085, P=0.000),敲降ITGBL1后,细胞迁移能力减弱(t=-9.209, P=0.000),见图 3D。Transwell实验结果显示,过表达ITGBL1后,细胞侵袭能力增强(t=7.990, P=0.001),敲降ITGBL1后,细胞侵袭能力减弱(t=-19.092, P=0.000),见图 3E。
3 讨论术后HCC患者的预后一直是研究关注的焦点。寻找有效的预测患者预后的指标将有助于临床医生制定个体化的随访及后续的治疗方案,减少患者费用,延长患者的生存率。80%~90%的HCC发生在肝纤维化及肝硬化的基础之上,并且肝纤维化与HCC患者术后复发相关[8]。有研究表明,在慢性肝炎患者中,ITGBL1是肝硬化形成的重要风险因子及肝纤维化的主要调节因子[9-10]。此外,ITGBL1在多种肿瘤中表达增高并与肿瘤的不良预后相关。在胃癌中,ITGBL1在癌组织表达高于癌旁组织,且与患者的不良预后、上皮间质转化及免疫细胞浸润相关[4, 11];在结肠癌中,ITGBL1在癌组织中高表达,且高表达患者的生存时间较短[12]。本实验对新鲜HCC样本进行RT-qPCR检测,对石蜡样本进行免疫组织化学检测,结果显示癌组织中ITGBL1基因表达高于癌旁组织,并且ITGBL1蛋白表达与多种不良预后因素如肿瘤包膜侵犯、脉管癌栓、肿瘤分化及分期等相关,提示该基因可能与HCC的侵袭及进展密切相关。Kaplan-Meier单因素分析结果显示ITGBL1高表达组患者DFS较短,但多因素COX分析未能显示ITGBL1基因表达是影响HCC患者DFS的独立预后因素,且两组患者OS无明显差异,这可能与具有完整随访资料的术后患者较少有关,后续将扩大病例量,并对所有病例的随访资料完善后进行进一步的分析。此外,本组病例患者术后治疗方式多样,根据《原发性肝癌诊疗指南(2022年版)》,术后TACE治疗具有减少复发、延长生存的效果,免疫治疗、靶向药物等治疗策略也在积极的探索中。一旦发现肿瘤复发,根据复发肿瘤的特征,可以选择再次手术切除、消融治疗、介入治疗、放射治疗或系统抗肿瘤治疗等,延长患者生存[13]。术后治疗方式的选择会对患者的预后产生影响,试验的理想情况是患者的治疗数据尽量一致,但在真实世界中很难做到。在本组病例中,即便是单纯TACE治疗,患者治疗的次数也不尽相同,以现有的病例数难以根据治疗情况进行分层分析。
ITGBL1与多种肿瘤的侵袭转移相关。既往研究表明,ITGBL1可以通过Wnt信号通路促进结肠癌细胞的侵袭与转移[14];通过Akt信号通路促进胃癌细胞的增殖和侵袭[15];通过NF-κB信号通路促进前列腺癌细胞的上皮间质转化、侵袭及转移[16]。本实验通过检测三株常用的HCC细胞株内(包含1株低转移潜能的HUH7细胞株,及2株高转移潜能的细胞株MHCC97H和LM3)ITGBL1的表达发现,ITGBL1在HUH7细胞中低表达,在MHCC97H和LM3中高表达,提示该基因可能与肿瘤的侵袭相关;细胞实验结果也进一步显示,ITGBL1可以促进HCC细胞的侵袭和转移:过表达ITGBL1基因后,HUH7细胞的迁移和侵袭能力增强,而下调表达ITGBL1后LM3细胞的迁移和侵袭能力降低,与Huang等[17]在其他HCC细胞株中的研究结果一致。肿瘤细胞的迁移能力是造成肿瘤转移的重要因素[18],这也在一定程度上解释了本组高表达ITGBL1患者具有较短的DFS。此外,本实验结果还显示ITGBL1可以促进HCC细胞的增殖能力,但具体机制还有待进一步探讨。
ITGBL1为分泌性蛋白,Ji等发现,在结肠癌模型中,肿瘤细胞可通过分泌富含ITGBL1的胞外囊泡进入循环系统,促进远隔脏器内成纤维细胞的活化,而活化的成纤维细胞可通过分泌促炎因子及纤维相关因子(如TGF-β、SMA)促进转移部位肿瘤细胞的生长[19],Li等也发现ITGBL1可以通过激活TGF-β信号通路促进乳腺癌骨转移[20]。在本实验的部分病例中可见ITGBL1蛋白在包膜侵犯处、脉管周围癌组织及癌巢浸润性边缘都具有较强的表达,也提示该基因在促进肿瘤侵袭转移中起着重要作用。此外,ITGBL1在脉管周围表达增高的模式,提示外周血中ITGBL1的检测可能具有一定的临床意义。Ye等的研究结果显示,血清ITGBL1联合AFP检测可以提高HBV相关早期HCC的检出率[21],本实验结果也显示,HCC癌组织中ITGBL1的表达与血清AFP水平具有一定的相关性,但ITGBL1能否与AFP一样作为评估HCC患者预后的血清生物学标志物还有待于进一步的探讨。Cheli等发现,在恶性黑色素瘤中ITGBL1可以通过抑制NK细胞的细胞毒性,使黑色素瘤细胞逃脱免疫监视,但具体机制及特异性靶向该基因在改善免疫系统中的作用仍在进一步研究中[22]。
综上所述,ITGBL1基因在HCC癌组织中表达增高,并可以促进HCC细胞的增殖、迁移和侵袭,与肿瘤的进展密切相关,是HCC患者预后判断的潜在生物学标志物,并为开发新的治疗方法、治疗药物提供基础和依据,但ITGBL1在HCC中具体作用的分子机制仍不明确,尚需要在细胞株中进行深入探索。
作者贡献:
林丽燕:实验设计与操作、文章撰写
卢建平、何时:免疫组织化学结果判读与临床资料收集
朱伟峰:病理切片的制备
彭凤英:免疫组织化学染色
陈刚:实验设计与文章修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J (Engl), 2021, 134(7): 783-791. DOI:10.1097/CM9.0000000000001474 |
| [3] |
Berg RW, Leung E, Gough S, et al. Cloning and Characterization of a Novel β Integrin-Related cDNA Coding for the Protein TIED ("Ten β Integrin EGF-like Repeat Domains") That Maps to Chromosome Band 13q33: A Divergent Stand-Alone Integrin Stalk Structure[J]. Genomics, 1999, 56(2): 169-178. DOI:10.1006/geno.1998.5707 |
| [4] |
Li R, Zhuang C, Jiang S, et al. ITGBL1 Predicts a Poor Prognosis and Correlates EMT Phenotype in Gastric Cancer[J]. J Cancer, 2017, 8(18): 3764-3773. DOI:10.7150/jca.20900 |
| [5] |
Shan M, Xia Q, Yan D, et al. Molecular analyses of prostate tumors for diagnosis of malignancy on fine-needle aspiration biopsies[J]. Oncotarget, 2017, 8(62): 104761-104771. DOI:10.18632/oncotarget.22289 |
| [6] |
Matsuyama T, Ishikawa T, Takahashi N, et al. Transcriptomic expression profiling identifies ITGBL1, an epithelial to mesenchymal transition (EMT)-associated gene, is a promising recurrence prediction biomarker in colorectal cancer[J]. Mol Cancer, 2019, 18(1): 19. DOI:10.1186/s12943-019-0945-y |
| [7] |
Song J, Yang P, Lu J. Upregulation of ITGBL1 predicts poor prognosis and promotes chemoresistance in ovarian cancer[J]. Cancer Biomark, 2020, 27(1): 51-61. |
| [8] |
Baglieri J, Brenner DA, Kisseleva T. The Role of Fibrosis and Liver-Associated Fibroblasts in the Pathogenesis of Hepatocellular Carcinoma[J]. Int J Mol Sci, 2019, 20(7): 1723. DOI:10.3390/ijms20071723 |
| [9] |
Xu MY, Qu Y, Li Z, et al. A 6 gene signature identifies the risk of developing cirrhosis in patients with chronic hepatitis B[J]. Front Biosci (Landmark Ed), 2016, 21(3): 479-486. DOI:10.2741/4403 |
| [10] |
Wang M, Gong Q, Zhang J, et al. Characterization of gene expression profiles in HBV-related liver fibrosis patients and identification of ITGBL1 as a key regulator of fibrogenesis[J]. Sci Rep, 2017, 7: 43446. DOI:10.1038/srep43446 |
| [11] |
Wang Z, Fu L, Zhang J, et al. A comprehensive analysis of potential gastric cancer prognostic biomarker ITGBL1 associated with immune infiltration and epithelial-mesenchymal transition[J]. Biomed Eng Online, 2022, 21(1): 30. DOI:10.1186/s12938-022-00998-5 |
| [12] |
Qiu X, Feng JR, Qiu J, et al. ITGBL1 promotes migration, invasion and predicts a poor prognosis in colorectal cancer[J]. Biomed Pharmacother, 2018, 104: 172-180. DOI:10.1016/j.biopha.2018.05.033 |
| [13] |
中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版)[J]. 中华消化外科杂志, 2022, 21(2): 143-168. [Medical Administration Bureau of the National Health Commission of the People's Republic of China. Standardization for diagnosis and treatment of hepatocellular carcinoma (2022 edition)[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2022, 21(2): 143-168.] |
| [14] |
Qi L, Song F, Ding Y. Regulatory Mechanism of ITGBL1 in the Metastasis of Colorectal Cancer[J]. Front Oncol, 2020, 10: 259. DOI:10.3389/fonc.2020.00259 |
| [15] |
Yin FY, Qi HP, Qiao H, et al. ITGBL1 promotes gastric cancer cell proliferation and invasion via Akt signal pathway[J]. Front Biosci (Landmark Ed), 2021, 26(4): 682-691. DOI:10.2741/4912 |
| [16] |
Li W, Li S, Yang J, et al. ITGBL1 promotes EMT, invasion and migration by activating NF-κB signaling pathway in prostate cancer[J]. Onco Targets Ther, 2019, 12: 3753-3763. DOI:10.2147/OTT.S200082 |
| [17] |
Huang W, Yu D, Wang M, et al. ITGBL1 promotes cell migration and invasion through stimulating the TGF-β signalling pathway in hepatocellular carcinoma[J]. Cell Prolif, 2020, 53(7): e12836. |
| [18] |
Northey JJ, Przybyla L, Weaver V. Tissue Force Programs Cell Fate and Tumor Aggression[J]. Cancer Discov, 2017, 7(11): 1224-1237. DOI:10.1158/2159-8290.CD-16-0733 |
| [19] |
Ji Q, Zhou L, Sui H, et al. Primary tumors release ITGBL1-rich extracellular vesicles to promote distal metastatic tumor growth through fibroblast-niche formation[J]. Nat Commun, 2020, 11(1): 1211. DOI:10.1038/s41467-020-14869-x |
| [20] |
Li XQ, Du X, Li DM, et al. ITGBL1 Is a Runx2 Transcriptional Target and Promotes Breast Cancer Bone Metastasis by Activating the TGF-β Signaling Pathway[J]. Cancer Res, 2015, 75(16): 3302-3313. DOI:10.1158/0008-5472.CAN-15-0240 |
| [21] |
Ye F, Huang W, Xue Y, et al. Serum Levels of ITGBL1 as an Early Diagnostic Biomarker for Hepatocellular Carcinoma with Hepatitis B Virus Infection[J]. J Hepatocell Carcinoma, 2021, 8: 285-300. DOI:10.2147/JHC.S306966 |
| [22] |
Cheli Y, Tulic MK, El Hachem N, et al. ITGBL1 is a new immunomodulator that favors development of melanoma tumors by inhibiting natural killer cells cytotoxicity[J]. Mol Cancer, 2021, 20(1): 12. DOI:10.1186/s12943-020-01306-2 |
 2022, Vol. 49
2022, Vol. 49